안지오포에틴
Angiopoietin| 안지오포에틴 1 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | ANGPT1 | ||||||
| 엔씨비유전자 | 284 | ||||||
| HGNC | 484 | ||||||
| 오밈 | 601667 | ||||||
| RefSeq | NM_001146 | ||||||
| 유니프로트 | Q15389 | ||||||
| 기타자료 | |||||||
| 로커스 | 8번 씨 Q22.3-8q23 | ||||||
| |||||||
| 안조포이에틴2 | |||||||
|---|---|---|---|---|---|---|---|
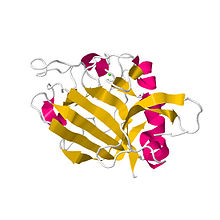 인간 혈관조포에틴-2 수용체 결합 영역의 결정 구조.[1] | |||||||
| 식별자 | |||||||
| 기호 | AGPT2 | ||||||
| 엔씨비유전자 | 285 | ||||||
| HGNC | 485 | ||||||
| 오밈 | 601922 | ||||||
| RefSeq | NM_001147 | ||||||
| 유니프로트 | O15123 | ||||||
| 기타자료 | |||||||
| 로커스 | 8번 씨 p23 | ||||||
| |||||||
안지오포에틴은 배아 및 산후 혈관신생에 역할을 하는 혈관 성장 요인의 일부다.안지오포에틴은 기존의 혈관으로부터 새로운 동맥과 정맥이 형성되는 과정인 혈관신생과 가장 직접적으로 일치한다.혈관신생은 싹트기, 내피세포이전, 증식, 선박 불안정화 및 안정화를 통해 진행된다.그들은 혈관의 내피 안감을 조립하고 분해하는 일을 담당한다.[2]혈관 주변의 부드러운 근육세포를 신호로 미세혈관 투과성, 혈관수축성, 혈관수축성 등을 제어하는 안지오피에틴 시토카인 등이 관여한다.[3]opoietin cytokines)이 관여한다.현재 확인된 안지오포이에틴은 네 가지다.AGPT1, AGPT2, AGPTL3, AGPT4.[4]
이외에도 안지오피에틴('좋다')과 밀접한 관계가 있는 단백질(안지오포피에틴 관련 단백질 1, ANGPTL2, ANGPTL3, ANGPTL4, ANGPTL5, ANGPTL6, ANGPTL7, ANGPTL8)이 다수 존재한다.[5]
혈관 성숙, 접착, 이동, 생존에는 안지오포에틴-1이 중요하다.반면 안지오포에틴-2는 세포사멸을 촉진하고 혈관조영에 지장을 준다.그러나 혈관 내피성장인자, 즉 VEGF와 연계되어 있을 때, 그것은 신혈관화를 촉진할 수 있다.[6]
구조
구조적으로 안지오포이에틴은 리간드와 수용체 사이의 결합을 담당하는 N-단자 슈퍼 클러스터링 영역, 중앙 코일 영역, 링커 영역, C-단자 피브리노겐 관련 영역을 가지고 있다.[6]
Angiopoietin-1은 분자량 57 kDa인 498 아미노산 폴리펩타이드 인코딩이고, Angiopoietin-2는 496 아미노산 폴리펩타이드 인코딩이다.[7]
클러스터/멀티머만이 수용체를 활성화함
Angiopoietin-1과 Angiopoietin-2는 디머, 트리머, 테트라머를 형성할 수 있다.Angiopoietin-1은 슈퍼 클러스터링 도메인을 통해 고차 멀티머를 형성할 수 있는 능력을 가지고 있다.그러나 모든 구조가 티로신키나제 수용체와 상호작용할 수 있는 것은 아니다.수용기는 테트라머 레벨 이상에서만 활성화할 수 있다.[6]
특정 메커니즘
동점길
혈관조포이에틴, 수용체 티로신 키나제, 혈관 내피 성장인자와 수용체 사이의 집단적 상호작용은 두 신호 경로인 Tie-1과 Tie-2를 형성한다.두 수용체 경로는 특정 티로인의 인산화 유도를 통해 세포 신호를 매개하는 역할을 한 결과 이름이 붙여졌다.이것은 세포 신호라고 알려진 과정인 다운스트림 세포내 효소의 결합과 활성화를 차례로 시작한다.
넥타이-2
Tie-2/Ang-1 신호는 LSK-Tie2+ 세포에서 β1-integrin과 N-cadherin을 활성화하고 세포외 매트릭스 및 세포 성분과의 조혈모세포(HSC) 상호작용을 촉진한다.Ang-1은 체내 HSC의 정지를 촉진한다.Tie-2/Ang-1 신호에 의해 유도된 HSC의 정지 또는 저속 셀 순환은 HSC의 장기 재생 능력을 유지하고 다양한 셀 스트레스로부터 HSC 구획을 보호하는 데 기여한다.Tie-2/Ang-1 신호는 골수에서 HSC의 장기 유지와 생존에 필요한 HSC에 중요한 역할을 한다.내막에서 Tie-2/Ang-1 신호는 주로 골세포에 의해 표현된다.[8]특정 TIE 수용체가 혈관신생 자극의 다운스트림 신호를 중재하는 것은 매우 경쟁적이지만, TIE-2가 혈관신생 자극의 결합에 의해 활성화될 수 있는 것은 분명하다.
Angiopoietin 단백질 1~4는 모두 Tie-2 수용체용 리간드다.Tie-1은 Tie-2로 이질화하여 혈관 발달 및 성숙을 위한 Tie-2의 신호 전도를 개선하고 변조한다.티로신키나아제 수용체는 일반적으로 혈관 내피세포와 면역 반응을 위한 특정 대식세포에 표현된다.[6]안지오포이에틴-1은 혈관 지지 세포, 신장 내 특화된 과육체, 간 내 간강(ITO) 세포가 생성하는 성장 인자다.이 성장인자는 또한 당단백질이며 내피세포에서 발견되는 티로신 수용체의 작용제 역할을 한다.[9]혈관 발달과 성숙한 혈관의 안정성을 조절하기 위해서는 안지오포에틴-1과 티로신 키나아제 신호가 필수적이다.[9]
혈관 내피성장인자(VEGF)가 없는 상태에서 혈관포피에틴-2를 발현하면 내피세포 사망과 혈관 퇴행으로 이어진다.[10]Ang2의 증가된 수치는 종양 혈관신생, 전이, 염증을 촉진시킨다.염증과 암에서 Ang2를 조절할 수 있는 효과적인 방법은 임상적 가치가 있어야 한다.[11]Angiopoeitin, 보다 구체적으로 Ang-1과 Ang-2는 VEGF와 손잡고 혈관신생을 중재한다.Ang-2는 Ang-1의 길항제 역할을 하며 VEGF가 없을 경우 혈관 회귀를 촉진한다.Ang-2는 세포 증식과 내피 세포의 이동을 촉진하기 위해 VEGF와 협력한다.[12]뇌허혈 후 쥐의 뇌에서 Ang-1, Ang-2, VEGF의 발현 변화가 보고되었다.[13][14]
혈관신생 신호
이동하기 위해서는 내피세포가 혈관의 기저부 라미나와 ECM 비계를 분해하여 내피 연결을 느슨하게 할 필요가 있다.이러한 연결은 혈관 투과성의 핵심 결정요인이며 혈관 내피 세포 접촉을 완화시켜주는 것으로 혈관 안정성과 성숙도의 주요 요인이기도 하다.물리적 장벽이 제거된 후, 성장 요인 VEGF의 영향 하에서 혈관조포에틴-1과 같은 다른 요인의 추가 기여를 받는 통합체 및 화학적 요인이 필수적인 역할을 한다.VEGF와 ang-1은 내피 튜브 형성에 관여한다.[15]
혈관 투과성 신호
Angiopoietin-1과 Angiopoietin-2는 내피 투과성과 장벽 기능의 조절기다.내피세포는 자동분비 신호를 위해 안지오포에틴-2를 분비하고, 외혈관조직의 실질세포는 파라시린 신호를 위해 안지오포에틴-2를 내피세포에 분비하여 세포외 매트릭스에 결합하여 내피세포 내에 저장한다.[7]
암
Angiopoietin-2는 다양한 암 종류에서 바이오마커로 제안되었다.안지오포에틴-2의 발현 수준은 소세포 폐암과 비소세포 폐암 모두의 암 단계에 비례한다.그것은 또한 간세포암과 자궁내막암에 의한 혈관신생술에 대한 역할을 하도록 연루되어 왔다.혈관조포이틴-2 차단 항체를 이용한 실험에서 폐와 림프절에 대한 전이가 감소하는 것으로 나타났다.[16]
임상 관련성
혈관조피에틴과 티로신키나아제 경로의 규제완화는 당뇨병, 말라리아, 패혈증, 폐고혈압 등 혈액관련 질환에서 흔히 볼 수 있다.이는[clarification needed] 혈청 내 안지오포에틴-2와 안지오포에틴-1의 증가된 비율로 입증된다.구체적으로 말하면, 안지오포에틴 수치는 패혈증에 대한 지표를 제공한다.Angiopoietin-2에 대한 연구는 그것이 패혈성 쇼크의 시작에 관여한다는 것을 보여주었다.발열과 높은 수치의 안지오포에틴-2의 결합은 패혈성 쇼크의 발달을 더 크게 예상하는 것과 관련이 있다.또한 Angiopoietin-1과 Angiopoietin-2 신호의 불균형이 서로 독립적으로 작용할 수 있다는 것을 보여주었다.한 안지오포이에틴 인자는 높은 수준에서 신호를 보낼 수 있고 다른 안지오피에틴 인자는 기준선 수준 신호에 머물 수 있다.[2]
Angiopoietin-2는 내피세포의 Weibel-Palade 체내에서 생산되어 저장되며 TEK tyrosine kinase 적으로 작용한다.그 결과 내피 활성화, 불안정화, 염증 등의 촉진이 촉진된다.혈관신생을 하는 동안 그것의 역할은 베그프-a의 존재에 달려있다.[9]
혈관조피에틴-2 표현의 혈청 수준은 구강 편평 세포암에서 다발성 골수종,[17] 혈관신생, 전반적인 생존의 성장과 관련이 있다.[18]순환 안지오포에틴-2는 만성 투석 중인 어린이들의 초기 심혈관 질환의 표식이다.[19]카포시의 육종 관련 헤르페스 바이러스는 내피세포에서 안지오포에틴-2의 빠른 방출을 유도한다.[20]
안지오포이에틴-2는 혈관조종 환자에서 상승한다.[21]
연구는 안지오포에틴이 암 치료에도 관련이 있다는 신호를 보내는 것을 보여주었다.종양이 성장하는 동안, 친혈관신생 분자와 항혈관신생 분자는 균형을 잃는다.친기생성 분자의 수가 증가할 정도로 평형이 흐트러진다.안지오포에틴은 물론 VEGF와 혈소판 유도성장인자(PDGF)까지 영입된 것으로 알려졌다.이는 혈관신생을 억제하면 종양 증식을 억제하는 데 도움이 될 수 있기 때문에 암 치료에 대한 임상적 사용과 관련이 있다.[22]
참조
- ^ PDB: 1Z3U;Barton WA, Tzvetkova D, Nikolov DB (May 2005). "Structure of the angiopoietin-2 receptor binding domain and identification of surfaces involved in Tie2 recognition". Structure. 13 (5): 825–32. doi:10.1016/j.str.2005.03.009. PMID 15893672.
- ^ a b Alves BE, Montalvao SA, Aranha FJ, Siegl TF, Souza CA, Lorand-Metze I, et al. (2010). "Imbalances in serum angiopoietin concentrations are early predictors of septic shock development in patients with post chemotherapy febrile neutropenia". BMC Infect Dis. 10: 143. doi:10.1186/1471-2334-10-143. PMC 2890004. PMID 20509945.
- ^ Scott F. Gilbert (10 April 2010). Developmental Biology (Loose Leaf). Sinauer Associates Incorporated. ISBN 978-0-87893-558-1.
- ^ Valenzuela DM, Griffiths JA, Rojas J, Aldrich TH, Jones PF, Zhou H, McClain J, Copeland NG, Gilbert DJ, Jenkins NA, Huang T, Papadopoulos N, Maisonpierre PC, Davis S, Yancopoulos GD (Apr 1999). "Angiopoietins 3 and 4: Diverging gene counterparts in mice and humans". Proc Natl Acad Sci U S A. 96 (5): 1904–9. doi:10.1073/pnas.96.5.1904. PMC 26709. PMID 10051567.
- ^ Santulli G (2014). "Angiopoietin-like proteins: a comprehensive look". Frontiers in Endocrinology. 5: 4. doi:10.3389/fendo.2014.00004. PMC 3899539. PMID 24478758.
- ^ a b c d Fagiani E, Christofori G (2013). "Angiopoietins in angiogenesis". Cancer Lett. 328 (1): 18–26. doi:10.1016/j.canlet.2012.08.018. PMID 22922303.
- ^ a b Sarah Y. Yuan; Robert R. Rigor (30 September 2010). Regulation of Endothelial Barrier Function. Morgan & Claypool Publishers. ISBN 978-1-61504-120-6.
- ^ Arai, F. (July 11, 2008). "Quiescent stem cells in the niche". Stembook. Cambridge, MA: Harvard Stem Cell Institute. doi:10.3824/stembook.1.6.1. PMID 20614597.
- ^ a b c Jeansson M, Gawlik A, Anderson G, Li C, Kerjaschki D, Henkelman M, et al. (2011). "Angiopoietin-1 is essential in mouse vasculature during development and in response to injury". J Clin Invest. 121 (6): 2278–89. doi:10.1172/JCI46322. PMC 3104773. PMID 21606590.
- ^ Harmey, Judith (2004). VEGF and cancer. Georgetown, Tex: Landes Bioscience/Eurekah.com New York, N.Y. Kluwer Academic/Plenum Publishers. ISBN 0-306-47988-5.
- ^ Eklund L, Saharinen P (2013). "Angiopoietin signaling in the vasculature". Exp Cell Res. 319 (9): 1271–80. doi:10.1016/j.yexcr.2013.03.011. PMID 23500414.
- ^ Lim HS, Blann AD, Chong AY, Freestone B, Lip GY (2004). "Plasma vascular endothelial growth factor, angiopoietin-1, and angiopoietin-2 in diabetes: implications for cardiovascular risk and effects of multifactorial intervention". Diabetes Care. 27 (12): 2918–24. doi:10.2337/diacare.27.12.2918. PMID 15562207.
- ^ Zan L, Wu H, Jiang J, Zhao S, Song Y, Teng G, Li H, Jia Y, Zhou M, Zhang X, Qi J, Wang J (2011). "Temporal profile of Src, SSeCKS, and angiogenic factors after focal cerebral ischemia: correlations with angiogenesis and cerebral edema". Neurochem. Int. 58 (8): 872–9. doi:10.1016/j.neuint.2011.02.014. PMC 3100427. PMID 21334414.
- ^ Zan L, Zhang X, Xi Y, Wu H, Song Y, Teng G, Li H, Qi J, Wang J (2014). "Src regulates angiogenic factors and vascular permeability after focal cerebral ischemia-reperfusion". Neuroscience. 262: 118–28. doi:10.1016/j.neuroscience.2013.12.060. PMC 3943922. PMID 24412374.
- ^ Félétou, M. (2011). "Chapter 2, Multiple Functions of the Endothelial Cells.". The Endothelium: Part 1: Multiple Functions of the Endothelial Cells—Focus on Endothelium-Derived Vasoactive Mediators. San Rafael, CA: Morgan & Claypool Life Sciences.
- ^ Akwii RG, Sajib MS, Zahra FT, Mikelis CM (May 2019). "Role of Angiopoietin-2 in Vascular Physiology and Pathophysiology". Cells. 8 (5): 471. doi:10.3390/cells8050471. PMC 6562915. PMID 31108880.
- ^ Pappa CA, Tsirakis G, Samiotakis P, Tsigaridaki M, Alegakis A, Goulidaki N, et al. (2013). "Serum levels of angiopoietin-2 are associated with the growth of multiple myeloma". Cancer Invest. 31 (6): 385–9. doi:10.3109/07357907.2013.800093. PMID 23758184. S2CID 12275550.
- ^ Li C, Sun CJ, Fan JC, Geng N, Li CH, Liao J, et al. (2013). "Angiopoietin-2 expression is correlated with angiogenesis and overall survival in oral squamous cell carcinoma". Med Oncol. 30 (2): 571. doi:10.1007/s12032-013-0571-2. PMID 23649549. S2CID 41226861.
- ^ Shroff RC, Price KL, Kolatsi-Joannou M, Todd AF, Wells D, Deanfield J, et al. (2013). "Circulating angiopoietin-2 is a marker for early cardiovascular disease in children on chronic dialysis". PLOS ONE. 8 (2): e56273. doi:10.1371/journal.pone.0056273. PMC 3568077. PMID 23409162.
- ^ Ye FC, Zhou FC, Nithianantham S, Chandran B, Yu XL, Weinberg A, et al. (2013). "Kaposi's sarcoma-associated herpesvirus induces rapid release of angiopoietin-2 from endothelial cells". J Virol. 87 (11): 6326–35. doi:10.1128/JVI.03303-12. PMC 3648120. PMID 23536671.
- ^ Amo Y, Masuzawa M, Hamada Y, Katsuoka K (May 2004). "Observations on angiopoietin 2 in patients with angiosarcoma". Br. J. Dermatol. 150 (5): 1028–9. doi:10.1111/j.1365-2133.2004.05932.x. PMID 15149523. S2CID 7399513.
- ^ Falcón BL, Hashizume H, Koumoutsakos P, Chou J, Bready JV, Coxon A, et al. (2009). "Contrasting actions of selective inhibitors of angiopoietin-1 and angiopoietin-2 on the normalization of tumor blood vessels". Am J Pathol. 175 (5): 2159–70. doi:10.2353/ajpath.2009.090391. PMC 2774078. PMID 19815705.
외부 링크
- 미국 국립 의학 도서관의 Angiopoietins(MesH) 제목
- "angiopoietin.de: endothelia activation from bench to bedside". Medical School Hannover. Retrieved 2009-01-22.


