바이오 펌프
Biological pump| 에 대한 일련의 개요의 일부 |
| 해양생물 |
|---|
 |
해양 탄소 펌프라고도 알려진 생물학적 펌프는, 가장 간단한 형태로, 대기와 육지 유출로부터 해양 내부와 해저 [1]퇴적물로의 탄소의 생물학적으로 구동되는 격리 장치입니다.광합성 중 식물성 플랑크톤(연조직 펌프)에 의해 주로 형성되는 유기물의 순환과 플랑크톤, 연체동물(탄산 펌프)[2] 등 특정 유기물에 의해 껍데기로 형성되는 탄산칼슘(CaCO3) 순환을 담당하는 해양 탄소 순환의 일부이다.
생물학적 탄소 펌프의 예산 계산은 침전(탄소 해저 수출)과 재염화(탄소 대기 방출) 간의 비율을 기반으로 합니다.
생물학적 펌프는 단일 공정의 결과라기보다는 생물학적 펌핑에 영향을 미칠 수 있는 여러 공정의 합입니다.전체적으로, 이 펌프는 매년 약 11기가톤의 탄소를 해양 내부로 운반한다.이것은 수천 년 또는 그 이상 동안 대기와의 접촉에서 탄소를 필요로 한다.생물 펌프가 없는 바다는 현재보다 약 400ppm 높은 대기 중 이산화탄소 수치를 초래할 것이다.
개요

생물학적 펌프는 표면에서 용해된 무기 탄소(DIC)의 경사도에 반하여 탄소가 운반되는 결과로 지표수에서 해양 내부로 수출되는 1차 생산 유기물의 비율에 의존합니다.깊은 바다로.이러한 이동은 용해 및 미립자 유기 탄소(POC)의 물리적 혼합 및 운반, 생물(동물 플랑크톤, 물고기)의 수직 이동 및 미립자 유기 [4][5]: 526 [6]탄소의 중력 침하를 통해 발생합니다.
생물학적 펌프는 세 개의 뚜렷한 단계로 나눌 수 있는데, 첫 번째 단계는 해양의 완만한(햇빛이 비치는) 표면 영역에서 플랑크톤 광영양에 의한 고정 탄소의 생성입니다.이러한 지표수에서, 식물성 플랑크톤은 탄수화물, 지질, 그리고 단백질을 만들기 위해 광합성을2 하는 동안 이산화탄소, 질소, 인, 그리고 다른 미량 원소들을 사용합니다.일부 플랑크톤(예: 콕콜리소포 및 유라미페라)은 칼슘(Ca)과 용해된 탄산염(탄산 및 중탄산염)을 결합하여 탄산칼슘([7]CaCO3) 보호막을 형성합니다.
일단 이 탄소가 연조직이나 단단한 조직에 고정되면, 생물들은 재생 영양 주기의 일부로 재활용되기 위해 유포틱 존에 머무르거나, 그들이 죽으면, 생물 펌프의 두 번째 단계로 계속 진행되어 해저로 가라앉기 시작합니다.가라앉는 입자는 가라앉을 때 응집체를 형성하여 가라앉는 속도를 크게 증가시킨다.입자가 물기둥의 포식과 부패에서 벗어나 최종적으로 [7]해저로 들어갈 수 있는 더 나은 기회를 주는 것이 바로 이 집합체입니다.
내려가는 도중 또는 해저에서 박테리아에 의해 분해된 고정 탄소는 펌프의 최종 단계로 진입하여 재메랄화되어 1차 생산에 다시 사용된다.이러한 과정을 완전히 벗어난 입자들은 침전물에 격리되어 수백만 년 동안 그곳에 남아있을 수 있다.이 고립된 탄소는 궁극적으로 대기 [7]중2 이산화탄소를 감소시키는 원인이 된다.
| 의 시리즈의 일부 |
| 탄소 순환 |
|---|
 |
위의 다이어그램은 생물학적 펌프의 구성 요소를 보여 줍니다.생물학, 물리학과 중력은 깊은 바다로 유기 탄소를 퍼올리기 위해 상호작용합니다.광합성 중 유기물에 무기 탄소를 고정하는 과정, 먹이 거미줄에 의한 변화(로파워역학), 물리적 혼합, 수송 및 중력 침하를 총칭하여 생물학적 [8]펌프라고 한다.
생물학적 펌프는 용해된 무기 탄소(DIC)를 유기 바이오매스로 변환하여 미립자나 용해된 형태로 심해로 펌핑하는 역할을 합니다.무기영양소와 이산화탄소는 광합성 시 용해유기물(DOM)을 방출하고 초식동물플랑크톤에 의해 소비되는 식물성플랑크톤에 의해 고정된다.요각류 등 대형 동물성 플랑크톤 - 재흡입하여 침하하거나 다른 유기성 쓰레기와 함께 수집하여 더 빨리 침하되는 대형 골재로 만들 수 있는 분뇨 알갱이.DOM은 부분적으로 박테리아(검은 점)에 의해 소비되고 호흡되며, 나머지 내화물 DOM은 이음매되어 심해에 혼합됩니다.심층수로 수출된 DOM과 골재는 소비되고 호흡되며, 따라서 유기 탄소는 DIC의 거대한 심해 저장소로 되돌아갑니다.바다 표면에서 나오는 입자의 약 1%가 해저에 도달하여 소비, 호흡 또는 퇴적물에 묻힙니다.그곳에서 탄소는 수백만 년 동안 저장된다.이러한 공정의 순효과는 표면에서 유기 형태의 탄소를 제거하고 더 깊은 곳의 DIC로 되돌려 DIC의 표면에서 깊은 바다까지의 구배를 유지하는 것이다.열염 순환은 밀레니얼 [8]타임스케일로 해양의 깊은 DIC를 대기로 돌려보냅니다.
프라이머리 생산
생물학적 펌프의 첫 번째 단계는 해양의 [11]가장 햇빛이 비치는 층에서 식물성 플랑크톤에 의해 유기 탄소 화합물과 무기 탄소 화합물을 합성하는 것입니다.당, 탄수화물, 지질 및 단백질 형태의 유기 화합물은 광합성 과정에서 합성됩니다.
CO2 + HO2 + 라이트 → CHO2 + O2
식물성 플랑크톤에서 발견되는 유기물은 탄소 외에 질소, 인 및 각종 미량 금속으로 구성되어 있다.탄소 대 질소 및 인의 비율은 [12]장소마다 다르지만, 레드필드 비율이라고 알려진 106C:16N:1P에 가까운 평균 비율을 가지고 있습니다.마그네슘, 카드뮴, 철, 칼슘, 바륨, 구리와 같은 미량 금속은 식물성 플랑크톤 유기 물질에 많이 분포하지 않지만 특정 대사 과정에 필요하며 따라서 물기둥에 [7]함유된 양이 낮기 때문에 광합성의 영양소를 제한할 수 있습니다.
해양 1차 생산은 지구상에서 이루어지는 탄소 고정의 약 절반을 차지한다.탄소의 약 50-60Pg는 지구 전체 광합성 바이오매스의 1% 미만을 구성함에도 불구하고 매년 해양 식물성 플랑크톤에 의해 고정된다.이 탄소 고정의 대부분은 외양에서 이루어지며(80%까지), 나머지 양은 매우 생산적인 바다의 상승 지역에서 발생합니다.이들 생산지역은 면적당 2~3배의 고정탄소를 생산하고 있지만, 외해는 해양 면적의 90% 이상을 차지하기 때문에 더 큰 [7]기여를 하고 있다.
탄소의 형태
- 용존 미립자 탄소
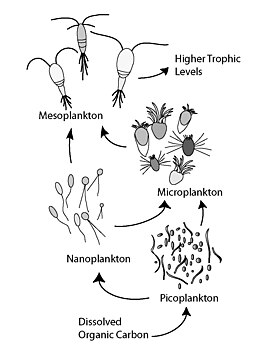
식물성 플랑크톤은 무기화합물을 유기성분으로 전환하기 때문에 바다의 모든 생명체를 지탱한다.이 자기영양생성 바이오매스는 해양식품망의 [13]토대가 된다.아래 그림에서 화살표는 DOM의 다양한 생산(화살표가 DOM 풀을 가리키고 있음) 및 제거 과정을 나타내며, 파선 화살표는 DOM의 전송에 관련된 주요 생물학적 과정을 나타냅니다.이러한 과정으로 인해, DOM 풀의 내화 특성은 심해로 수출되는 동안 상당히 증가하는 반면, 유연한 DOM의 비율은 깊이에 따라 급격히 감소한다.DOM, 용해된 유기물.[13][14]
탄산칼슘
미립자 무기 탄소(PIC)는 보통 탄산칼슘(CaCO3)의 형태를 취하며 해양 탄소 [16]순환에서 중요한 역할을 합니다.이 생물학적으로 고정된 탄소는 더 큰 해양 생물(몰루스크 껍질)뿐만 아니라 많은 플랑크톤 종의 보호막으로 사용됩니다.또한 탄산칼슘은 어류에 의한 삼투압 조절 중에 높은 속도로 배설되어 백색 현상으로 [17]형성될 수 있다.이러한 형태의 탄소는 대기 예산에서 직접 추출되지 않지만, CO와2 평형 상태에 있는 용해된 형태의 탄산염으로 형성되며,[18] 격리된 상태로 이 탄소를 제거하는 역할을 합니다.
CO2 + HO2 → HCO23 → H+ + HCO3−
Ca2+ + 2HCO3− → CaCO3 + CO22 + HO
이 과정은 많은 양의 탄소를 고정시키는 데 성공하지만, 격리된 [2][19]탄소의 단위당 두 개의 알칼리도가 격리됩니다.따라서 CaCO의3 형성 및 침하로 인해 지표수의 pH를 상승시키는 역할을 하는 깊은 알칼리성 구배까지 표면이 이동하게 되고, 용존 탄소의 사양이 바뀌어 지표수의 용존2 CO의 부분 압력이 상승하게 되어 실제로 대기 레벨이 상승하게 됩니다.또한 침전물에 CaCO를3 매립하면 전체적인 해양 알칼리도가 낮아져 [1]풍화작용에 의한 알칼리도의 신규 투입에 의해 상쇄되지 않는 경우 pH를 상승시키는 경향이 있어 대기 중 CO2 수준이 저하된다.해저에 영구적으로 묻혀있는 탄소의 부분은 지질학 기록의 일부가 된다.탄산칼슘은 종종 주목할 만한 퇴적물을 형성하는데, 이것은 영국 남부 도버의 하얀 절벽에서처럼 지각 운동을 통해 육지로 올라올 수 있습니다.이 절벽들은 거의 완전히 콕콜리소포체의 [20]판으로 이루어져 있다.
해양 탄소 순환
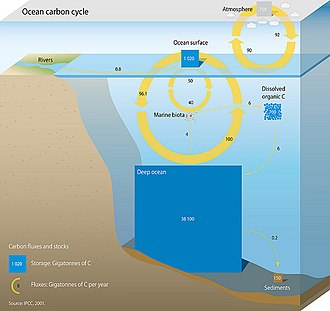
해양 탄소 순환을 구성하는 세 가지 주요 과정(또는 펌프)은 대기의 이산화탄소(CO2)를 해양 내부로 들여와 해양을 통해 분배합니다.이 3개의 펌프는 (1)용해성 펌프 (2)카보네이트 펌프 (3)바이오 펌프이다.10,000년 미만의 지속 기간 동안 지구 표면의 총 활성 탄소 풀은 약 40,000 기가톤 C(Gt C, 1 기가톤은 10억 톤, 즉 약 600만 마리의 청고래의 무게)이며, 약 95%(약 38,000 Gt C)는 대부분 용해된 무기 [21][22]탄소로 바다에 저장됩니다.해양 탄소 순환에서 용해된 무기 탄소의 분화는 해양에서 산염기 화학의 주요 제어 장치이다.
용해도 펌프
생물학적 펌프는 용해성 펌프라고 알려진 물리 화학적 대응 펌프와 함께 제공됩니다.이 펌프는 용해된 무기 탄소(DIC)의 형태로 해양 표면에서 내부로 상당한 양의 탄소를 운반합니다.물리적 및 화학적 과정만 포함되며 생물학적 [23]과정은 포함되지 않습니다.
용해성 펌프는 해양에서 다음 두 프로세스가 일치하여 구동됩니다.
- 이산화탄소의 용해성은 해수 온도의 강력한 역함수이다(즉, 차가운 물에서 용해성이 더 높음).
- 열염 순환은 보통 바닷물이 더 차갑고 밀도가 높은 고위도에서 깊은 물의 형성에 의해 추진된다.
깊은 물(즉, 해양 내부의 해수)은 이산화탄소 용해성을 촉진하는 동일한 표면 조건에서 형성되기 때문에, 평균 표면 농도에서 예상할 수 있는 것보다 높은 농도의 용해 무기 탄소를 포함합니다.그 결과, 이 두 가지 과정은 함께 작용하여 대기 중의 탄소를 해양 내부로 내보냅니다.이것의 한 가지 결과는 따뜻한 적도 위도에서 깊은 물이 차오르면 [24]가스의 용해도가 감소하기 때문에 이산화탄소를 대기 중으로 강하게 배출하는 것입니다.
탄산펌프
탄산염 펌프는 생물학적 [25]펌프의 "경질 조직" 구성 요소로 언급되기도 합니다.콕콜리소포어와 같은 일부 표면 해양 생물들은 중탄산염을 [26]고정시킴으로써 입자상 무기 탄소의 한 형태인 탄산칼슘으로 단단한 구조를 만든다.DIC의 이러한 고정은 해양 탄소 순환의 중요한 부분이다.
Ca2+ + 2 HCO3− → CaCO3 + CO22 + HO
생물학적 탄소 펌프가 설탕(CHO6126) 형태의 미립자 유기 탄소에 무기 탄소(CO2)를 고정하는 반면, 탄산 펌프는 무기 중탄산염을 고정시켜 CO의2 [26]순 방출을 일으킨다.이와 같이 탄산펌프는 탄산카운터펌프라고 할 수 있다.CO 플럭스를 생체2 [27]펌프에 중화시킴으로써 생체 펌프에 역작용합니다.
대륙붕 펌프
대륙붕 펌프는 대륙수에서 인접한 심해 [28]내부로 탄소(용해 또는 미립자)를 운반하는 메커니즘으로 대륙붕의 얕은 물에서 작동하도록 제안된다.원래 공식화된 바와 같이 펌프는 용해성 펌프가 냉각기와 상호작용하여 대륙 경사면을 따라 인근 [28]심해로 공급되는 선반 바닥의 고밀도 물이 발생하는 것으로 생각됩니다.대륙붕의 얕음은 냉각수의 대류를 제한하기 때문에, 대륙붕의 냉각은 인접한 개방된 바닷물보다 더 클 수 있다.이러한 차가운 물은 용해성 펌프를 촉진하고 용해된 무기 탄소의 저장을 증가시킵니다.이 여분의 탄소 저장고는 [29]선반의 생물학적 생산 특성이 증가함에 따라 더욱 강화됩니다.고밀도의 탄소가 풍부한 저장 물은 저장 바닥으로 가라앉고 등온 [28]혼합을 통해 외양 지하층으로 들어갑니다.지구 온난화에 따라 해수면이 상승함에 따라, 저장 바다의 표면적이 증가하게 되고, 그 결과 저장 바다 펌프의 강도가 [30]증가하게 된다.
바이오펌프 내 공정
오른쪽 그림에서 식물성 플랑크톤은 대기 중 용해된 CO를 1차 생산 시(~50 Gt C년−1−1) 미립자 유기탄소(POC)로 변환한다2.식물성 플랑크톤은 요각류, 크릴, 그리고 다른 작은 동물성 플랑크톤 방목자들에 의해 소비되고, 그들은 다시 더 높은 영양 수준에 의해 잡아먹힌다.미소비 식물성 플랑크톤 형태의 골재 및 동물성 플랑크톤 분변 알갱이와 함께 빠르게 침하되어 혼합층 밖으로 내보내진다(< 12 Gt−1 C yr 14).크릴, 요각류, 동물성 플랑크톤 및 미생물은 바다 표면에서 식물성 플랑크톤을 흡수하고 깊이에서 유해 입자를 가라앉혀 이 POC를 CO(용해2 무기 탄소, DIC)로 소비하고 호흡하며, 표면에서 생성된 탄소의 극히 일부만 심해로 가라앉힌다(즉, 깊이 1000m 이상).크릴과 더 작은 동물성 플랑크톤은 입자를 물리적으로 작고 느린 조각이나 가라앉지 않는 조각으로 분할하여 [32]POC 수출을 지연시킵니다.이는 세포에서 직접 또는 세균의 가용화(델 텔레폰 어드바이저 주위의 노란색 원)를 통해 용해된 유기 탄소(DOC)를 방출한다.그런 다음 박테리아는 DOC에서 DIC(CO, 미생물 정원 가꾸기)[31]로2 재미네랄화할 수 있습니다.
생물학적 탄소 펌프는 해양에서 탄소의 수직 분포를 결정하는 주요 요인 중 하나이며, 따라서 공기-바다2 [33]CO 교환을 지배하는 CO 표면2 분압의 주요 결정 요인 중 하나이다.그것은 식물성 플랑크톤 세포와 그 소비자와 그들의 폐기물을 흡수하는 박테리아로 구성되어 있으며 수세기 동안 [34]집중되고 고립된 심해에 탄소를 공급함으로써 지구 탄소 순환의 중심 역할을 한다.식물성 플랑크톤에 의한 광합성은 해양 상층부의 CO2 분압을 낮추어 보다 가파른2 CO구배를 [35]발생시킴으로써 대기 중의 CO2 흡수를 촉진한다.또한 표층부(0~200m 깊이)의 유포틱 층에서 미립자 유기 탄소(POC)가 형성된다.POC는 미생물, 동물성 플랑크톤 및 그 소비자에 의해 분변 알갱이, 유기 골재("해양 눈") 및 기타 형태로 처리되며, 그 후 동물성 플랑크톤과 어류에 [36]의한 침하 및 수직 이동에 의해 메소펠라그(깊이 200-1000m) 및 수경 지대로 수출된다.1차 생산에는 용해된 유기탄소 및 미립자 유기탄소(DOC 및 POC)가 포함되지만, 해양 내부로의 효율적인 탄소 수출로 이어지는 것은 POC뿐이며, 지표수의 DOC 분율은 대부분 [37]박테리아에 의해 재활용됩니다.그러나, 유포틱 존(순 군집 생산성의 15-20%를 차지)에서 생성된 보다 생물학적으로 내성이 강한 DOC 분율은 미생물에 의해 즉시 광물화되지 않고 생물학적으로 반취약성 [38]DOC로 해수면에 축적된다.이 반연성 DOC는 심해로 순수출되므로 생물학적 탄소 [39]펌프의 동적 부분을 구성합니다.DOC 생산과 수출의 효율은 해양학 지역에 따라 다르며, 근위축 아열대 해양에서 [40]더욱 두드러진다.생물학적 탄소 펌프의 전반적인 효율은 대부분 POC [37][41]수출에 의해 제어됩니다.
해양 눈
유기 및 무기 생물 물질에 포함된 대부분의 탄소는 해저로 가라앉기 시작할 수 있는 해수면에서 형성된다.깊은 바다는 해양 눈의 형태로 가라앉을 때 높은 물기둥으로부터 대부분의 영양분을 얻는다.이것은 죽거나 죽어가는 동물과 미생물, 분변 물질, 모래와 다른 무기 [43]물질로 구성되어 있다.단일 식물성 플랑크톤 세포는 하루에 약 1미터의 침하 속도를 가진다.바다의 평균 깊이가 약 4킬로미터라는 것을 고려하면, 이러한 세포들이 해저에 도달하는 데는 10년 이상이 걸릴 수 있다.그러나 포식자 분변 알갱이에서의 응고 및 배출과 같은 과정을 통해 이러한 세포는 응집체를 형성한다.해양 눈이라고 알려진 이 집합체는 개별 세포보다 훨씬 큰 규모의 침하 속도를 가지며 [7]수일 내에 깊은 곳으로의 여정을 완료한다.
오른쪽 도표에서 식물성 플랑크톤은 태양 에너지를 이용하여 유포틱 존에서 CO를 고정시키고2 미립자 유기 탄소(POC)를 생성한다.유포틱 존에서 형성된 POC는 미생물, 동물성 플랑크톤과 그 소비자에 의해 유기 응집체(해상 눈)로 가공되고, 그 후 동물성 플랑크톤과 어류에 의한 침하와 수직 이동에 의해 메소필라직 존(깊이 200-1000m)과 수경 구역으로 수출된다.수출 플럭스는 표면층으로부터의 침전(심도 약 100m)으로 정의되며 격리 플럭스는 중층부로부터의 침전(심도 약 1000m)으로 정의된다.POC의 일부는 주로 이종영양 미생물 및 동물성 플랑크톤에 의해 심층 해양수기둥의 CO로2 환원되어 용해무기탄소(DIC) 농도의 수직구배를 유지한다.이 심해 DIC는 열염 순환을 통해 밀레니얼 타임스케일로 대기로 돌아옵니다.1차 생산의 1%에서 40%가 유포틱 존 밖으로 내보내지며, 유포틱 존의 밑부분을 향해 기하급수적으로 감소하며, 표면 생산의 약 1%만이 [41][44][36]해저에 도달한다.
연간 고정 탄소 50-60Pg 중 약 10%는 바다의 표면 혼합층을 떠나지만, 0.5% 미만이 결국 해저에 [7]도달한다.대부분은 유포틱존의 재생생산으로 유지되며, 상당부분은 입자 침하 중 중간수 과정에서 재메네랄화된다.바다의 혼합된 표면을 떠나는 탄소의 부분은 때때로 "순서화"된 것으로 여겨지며, 근본적으로 수 세기 [44]동안 대기와의 접촉에서 제거된다.그러나, 연구는 또한 남양과 같은 지역에서 이 탄소의 많은 부분이 빠르게 (수십 년 이내에)[45] 대기와 다시 접촉할 수 있다는 것을 발견했다.
생물학적 탄소 펌프의 예산 계산은 침전(탄소 수출)과 재염화(대기 [42]방출) 간의 비율을 기반으로 합니다.가라앉는 입자는 해양에서 식물성 플랑크톤에 의해 포획된 탄소의 25%를 더 깊은 [46]수층으로 내보내는 것으로 추정되고 있다.이 수출의 약 20%(표면값의 5%)는 주로 광물 [48]밸러스트 때문에 해양 퇴적물에 묻혀 있다.침하 과정 동안 이러한 유기 입자는 미생물 활동의 핫스팟이며 [49][50][42]물기둥에서 유기물 광화와 영양분 재배포를 위한 중요한 위치를 나타냅니다.
바이오미네랄화
밸러스트 광물
| 관련된 시리즈의 일부 |
| 바이오미네랄화 |
|---|
 |
관찰 결과 밸러스트 광물(탄산칼슘, 오팔, 암석유전자 물질)의 플럭스와 유기 탄소 플럭스는 바다의 [48]수심대에서 밀접한 상관관계가 있는 것으로 나타났다.미립자 유기물의 많은 부분은 해양에서 [51]식물성 플랑크톤, 잔해, 무기질 입자 및 분변 알갱이로 구성된 해양 눈 집합체(>0.5 mm)의 형태로 발생한다.이러한 골재의 형성 및 침하로 인해 표면 혼합층에서 심해 및 퇴적물로 유기물을 수출 및 침전시킴으로써 생물학적 탄소 펌프가 구동됩니다.해양의 상층 혼합층을 떠나는 유기물의 분율은 무엇보다도 이러한 골재의 침하 속도와 미생물 재메네랄화 속도에 의해 결정된다.최근 관찰된 바에 따르면 밸러스트 광물(탄산칼슘, 오팔, 암석원성 물질)의 플럭스와 유기 탄소 플럭스는 해양의 수냉 구역에서 밀접한 상관관계가 있는 것으로 나타났다.이로 인해 유기 탄소 수출은 침전 [52][53][54][48]골재 내에 밸러스트 광물의 존재에 의해 결정된다는 가설이 제기되었습니다.
광물 발라스트는 북대서양 고도에서 미립자 유기 탄소(POC) 플럭스의 약 60%와 남해에서 [55]플럭스의 약 40%와 관련되어 있습니다.심해에는 밸러스트 광물의 존재와 POC의 플럭스 사이의 강한 상관관계가 존재한다.이는 밸러스트 광물이 밸러스트된 골재의 싱크 속도를 증가시킴으로써 POC 플럭스를 향상시킨다는 것을 시사한다.밸러스트 광물은 추가적으로 응집된 유기물을 [56]열화로부터 보호할 수 있다.
밸러스트 광물이 존재할 때 골재 밀도와 침하 속도가 증가하거나 밸러스트 [52][53][54]광물과 정량적 연관성에 의한 유기물 보호를 통해 유기 탄소가 침하 입자에 더 잘 보존된다는 것이 제안되었다.2002년에 Klaas와 Archer는 전 세계 미립자 유기 탄소(POC) 플럭스의 약 83%가 탄산염과 관련이 있다는 것을 관찰했으며, 탄산염이 오팔 및 토종 물질에 비해 더 효율적인 밸러스트 광물이라고 제안했습니다.그들은 오팔에 비해 탄산칼슘의 밀도가 높고 토종 물질에 비해 탄산칼슘의 양이 많은 것이 탄산칼슘에 의한 효율적인 밸러스트의 원인일 수 있다는 가설을 세웠다.그러나 침하 속도와 침하 골재의 열화율에 대한 밸러스트 광물의 직접적인 영향은 여전히 [54][48]불분명하다.
2008년 연구에서 규조류 또는 콕콜리소포리드 식단에서 생성된 요각류 분변 알갱이는 나노편모충 [57]식단에서 생성된 알갱이에 비해 침하 속도가 더 빠르다는 것이 입증되었다.그러나 펠릿의 탄소 특이 호흡 속도는 유사하고 미네랄 함량과 독립적이었다.이러한 결과는 미네랄 조성의 차이로 인해 미생물 열화에 대한 POC의 차별적 보호는 이루어지지 않지만, 향상된 침하 속도는 생물 광물이[57][48] 함유된 펠릿에서 생물 광물이 없는 펠릿에 비해 최대 10배 더 높은 탄소 보존을 초래할 수 있음을 시사한다.
미네랄은 식물성 플랑크톤 응집체의 응집을 촉진하는 것으로 보이며, 골재 형성 [60]시 촉매 역할을 할 수도 있다.그러나 광물의 혼입으로 인해 골재가 더 작고 밀도가 높은 [61]골재로 분할될 수 있다는 사실도 밝혀졌다.이는 골재 크기가 감소하여 응집된 유기물의 침하속도를 낮출 수 있으며, 따라서 유기물의 총수출량을 낮출 수 있다.반대로 광물의 혼입이 골재 밀도를 증가시키면 그 크기 고유의 침하 속도도 증가하여 탄소 수출이 증가할 수 있다.따라서 광물과 유기 골재 간의 상호작용이 골재의 분해 및 침하 속도와 이에 따른 [61][48]해양 탄소 격리에 어떻게 영향을 미치는지에 대한 더 나은 정량적 조사가 여전히 필요하다.
재메네랄화
재메네랄화는 유기물(생물학적 원천에서 파생된 분자)이 가장 단순한 무기 형태로 분해되거나 변형되는 것을 말한다.이러한 변화들은 다른 [5]유기체들에 의해 영양소로 재사용될 수 있도록 시스템 내의 유기 분자와 재활용 물질에 저장된 에너지를 해방시키는 데 책임이 있기 때문에 생태계 내에서 중요한 고리를 형성합니다.탈옥의 재메네랄라이제이션은 장소에 따라 어떤 분수가 다른가.예를 들어 북해의 경우 탄소 퇴적량은 1차[62] 생산량의 1% 이하인 반면 외양에서는 평균 [63]0.5% 미만이다.따라서 대부분의 영양소는 물기둥에 남아 생물에 의해 재활용된다.이종영양 유기체는 자가영양(및 화학영양) 유기체에 의해 생성된 물질을 사용하고 호흡을 통해 유기 형태에서 무기 형태로 화합물을 재메네랄화하여 1차 생산자가 다시 사용할 수 있게 합니다.
해양의 대부분의 영역에서 탄소 재메네랄화 속도가 가장 높은 곳은 물기둥의 깊이 100–1,200m(330–3,940ft) 사이이며, 재메네랄화 속도는−1 0.1μmol−1 kg [64]yr로 상당히 일정하게 유지된다.이것은 무기 영양소가 [65]부족한 상부 지표수를 남겨두지만, 포토존 내의 1차 생산자들에게 가장 많은 영양분을 제공합니다.대부분의 재미네랄화는 용해된 유기 탄소(DOC)로 이루어집니다.연구에 따르면 부유 입자와 용해된 유기물은 대부분 재멸멸멸에 [67]의해 소비되는 반면, 물질을[66] 해저로 운반하는 것은 더 큰 침하 입자인 것으로 나타났다.이것은 부분적으로 유기체가 보통 그들보다 작은 영양소를 섭취해야 한다는 사실 때문에 일어난다.[68]미생물 집단이 [69]해양 바이오매스의 90%를 차지하기 때문에,[70] 재멸종을 위해 섭취되는 미생물보다 작은−6 입자들(10개 정도)이다.
식물 플랑크톤의 주요 역할
| 시리즈의 일부 |
| 생물 지구 화학적 순환 |
|---|
 |
해양 식물성 플랑크톤은 지구상에서 광합성의 절반을 수행하며 지구 생물화학적 순환과 기후에 직접적인 영향을 미치지만 미래의 지구 변화에 어떻게 대응할지는 알려지지 않았다.이산화탄소는 지구 변화의 주요 원동력 중 하나이며 21세기의 [72]주요 과제 중 하나로 확인되었습니다.삼림 벌채와 에너지 생성용 화석 연료 연소 등 인위적인 활동에서 발생하는 이산화탄소(CO2)는 표면 해양에서 빠르게 용해되어 해수 pH를 낮추는 반면2, 대기 중에 잔류하는 CO는 지구 온도를 상승시키고 해양 열 성층화를 증가시킨다.대기 중 CO 농도는 산업혁명 이전 약 270ppm으로 추정되지만, 현재2 약 400ppm까지 증가했으며, "평소와 같은2" CO [74][41]배출 시나리오에 따라 금세기 말까지 800-1000ppm에 이를 것으로 예상된다.
해양 생태계는 대기2 CO의 주요 흡수원이며 지상 생태계와 유사한 양의 CO를2 차지한다. 현재 대기 중 [73][74]인공 CO2 배출량의 거의 1/3을 차지한다.대기에서 해양으로 CO의2 순이송은 주로 용해성과 생물학적 [75]펌프의 결합된 영향의 직접적인 결과이다.반면 가용성성을 펌프가 깊은 바다에서 무기 탄소(CO2+중탄산염 소다와 탄산 이온)이 녹아 집중하기, 생물학적 탄소 펌프(중요한 자연스러운 과정과 세계 탄소 순환의 대기 중 이산화 탄소 수치를 조절한다는 주요 요소)양도 모두 유기물과 무기 탄소 1차 생산자들에 의해 고정되어(phy.topplankton)은 해양 내부 및 그 후 기초 [75][34]퇴적물로 유포틱 존에서 발생한다.따라서 생물학적 펌프는 탄소를 수천 년 이상 대기와의 접촉에서 벗어나게 하고 존재하지 [76]않는 경우보다 훨씬 낮은 수준으로2 대기 중 CO를 유지합니다.생물학적 펌프가 없는 바다는 약 11 Gt Cr을−1 해양 내부로 전달하며, 대기 [77][78][41]중 CO 수치가2 현재보다 최대 400ppm까지 높아집니다.
Passow와 Carlson은 표면층으로부터의 침전(심도 약 100m)을 "수출 플럭스"로 정의하고, 메소필러지존으로부터의 침전(심도 약 1000m)을 "시퀀스 플럭스"[44]로 정의했다.일단 탄소가 메소필라그 존 아래로 운반되면, 그것은 100년 또는 그 이상 동안 심해에 머무르게 되고, 따라서 "순열" 플럭스라는 용어를 사용합니다.Bueseler와 Boyd의 모델링 결과에 따르면 1차 생산의 1%에서 40%가 유포틱 [79]존 밖으로 내보내지며, 이는 중엽성 존의 밑부분을 향해 기하급수적으로 감소하며 표면 생산의 약 1%만이 [80]해저에 도달한다.미립자 유기탄소(POC)의 수출효율은 지역별 변동성을 나타낸다.예를 들어 북대서양에서는 순 1차 생산량의 40% 이상이 유포틱 존 밖으로 수출되는데 반해 [79]남태평양에서는 10%에 불과하며, 이는 부분적으로 세포 크기와 조성을 포함한 식물성 플랑크톤 군락의 구성에 의해 추진된다(아래 참조).수출된 유기 탄소는 주로 이종영양 미생물 및 동물성 플랑크톤에 의해 재메랄화된다. 즉, 깊은 바닷물 기둥에서 CO로2 환원된다.따라서 생물학적 탄소 펌프는 용해 무기 탄소(DIC) 농도의 수직 구배를 유지하며, 해양 [81]깊이가 높아질수록 값이 높아진다.이 심해 DIC는 열염 [8][41]순환을 통해 밀레니얼 타임스케일로 대기로 돌아옵니다.
2001년, Hugh 등은 생물 펌프의 효율을 표층으로부터 수출된 탄소량을 광합성(전체 생산)[8]으로 나눈 값으로 표현했다.Bueseler와 Boyd의 모델링 연구는 생물학적 펌프의 전체적인 전달 효율이 계절성,[79] 식물성 플랑크톤 종의 구성, 동물성 플랑크톤에 의한 입자의 조각화, 미생물에 의한 입자의 가용화 등의 요소의 조합에 의해 결정된다는 것을 밝혀냈다.또한 생물학적 펌프의 효율은 유기물이 풍부한 골재의 응집 및 분해, POC 골재와 부유 "발라스트"[82] 광물 간의 상호작용에 좌우됩니다.밸러스트 광물(실리케이트 및 탄산염 바이오미너럴 및 먼지)은 침하를 통해 해양 표면을 떠나는 입자의 주요 성분입니다.이들은 일반적으로 바닷물이나 대부분의 유기물보다 밀도가 높기 때문에 입자 [52]침하 시 필요한 밀도 차이의 큰 부분을 제공합니다.입자의 집합은 작은 부유 입자를 더 크고 빠르게 가라앉는 입자로 변환하여 수직 플럭스를 증가시킵니다.그것은 표층 식물성 플랑크톤 [36]꽃에서 식물성 침전에 중요한 역할을 한다.2015년 터너에 의해 설명되었듯이, 침하 입자의 수직 플럭스는 주로 분변 펠릿, 해양 눈 및 식물성 플랑크톤 꽃의 직접 침전 조합에 기인한다. 이들은 전형적으로 규조류, 코콜리소포리드, 디노플라겔레이트 및 기타 [36]플랑크톤으로 구성되어 있다.해병 눈입니다., 크기에 500µm고 전체phytoplankton(phytodetritus)의 덩어리에서 야기한 경우appendicularian 집, 배설물 그리고 다른 기타 쇄설성 particles,[36]Appendicularians을 분비하다 점막에게 먹이를 주고 구조 또는“집”고는 음식 잔여물 및 삭제를 모으기 위해 버려지는 거시적 유기 총체로 구성되어 있다. 그들어서 그러는데하루 [83]40회.폐기된 부속 주택은 매우 풍부하며(표층수에 m3당 수천 개), 세균, 섬모충류, 편모충류 및 식물성 플랑크톤이 고농도로 있는 미생물 핫스팟이다.따라서 이러한 폐기된 주택은 탄소 순환 [84][41]잠재력 측면에서 동물성 플랑크톤이 직접 생산하는 골재의 가장 중요한 공급원 중 하나이다.

유포틱 존에서 식물성 플랑크톤 군집의 구성은 [80]깊이까지 가라앉는 유기물의 양과 품질을 크게 결정한다.수출 생산에 기여하는 해양 식물성 플랑크톤의 주요 기능군은 질소 정착제(디아조영양 시아노박테리아), 규화제(디아톰), 석회화제(코콜리소포)를 포함한다.이러한 식물성 플랑크톤 그룹은 각각 세포벽과 피복의 크기와 구성이 다르며, 이는 가라앉는 [85]속도에 영향을 미친다.예를 들어, 독립 영양 picoplankton(지름 0.2–2 µm)—which 같은 분류 군에게 포함한다 cyanobacteria(예:프로 클로로 코커스 spp고 시네 코코 커스 spp.)과 prasinophytes 표면에서 크기가 작고 느린 가라앉는 속도(<>0.5m/day)때문에 그 이하 carbon 수출의 원인으로 생각되고(진핵 생물의 다양한 속;2µm <)—are.그리고.미생물 [85][86]고리의 빠른 회전.반면, 규조류(지름 2~500μm)와 같은 대형 식물성 플랑크톤 세포는 급속 침하 [44]골재를 형성하여 탄소를 깊이까지 운반하는 데 매우 효율적이다.그것들은 식물성 플랑크톤에서 독특하다. 왜냐하면 그들은 생물학적 실리카(bSiO2)로 만들어지고 [85][87]밸러스트 역할을 하는 그들의 좌절의 성장과 생산을 위해 규산(Si(OH)4) 형태의 Si를 필요로 하기 때문이다.Miklasz와 [88]Denny의 보고에 따르면, 규조류의 [85][87][88]침하 속도는 하루에 0.4에서 35m 사이일 수 있다.이와 유사하게, 콕콜리소포는 응집과 밸러스트의 중심인 '콕콜리스'라고 불리는 탄산칼슘 판으로 덮여 있으며,[44][85] 하루에 약 5m의 침하 속도를 낸다.해양의 광대한 [80]과영양 영역을 특징짓는 피코피토플랑크톤이 입자 유기 탄소(POC) 플럭스에 실질적으로 기여하지 않는다고 가정했지만, 2007년 리처드슨과 잭슨은 피코플랑크톤 세포를 포함한 모든 식물 플랑크톤이 POC [86]수출에 동등하게 기여한다고 제안했다.그들은 직접 침하(POC로서의 피코플랑크톤의 수출) 및 메소조플랑크톤 또는 대형 필터 공급기 매개 [41]침하(mesooplankton-mediated scling) 모두를 위한 메커니즘으로서 집계에 의존하는 피코플랑크톤 탄소 순환을 위한 대체 경로를 제안했다.
주플랑크톤 방목
허술한 식사
동물성 플랑크톤은 1차 생산자와 해양 식품 거미줄의 영양 수준을 연결하는 것 외에도 생물 펌프를 포함한 해양 생물 지구 화학적 순환에 큰 영향을 미치는 탄소 및 기타 영양소의 "리사이클러"로서 중요한 역할을 한다.이것은 특히 요각류와 크릴새우의 경우이며, 특히 외양의 영양 부족 해역에서 중요하다.동물성 플랑크톤은 분변 펠릿의 엉성한 공급, 배설, 분출, 침출 등을 통해 DOM 사이클링을 제어하고 미생물 루프를 지탱하는 용해유기물(DOM)을 방출한다.흡수 효율, 호흡, 먹이 크기는 모두 동물성 플랑크톤이 어떻게 탄소를 [91]심해에 변형시키고 전달할 수 있는지를 더욱 복잡하게 만듭니다.
갑각류 동물성 플랑크톤 매개 DOM 방출의 80%와 20%는 배설과 허술한 먹이 공급(식량원의 물리적 분해)이다.[93]같은 연구에서 분변 펠릿 침출은 중요하지 않은 요인으로 밝혀졌다.원생동물 방목자의 경우 DOM은 주로 배설과 분출에 의해 방출되며 젤라틴 상태의 동물성 플랑크톤도 점액 생산을 통해 DOM을 방출할 수 있다.분뇨 알갱이의 침출은 최초 분출 후 몇 시간에서 며칠까지 연장될 수 있으며, 그 효과는 음식 농도와 [94][95]품질에 따라 달라질 수 있다.다양한 요인은 동물성 플랑크톤 개체 또는 모집단에서 방출되는 DOM의 양에 영향을 미칠 수 있다.
분변 알갱이
동물성 플랑크톤의 분변 알갱이는 미립자 유기 탄소(POC)를 심해로 이동시키는 데 중요한 매개체가 될 수 있으며, 종종 탄소 격리에 큰 기여를 한다.요각류 군집의 크기 분포는 많은 수의 작은 분변 알갱이가 표층에서 생산된다는 것을 나타낸다.그러나 작은 분뇨 알갱이는 깊은 층에서 드물기 때문에 효율적으로 깊이로 전달되지 않습니다.이는 특히 탄소의 측면에서, 메조 및 배스펠라그에서 작은 분변 알갱이가 분변 알갱이 플럭스에 미미한 기여만 한다는 것을 의미한다.남양에서 가장 생산성이 높은 지역 중 일부를 포함하는 스코샤해에 초점을 맞춘 연구에서, 상층 중엽에 있는 지배적인 분변 알갱이는 원통형이고 타원형인 반면, 난형 분변 알갱이는 욕심맥에서 지배적이었다.크기 분포뿐만 아니라 분변 펠릿 형태학의 변화는 중완골의 표면 펠릿 재포장 및 하부 중완골 및 배시펠라에서의 현장 생산을 가리키며, 이는 동물성 플랑크톤 수직 이동을 통한 분변 펠릿 입력에 의해 증가할 수 있다.이는 남양 내 깊은 층에 대한 탄소의 플럭스가 메소 및 수심 동물성 플랭크톤에 의해 강하게 조절된다는 것을 의미한다. 즉, 이러한 구역의 군집 구조가 해양 [92]깊이로 분변 펠릿 이동의 효율성에 큰 영향을 미친다는 것을 의미한다.
흡수 효율(AE)은 플랑크톤에 의해 흡수되는 식품의 비율로, 소비된 유기 물질이 요구되는 생리학적 [91]요구를 충족하는 데 얼마나 이용 가능한지를 결정합니다.먹이 공급 속도와 먹이 구성에 따라 AE의 변화는 분변 펠릿 생산의 변화를 초래할 수 있으며, 따라서 해양 환경으로 재활용되는 유기 물질의 양을 조절합니다.공급 속도가 낮으면 일반적으로 높은 AE와 작고 밀도가 높은 알갱이가 생기지만, 공급 속도가 높으면 일반적으로 낮은 AE와 더 많은 유기 함량을 가진 더 큰 알갱이가 생기게 됩니다.DOM 릴리스의 다른 요인으로는 호흡수가 있습니다.산소 가용성, pH 및 빛 조건과 같은 물리적 요인은 전체 산소 소비량과 호흡2 CO의 형태로 동물성 플랑크톤에서 손실되는 탄소의 양에 영향을 미칠 수 있다.동물성 플랑크톤과 먹잇감의 상대적 크기는 또한 엉성한 먹이를 통해 얼마나 많은 탄소가 방출되는지를 중재한다.더 작은 먹잇감은 통째로 섭취되는 반면, 더 큰 먹잇감은 더 "슬롭게" 먹힐 수 있는데, [96][97]이는 비효율적인 소비를 통해 더 많은 생체 물질이 방출된다는 것이다.육식성 식단이 잡식성 [94]식단보다 더 많은 용해성 유기 탄소(DOC)와 암모늄을 방출하면서, 식단 구성이 영양소 방출에 영향을 미칠 수 있다는 증거도 있다.
미생물 루프
세균 용해
미생물 루프는 용해된 유기 탄소(DOC)가 박테리아 바이오매스에 결합되어 더 높은 영양 수준으로 돌아간 후 식물성 플랑크톤-동물성 플랑크톤-넥톤에 의해 형성된 고전적인 먹이사슬과 결합되는 해양 미생물 먹이 거미줄의 영양 경로를 설명합니다.미생물 루프라는 용어는 1983년 Farooq Azam, Tom Fenchel [98]등에 의해 해양 환경의 탄소와 영양 순환에서 박테리아가 수행하는 역할을 포함시키기 위해 만들어졌다.일반적으로 용해된 유기 탄소는 박테리아 용해, 식물성 플랑크톤으로부터의 고정 탄소의 누출 또는 삼출(예를 들어, 디아톰으로부터의 점액질 엑소폴리머), 갑작스런 세포 노화, 동물성 플랑크톤에 의한 엉성한 먹이, 수생 동물에 의한 폐기물의 배설 또는 분해 또는 용해로부터 해양 환경에 도입된다.육지 식물과 [99]토양에서 추출된 rganic 입자.미생물 고리의 박테리아는 이 미립자 잔여물을 분해하여 이 에너지가 풍부한 물질을 성장을 위해 이용합니다.해양 생태계에서 유기물의 95% 이상이 고분자, 고분자량(HMW) 화합물(예: 단백질, 다당류, 지질)로 구성되어 있기 때문에, 전체 용해 유기물(DOM)의 극히 일부만이 영양 수준이 높은 대부분의 해양 생물에게 쉽게 이용 가능하다.이것은 용해된 유기 탄소가 대부분의 해양 생물에게 직접적으로 제공되지 않는다는 것을 의미합니다; 해양 박테리아는 이 유기 탄소를 먹이 그물로 유입시켜, 결과적으로 더 높은 영양 수준으로 [100]추가 에너지를 이용할 수 있게 됩니다.
바이러스 분로
전 세계 해양에서 식물 플랑크톤에서 생산되는 주요 생산물의 25%가 바이러스 [101]분해를 통해 미생물 루프 내에서 재활용될 수 있다.바이러스 션트는 해양바이러스가 미생물이 쉽게 흡수할 수 있는 미생물 미립자 유기물(POM)을 용해유기물(DOM)로 재활용해 영양수치가 올라가는 것을 막는 메커니즘이다.바이러스 분로 경로에 의해 재활용된 DOM은 해양 [102]DOM의 다른 주요 공급원에 의해 생성된 양에 필적합니다.바이러스는 [103][104]미생물에 비해 상대적으로 풍부하기 때문에 미생물 루프에 있는 미생물을 쉽게 감염시킬 수 있다.원핵생물과 진핵생물의 사망률은 세포 용해를 통한 탄소 영양소 재활용에 기여한다.질소(특히 암모늄) 재생의 증거도 있다.이 영양소 재활용은 미생물의 [105]성장을 촉진하는데 도움을 준다.
매크로 유기체
젤리폴
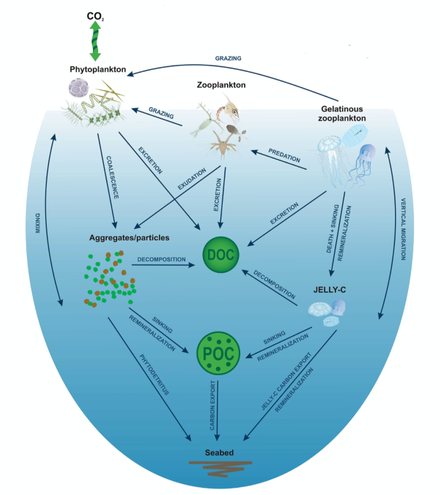
젤리 낙하란 젤라틴 상태의 동물성 플랑크톤(주로 카니다리아)이 해저로 가라앉고 빠르게 가라앉는 입자 유기물을 [107]통해 탄소와 질소 플럭스를 향상시키는 해양 탄소 순환 이벤트입니다.이러한 사건들은 해저 거대 동물군과 [108][109]박테리아에게 영양을 공급한다.젤리 방울은 생물학적 [110]펌프를 통한 불안정한 생물 발생 탄소의 격리를 위한 주요 "겔라틴 경로"와 관련이 있다.이러한 사건은 1차 생산량과 수질이 높은 보호 지역에서 흔히 발생한다.이 지역들은 하구를 포함하며 노르웨이의 [109]피오르드에서 몇 가지 연구가 수행되었다.

고래 펌프

고래와 다른 해양 포유동물들은 또한 응집성 분뇨의 [112][113]방출을 통해 표면 근처의 질소를 농축함으로써 그들의 먹이 영역의 1차 생산성을 향상시킨다.예를 들어, 고래와 바다표범은 메인만의 유포틱 지역에서 모든 강의 유입량을 합친 것보다 더 많은 질소를 보충하는 역할을 할 수 있다.이 상향 고래 펌프는 산업 어업이 해양 포유류의 자원을 황폐화시키기 전에 훨씬 더 큰 역할을 했습니다. 이때 질소의 재활용은 대기 중 [112]질소 투입량의 세 배 이상이었을 것입니다.
생물학적 펌프는 무척추동물과 [114]어류의 골재, 대변, 수직 이동의 하향 흐름을 통해 유포틱 존에서 탄소와 질소의 제거를 중개합니다.요각류 및 다른 동물성 플랑크톤은 가라앉는 분변 알갱이를 생성하고 이동 주기 동안 깊은 곳에서 호흡 및 배설함으로써 용해 및 미립자 유기물의 하향 수송에 기여하며, 따라서 지표수에서 [115][116][112]영양소(N, P, Fe)의 수출에 중요한 역할을 한다.
동물성 플랑크톤은 유포틱 지역에서 먹이를 먹고 분변 알갱이 침하와 수직 이동을 통해 영양분을 수출한다.물고기는 전형적으로 먹이를 주는 것과 같은 깊이로 영양분을 방출한다.해양 포유동물의 배설은 호흡을 위해 지표면에 묶여 있으며 물기둥에서 먹이를 [112]먹는 곳보다 더 얕을 것으로 예상된다.
해양 포유류는 중요한 생태계 서비스를 제공한다.전세계적으로, 그들은 고래 [117]사체가 가라앉는 것을 통해 지표수에서 심해로 탄소를 수출하고 수정 이벤트를 통해 기후에 영향을 미칠 수 있다.해안 지역에서 고래는 지역적으로 영양분을 보유하고 있어 생태계 생산성을 높이고 상업적인 [112]어종을 포함한 다른 해양 소비자들을 위한 운반 능력을 높일 수 있다.탄소 격리 측면에서 고래 한 마리는 수천 그루의 [118]나무와 맞먹는 것으로 추정되어 왔다.
수직 이행
수직으로 이동하는 크릴, 살포, 작은 동물성 플랑크톤 및 물고기는 밤에 표층에서 POC를 섭취하고 낮의 메소펠라 거주 깊이에서 이를 대사함으로써 탄소를 깊이까지 능동적으로 운반할 수 있다.종족의 생활력에 따라 계절에 따라 활발한 이동도 일어날 수 있다.[31]
수직 이동 없이는 생물 펌프가 거의 효율적이지 못할 것이다.유기체는 밤에 먹이를 먹기 위해 위로 이동하기 때문에 낮에 깊이까지 이동하면 가라앉는 큰 분뇨 알갱이들을 배설합니다.몇몇 큰 분뇨 알갱이들은 꽤 빨리 가라앉을 수 있지만, 유기체가 다시 깊이로 이동하는 속도는 여전히 더 빠르다.야간 생물은 물기둥의 상위 100m에 속하지만 낮에는 800~1000m까지 내려갑니다.만약 유기체가 표면에서 변을 본다면, 분뇨 알갱이가 몇 시간 안에 도달하는 깊이에 도달하는 데 며칠이 걸릴 것이다.따라서, 분뇨 알갱이를 수심까지 방출함으로써, 그들은 심해로 가기 위해 거의 1000m를 덜 이동할 수 있습니다.이것은 액티브 트랜스포트라고 불리는 것입니다.그 유기체들은 유기물을 깊은 곳으로 옮기는 데 더 적극적인 역할을 하고 있다.심해, 특히 해양 미생물의 대부분은 영양분이 떨어지는 것에 의존하기 때문에, 그들은 해저에 [43]더 빨리 도달할 수 있습니다.
동물성 플랑크톤과 살푸스는 분변 펠릿의 활발한 수송에 큰 역할을 한다.동물성 플랑크톤 바이오매스의 15~50%가 이동하는 것으로 추정되며,[43] 이는 입자상 유기 질소의 5~45%를 차지한다.살푸스는 800미터의 수직 이동을 할 수 있고 수면에서 많은 양의 음식을 먹을 수 있는 커다란 젤라틴 모양의 플랑크톤입니다.그들은 내장 유지 시간이 매우 길기 때문에, 분뇨 알갱이는 보통 최대 깊이로 방출됩니다.살구는 또한 가장 큰 분뇨 알갱이를 가지고 있는 것으로 알려져 있다.이 때문에 침하 속도가 매우 빠르기 때문에 작은 먼지 입자가 그 위에 모이는 것으로 알려져 있습니다.이렇게 하면 훨씬 더 빨리 가라앉을 수 있어요.그래서 현재 왜 유기체가 수직으로 이동하는지에 대한 많은 연구가 이루어지고 있지만, 수직 이동은 용해된 유기물을 [119]깊이까지 능동적으로 운반하는 데 큰 역할을 하는 것이 분명하다.
지질 펌프
지질 펌프는 수직 이동성 동물성 플랑크톤과 관련된 지질들을 통해 해양 표면에서 더 깊은 물로 탄소를 격리시킵니다.지질은 세포 구조에 필수적인 탄화수소, 질소 및 인 결핍 화합물의 한 종류입니다.지질과 관련된 탄소는 지질 매장량의 호흡에 의해 생성된 이산화탄소와 동물성 플랑크톤의 사망으로 인한 유기물로 깊은 바다로 들어간다.보다 일반적인 생물학적 펌프와 비교하여, 지질 펌프는 또한 지질 분로를 초래하는데, 그곳에서 과도하게 소비되는 질소와 인과 같은 다른 영양소는 표면 환경으로 다시 배출되어야 하며,[120] 따라서 바다의 표면 혼합층에서 제거되지 않습니다.이것은 지질 펌프에 의해 운반되는 탄소가 해양 표면에서 필수 영양소의 가용성을 제한하지 않는다는 것을 의미합니다.따라서 지질 펌프를 통한 탄소 격리는 영양소 제거에서 분리되며, 해양 1차 생산에 의한 탄소 흡수가 지속됩니다.생물학적 펌프에서 영양소 제거는 항상 탄소 격리와 결합됩니다. 1차 생산은 탄소와 영양소가 유기물의 [120]형태로 깊이까지 함께 운반되기 때문에 제한됩니다.지질 펌프가 심해에서 탄소를 분리하는 데 미치는 영향은 상당하다. 북극해의 칼라누스속 요각류에 의해 1,000m(3,300ft) 이하로 운반되는 탄소는 이 [121]지역의 입자 유기 탄소(POC)에 의해 매년 같은 깊이 이하로 운반되는 탄소와 거의 같다.이 운반된 탄소의 상당 부분은 호흡과 사망률 때문에 지표로 돌아오지 않을 것이다.깊이에 [120][121][122]남아있는 양을 더 정확하게 추정하기 위한 연구가 진행 중이다.지질 펌프의 수출 속도는 계절 이동 동물성 플랑크톤을 [122]포함하는 온대 및 아극 지역 전체에서 1~9.3 g Cm−2−1 y로 달라질 수 있다.식용 거미줄에서 동물성 플랑크톤, 특히 요각류의 역할은 요각류인 영양 수준이 높은 유기체의 생존에 매우 중요합니다.기후 변화로 인해 해양이 따뜻해지고 만년설이 녹으면서 지질 펌프와 관련된 생물들이 영향을 받아 상업적으로 중요한 많은 물고기와 멸종 위기에 처한 해양 [123][124][125]포유류의 생존에 영향을 미칠 수 있다.해양 탄소 격리의 새로운 그리고 이전에 정량화되지 않은 요소로서, 지질 펌프에 대한 추가 연구는 지구 해양 [120][121][122]시스템의 탄소 플럭스의 정확성과 전반적인 이해를 향상시킬 수 있습니다.
생물발광분로
빛 기관 공생의 발광 박테리아는 청소년인 동안 숙주(오징어, 물고기)에 의해 해수로부터 순차적으로 획득된 후 정기적으로 [126]바다로 방출된다.
오른쪽 그림에서는 광기관의 위치에 따라 장에서 분변 펠릿으로 발광균이 방출되거나 바닷물로 직접 방출된다(스텝 1).운동성 발광 박테리아는 물기둥을 따라 가라앉은 유기물을 군집화시킨다.분변 알갱이와 입자를 형성하는 생물 발광 박테리아는 동물성 플랑크톤 소비율에 영향을 미친다.이러한 시각적 표지는 검출("bait 가설")과 흡인력 및 상위 영양 레벨에 의한 포식력을 증가시킨다(2단계).메소필라직에서, 동물성 플랑크톤과 그 포식자들은 가라앉는 발광 입자와 분변 알갱이를 먹고 살며, 이들은 빠른 가라앉는 속도의 집합체(재포장) 또는 느린 가라앉는 속도의 유기물 조각(3단계)[126]을 형성한다.
필터 피더는 또한 광물질의 특별한 시각적 검출 및 선택 없이 침하 유기물을 집적한다.발광성 식품을 섭취하는 다이엘(및 계절성) 수직 이동기는 표면에서 발광성 분변 알갱이를 중배엽으로 대사하고 방출한다(4단계).이것은 동물성 플랑크톤이나 심지어 장거리를 활발하게 헤엄치는 일부 물고기의 경우, 큰 공간적 규모로 생물 발광 박테리아가 분산된다는 것을 의미한다.입자에 부착된 발광균이 해저에 가라앉아 해양학적 물리적 조건(5단계)에 의해 퇴적물이 다시 부유해 에피저생 생물에 의해 소비될 수 있다.계측기는 (a) 플랑크톤 그물, (b) 어망, (c) 니스킨 물채취기, (d) 욕광도계, (e) 침전물 트랩, (f) 자율 수중 차량, (g) 광전자 증배 모듈, (h) 천체물리학 광학 모듈 ANTARES 및 (i-j) 원격 작동 [126]차량이다.
정량화

탄소 순환의 지질학적 구성요소는 지구 탄소 순환의 다른 부분에 비해 느리게 작동합니다.그것은 대기 중의 탄소량과 지구 [128]온도의 가장 중요한 결정 요인 중 하나이다.
생물학적 펌프가 지구의 탄소 순환에서 중요한 역할을 하기 때문에, 그 강도를 수량화하는 데 상당한 노력이 소요됩니다.그러나 그것들은 보통 깊이에서 잘 제약되지 않은 생태적 상호작용의 결과로 발생하기 때문에 생물학적 펌프를 형성하는 과정은 측정하기가 어렵다.일반적인 방법은 질산염과 암모늄이 침하물질의 재메네랄화와 관련된 다른 공급원을 가지고 있기 때문에 이들 영양소의 1차 생산을 추정하는 것이다.이들로부터 생물학적 펌프의 국소 강도에 대한 대용물인 이른바 f-ratio를 도출할 수 있다.지역 연구 결과를 지구 규모로 적용하는 것은 해양의 [129]순환이 다른 지역에서 수행하는 역할에 따라 복잡하다.
인위적 변화
토지 이용의 변화, 화석 연료의 연소, 시멘트의 생산은 대기 중의 CO2 농도를 증가시켰다.현재 인공 CO 배출량의2 약 3분의 1(약 2 Pg−1 Cy =[130][131][unreliable source?] 연간 215 × 10g의 탄소)이 바다로 유입될 수 있지만,[132] 이는 상당히 불확실하다.일부 연구에 따르면 CO의2 증가와 해양 1차 생산 간의 연관성이 존재한다.[133]

기후 변화는 미래의 해수면을 따뜻하게 하고 층화함으로써 생물 펌프에 영향을 미칠 수 있다.이것은 영양소의 공급을 감소시켜 그곳의 1차 생산을 감소시킬 수 있다고 믿어진다.또, 해양 산성화에 의한 석회화 생물의 생태적 성공 변화는 경조직 [136]펌프의 강도를 변화시킴으로써 생물 펌프에 영향을 줄 수 있다.그러면 탄산칼슘이 침하하는 [137]밸러스트에 작용하기 때문에 연조직 펌프에 "노크온" 효과가 있을 수 있습니다.
오른쪽의 두 번째 다이어그램은 북극 탄소량에 대한 해빙 감소와 영구 동토층 해빙의 가능한 영향을 보여줍니다.땅에서는 식물이 탄소를 흡수하는 반면 토양 속 미생물은 메탄과 이산화탄소를2 배출한다.호수는 메탄 순 방출체이며, 유기 및 무기 탄소(용해 및 미립자)가 담수 시스템을 통해 바다로 유입됩니다.바다에서는 해빙된 해저 영구 동토층에서 메탄이 방출될 수 있으며2, 대기 중 CO가2 물 속에서 저포화돼 CO가 흡수된다.또한 다중 플럭스는 해빙과 밀접하게 관련되어 있습니다.현재 최선의 대기 플럭스 추정치는 이용 가능한 경우−1 Tg C 연도에 제시된다.호수에 대한 방출 추정치는 다른 지상 플럭스에 대한 북극 툰드라의 좁은 정의보다는 ~50µN 북쪽 지역에 대한 것이다.사용 가능한 경우, 불확실성 범위는 괄호로 둘러싸여 있습니다.화살표는 각 [135][134]플럭스의 크기를 나타내지 않습니다.
생물학적 펌프는 과거 빙하-간빙기 동안 대기 중2 CO 변동에 중요한 역할을 한 것으로 생각된다.하지만 생물학적 펌프가 미래의 기후 [36]변화에 어떻게 반응할지는 아직 명확하지 않다.이러한 예측이 타당하기 위해서는 우선 미래의 대기 CO2 변화에 대한 생물학적 펌프의 핵심 구성요소 중 하나인 식물성 플랑크톤의 반응을 해독하는 것이 중요하다.그들의 계통학적 다양성 때문에, 다른 식물성 플랑크톤 분류군은 기후 변화에 다른 방식으로 [85]반응할 것이다.예를 들어, 미래의 바다의 [138]성층화 증가로 인해 규조류의 양이 감소할 것으로 예상된다.규조류는 크고 빠르게 가라앉는 골재를 형성하여 탄소를 깊이로 운반하는 데 매우 효율적이며, 그 수가 감소하면 탄소 [44]수출 감소로 이어질 수 있습니다.
또한 해양 산성화에 의한 해양 pH의 감소는 석회질 판을 생성하는 콕콜리소포의 능력을 저해하여 생물 펌프에 [85]영향을 미칠 수 있지만, 일부 종은 다른 [139]종보다 더 민감한 것으로 보인다.따라서 이들 또는 다른 식물성 플랑크톤 분류군의 상대적 풍부함의 미래 변화는 전체 해양 생산성에 현저한 영향을 미칠 수 있으며, 이후 해양 생물 지구 화학과 탄소 저장에 영향을 미칠 수 있다.2015년 연구에서는 1960년대 이후 북대서양의 콕콜리소포어 농도가 몇 배나 증가했으며 흡수된2 CO와 온도 증가가 [140]이러한 증가의 가장 유력한 원인으로 모델링되었다.2017년 연구에서 젠슨 외 연구진.생물학적 펌프에 중요한 두 식물성 플랑크톤 종의 미래 전지구적 분포를 예측하기 위해 종 분포 모델링(SDM)을 사용했다. 즉, 규조류 채토케로스 디아데마와 콕콜리소포어 에밀리아 헉슬레이이다.[141]이들은 IPCC 대표 집중 경로 시나리오 8.5에 기술된 환경 데이터를 채택했다. 이 시나리오에서는 산업화 이전의 가치에 대해 2100년의 복사 강제력을 예측한다.이들의 모델링 결과는 조사된 기후 시나리오에서 C. diadema와 E. huxleyi로 커버된 총 해양 면적이 각각 8%와 16% 감소할 것으로 예측했다.그들은 이러한 미래 해양 조건 하에서 이 두 식물성 플랑크톤 종의 범위와 분포의 변화가 실현된다면, 생물학적 [41]펌프를 통한 탄소 격리에 대한 기여가 줄어들 것이라고 예측했다.2019년 연구에 따르면 현재의 해수 산성화 속도에서는 금세기 [142]말 이전에 남극 식물 플랑크톤이 더 작고 탄소를 저장하는 데 덜 효과적이라는 것을 알 수 있었다.
필요한 조사
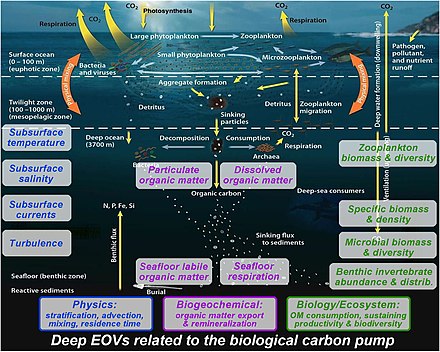
생물학적 [143]펌프를 올바르게 이해하기 위해서는 심층수 컬럼에 대한 다원적 관찰이 여전히 필요합니다.
- 물리: 층화는 입자 침하에 영향을 미칩니다.심해에서의 입자 재미네랄화로부터 입자의 기원과 DIC의 체류 시간을 이해하기 위해서는 이류와 [143]혼합의 측정이 필요합니다.
- 생물지구화학: 표층으로부터의 미립자와 용해된 유기물의 수출/혼합은 해저에 도달하는 불안정한 유기물을 결정하며, 해저 생물에 의해 호흡되거나 [143]침전물에 장기간 저장된다.
- 생물학과 생태계: 동물성 플랑크톤과 미생물은 물기둥의 가라앉는 입자를 분해하고 재메랄화한다.수출된 유기물은 바이오매스, 밀도, [143]생물다양성을 유지하는 모든 물기둥과 해저생물(동물, 해저 무척추동물, 미생물)을 공급한다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Sigman DM & GH Haug, 2006.과거의 생물학적 펌프.인: 지구화학에 관한 논문; 제6권, (ed.)퍼가몬 프레스, 491-528페이지
- ^ a b Hain, M.P.; Sigman, D.M.; Haug, G.H. (2014). The Biological Pump in the Past (PDF). Treatise on Geochemistry, 2nd Edition. Vol. 8. pp. 485–517. doi:10.1016/B978-0-08-095975-7.00618-5. ISBN 9780080983004. Retrieved 1 June 2015.
- ^ a b Boscolo-Galazzo, F, 크라이튼은,인 KAApplegate;바커, S, 피어슨, 타진음.(2018년).신진 대사율의 위쪽의 해양에서``온도 의존:.기후 변화에 긍정적인 피드백?"라고.위성 및 행성 변경 글로벌.170:201–212.Bibcode:2018GPC...170..201B. doi:10.1016/j.gloplacha.2018.08.017.수정 텍스트는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Volk, Tyler; Hoffert, Martin I. (2013). "Ocean Carbon Pumps: Analysis of Relative Strengths and Efficiencies in Ocean-Driven Atmospheric CO2 Changes". The Carbon Cycle and Atmospheric CO2 : Natural Variations Archean to Present. Geophysical Monograph Series. pp. 99–110. doi:10.1029/GM032p0099. ISBN 9781118664322.
- ^ a b Sarmiento, Jorge L. (17 July 2013). Ocean Biogeochemical Dynamics. p. 526. ISBN 9781400849079.
- ^ 미델 뷔르흐, 잭은 J.(2019년)."그 반환 유기에서 무기 탄소에".해양 탄소 Biogeochemistry.지구 시스템 과학에 SpringerBriefs.를 대신하여 서명함. 37–56. doi:10.1007/978-3-030-10822-9_3.아이 에스비엔 978-3-030-10821-2.S2CID 104330175.수정 텍스트는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ a b c d e f g de la Rocha, C.L.; Passow, U. (2014). "The Biological Pump". Treatise on Geochemistry. pp. 93–122. doi:10.1016/B978-0-08-095975-7.00604-5. ISBN 9780080983004.
- ^ a b c d Ducklow, Hugh; Steinberg, Deborah; Buesseler, Ken (2001). "Upper Ocean Carbon Export and the Biological Pump". Oceanography. 14 (4): 50–58. doi:10.5670/oceanog.2001.06.
 수정된 텍스트는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 원본에서 복사되었습니다.
수정된 텍스트는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 원본에서 복사되었습니다. - ^ Monroy, P., Herndez-Garcia, E., Rossi, V. 및 Lopez, C.(2017) "해양 흐름에서 생물 입자의 동적 침하를 모델링"지구물리학의 비선형 프로세스, 24(2): 293–305. doi:10.5194/npg-24-293-2017.
 수정된 텍스트는 Creative Commons Attribution 3.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
수정된 텍스트는 Creative Commons Attribution 3.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ Simon, M., Grossart, H., Schweitzer, B. 및 Floug, H.(2002) "수생 생태계에서 유기 골재의 미생물 생태"수생 미생물 생태, 28:175~211.doi:10.3354/ame028175.
- ^ Sigman, D.M.; Hain, M.P. (2012). "The Biological Productivity of the Ocean" (PDF). Nature Education Knowledge. 3 (6): 1–16. Retrieved 1 June 2015.
The value of NEP [Net Ecosystem Production] depends on the boundaries defined for the ecosystem. If one considers the sunlit surface ocean down to the 1% light level (the “euphotic zone”) over the course of an entire year, then NEP is equivalent to the particulate organic carbon sinking into the dark ocean interior plus the dissolved organic carbon being circulated out of the euphotic zone. In this case, NEP is also often referred to as “export production” (or “new production” (Dugdale & Goering 1967), as discussed below).
- ^ Martiny, Adam C.; Pham, Chau T. A.; Primeau, Francois W.; Vrugt, Jasper A.; Moore, J. Keith; Levin, Simon A.; Lomas, Michael W. (April 2013). "Strong latitudinal patterns in the elemental ratios of marine plankton and organic matter". Nature Geoscience. 6 (4): 279–283. Bibcode:2013NatGe...6..279M. doi:10.1038/NGEO1757. S2CID 5677709.
- ^ a b c 하인리히 마라 E.;모리, 코린나;Dlugosch, 레온(2020년)."수생 생물체와 그들의 화학 환경 Elucidated 사이에 다른 전망에서 단지 상호 작용".YOUMARES 9- 넘쳐나는:우리 연구, 변화하는 미래.를 대신하여 서명함. 279–297. doi:10.1007/978-3-030-20389-4_15.아이 에스비엔 978-3-030-20388-7. S2CID 210308256.수정 텍스트는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Carlson CA (2002) [books.google.com/books?id=D6TMKZOgldAC&q=%22Production+and+removal+processes%22&pg=PA91 "생산 및 제거 프로세스"]인: Hansell DA, Carlson CA (eds) 해양용해유기물의 생물지구화학.학술 출판사, 샌디에이고, 91~151쪽.ISBN 9780123238412.
- ^ Capelle, 데이비드 안스, Kuzyk, 추 추 A;Papakyriakou, 팀;Guéguen, Céline, 밀러, 리사 A., 맥도널드, 로비 W(2020년)."지상파 유기 물질의 해양 산성화와 이산화 탄소 흐름에 북극 선반 바다에 미치는 영향".진보 해양에. 185:102319.Bibcode:2020PrOce.18502319C. doi:10.1016/j.pocean.2020.102319.수정 텍스트는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Mitchell, C.; Hu, C.; Bowler, B.; Drapeau, D.; Balch, W. M. (2017). "Estimating Particulate Inorganic Carbon Concentrations of the Global Ocean from Ocean Color Measurements Using a Reflectance Difference Approach". Journal of Geophysical Research: Oceans. 122 (11): 8707–8720. Bibcode:2017JGRC..122.8707M. doi:10.1002/2017JC013146.
- ^ Wilson, R. W.; Millero, F. J.; Taylor, J. R.; Walsh, P. J.; Christensen, V.; Jennings, S.; Grosell, M. (16 January 2009). "Contribution of Fish to the Marine Inorganic Carbon Cycle". Science. 323 (5912): 359–362. Bibcode:2009Sci...323..359W. doi:10.1126/science.1157972. PMID 19150840. S2CID 36321414.
- ^ 필슨 MEQ, 2012년바다의 화학 입문케임브리지 대학 출판부, 페이지
- ^ Hain, M.P.; Sigman, D.M.; Haug, G.H. (2010). "Carbon dioxide effects of Antarctic stratification, North Atlantic Intermediate Water formation, and subantarctic nutrient drawdown during the last ice age: Diagnosis and synthesis in a geochemical box model". Global Biogeochemical Cycles. 24 (4): 1–19. Bibcode:2010GBioC..24.4023H. doi:10.1029/2010GB003790.
- ^ Webb, Paul (2019) 해양학 입문, 12장: 해양 퇴적물, 273-297페이지, Rebus Community.2020년 갱신.
- ^ H., Schlesinger, William (2013). Biogeochemistry : an analysis of global change. Bernhardt, Emily S. (3rd ed.). Waltham, Mass.: Academic Press. ISBN 9780123858740. OCLC 827935936.
- ^ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; Högberg, P. (13 October 2000). "The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System". Science. 290 (5490): 291–296. Bibcode:2000Sci...290..291F. doi:10.1126/science.290.5490.291. ISSN 0036-8075. PMID 11030643.
- ^ Raven, J. A.; P. G. Falkowski (1999). "Oceanic sinks for atmospheric CO2". Plant, Cell and Environment. 22 (6): 741–755. doi:10.1046/j.1365-3040.1999.00419.x.
- ^ Raven, J. A.; Falkowski, P. G. (1999). "Oceanic sinks for atmospheric CO2". Plant, Cell and Environment. 22 (6): 741–755. doi:10.1046/j.1365-3040.1999.00419.x.
- ^ Hain, M.P.; Sigman, D.M.; Haug, G.H (2014). "The Biological Pump in the Past". Treatise on Geochemistry. 8: 485–517. doi:10.1016/B978-0-08-095975-7.00618-5. ISBN 9780080983004.
- ^ a b Rost, Bjorn; Reibessel, Ulf (2004). Coccolithophores and the biological pump: responses to environmental changes. Berlin, Heidelberg: Springer. ISBN 978-3-642-06016-8.
- ^ 지베, R.E., 2016년"탄산칼슘 카운터 펌프: 기초, 시간의 경과에 따른 진화, 장래의 피드백.미국 지구물리학 연합, 페이지.B23A-08.
- ^ a b c Tsunogai, S.; Watanabe, S.; Sato, T. (1999). "Is there a "continental shelf pump" for the absorption of atmospheric CO2". Tellus B. 51 (3): 701–712. Bibcode:1999TellB..51..701T. doi:10.1034/j.1600-0889.1999.t01-2-00010.x.
- ^ 울라스트, R. (1998년)연안 지역과 외양 지역의 지구 탄소 순환 평가 및 비교, 페이지 213-252.K. H. 브링크와 A. R. 로빈슨(에드)의 글로벌 코스트 오션.John Wiley & Sons.
- ^ Rippeth, T. P.; Scourse, J. D.; Uehara, K.; McKeown, S. (2008). "Impact of sea-level rise over the last deglacial transition on the strength of the continental shelf CO2 pump". Geophys. Res. Lett. 35 (24): L24604. Bibcode:2008GeoRL..3524604R. doi:10.1029/2008GL035880. S2CID 1049049.
- ^ a b c Cavan, E.L., Belcher, A., 앳킨슨, A., 힐, S.L, 가와구치, S., Meyer, B., 니콜, S., Ratnarah, L. 슈미트, K. 및 D.2019.Nature Communications, 10 (1) : 1 ~13. doi : 10.1038/s41467-019-12668-7.
 수정된 텍스트는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 원본에서 복사되었습니다.
수정된 텍스트는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 원본에서 복사되었습니다. - ^ Lampitt, R. S.; Noji, T.; von Bodungen, B. (1990). "What happens to zooplankton faecal pellets? Implications for material flux". Marine Biology. 104: 15–23. doi:10.1007/BF01313152. S2CID 86523326.
- ^ Bishop, James (2009). "Autonomous Observations of the Ocean Biological Carbon Pump". Oceanography. 22 (2): 182–193. doi:10.5670/oceanog.2009.48.
- ^ a b Chisholm, Sallie W. (1995). "The iron hypothesis: Basic research meets environmental policy". Reviews of Geophysics. 33 (S2): 1277–1286. Bibcode:1995RvGeo..33S1277C. doi:10.1029/95RG00743.
- ^ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; Högberg, P.; Linder, S.; MacKenzie, F. T.; Moore b, 3rd; Pedersen, T.; Rosenthal, Y.; Seitzinger, S.; Smetacek, V.; Steffen, W. (2000). "The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System". Science. 290 (5490): 291–296. Bibcode:2000Sci...290..291F. doi:10.1126/science.290.5490.291. PMID 11030643.
- ^ a b c d e f Turner, Jefferson T. (2015). "Zooplankton fecal pellets, marine snow, phytodetritus and the ocean's biological pump". Progress in Oceanography. 130: 205–248. Bibcode:2015PrOce.130..205T. doi:10.1016/j.pocean.2014.08.005.
- ^ a b Kim, Ja-Myung; Lee, Kitack; Shin, Kyungsoon; Yang, Eun Jin; Engel, Anja; Karl, David M.; Kim, Hyun-Cheol (2011). "Shifts in biogenic carbon flow from particulate to dissolved forms under high carbon dioxide and warm ocean conditions". Geophysical Research Letters. 38 (8): n/a. Bibcode:2011GeoRL..38.8612K. doi:10.1029/2011GL047346.
- ^ Hansell, Dennis; Carlson, Craig; Repeta, Daniel; Schlitzer, Reiner (2009). "Dissolved Organic Matter in the Ocean: A Controversy Stimulates New Insights". Oceanography. 22 (4): 202–211. doi:10.5670/oceanog.2009.109.
- ^ Carlson, Craig A.; Ducklow, Hugh W.; Michaels, Anthony F. (1994). "Annual flux of dissolved organic carbon from the euphotic zone in the northwestern Sargasso Sea". Nature. 371 (6496): 405–408. Bibcode:1994Natur.371..405C. doi:10.1038/371405a0. S2CID 4279712.
- ^ Roshan, Saeed; Devries, Timothy (2017). "Efficient dissolved organic carbon production and export in the oligotrophic ocean". Nature Communications. 8 (1): 2036. Bibcode:2017NatCo...8.2036R. doi:10.1038/s41467-017-02227-3. PMC 5725454. PMID 29230041.
- ^ a b c d e f g h i Basu, Samarpita; MacKey, Katherine (2018). "Phytoplankton as Key Mediators of the Biological Carbon Pump: Their Responses to a Changing Climate". Sustainability. 10 (3): 869. doi:10.3390/su10030869.
 수정된 텍스트는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 원본에서 복사되었습니다.
수정된 텍스트는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 원본에서 복사되었습니다. - ^ a b c Ionescu, 대니, Bizic-Ionescu, 미나야;할릴리, Arzhang, Malekmohammadi, 레자;Morad, 모하마드 레자, 드 비어, 디르크;Grossart, Hans-Peter(2015년).POM-bacteria 상호 작용에 장기 연구를 " 새로운 도구:.그 100년 된 보틀 Effect" 극복.과학 보고서.5:14706.Bibcode:2015NatSR...514706I.doi:10.1038/srep14706.PMC 4592964.PMID 26435525.수정 텍스트는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ a b c Steinberg, Deborah; Sarah Goldthwait; Dennis Hansell (2002). "Zooplankton vertical migration and the active transport of dissolved organic and inorganic nitrogen in the Sargasso Sea". Deep-Sea Research Part I. 49 (8): 1445–1461. Bibcode:2002DSRI...49.1445S. CiteSeerX 10.1.1.391.7622. doi:10.1016/S0967-0637(02)00037-7. ISSN 0967-0637.
- ^ a b c d e f Passow, U.; Carlson, CA (2012). "The biological pump in a high CO2 world". Marine Ecology Progress Series. 470: 249–271. Bibcode:2012MEPS..470..249P. doi:10.3354/meps09985.
- ^ Robinson, J.; Popova, E.E.; Yool, A.; Srokosz, M.A.; Lampitt, R.S.; Blundell, J.R. (2014). "How deep is deep enough? Ocean iron fertilization and carbon sequestration in the Southern Ocean" (PDF). Geophys. Res. Lett. 41 (7): 2489–2495. Bibcode:2014GeoRL..41.2489R. doi:10.1002/2013GL058799.
- ^ Falkowski, P. G.; Barber, R. T.; Smetacek v, V. (1998). "Biogeochemical Controls and Feedbacks on Ocean Primary Production". Science. 281 (5374): 200–206. doi:10.1126/science.281.5374.200. PMID 9660741.
- ^ Yool, Andrew; Martin, Adrian P.; Fernández, Camila; Clark, Darren R. (2007). "The significance of nitrification for oceanic new production". Nature. 447 (7147): 999–1002. Bibcode:2007Natur.447..999Y. doi:10.1038/nature05885. PMID 17581584. S2CID 4416535.
- ^ a b c d e f 이베르센, M.H.;Ploug, H."안정기 미네랄 바다에 가라앉는 탄소 자속:Carbon-specific 호흡률과 거시적 유기적 집합의 가라앉는 속도(해병 눈)". doi:10.5194/bgd-7-3335-2010.{{ 들고 일기}}:Cite저널 journal=( 도와 주)수정 텍스트는 창조적 공용 귀인 3.0국제 라이센스 하에 가능하다 이 원본에서 복제돼 필요로 한다.
- ^ Simon, M.; Grossart, HP; Schweitzer, B.; Ploug, H. (2002). "Microbial ecology of organic aggregates in aquatic ecosystems". Aquatic Microbial Ecology. 28: 175–211. doi:10.3354/ame028175.
- ^ Azam, F.; Fenchel, T.; Field, JG; Gray, JS; Meyer-Reil, LA; Thingstad, F. (1983). "The Ecological Role of Water-Column Microbes in the Sea". Marine Ecology Progress Series. 10: 257–263. Bibcode:1983MEPS...10..257A. doi:10.3354/meps010257.
- ^ Alldredge, Alice L.; Silver, Mary W. (1988). "Characteristics, dynamics and significance of marine snow". Progress in Oceanography. 20 (1): 41–82. Bibcode:1988PrOce..20...41A. doi:10.1016/0079-6611(88)90053-5.
- ^ a b c Armstrong, Robert A.; Lee, Cindy; Hedges, John I.; Honjo, Susumu; Wakeham, Stuart G. (2001). "A new, mechanistic model for organic carbon fluxes in the ocean based on the quantitative association of POC with ballast minerals". Deep Sea Research Part II: Topical Studies in Oceanography. 49 (1–3): 219–236. Bibcode:2001DSRII..49..219A. doi:10.1016/S0967-0645(01)00101-1.
- ^ a b Francois, Roger; Honjo, Susumu; Krishfield, Richard; Manganini, Steve (2002). "Factors controlling the flux of organic carbon to the bathypelagic zone of the ocean". Global Biogeochemical Cycles. 16 (4): 34-1–34-20. Bibcode:2002GBioC..16.1087F. doi:10.1029/2001GB001722. S2CID 128876389.
- ^ a b c Klaas, Christine; Archer, David E. (2002). "Association of sinking organic matter with various types of mineral ballast in the deep sea: Implications for the rain ratio". Global Biogeochemical Cycles. 16 (4): 63-1–63-14. Bibcode:2002GBioC..16.1116K. doi:10.1029/2001GB001765.
- ^ Le Moigne, Frédéric A. C.; Pabortsava, Katsiaryna; Marcinko, Charlotte L. J.; Martin, Patrick; Sanders, Richard J. (2014). "Where is mineral ballast important for surface export of particulate organic carbon in the ocean?". Geophysical Research Letters. 41 (23): 8460–8468. Bibcode:2014GeoRL..41.8460L. doi:10.1002/2014GL061678. PMC 4459180. PMID 26074644.
- ^ Iversen, Morten H.; Robert, Maya L. (2015). "Ballasting effects of smectite on aggregate formation and export from a natural plankton community". Marine Chemistry. 175: 18–27. doi:10.1016/j.marchem.2015.04.009.
- ^ a b Ploug, Helle; Iversen, Morten Hvitfeldt; Koski, Marja; Buitenhuis, Erik Theodoor (2008). "Production, oxygen respiration rates, and sinking velocity of copepod fecal pellets: Direct measurements of ballasting by opal and calcite". Limnology and Oceanography. 53 (2): 469–476. Bibcode:2008LimOc..53..469P. doi:10.4319/lo.2008.53.2.0469.
- ^ Engel, Anja; Abramson, Lynn; Szlosek, Jennifer; Liu, Zhanfei; Stewart, Gillian; Hirschberg, David; Lee, Cindy (2009). "Investigating the effect of ballasting by CaCO3 in Emiliania huxleyi, II: Decomposition of particulate organic matter". Deep Sea Research Part II: Topical Studies in Oceanography. 56 (18): 1408–1419. Bibcode:2009DSRII..56.1408E. doi:10.1016/j.dsr2.2008.11.028.
- ^ Engel, Anja; Szlosek, Jennifer; Abramson, Lynn; Liu, Zhanfei; Lee, Cindy (2009). "Investigating the effect of ballasting by CaCO3 in Emiliania huxleyi: I. Formation, settling velocities and physical properties of aggregates". Deep Sea Research Part II: Topical Studies in Oceanography. 56 (18): 1396–1407. Bibcode:2009DSRII..56.1396E. doi:10.1016/j.dsr2.2008.11.027.
- ^ Lee, Cindy; Peterson, Michael L.; Wakeham, Stuart G.; Armstrong, Robert A.; Cochran, J. Kirk; Miquel, Juan Carlos; Fowler, Scott W.; Hirschberg, David; Beck, Aaron; Xue, Jianhong (2009). "Particulate organic matter and ballast fluxes measured using time-series and settling velocity sediment traps in the northwestern Mediterranean Sea". Deep Sea Research Part II: Topical Studies in Oceanography. 56 (18): 1420–1436. Bibcode:2009DSRII..56.1420L. doi:10.1016/j.dsr2.2008.11.029.
- ^ a b Passow, Uta; de la Rocha, Christina L. (2006). "Accumulation of mineral ballast on organic aggregates". Global Biogeochemical Cycles. 20 (1): n/a. Bibcode:2006GBioC..20.1013P. doi:10.1029/2005GB002579.
- ^ Thomas, Helmuth; Bozec, Yann; Elkalay, Khalid; Baar, Hein J. W. de (14 May 2004). "Enhanced Open Ocean Storage of CO2 from Shelf Sea Pumping" (PDF). Science. 304 (5673): 1005–1008. Bibcode:2004Sci...304.1005T. doi:10.1126/science.1095491. hdl:11370/e821600e-4560-49e8-aeec-18eeb17549e3. ISSN 0036-8075. PMID 15143279. S2CID 129790522.
- ^ De La Rocha, C. L. (2006). "The Biological Pump". In Holland, Heinrich D.; Turekian, Karl K. (eds.). Treatise on Geochemistry. Treatise on Geochemistry. Vol. 6. Pergamon Press. p. 625. Bibcode:2003TrGeo...6...83D. doi:10.1016/B0-08-043751-6/06107-7. ISBN 978-0-08-043751-4.
- ^ Feely, Richard A.; Sabine, Christopher L.; Schlitzer, Reiner; Bullister, John L.; Mecking, Sabine; Greeley, Dana (1 February 2004). "Oxygen Utilization and Organic Carbon Remineralisation in the Upper Water Column of the Pacific Ocean". Journal of Oceanography. 60 (1): 45–52. doi:10.1023/B:JOCE.0000038317.01279.aa. ISSN 0916-8370. S2CID 67846685.
- ^ Administration, US Department of Commerce, National Oceanic and Atmospheric. "How far does light travel in the ocean?". oceanservice.noaa.gov. Retrieved 29 February 2016.
- ^ Karl, David M.; Knauer, George A.; Martin, John H. (1 March 1988). "Downward flux of particulate organic matter in the ocean: a particle decomposition paradox". Nature. 332 (6163): 438–441. Bibcode:1988Natur.332..438K. doi:10.1038/332438a0. ISSN 0028-0836. S2CID 4356597.
- ^ Lefévre, D.; Denis, M.; Lambert, C. E.; Miquel, J. -C. (1 February 1996). "Is DOC the main source of organic matter remineralization in the ocean water column?". Journal of Marine Systems. The Coastal Ocean in a Global Change Perspective. 7 (2–4): 281–291. Bibcode:1996JMS.....7..281L. doi:10.1016/0924-7963(95)00003-8.
- ^ Schulze, Ernst-Detlef; Mooney, Harold A. (6 December 2012). Biodiversity and Ecosystem Function. Springer Science & Business Media. ISBN 978-3-642-58001-7.
- ^ "International Census of Marine Microbes (ICoMM)". www.coml.org. Census of Marine Life. Archived from the original on 17 March 2016. Retrieved 29 February 2016.
- ^ "Microbe Size - Boundless Open Textbook". Boundless. Retrieved 29 February 2016.
- ^ Baumert, Helmut Z.; Petzoldt, Thomas (2008). "The role of temperature, cellular quota and nutrient concentrations for photosynthesis, growth and light–dark acclimation in phytoplankton". Limnologica. 38 (3–4): 313–326. doi:10.1016/j.limno.2008.06.002.
- ^ Lam, Man Kee; Lee, Keat Teong; Mohamed, Abdul Rahman (2012). "Current status and challenges on microalgae-based carbon capture". International Journal of Greenhouse Gas Control. 10: 456–469. doi:10.1016/j.ijggc.2012.07.010.
- ^ a b Häder, Donat-P.; Villafañe, Virginia E.; Helbling, E. Walter (2014). "Productivity of aquatic primary producers under global climate change". Photochem. Photobiol. Sci. 13 (10): 1370–1392. doi:10.1039/C3PP50418B. PMID 25191675.
- ^ a b Li, Wei; Gao, Kunshan; Beardall, John (2012). "Interactive Effects of Ocean Acidification and Nitrogen-Limitation on the Diatom Phaeodactylum tricornutum". PLOS ONE. 7 (12): e51590. Bibcode:2012PLoSO...751590L. doi:10.1371/journal.pone.0051590. PMC 3517544. PMID 23236517.
- ^ a b Hülse, Dominik; Arndt, Sandra; Wilson, Jamie D.; Munhoven, Guy; Ridgwell, Andy (2017). "Understanding the causes and consequences of past marine carbon cycling variability through models" (PDF). Earth-Science Reviews. 171: 349–382. Bibcode:2017ESRv..171..349H. doi:10.1016/j.earscirev.2017.06.004.
- ^ Hutchins, David A.; Fu, Feixue (2017). "Microorganisms and ocean global change". Nature Microbiology. 2 (6): 17058. doi:10.1038/nmicrobiol.2017.58. PMID 28540925. S2CID 23357501.
- ^ Sanders, Richard; Henson, Stephanie A.; Koski, Marja; de la Rocha, Christina L.; Painter, Stuart C.; Poulton, Alex J.; Riley, Jennifer; Salihoglu, Baris; Visser, Andre; Yool, Andrew; Bellerby, Richard; Martin, Adrian P. (2014). "The Biological Carbon Pump in the North Atlantic". Progress in Oceanography. 129: 200–218. Bibcode:2014PrOce.129..200S. doi:10.1016/j.pocean.2014.05.005.
- ^ Boyd, Philip W. (2015). "Toward quantifying the response of the oceans' biological pump to climate change". Frontiers in Marine Science. 2. doi:10.3389/fmars.2015.00077. S2CID 16787695.
- ^ a b c Buesseler, Ken O.; Boyd, Philip W. (2009). "Shedding light on processes that control particle export and flux attenuation in the twilight zone of the open ocean". Limnology and Oceanography. 54 (4): 1210–1232. Bibcode:2009LimOc..54.1210B. doi:10.4319/lo.2009.54.4.1210.
- ^ a b c Herndl, Gerhard J.; Reinthaler, Thomas (2013). "Microbial control of the dark end of the biological pump". Nature Geoscience. 6 (9): 718–724. Bibcode:2013NatGe...6..718H. doi:10.1038/ngeo1921. PMC 3972885. PMID 24707320.
- ^ Hofmann, M.; Schellnhuber, H.-J. (2009). "Oceanic acidification affects marine carbon pump and triggers extended marine oxygen holes". Proceedings of the National Academy of Sciences. 106 (9): 3017–3022. Bibcode:2009PNAS..106.3017H. doi:10.1073/pnas.0813384106. PMC 2642667. PMID 19218455.
- ^ de la Rocha, Christina L.; Passow, Uta (2007). "Factors influencing the sinking of POC and the efficiency of the biological carbon pump" (PDF). Deep Sea Research Part II: Topical Studies in Oceanography. 54 (5–7): 639–658. Bibcode:2007DSRII..54..639D. doi:10.1016/j.dsr2.2007.01.004.
- ^ Sato, R.; Tanaka, Y.; Ishimaru, T. (2003). "Species-specific house productivity of appendicularians". Marine Ecology Progress Series. 259: 163–172. Bibcode:2003MEPS..259..163S. doi:10.3354/meps259163.
- ^ Nishibe, Yuichiro; Takahashi, Kazutaka; Ichikawa, Tadafumi; Hidaka, Kiyotaka; Kurogi, Hiroaki; Segawa, Kyohei; Saito, Hiroaki (2015). "Degradation of discarded appendicularian houses by oncaeid copepods". Limnology and Oceanography. 60 (3): 967–976. Bibcode:2015LimOc..60..967N. doi:10.1002/lno.10061.
- ^ a b c d e f g Collins, Sinéad; Rost, Björn; Rynearson, Tatiana A. (2014). "Evolutionary potential of marine phytoplankton under ocean acidification". Evolutionary Applications. 7 (1): 140–155. doi:10.1111/eva.12120. PMC 3894903. PMID 24454553.
- ^ a b Richardson, T. L.; Jackson, G. A. (2007). "Small Phytoplankton and Carbon Export from the Surface Ocean". Science. 315 (5813): 838–840. Bibcode:2007Sci...315..838R. doi:10.1126/science.1133471. PMID 17289995. S2CID 45563491.
- ^ a b Ragueneau, Olivier; Schultes, Sabine; Bidle, Kay; Claquin, Pascal; Moriceau, Brivaëla (2006). "Si and C interactions in the world ocean: Importance of ecological processes and implications for the role of diatoms in the biological pump". Global Biogeochemical Cycles. 20 (4): n/a. Bibcode:2006GBioC..20.4S02R. doi:10.1029/2006GB002688.
- ^ a b Miklasz, Kevin A.; Denny, Mark W. (2010). "Diatom sinkings speeds: Improved predictions and insight from a modified Stokes' law". Limnology and Oceanography. 55 (6): 2513–2525. Bibcode:2010LimOc..55.2513M. doi:10.4319/lo.2010.55.6.2513.
- ^ Møller, EF; Thor, P.; Nielsen, TG (2003). "Production of DOC by Calanus finmarchicus, C. Glacialis and C. Hyperboreus through sloppy feeding and leakage from fecal pellets". Marine Ecology Progress Series. 262: 185–191. Bibcode:2003MEPS..262..185M. doi:10.3354/meps262185.
- ^ Saba, GK; Steinberg, DK; Bronk, DA (2009). "Effects of diet on release of dissolved organic and inorganic nutrients by the copepod Acartia tonsa". Marine Ecology Progress Series. 386: 147–161. Bibcode:2009MEPS..386..147S. doi:10.3354/meps08070.
- ^ a b c Steinberg, Deborah K.; Landry, Michael R. (2017). "Zooplankton and the Ocean Carbon Cycle". Annual Review of Marine Science. 9: 413–444. Bibcode:2017ARMS....9..413S. doi:10.1146/annurev-marine-010814-015924. PMID 27814033.
- ^ a b c Belcher, 안나, 만노, 클라라, 워드, 피터, 헨슨. StephanieA., 샌더스, 리처드, Tarling, 제레인트 A(2017년)."남극해의 meso-과 심층성 층을 통해 봄에 요각류faecal 펠릿 이송".Biogeosciences.14(6):1511–1525.Bibcode:2017BGeo...14.1511B. doi:10.5194/bg-14-1511-2017.수정 텍스트는 창조적 공용 귀인 3.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Saba, Grace K.; Steinberg, Deborah K.; Bronk, Deborah A. (2011). "The relative importance of sloppy feeding, excretion, and fecal pellet leaching in the release of dissolved carbon and nitrogen by Acartia tonsa copepods". Journal of Experimental Marine Biology and Ecology. 404 (1–2): 47–56. doi:10.1016/j.jembe.2011.04.013.
- ^ a b Thor, P.; Dam, HG; Rogers, DR (2003). "Fate of organic carbon released from decomposing copepod fecal pellets in relation to bacterial production and ectoenzymatic activity". Aquatic Microbial Ecology. 33: 279–288. doi:10.3354/ame033279.
- ^ Hansell, Dennis A.; Carlson, Craig A. (2 October 2014). Biogeochemistry of Marine Dissolved Organic Matter. ISBN 9780124071537.
- ^ Moller, E. F. (2004). "Sloppy feeding in marine copepods: Prey-size-dependent production of dissolved organic carbon". Journal of Plankton Research. 27: 27–35. doi:10.1093/plankt/fbh147.
- ^ Møller, Eva Friis (2007). "Production of dissolved organic carbon by sloppy feeding in the copepods Acartia tonsa, Centropages typicus, and Temora longicornis". Limnology and Oceanography. 52 (1): 79–84. Bibcode:2007LimOc..52...79M. doi:10.4319/lo.2007.52.1.0079.
- ^ Azam, Farooq; Fenchel, Tom; Field, J.G.; Gray, J.S.; Meyer-Reil, L.A.; Thingstad, F. (1983). "The Ecological Role of Water-Column Microbes in the Sea". Marine Ecology Progress Series. 10: 257–263. Bibcode:1983MEPS...10..257A. doi:10.3354/meps010257.
- ^ Van den Meersche, Karel; Middelburg, Jack J.; Soetaert, Karline; van Rijswijk, Pieter; Boschker, Henricus T. S.; Heip, Carlo H. R. (2004). "Carbon-nitrogen coupling and algal-bacterial interactions during an experimental bloom: Modeling a13C tracer experiment". Limnology and Oceanography. 49 (3): 862–878. Bibcode:2004LimOc..49..862V. doi:10.4319/lo.2004.49.3.0862. hdl:1854/LU-434810. ISSN 0024-3590. S2CID 53518458.
- ^ Mentges, A.; Feenders, C.; Deutsch, C.; Blasius, B.; Dittmar, T. (2019). "Long-term stability of marine dissolved organic carbon emerges from a neutral network of compounds and microbes". Scientific Reports. 9 (1): 17780. Bibcode:2019NatSR...917780M. doi:10.1038/s41598-019-54290-z. PMC 6883037. PMID 31780725.
- ^ Wilhelm, Steven W.; Suttle, Curtis A. (1999). "Viruses and nutrient cycles in the sea: viruses play critical roles in the structure and function of aquatic food webs". BioScience. 49 (10): 781–788. doi:10.2307/1313569. JSTOR 1313569.
- ^ 로빈슨, 캐롤, 나가파 라마야."미생물적 이영양대사율은 미생물 탄소 펌프에 제약을 가합니다."미국과학진보협회, 2011.
- ^ Fuhrman, Jed A. (1999). "Marine viruses and their biogeochemical and ecological effects". Nature. 399 (6736): 541–548. Bibcode:1999Natur.399..541F. doi:10.1038/21119. ISSN 0028-0836. PMID 10376593. S2CID 1260399.
- ^ Wigington, Charles H.; Sonderegger, Derek; Brussaard, Corina P. D.; Buchan, Alison; Finke, Jan F.; Fuhrman, Jed A.; Lennon, Jay T.; Middelboe, Mathias; Suttle, Curtis A.; Stock, Charles; Wilson, William H. (March 2016). "Re-examination of the relationship between marine virus and microbial cell abundances". Nature Microbiology. 1 (3): 15024. doi:10.1038/nmicrobiol.2015.24. ISSN 2058-5276. PMID 27572161. S2CID 52829633.
- ^ 차이, 안이, 구칭공, 위원황. "Synechoccus Spp의 질소 순환에서 바이러스 분로의 중요성.아열대 서태평양 연안 수역에서의 성장"지상, 대기 및 해양 과학 25.6(2014).
- ^ Lebrato, 마리오, Pahlow, 마르쿠스;프로스트, 제시카는 R.;Küter, 마리, 예수는 멘데스, 페드로;Molinero, Juan‐Carlos, Oschlies, 안드레아스(2019년)."Gelatinous 동물성 플랑크톤 바이오매스의 허비하는 것 유학 중인 딥 탄소 효율 글로벌".글로벌 Biogeochemical의 사이클. 33(12):1764–1783.Bibcode:2019년GBioC..33.1764L. doi:10.1029/2019GB006265.수정 텍스트는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Lebrato, Mario; Pitt, Kylie A.; Sweetman, Andrew K.; Jones, Daniel O. B.; Cartes, Joan E.; Oschlies, Andreas; Condon, Robert H.; Molinero, Juan Carlos & Adler, Laetitia (2012). "Jelly-falls historic and recent observations: a review to drive future research directions". Hydrobiologia. 690 (1): 227–245. doi:10.1007/s10750-012-1046-8. S2CID 15428213.
- ^ Lebrato, M. & Jones, D. O. B. (2009). "Mass deposition event of Pyrosoma atlanticum carcasses off Ivory Coast (West Africa)" (PDF). Limnology and Oceanography. 54 (4): 1197–1209. Bibcode:2009LimOc..54.1197L. doi:10.4319/lo.2009.54.4.1197.
- ^ a b Sweetman, Andrew K. & Chapman, Annelise (2011). "First observations of jelly-falls at the seafloor in a deep-sea fjord". Deep Sea Research Part I: Oceanographic Research Papers. 58 (12): 1206–1211. Bibcode:2011DSRI...58.1206S. doi:10.1016/j.dsr.2011.08.006.
- ^ Burd, Adrian. "Towards a transformative understanding of the ocean's biological pump: Priorities for future research-Report on the NSF Biology of the Biological Pump Workshop" (PDF). OCB: Ocean Carbon & Biogeochemistry. Retrieved 30 October 2016.
- ^ Hays, Graeme C.; Doyle, Thomas K.; Houghton, Jonathan D.R. (2018). "A Paradigm Shift in the Trophic Importance of Jellyfish?". Trends in Ecology & Evolution. 33 (11): 874–884. doi:10.1016/j.tree.2018.09.001. PMID 30245075. S2CID 52336522.
- ^ a b c d e 로마, 조, 매카시, 제임스 J.(2010년)."TheWhale펌프:해양 Mammals 향상 1차 생산성 해안 역에서의".PLOS다. 5(10):e13255.Bibcode:2010년PLoSO...513255R.doi:10.1371/journal.pone.0013255.PMC 2952594.PMID 20949007.수정 텍스트는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Brown, Joshua E. (12 October 2010). "Whale poop pumps up ocean health". Science Daily. Retrieved 18 August 2014.
- ^ Longhurst, Alan R.; Glen Harrison, W. (1989). "The biological pump: Profiles of plankton production and consumption in the upper ocean". Progress in Oceanography. 22 (1): 47–123. Bibcode:1989PrOce..22...47L. doi:10.1016/0079-6611(89)90010-4.
- ^ Hutchins, David A.; Wang, Wen-Xiong; Fisher, Nicholas S. (1995). "Copepod grazing and the biogeochemical fate of diatom iron". Limnology and Oceanography. 40 (5): 989–994. Bibcode:1995LimOc..40..989H. doi:10.4319/lo.1995.40.5.0989.
- ^ Steinberg, Deborah K.; Goldthwait, Sarah A.; Hansell, Dennis A. (2002). "Zooplankton vertical migration and the active transport of dissolved organic and inorganic nitrogen in the Sargasso Sea". Deep Sea Research Part I: Oceanographic Research Papers. 49 (8): 1445–1461. Bibcode:2002DSRI...49.1445S. doi:10.1016/S0967-0637(02)00037-7.
- ^ Pershing, Andrew J.; Christensen, Line B.; Record, Nicholas R.; Sherwood, Graham D.; Stetson, Peter B. (2010). "The Impact of Whaling on the Ocean Carbon Cycle: Why Bigger Was Better". PLOS ONE. 5 (8): e12444. Bibcode:2010PLoSO...512444P. doi:10.1371/journal.pone.0012444. PMC 2928761. PMID 20865156.
- ^ "Nature's Solution to Climate Change – IMF F&D". International Monetary Fund. Retrieved 2 November 2019.
- ^ Wiebe, P.H; L.P. Madin; L.R. Haury; G.R. Harbison; L.M. Philbin (1979). "Diel Vertical Migration by Salpa aspera and its potential for large-scale particulate organic matter transport to the deep-sea". Marine Biology. 53 (3): 249–255. doi:10.1007/BF00952433. S2CID 85127670.
- ^ a b c d Jónasdóttir, Sigrún Huld; Visser, André W.; Richardson, Katherine; Heath, Michael R. (29 September 2015). "Seasonal copepod lipid pump promotes carbon sequestration in the deep North Atlantic". Proceedings of the National Academy of Sciences. 112 (39): 12122–12126. doi:10.1073/pnas.1512110112. ISSN 0027-8424. PMC 4593097. PMID 26338976.
- ^ a b c Visser, Andre (2 March 2017). "Calanus hyperboreus and the lipid pump". Limnology and Oceanography. 62 (3): 1155–1165. Bibcode:2017LimOc..62.1155V. doi:10.1002/lno.10492. S2CID 51989153.
- ^ a b c Steinberg, Deborah K.; Landry, Michael R. (3 January 2017). "Zooplankton and the Ocean Carbon Cycle". Annual Review of Marine Science. 9 (1): 413–444. Bibcode:2017ARMS....9..413S. doi:10.1146/annurev-marine-010814-015924. ISSN 1941-1405. PMID 27814033.
- ^ Parent, Genevieve J.; Plourde, Stephane; Turgeon, Julie (1 November 2011). "Overlapping size ranges of Calanus spp. off the Canadian Arctic and Atlantic Coasts: impact on species' abundances". Journal of Plankton Research. 33 (11): 1654–1665. doi:10.1093/plankt/fbr072. ISSN 0142-7873.
- ^ Kristiansen, Inga; Gaard, Eilif; Hátún, Hjálmar; Jónasdóttir, Sigrún; Ferreira, A. Sofia A. (1 May 2016). "Persistent shift of Calanus spp. in the southwestern Norwegian Sea since 2003, linked to ocean climate". ICES Journal of Marine Science. 73 (5): 1319–1329. doi:10.1093/icesjms/fsv222. ISSN 1054-3139.
- ^ Jensen, Maj Holst; Nielsen, Torkel Gissel; Dahllöf, Ingela (28 April 2008). "Effects of pyrene on grazing and reproduction of Calanus finmarchicus and Calanus glacialis from Disko Bay, West Greenland". Aquatic Toxicology. 87 (2): 99–107. doi:10.1016/j.aquatox.2008.01.005. ISSN 0166-445X. PMID 18291539.
- ^ a b c d Tanet, 리사;마르티니, Séverine, Casalot, 로리..Tamburini, 기독교(2020년)."평과 syntheses:생물학적 탄소 펌프의 박테리아 생물 발광–는 생태학과 영향".Biogeosciences.17(14):3757–3778. Bibcode:2020BGeo...17.3757T. doi:10.5194/bg-17-3757-2020.수정 텍스트는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Kayler, Z., Janowiak, M., Swanston, C. (2017). "The Global Carbon Cycle". Considering Forest and Grassland Carbon in Land Management. General Technical Report WTO-GTR-95. Vol. 95. United States Department of Agriculture, Forest Service. pp. 3–9. doi:10.2737/WO-GTR-95.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ NASA (16 June 2011). "The Slow Carbon Cycle". Archived from the original on 16 June 2012. Retrieved 24 June 2012.
- ^ Marinov, I.; Gnanadesikan, A.; Toggweiler, J. R.; Sarmiento, J. L. (2006). "The Southern Ocean biogeochemical divide". Nature. 441 (7096): 964–967. Bibcode:2006Natur.441..964M. doi:10.1038/nature04883. PMID 16791191. S2CID 4428683.
- ^ Takahashi, Taro; Sutherland, Stewart C.; Sweeney, Colm; Poisson, Alain; Metzl, Nicolas; Tilbrook, Bronte; Bates, Nicolas; Wanninkhof, Rik; Feely, Richard A.; Sabine, Christopher; Olafsson, Jon; Nojiri, Yukihiro (2002). "Global sea–air CO2 flux based on climatological surface ocean pCO2, and seasonal biological and temperature effects". Deep Sea Research Part II: Topical Studies in Oceanography. 49 (9–10): 1601–1622. Bibcode:2002DSRII..49.1601T. doi:10.1016/S0967-0645(02)00003-6.
- ^ Orr, J. C., E. Maier-Reimer, U. Mikolajewicz, P. Monfray, J. L. Sarmianto, J. R.노스캐롤라이나 주 토글와일러Taylor, J. Palmer, N. 그루버, C. L. Sabine, C.르 케레, R.M. 키, J. 부탱(2001)이 그것이다.4개의 3차원 세계 해양 모델에서 인공 탄소 흡수 추정치.지구 생물 화학. 사이클 15, 43~60
- ^ "Study reveals uncertainty in how much carbon the ocean absorbs over time". MIT News Massachusetts Institute of Technology. Retrieved 7 May 2021.
- ^ 리에베셀, 미국, 슐츠, K.G., 벨러비, R.G.J., 보트로스, M., Neill, C., Nonal, G. Oschlies, A. 및 Zohlers.높은 CO2 해양에서 생물학적 탄소 소비량 증가.네이처 450, 545~548
- ^ a b 빠르망띠에, Frans-Jan W.크리스텐슨 주아프가니스탄 Torben R.;Rysgaard, 쇠렌;Bendtsen, Jørgen, Glud, 로니 N;Else, 브렌트;반 Huissteden, 야코부스;삭스 Torsten, Vonk, Jorien E.,.Sejr, 미카엘. K.(2017년)."북극과 해상 지상파 탄소 사이클의 감소하고 있는 cryosphere의 압력에 따른 합성".Ambio.46(Suppl 1):53–69. doi:10.1007/s13280-016-0872-8.PMC5258664.PMID 28116680.수정 텍스트는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ a b Parmentier, Frans-Jan W.; Christensen, Torben R.; Sørensen, Lise Lotte; Rysgaard, Søren; McGuire, A. David; Miller, Paul A.; Walker, Donald A. (2013). "The impact of lower sea-ice extent on Arctic greenhouse-gas exchange". Nature Climate Change. 3 (3): 195–202. Bibcode:2013NatCC...3..195P. doi:10.1038/nclimate1784.
- ^ Orr, James C.; Fabry, Victoria J.; Aumont, Olivier; Bopp, Laurent; Doney, Scott C.; Feely, Richard A.; Gnanadesikan, Anand; Gruber, Nicolas; Ishida, Akio; et al. (2005). "Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms" (PDF). Nature. 437 (7059): 681–686. Bibcode:2005Natur.437..681O. doi:10.1038/nature04095. PMID 16193043. S2CID 4306199.
- ^ Armstrong, Robert A.; Lee, Cindy; Hedges, John I.; Honjo, Susumu & Wakeham, Stuart G. (2001). "A new, mechanistic model for organic carbon fluxes in the ocean based on the quantitative association of POC with ballast minerals". Deep Sea Research Part II: Topical Studies in Oceanography. 49 (1–3): 219–236. Bibcode:2001DSRII..49..219A. doi:10.1016/s0967-0645(01)00101-1.
- ^ Bopp, L.; Aumont, O.; Cadule, P.; Alvain, S.; Gehlen, M. (2005). "Response of diatoms distribution to global warming and potential implications: A global model study". Geophysical Research Letters. 32 (19): n/a. Bibcode:2005GeoRL..3219606B. doi:10.1029/2005GL023653.
- ^ Iglesias-Rodriguez, M. D.; Halloran, P. R.; Rickaby, R. E. M.; Hall, I. R.; Colmenero-Hidalgo, E.; Gittins, J. R.; Green, D. R. H.; Tyrrell, T.; Gibbs, S. J.; von Dassow, P.; Rehm, E.; Armbrust, E. V.; Boessenkool, K. P. (2008). "Phytoplankton Calcification in a High-CO2 World". Science. 320 (5874): 336–340. Bibcode:2008Sci...320..336I. doi:10.1126/science.1154122. PMID 18420926. S2CID 206511068.
- ^ Rivero-Calle, Sara; Gnanadesikan, Anand; Castillo, Carlos E. Del; Balch, William M. & Guikema, Seth D. (2015). "Multidecadal increase in North Atlantic coccolithophores and the potential role of rising CO2". Science. 350 (6267): 1533–1537. Bibcode:2015Sci...350.1533R. doi:10.1126/science.aaa8026. PMID 26612836.
- ^ Jensen, Lasse Ørsted; Mousing, Erik Askov; Richardson, Katherine (2017). "Using species distribution modelling to predict future distributions of phytoplankton: Case study using species important for the biological pump". Marine Ecology. 38 (3): e12427. Bibcode:2017MarEc..38E2427J. doi:10.1111/maec.12427.
- ^ Petrou, Katherina; Nielsen, Daniel (27 August 2019). "Acid oceans are shrinking plankton, fueling faster climate change". phys.org. Retrieved 7 September 2019.
- ^ a b c d e L.A., B.J., 게이츠, A.R., Heimbach, P., Howe, B.M., Jansen, F., McCurdy, A., Ruhl, H.A., Snelgrove, P.I. 주식.해양과학 분야 프런티어, 6:241.doi:10.3389/fmars.2019.00241.
 수정된 텍스트는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 원본에서 복사되었습니다.
수정된 텍스트는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 원본에서 복사되었습니다.