크기 제외 크로마토그래피
Size-exclusion chromatography 크기 제외 크로마토그래피를 실행하기 위한 장치.버퍼는 컴퓨터 제어 장치에 의해 열(오른쪽)에 펌핑됩니다. | |
| 약자 | 초 |
|---|---|
| 분류 | 크로마토그래피 |
| 분석물 | 고분자 합성 고분자 생체 분자 |
| 제조원 | Cytiva, Bio-Rad, Bio-Works, Emp Biotech, Knauer. |
| 기타 기술 | |
| 관련된 | 고성능 액체 크로마토그래피 수성 정상 크로마토그래피 이온 교환 크로마토그래피 미셀액 크로마토그래피 |
크기 제외 크로마토그래피([1]SEC)는 분자 체 크로마토그래피로도 알려져 있으며 용액 속의 분자가 크기와 경우에 따라 분자량에 [2]따라 분리되는 크로마토그래피 방법이다.그것은 보통 단백질과 산업용 폴리머와 같은 큰 분자 또는 고분자 복합체에 적용된다.일반적으로 수용액을 사용하여 시료를 컬럼을 통해 운반하는 경우, 이 기술은 겔 여과 크로마토그래피로 알려져 있으며, 겔 투과 크로마토그래피라는 이름은 유기 용제를 이동상으로 사용할 때 사용됩니다.크로마토그래피 컬럼에는 일반적으로 덱스트란, 아가로스 또는 폴리아크릴아미드 중합체로 구성된 미세한 다공질 비즈가 채워져 있습니다.이 구슬들의 모공 크기는 [1]고분자의 크기를 추정하는데 사용된다.SEC는 폴리머에 좋은 몰 질량 분포(Mw) 결과를 제공할 수 있기 때문에 널리 사용되는 폴리머 특성화 방법입니다.
적용들
겔 여과 크로마토그래피의 주요 적용 분야는 단백질 및 기타 수용성 고분자의 분획이며, 겔 투과 크로마토그래피는 유기 수용성 고분자의 분자량 분포를 분석하는데 사용된다.두 기술 모두 전하에 따라 전기장이 분자를 겔을 통해 "끌어당기" 또는 "밀어내기" 위해 사용되는 겔 전기영동과 혼동해서는 안 됩니다.모공 내에 용질이 남아 있는 시간은 모공의 크기에 따라 달라집니다.큰 솔트에서는 작은 볼륨에 액세스 할 수 있습니다.또, 그 반대의 경우도 마찬가지입니다.따라서 큰 [3]용질보다 작은 용질이 모공 내에 더 오랜 시간 동안 남아 있게 됩니다.
크기 제외 크로마토그래피의 또 다른 용도는 [4]물 속의 자연 유기물의 안정성과 특성을 조사하는 것이다.이 방법에서는 Margit B.뮬러, 다니엘 슈미트, 프리츠 H. 프리츠 프리멜은 자연 유기물이 일정 [4]기간 동안 얼마나 안정적인지를 결정하기 위해 세계 여러 곳의 수원을 테스트했다.크기 제외 크로마토그래피가 천연 유기물 연구에 널리 활용되고 있지만 한계가 있다.이러한 한계 중 하나는 표준 분자량 [4]마커가 없다는 것입니다. 따라서 결과를 다시 비교할 필요가 없습니다.정확한 분자량이 필요한 경우 다른 방법을 사용해야 합니다.
이점
이 방법의 장점은 최소한의 [5]용출 부피로 작은 분자에서 큰 분자를 잘 분리할 수 있고, 다양한 용액을 여과 과정을 방해하지 않고 적용할 수 있다는 것이다.이 기술은 일반적으로 산도, 염기성, 전하 및 특정 화합물에 대한 친화력과 같은 다른 특성에 의해 분자를 더욱 분리하는 다른 기술과 결합됩니다.크기 제외 크로마토그래피에서는 분리 시간이 짧고 명확하게 정의되며 띠가 좁아 감도가 좋다.용질은 정지상과 상호작용하지 않기 때문에 샘플 손실도 없습니다.
이 실험 방법의 또 다른 장점은 특정 경우에 화합물의 대략적인 분자량을 결정할 수 있다는 것이다.화합물(용리액)의 모양과 크기에 따라 화합물이 겔(정지상)과 어떻게 상호작용하는지가 결정됩니다.대략적인 분자량을 결정하기 위해 해당 분자량을 갖는 화합물의 용출량을 구한 후 "Kav" 대 "log(Mw)"의 그래프를 만든다. 서 v ( e- o)/ ( t- o) { } = ( _ {} - V _ { V _ { { V } / { V o ) { T _ { V ( V } )이 그래프는 원하는 화합물의 분자량을 근사하는 데 사용되는 검정 곡선 역할을 합니다.Ve 성분은 기둥의 비드에 부분적으로 접근할 수 있는 분자와 같이 중간 분자가 용출되는 부피를 나타냅니다.또한 V는t 구슬과 구슬 내의 부피의 합계입니다.Vo 성분은 큰 분자가 [6][7]용출되는 부피를 나타내며 처음에는 용출됩니다.단점은 예를 들어 크로마토그램의 시간 척도가 짧기 때문에 제한된 수의 밴드만 수용될 수 있고 일반적으로 분해능이 [5]좋으려면 분자량의 10% 차이가 있어야 한다는 것이다.
검출
이 기술은 1955년 런던의 [8][9]퀸 샬롯 병원에서 일하는 그랜트 헨리 라트와 콜린 R 루스벤에 의해 발명되었다.그들은 나중에 이 [10]발명품으로 존 스콧 상을 받았다.Lathe와 Ruthven은 전분 겔을 매트릭스로 사용했지만, Jerker Porath와 Per Flodin은 나중에 덱스트란 [11]겔을 도입했다. 크기 분류 특성이 있는 다른 겔은 아가로스 및 폴리아크릴아미드를 포함한다.이러한 발전에 대한 짧은 검토가 나타났다.[12]
합성 고분자를 분류하려는 시도도 있었지만 1964년이 되어서야 J. C.다우케미칼사의 무어는 모공 [13]크기를 조절한 가교 폴리스티렌을 기반으로 한 겔 투과 크로마토그래피(GPC) 컬럼의 제조에 관한 연구를 발표하면서 이 분야의 연구 활동이 급격히 증가하기 시작했다.적절한 교정을 통해 GPC는 합성 고분자의 몰 질량 및 몰 질량 분포 정보를 제공할 수 있다는 것이 거의 즉시 인식되었다.후자의 정보는 다른 방법으로는 입수하기 어려웠기 때문에 GPC는 빠르게 널리 [14]쓰이게 되었다.
이론 및 방법
SEC는 주로 단백질이나 폴리머와 같은 큰 분자의 분석에 사용된다.SEC는 흡착제("정지상")의 모공에 더 작은 분자를 가두어 작동합니다.이 과정은 보통 다양한 크기의 모공이 포함된 마이크로 스케일 폴리머 비즈로 꽉 채워진 중공 튜브로 구성된 컬럼 내에서 수행됩니다.이 모공들은 표면의 움푹 패인 부분일 수도 있고 비드를 통과하는 통로일 수도 있습니다.용액이 기둥을 따라 이동하면서 일부 입자가 모공으로 들어갑니다.더 큰 입자는 그만큼 많은 모공에 들어갈 수 없습니다.입자가 클수록 용출 속도가 빨라집니다.더 큰 분자는 모공으로 들어가기엔 너무 크기 때문에 모공을 그냥 지나간다.따라서 더 큰 분자는 더 작은 분자보다 더 빨리 기둥을 통해 흐릅니다. 즉, 분자가 작을수록 유지 시간이 길어집니다.
SEC에 대한 한 가지 요건은 분석 물질이 정지상 표면과 상호작용하지 않는 것이며, 분석물 간의 용출 시간의 차이는 이상적으로는 정지상과의 화학적 또는 정전기적 상호작용이 아닌 분석물이 진입할 수 있는 용질량에만 기초한다.따라서 정지상 기공계의 모든 영역을 관통할 수 있는 작은 분자는 전체 기공 부피와 입자 간 부피의 합과 동일한 총 부피로 진입할 수 있다.이 작은 분자는 늦게 용출된다(분자가 모든 기공 및 입자 간 체적을 관통한 후, 약 80%).다른 극단으로, 작은 기공을 통과할 수 없는 매우 큰 분자는 입자간 부피(기둥 부피의 약 35%)에만 들어갈 수 있으며, 이 부피의 이동상이 기둥을 통과할 때 더 일찍 용출된다.SEC의 기본 원리는 크기가 다른 입자가 다른 속도로 정지상을 통해 용출(필터)된다는 것입니다.그 결과 크기에 따라 입자의 용액이 분리된다.모든 입자가 동시에 또는 거의 동시에 적재될 경우 같은 크기의 입자가 함께 용출되어야 합니다.
그러나 고분자 크기에는 다양한 측정이 존재하기 때문에(예를 들어 회전반경 및 유체역학반경), SEC 이론의 근본적인 문제는 다른 종류의 분자를 분리하는 적절한 분자 크기 매개변수의 선택이었다.실험적으로, Benoit와 동료들은 용출 부피와 동적 기반 분자 크기, 유체 역학적 부피 사이에 여러 가지 다른 사슬 구조와 화학 [15]조성에 대한 뛰어난 상관 관계를 발견했습니다.유체역학적 체적에 기초한 관측된 상관관계가 범용 SEC 보정의 기초로 받아들여졌다.
그러나 동적 특성에 기초한 크기인 유체역학적 볼륨을 SEC 데이터의 해석에 사용하는 것은 완전히 [16]이해되지 않는다.이는 SEC가 일반적으로 유체역학적 요인이 분리에 거의 영향을 미치지 않는 저유량 조건에서 가동되기 때문입니다.사실 이론과 컴퓨터 시뮬레이션 모두 열역학적 분리 원리를 전제로 한다: 분리 과정은 두 단계 사이의 용질 고분자의 평형 분포(분할)에 의해 결정된다: 간질 공간에 위치한 희박한 벌크 용액 단계와 컬럼 패킹의 공극 내의 제한된 용액 단계.Terial. 이 이론에 근거해, 모공내의 폴리머의 분할에 관련하는 사이즈 파라메타가 평균 스판 치수(직선상의 평균 최대 투영)[17]인 것을 알 수 있다.이 문제가 완전히 해결되지는 않았지만, 평균 스팬 치수와 유체 역학적 부피는 강한 상관 관계가 있을 수 있습니다.
각 크기 제외 열은 분리할 수 있는 분자량 범위를 가집니다.제외 한계는 열 '작동' 범위의 상단 끝의 분자량을 정의하며, 분자가 너무 커서 정지 상태에 갇힐 수 없습니다.범위의 하한은 투과 한계로 정의되며, 이는 정지상의 모든 기공을 관통할 수 있을 정도로 작은 분자의 분자량을 정의합니다.이 분자량 이하의 모든 분자는 너무 작아서 하나의 [5]띠로 용출된다.
마지막에 수집되는 여과 용액을 용출액이라고 합니다.보이드 부피에는 너무 커서 매체에 들어갈 수 없는 입자가 포함되어 있으며, 용제의 부피는 컬럼 부피라고 합니다.
크기 제외 크로마토그래피에서 다공질 겔 비즈에 일반적으로 사용되는 재료는 다음과 같습니다.
| 시니어 No. | 재료. 그리고 상호 | 구분 범위 (분자질량(Da)) |
|---|---|---|
| 1 | 세파덱스 G-10 | 0 ~ 700 |
| 2 | 세파덱스 G-25 | 1000 ~ 5000 |
| 3 | 세파덱스 G-50 | 1500~30000 |
| 4 | 세파덱스 G-75 | 3000 ~ 70000 |
| 5 | 세파덱스 G-100 | 4000 ~ 150000 |
| 6 | 세파덱스 G-150 | 5000 ~ 300000 |
| 7 | 세파덱스 G-200 | 5000 ~ 800000 |
| 8 | 바이오젤 P-2 | 100 ~ 1800 |
| 9 | 바이오젤 P-6 | 1000 ~ 6000 |
| 10 | 바이오젤 P-60 | 3000 ~ 60000 |
| 11 | 바이오젤 P-150 | 15000 ~ 150000 |
| 12 | 바이오젤 P-300 | 16000 ~ 400000 |
| 13 | 세파로즈 2B | 106 x 2 ~ 256 x 2 |
| 14 | 세파로즈 4B | 3 x 105 ~3 x 106 |
| 15 | 세파로즈 6B | 104 ~ 20 x 106 |
여과에 영향을 미치는 요인
실제 상황에서, 용액 속의 입자는 고정된 크기를 가지고 있지 않기 때문에, 그렇지 않으면 바로 옆을 지나는 기공에 의해 방해받을 가능성이 생긴다.또한 이상적으로는 정지상 입자가 정의되어 있지 않으며 입자와 기공의 크기가 다를 수 있습니다.따라서 용출 곡선은 가우스 분포와 유사합니다.정지상은 또한 입자와 바람직하지 않은 방식으로 상호작용할 수 있으며, 열 제조업체는 비활성화된 정지상을 사용하고 이 문제를 최소화하기 위해 많은 주의를 기울인다.
다른 형태의 크로마토그래피와 마찬가지로 컬럼 길이를 늘리면 분해능이 향상되고 컬럼 직경이 증가하면 컬럼 용량이 증가합니다.분해능을 최대화하기 위해서는 적절한 컬럼 패킹이 중요합니다.너무 꽉 찬 기둥은 구슬의 모공을 수축시켜 분해능을 떨어뜨릴 수 있습니다.덜 채워진 기둥은 작은 종들이 접근할 수 있는 정지상의 상대적인 표면적을 줄일 수 있고, 그 결과 이러한 종들이 모공에 갇히는 시간을 줄일 수 있습니다.어피니티 크로마토그래피 기술과 달리 컬럼 상단의 용제 헤드는 부하 전에 시료가 확산됨에 따라 분해능을 급격히 감소시켜 하류 용출량을 넓힐 수 있다.
분석.
단순 수동 열에서 용리액은 분율이라고 하는 일정한 부피로 수집됩니다.입자의 크기가 비슷할수록 같은 분수에 속하며 개별적으로 검출되지 않을 가능성이 높아집니다.고급 열은 용리액을 지속적으로 모니터링하여 이 문제를 해결합니다.
수집된 분율은 종종 용출된 입자의 농도를 결정하기 위해 분광기법으로 조사된다.일반적인 분광 검출 기술은 굴절률(RI)과 자외선(UV)입니다.분광학적으로 유사한 종(생물학적 정화 중 등)을 용출할 때 각 분획의 함량을 식별하기 위해 다른 기술이 필요할 수 있다.또한 RI, LALS, Multi-Angle Laser Light Satterrant MALS, UV 및/또는 점도 측정을 통해 용리액을 연속적으로 분석할 수 있습니다.
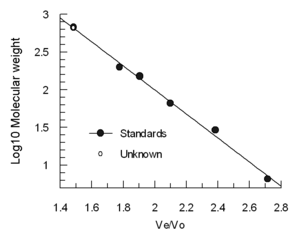
용출량(Ve)은 분자 유체역학 부피의 대수에 따라 대략 선형으로 감소합니다.컬럼은 종종 보이드 부피를 결정하기 위해 4-5개의 표준 샘플(예: 알려진 분자량의 접힌 단백질)과 티로글로불린과 같은 매우 큰 분자를 포함하는 샘플을 사용하여 보정된다. (블루 덱스트란은 이질적이고 가변적인 결과를 얻을 수 있기 때문에 Vo 결정에 권장되지 않는다.)표준 용출량은 티로글로불린 용출량(Ve/Vo)으로 나누어 표준 분자량 로그와 대조한다.
적용들
생화학적 응용
일반적으로 SEC는 유사한 종을 잘 식별하지 못하기 때문에 저해상도 크로마토그래피로 간주되며, 따라서 종종 정화의 마지막 단계를 위해 남겨진다.이 기술은 고분자 상호작용을 보존하면서 천연 용액 조건에서 수행될 수 있기 때문에 교환 시간이 느린 정제 단백질의 4차 구조를 결정할 수 있다.또한 SEC는 (분자량이 아닌) 유체역학적 부피를 측정하기 때문에 단백질 3차 구조를 분석할 수 있어 동일한 단백질의 접힘 및 펼침 버전을 구별할 수 있다.예를 들어 전형적인 단백질 도메인의 겉보기 유체역학 반경은 접힌 형태와 펴진 형태 각각 14Ω, 36Ω일 수 있다.SEC는 크기가 작기 때문에 접힌 형태가 훨씬 늦게 나타나기 때문에 이 두 형태를 분리할 수 있습니다.
고분자 합성
SEC는 합성 고분자의 크기와 다분산성, 즉 고분자 분자의 크기 분포를 구하는 능력의 척도로 사용될 수 있다.이미 알려진 크기의 표준을 실행한 경우 검정 곡선을 생성하여 분석을 위해 선택한 용매(종종 THF)에서 관심 있는 폴리머 분자의 크기를 결정할 수 있습니다.대안적인 방법으로, 알려진 분자량의 표준으로 교정에 의존하지 않는 절대 분자량을 산출하기 위해 SEC와 함께 광산란 및/또는 점도 측정과 같은 기술을 온라인으로 사용할 수 있다.분자량이 동일한 두 폴리머의 크기 차이로 인해 일반적으로 절대 결정 방법이 더 바람직하다.일반적인 SEC 시스템은 시료의 크기와 다분산성에 대한 정보를 폴리머 화학자에게 신속하게 제공할 수 있습니다(약 30분).예비 SEC는 분석 척도의 고분자 분류에 사용할 수 있습니다.
결점
SEC에서 질량은 고분자 분자의 유체역학 부피만큼 측정되지 않습니다. 즉, 특정 고분자 분자가 용액에 있을 때 차지하는 공간의 크기입니다.그러나 폴리스티렌의 분자량과 유체역학적 부피의 정확한 관계를 알 수 있기 때문에 SEC 데이터에서 대략적인 분자량을 계산할 수 있다.이를 위해 폴리스티렌을 표준으로 사용한다.그러나 유체역학적 부피와 분자량의 관계는 모든 폴리머에 대해 동일하지 않으므로 대략적인 측정값만 [19]얻을 수 있습니다.또 다른 단점은 정지상과 분석물 간의 상호작용 가능성이다.모든 상호작용은 용출 시간을 늦출 수 있으므로 분석물질 크기가 작아집니다.
이 방법을 실행할 때 용출 분자의 띠를 넓힐 수 있다.이는 이동상 분자의 흐름이 정지상 분자를 통과하여 발생하는 난류로 인해 발생할 수 있습니다.또한 유리벽의 분자와 용리제 분자 간의 분자열 확산과 마찰이 밴드 확대에 기여한다.넓어지는 것 외에 밴드끼리 겹치는 것도 있습니다.그 결과 용리액은 일반적으로 상당히 희석된다.밴드 확대의 가능성을 방지하기 위해 몇 가지 예방 조치를 취할 수 있습니다.예를 들어 컬럼 상단의 좁은 고농축 밴드로 시료를 적용할 수 있다.용리액이 농축될수록 시술이 더 효율적일 것입니다.단, 용리액을 농축하는 것이 항상 가능한 것은 아니기 때문에 또 하나의 [7]단점으로 생각할 수 있습니다.
절대 크기 제외 크로마토그래피
절대적 크기 제외 크로마토그래피(ASEC)는 광산란 기기, 가장 일반적으로 멀티앵글 광산란(MALS) 또는 다른 형태의 정적 광산란(SLS) 기기를 절대 몰 질량 및/또는 크기 측정용 크기 제외 크로마토그래피 시스템에 결합하는 기술이다.nts의 단백질과 고분자가 크로마토그래피 시스템에서 용출될 때 발생합니다.
이 경우 "절대"의 정의는 일련의 기준 표준을 사용하여 기둥의 유지 시간을 보정할 필요가 없으며, 종종 유체역학 직경(dydroadynamic diamic diamic diamic diameter, nm 단위로 D)이라고H 하는 몰 질량 또는 유체역학 크기를 얻을 필요가 없다는 것입니다.표준과 비교하여 유지 시간을 조절하는 정전기 또는 소수성 표면 상호작용과 같은 이상적이지 않은 열 상호작용은 최종 결과에 영향을 미치지 않는다.마찬가지로 분석물질과 표준물질의 조합 차이는 절대적인 측정에 영향을 미치지 않는다. 예를 들어, MOLS 분석에서는 본질적으로 무질서한 단백질의 몰 질량은 몰 질량이 동일한 구상 단백질보다 훨씬 이른 시간에 용출되지만 정확하게 특징지어지며, br의 경우도 마찬가지다.동일한 몰 [20][21][22]질량의 선형 기준 규격에 비해 늦게 용출되는 초중합체.ASEC의 또 다른 장점은 용출 피크의 각 지점에서 몰 질량 및/또는 크기가 결정되어 피크 내의 균질성 또는 다분산을 나타내는 것이다.예를 들어, 단일 분산 단백질의 SEC-MALS 분석에서는 전체 피크가 동일한 몰 질량의 분자로 구성되며, 이는 표준 SEC 분석에서는 가능하지 않습니다.
SLS에 의한 몰 질량 결정에는 광산란 측정과 농도 측정의 조합이 필요하다.따라서 SEC-MALS에는 일반적으로 광산란 검출기와 차동 굴절계 또는 UV/Vis 흡광도 검출기가 포함됩니다.또한 MLS는 특정 크기 제한(일반적으로 10 nm)을 초과하는 분자의 rms 반지름g R을 결정합니다.따라서 SEC-MALS는 R에 대한g 몰 질량의 관계를 통해 폴리머의 구조를 분석할 수 있다.더 작은 분자의 경우, DLS 또는 더 일반적으로, 차동 점도계를 추가하여 유체역학적 반지름을 결정하고 동일한 방식으로 분자 구조를 평가합니다.
SEC-DLS에서는 고분자의 크기가 크기 제외 컬럼 세트로부터 DLS 기기의 플로우 셀에 용출되면서 측정된다.분자 또는 입자의 유체역학적 크기는 측정되며 분자량은 측정되지 않습니다.단백질의 경우 Mark-Houwink 유형의 계산을 사용하여 유체역학적 크기에서 분자량을 추정할 수 있다.
SEC와 결합된 DLS의 주요 장점은 강화된 DLS [23]해상도를 얻을 수 있다는 것입니다.배치 DLS는 빠르고 단순하며 평균 크기를 직접 측정할 수 있지만 DLS의 기준선 분해능은 직경 3:1의 비율입니다.SEC를 이용하여 단백질과 단백질 올리고머를 분리하여 올리고머 분해가 가능하다.집약 스터디는, ASEC 를 사용해 실시할 수도 있습니다.광산란(SEC-MALS에서 몰 질량 측정을 위해 사용되는 것과 같은 온라인 농도 검출기는 골재 농도를 결정함)으로는 골재 농도를 계산할 수 없지만, 골재 크기는 SEC 컬럼에서 유출되는 최대 크기에 의해서만 측정할 수 있다.
DLS 검출에 의한 ASEC 의 제한에는, 플로우 레이트, 농도, 및 정밀도가 포함됩니다.상관 함수는 적절한 구축에 3~7초가 필요하기 때문에 피크 전체에서 제한된 수의 데이터 포인트를 수집할 수 있습니다.SLS 검출이 가능한 ASEC는 유량에 의해 제한되지 않으며 측정 시간은 기본적으로 순간적이며 농도 범위는 DLS보다 몇 배나 큽니다.그러나 SEC-MALS를 사용한 몰 질량 분석에는 정확한 농도 측정이 필요하다.MALS와 DLS 검출기는 종종 SEC에 의한 분리 후 보다 포괄적인 절대 분석을 위해 단일 계측기에 결합된다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Garrett RH, Grisham CM (2013). Biochemistry (5th ed.). Belmont, CA: Brooks/Cole, Cengage Learning. p. 108. ISBN 9781133106296. OCLC 1066452448.
- ^ Paul-Dauphin, S; Karaca, F; Morgan, TJ; et al. (6 Oct 2007). "Probing Size Exclusion Mechanisms of Complex Hydrocarbon Mixtures: The Effect of Altering Eluent Compositions". Energy & Fuels. 6. 21 (6): 3484–3489. doi:10.1021/ef700410e.
- ^ Brooks DE, Haynes CA, Hritcu D, et al. (June 2000). "Size exclusion chromatography does not require pores". Proceedings of the National Academy of Sciences of the United States of America. 97 (13): 7064–7. Bibcode:2000PNAS...97.7064B. doi:10.1073/pnas.120129097. JSTOR 122767. PMC 16499. PMID 10852951.
- ^ a b c Müller MB, Schmitt D, Frimmel FH (1 Dec 2000). "Fractionation of Natural Organic Matter by Size Exclusion Chromatography−Properties and Stability of Fractions". Environ Sci Technol. 34 (23): 4867–4872. Bibcode:2000EnST...34.4867M. doi:10.1021/es000076v.
- ^ a b c Skoog DA, Holler FJ, Crouch SR (2006). "Ch. 28. Liquid Chromatography" (PDF). Principles of instrumental analysis (6th ed.). Belmont, CA: Thomson Brooks/Cole. p. 816. ISBN 9780495012016. LCCN 2006926952. OCLC 77224390.
- ^ Rouessac A, Rouessac F (2000). Chemical analysis: modern instrumental methods and techniques (Engl. ed.). Chichester: Wiley. pp. 101–103. ISBN 978-0471972617. OCLC 635171657.
- ^ a b Ballou DP, Benore M, Ninfa AJ (2008). Fundamental laboratory approaches for biochemistry and biotechnology (2nd ed.). Hoboken, N.J.: Wiley. pp. 127–129. ISBN 9780470087664.
- ^ Lathe GH, Ruthven CR (August 1955). "The separation of substances on the basis of their molecular weights, using columns of starch and water". The Biochemical Journal. 60 (4): xxxiv. PMC 1216175. PMID 13249976.
- ^ Lathe GH, Ruthven CR (April 1956). "The separation of substances and estimation of their relative molecular sizes by the use of columns of starch in water". The Biochemical Journal. 62 (4): 665–74. doi:10.1042/bj0620665. PMC 1215979. PMID 13315231.
- ^ "The John Scott Award Recipients From 1822 - present". garfield.library.upenn.edu. Retrieved 3 Jan 2019.
- ^ Porath J, Flodin P (June 1959). "Gel filtration: a method for desalting and group separation". Nature. 183 (4676): 1657–9. Bibcode:1959Natur.183.1657P. doi:10.1038/1831657a0. PMID 13666849. S2CID 32287460.
- ^ Eisenstein M (2006). "Adventures in the matrix". Nature Methods. 3 (5): 410. doi:10.1038/nmeth0506-410. ISSN 1548-7105. S2CID 37935968.
- ^ Moore JC (1964). "Gel permeation chromatography. I. A new method for molecular weight distribution of high polymers". J Polym Sci A. 2 (2): 835–843. doi:10.1002/pol.1964.100020220. ISSN 1542-6246.
- ^ Striegel A, Yau WW, Kirkland JJ, Bly DD (2009). Modern Size-Exclusion Liquid Chromatography: Practice of Gel Permeation and Gel Filtration Chromatography (2nd ed.). Hoboken, N.J.: Wiley. ISBN 9780470442876. OCLC 587401945.
- ^ Grubisic Z, Rempp P, Benoit H (1967). "A universal calibration for gel permeation chromatography". J Polym Sci B. 5 (9): 753–759. Bibcode:1967JPoSL...5..753G. doi:10.1002/pol.1967.110050903. ISSN 1542-6254.
- ^ Sun T, Chance RR, Graessley WW, Lohse DJ (2004). "A Study of the Separation Principle in Size Exclusion Chromatography". Macromolecules. 37 (11): 4304–4312. Bibcode:2004MaMol..37.4304S. doi:10.1021/ma030586k. ISSN 0024-9297.
- ^ Wang Y, Teraoka I, Hansen FY, et al. (2010). "A Theoretical Study of the Separation Principle in Size Exclusion Chromatography". Macromolecules. 43 (3): 1651–1659. Bibcode:2010MaMol..43.1651W. doi:10.1021/ma902377g. ISSN 0024-9297.
- ^ Kumar, Pranav (2018). Fundamentals and techniques of Biophysics and Molecular biology. New Delhi: Pathfinder Publication. p. 05. ISBN 978-93-80473-15-4.
- ^ "Size Exclusion Chromatograhy". pslc.ws. Polymer Science Learning Center (PSLC). 2005. Retrieved 3 Jan 2019.
- ^ Wyatt, Philip J. (1 February 1993). "Light scattering and the absolute characterization of macromolecules". Analytica Chimica Acta. 272 (1): 1–40. doi:10.1016/0003-2670(93)80373-S.
- ^ Podzimek, Stepan (April 5, 2014). "Truths and myths about the determination of molar mass distribution of synthetic and natural polymers by size exclusion chromatography". Journal of Applied Polymer Science. 131 (7): 40111. doi:10.1002/app.40111.
- ^ Some, Daniel; Amartely, Hadar; Tsadok, Ayala; Lebendiker, Mario (June 20, 2019). "Characterization of Proteins by Size-Exclusion Chromatography Coupled to Multi-Angle Light Scattering (SEC-MALS)". Journal of Visualized Experiments (148): e59615. doi:10.3791/59615. PMID 31282880. Retrieved October 10, 2020.
- ^ Herold KE, Rasooly A (2009). Lab on a chip technology: Biomolecular separation and analysis. Vol. 2. Norfolk, UK: Horizon Scientific Press. p. 170. ISBN 9781904455462. OCLC 430080586.
외부 링크
| 라이브러리 리소스 정보 겔투과크로마토그래피 |