산염기 추출
Acid–base extraction| 산과 염기 |
|---|
 |
| 산 타입 |
| 베이스 타입 |
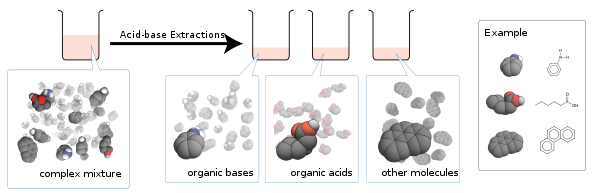
산-염기 추출은 순차적인 액체-액체 추출을 사용하여 산과 염기를 화학적 [1]: 118–122 특성에 기초한 혼합물로부터 정제하는 절차이다.
산-염기 추출은 화학 합성 후 작업 중에 정기적으로 수행되며 조 추출물로부터 알칼로이드와 같은 화합물과 천연물을 분리한다.제품에는 중성, 산성 또는 염기성 불순물이 거의 없습니다.이 간단한 방법으로는 화학적으로 유사한 산이나 염기를 분리할 수 없습니다.
이론.
이 기술의 기본 이론은 이온성인 소금은 수용성인 반면 중성 분자는 수용성인 경향이 있다는 것이다.
유기 염기와 산의 혼합물에 산을 첨가하면 산이 충전되지 않은 상태로 유지되는 반면 염기는 양성자화되어 소금을 형성합니다.카르본산 등의 유기산이 충분히 약하면 첨가산에 의해 자기이온을 억제할 수 있다.
반대로 유기산과 염기의 혼합물에 염기를 첨가하면 염기가 충전되지 않은 상태로 유지되며, 산을 탈양성하여 대응하는 소금을 얻을 수 있다.다시 한 번, 첨가된 염기에 의해 강염기의 자기 이온화가 억제된다.
또한a 산성-염기 추출b 절차는 pK(또는 pK) 상수의 차이가 충분히 클 경우 강한 산으로부터 매우 약한 산을, 더 강한 염기에서 매우 약한 염기를 분리하는 데 사용할 수 있다.예를 들어 다음과 같습니다.
- 벤조산 또는 소르브산(pKa 약 4-5)과 같은 강한 산으로부터 페놀, 2-나프톨 또는 4-히드록시인돌(pKa 약 10)과 같은 페놀계 OH기를 가진 매우 약한 산
- 메스칼린 또는 디메틸트립타민과 같은 더 강한 염기의 카페인 또는 4-니트로아닐린(pKb 약 13–14)과 같은 매우 약한 염기(pKb 약 3–4)
일반적으로 pH는 분리되는 화합물의 pKa(또는b pK) 상수 사이의 값으로 조정됩니다.중간산성 pH값에는 구연산, 인산, 희석황산 등의 약산을, 강산성 pH값에는 염산 이상의 농황산을 사용한다.마찬가지로 암모니아나 중탄산나트륨(NaHCO3)과 같은 약한 염기는 중간 정도의 기본 pH 값에 사용되며, 탄산칼륨(KCO23)이나 수산화나트륨(NaOH)과 같은 강한 염기는 강한 알칼리성 조건에 사용됩니다.
기술.
보통 디클로로메탄이나 디에틸에테르(에테르) 등의 적절한 용매에 녹여 분리 깔때기에 붓는다.산 또는 염기의 수용액을 첨가하고 해당 수용상의 pH를 조정하여 해당 화합물을 원하는 형태로 한다.흔들어서 상분리를 허용한 후 관심화합물을 포함한 위상을 수집한다.그런 다음 이 단계를 반대 pH 범위에서 반복합니다.순서는 중요하지 않으며 이 과정을 반복하여 간격을 늘릴 수 있습니다.단, 용제의 증발에 의해 생성물이 생성되도록 하기 위해 최종 공정 후 유기 단계에서 화합물을 용해시키는 것이 편리한 경우가 많다.
제한 사항
이 절차는 충전된 형태와 충전되지 않은 형태 간에 용해도가 큰 산과 염기에 대해서만 작동합니다.이 순서는, 다음의 경우에 기능하지 않습니다.
- 동일한 분자 내에 산성 및 염기성 관능기(예: 대부분의 pH에서 수용성 경향이 있는 글리신)를 가진 즈위테리온.
- 트리페닐아민 및 트리헥실아민 등 대전된 형태의 수성 단계에서 쉽게 녹지 않는 매우 친유성 아민.
- 지방산과 같이 충전된 형태의 수성 단계에서 쉽게 녹지 않는 매우 친유성 산.
- 암모니아, 메틸아민 또는 트리에탄올아민과 같은 낮은 아민으로, 대부분의 pH에서 혼합되거나 물에 상당히 용해됩니다.
- 아세트산, 구연산과 같은 친수성 산과 황산이나 인산 같은 대부분의 무기산입니다.
대체 수단
산염기 추출의 대안으로는 다음이 있다.
- 실리카겔 또는 알루미나의 플러그를 통해 혼합물을 여과하는 - 대전된 소금은 실리카겔 또는 알루미나에 강하게 흡착된 상태로 유지되는 경향이 있다.
- 이온 교환 크로마토그래피는 다른 pH에서 컬럼 매체에 대한 다양한 친화력에 의해 강산, 약산 및 염기의 혼합물을 분리할 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Harwood, Laurence M.; Moody, Christopher J. (1 January 1990). Experimental Organic Chemistry: Principles and Practice (Illustrated ed.). Blackwell Scientific Publications. ISBN 978-0-632-02016-4. LCCN 88007680. OCLC 18816225. OL 2032038M. Wikidata Q107313989. Retrieved 2021-06-22 – via Internet Archive.