분비물
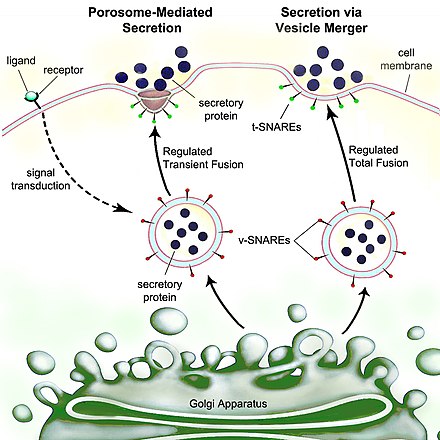
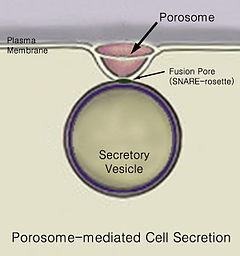
Secretion분비물은 세포나 선에서 분비된 화학 물질과 같은 물질이 한 지점에서 다른 지점으로 이동하는 것입니다.반대로 배설은 세포나 유기체에서 특정 물질이나 노폐물을 제거하는 것이다.세포 분비의 전통적인 메커니즘은 포로솜이라고 [1]불리는 혈장 막의 분비 문구를 통해 이루어진다.뽀로솜은 세포막에 내장된 영구 컵 모양의 리포단백질 구조이며, 세포에서 혈관 내 내용물을 방출하기 위해 분비성 소포가 일시적으로 도킹하고 융합합니다.
박테리아 종에서 분비물은 단백질, 효소 또는 독소(예: 병원성 세균의 콜레라 독소)와 같은 이펙터 분자의 이동 또는 전위를 의미한다.Vibrio colerae)는 세균 세포의 내부(세포질 또는 세포질)를 가로질러 외부로 이동합니다.분비물은 박테리아가 자연환경에서 적응과 생존을 위해 기능하고 작동하는데 매우 중요한 메커니즘이다.
진핵세포에서
메커니즘
인간 세포를 포함한 진핵 세포는 매우 진화한 분비 과정을 가지고 있다.외부를 대상으로 하는 단백질은 조세포망(ER)에 도킹된 리보솜에 의해 합성된다.이러한 단백질은 합성되면서 ER 내강으로 전이되어 글리코실화되고 분자 샤페론이 단백질 접힘을 돕는다.잘못 접힌 단백질은 보통 여기에서 확인되며 세포질로의 ER 관련 분해에 의해 역전이되며, 여기서 단백질에 의해 분해된다.적절하게 접힌 단백질을 포함한 소포가 골지 기구에 들어간다.
골지 장치에서는 단백질의 글리코실화가 수식되고, 또한 분할 및 기능화를 포함한 번역 후 수식이 발생할 수 있다.그 단백질들은 세포골격을 따라 세포 가장자리로 이동하는 분비성 소포로 이동된다.분비 소포에서 더 많은 변형이 발생할 수 있습니다(예: 인슐린은 분비 소포의 프로인슐린에서 분리됩니다).
결국, 포경 세포막과의 소포 융접이 세포 환경 [2]밖으로 내용물을 버리는 엑소사이토시스라고 불리는 과정에 의해 일어난다.
pH 구배를 사용하여 이 배열에 대해 엄격한 생화학적 제어가 유지된다. 즉, 세포질의 pH는 7.4, ER의 pH는 7.0, cis-golgi의 pH는 6.5이다.분비성 소포의 pH는 5.0에서 6.0 사이이며, 일부 분비성 소포는 pH가 4.8인 리소좀으로 진화합니다.
비고전성 분비물
FGF1(aFGF), FGF2(bFGF), 인터류킨-1(IL1) 등과 같이 신호 서열을 가지지 않는 단백질이 많다.그들은 고전적인 ER-Golgi 경로를 사용하지 않는다.이것들은 다양한 비고전적인 경로를 통해 분비된다.
적어도 4개의 비전통적(비전통적) 단백질 분비 경로가 [3]설명되었다.다음과 같은 것이 있습니다.
- 막수송단백질을통해가능성이높은플라즈마막을통한직접단백질전위
- 삐걱거리다
- 리소좀 분비
- 다공체로부터 유도된 엑소좀을 통해 방출되는
또한 단백질은 기계적 또는 생리학적[4] 상처 및 혈청 없는 매체 또는 [5]완충액으로 세포를 세척함으로써 유도되는 혈장막의 비치사적 과도성 종양 모공을 통해 세포에서 방출될 수 있다.
인체 조직 내
많은 인간 세포들은 분비 세포가 될 수 있는 능력을 가지고 있다.그들은 잘 발달된 소포체와 이 기능을 수행하기 위한 골지 기구를 가지고 있다.분비물을 만드는 조직에는 소화효소와 위산을 분비하는 위장관, 계면활성제를 분비하는 폐, 피지를 분비해 피부와 모발을 윤택하게 하는 피지선이 있다.눈꺼풀에 있는 마이봄샘은 마이봄을 분비하여 눈을 윤활하고 보호합니다.
그램 음성균
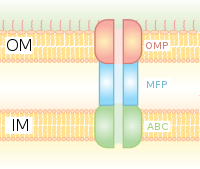
분비물은 진핵생물에게만 있는 것이 아니다 - 박테리아와 고세균에도 존재한다.ATP 결합 카세트(ABC) 타입의 운반체는 생명체의 세 영역에 공통적이다.일부 분비 단백질은 분비 단백질에 N-말단 신호 펩타이드의 존재를 필요로 하는 2개의 전위 시스템 중 하나인 SecYEG 전이로콘에 의해 세포질막을 가로질러 전위된다.다른 것들은 트윈 아르기닌 전이 경로(Tat)에 의해 세포질막을 가로질러 전이된다.그램 음성 박테리아는 두 개의 막을 가지고 있기 때문에 위상적으로 분비가 더 복잡해진다.그램 음성 박테리아에는 적어도 6개의 특수 분비 시스템이 있다.많은 분비된 단백질은 박테리아 병원 [6]형성에 특히 중요하다.
Type I 분비계(T1SS 또는 TOOS)
I형 분비물은 Hly 및 Tol 유전자 클러스터를 사용하는 샤페론 의존 분비 시스템이다.이 과정은 분비되는 단백질의 리더 배열이 HlyA에 의해 인식되고 막에 HlyB가 결합되면서 시작된다.이 신호 시퀀스는 ABC 트랜스포터 전용입니다.더 HlyAB 복합체는 HlyD를 자극하여 HlyD의 말단 분자 또는 신호를 TolC가 인식하는 외막에 도달합니다.HlyD는 TolC를 내막으로 모집하고 HlyA는 긴 터널 단백질 채널을 통해 외막 밖으로 배출된다.
타입 I 분비 시스템은 이온, 약품에서 다양한 크기의 단백질(20~900kDa)까지 다양한 분자를 운반한다.분비되는 분자는 작은 대장균 펩타이드 콜리신 V(10kDa)[7]부터 520kDa의 Pseudomonas 형광 세포 접착 단백질 LapA까지 크기가 다양하다.가장 잘 특징지어지는 것은 RTX 독소와 리파아제입니다.I형 분비물은 또한 고리형 β-글루칸 및 다당류와 같은 비단백질 기질의 수출에도 관여한다.
타입 II 분비계(T2SS)
Type II 시스템 또는 일반 분비 경로의 주요 말단 분지를 통해 분비되는 단백질은 배수로의 초기 운반을 위해 Sec 또는 Tat 시스템에 의존합니다.일단 그곳에 도착하면, 그들은 세크레틴 단백질을 형성하는 다량체(12~14 서브유닛)를 통해 외막을 통과한다.세크레틴 단백질 외에도, 10-15개의 다른 내막 및 외막 단백질이 완전한 분비 기구를 구성하며, 많은 단백질이 아직 알려지지 않은 기능을 가지고 있다.그램 음성 타입 IV 필리는 생물 형성을 위해 타입 II 시스템의 변형 버전을 사용하며, 어떤 경우에는 특정 단백질이 단일 박테리아 종 내에서 필러스 복합체와 타입 II 시스템 간에 공유된다.
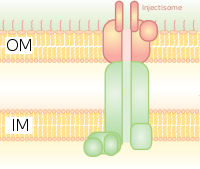
타입 III 분비계(T3SS 또는 TTSS)
그것은 세균 편모의 기초체와 상동한다.그것은 박테리아가 진핵 세포에 단백질을 주입할 수 있는 분자 주사기와 같다.세포 내 Ca 농도가 낮으면2+ T3SS를 조절하는 게이트가 열립니다.저칼슘 농도를 검출하기 위한 메커니즘 중 하나는 저칼슘 농도를 검출하고 T3SS 부착을 유도하기 위해 사용되는 Yersinia pestis에 의해 이용되는 lcrV(저칼슘 반응) 항원에 의해 설명되었다.식물 병원체의 Hrp 시스템은 유사한 메커니즘을 통해 하핀과 병원체 이펙터 단백질을 식물에 주입합니다.이 분비 시스템은 예르시니아 페스티스에서 처음 발견되었고 독소가 단순히 세포외 [8]매개체로 분비되는 것이 아니라 세균 세포질에서 숙주의 세포질로 직접 주입될 수 있다는 것을 보여주었다.
타입 IV 분비계(T4SS 또는 TFSS)
| T4SS | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 IV형 분비계 | |||||||||
| 식별자 | |||||||||
| 기호. | T4SS | ||||||||
| 팜 | PF07996 | ||||||||
| 인터프로 | IPR012991 | ||||||||
| SCOP2 | 1gl7/SCOPe/SUPFAM | ||||||||
| TCDB | 3. A.7 | ||||||||
| OPM 슈퍼 패밀리 | 215 | ||||||||
| OPM단백질 | 3jqo | ||||||||
| |||||||||
그것은 세균의 결합 기계인 결합 필리와 상동한다.그것은 DNA와 단백질을 운반할 수 있다.그것은 아그로박테리움 투메파시엔스에서 발견되었는데, 이것은 Ti 플라스미드의 T-DNA 부분을 식물 숙주로 도입하기 위해 이 시스템을 사용했고, 이것은 다시 영향을 받은 부위를 왕관 쓸개로 발전시킵니다.헬리코박터균은 IV형 분비 시스템을 사용하여 CagA를 위암과 관련된 [9]위상피세포에 전달합니다.백일해 원인물질인 보데텔라 백일해는 IV형 시스템을 통해 백일해 독소를 부분적으로 분비한다.레지오넬라증의 원인물질인 레지오넬라 기흉필라는 수많은 이펙터 단백질을 진핵 [10]숙주로 이동시키기 위해 icm/dot(세포 내 증식/소기관 밀매 유전자의 결함) 시스템으로 알려진 IVB형 분비 시스템을 이용한다.원형 IVA 분비 시스템은 아그로박테륨 투메파시엔스의 [11]VirB 복합체이다.
이 패밀리의 단백질 구성원은 IV형 분비 시스템의 구성요소이다.그들은 박테리아 결합 [12][13]기계와 조상적으로 관련된 메커니즘을 통해 고분자의 세포 내 전달을 매개한다.
기능.
간단히 말해서, 타입 IV 분비계(T4SS)는 박테리아 세포가 고분자를 분비하거나 흡수하는 일반적인 메커니즘이다.그들의 정확한 메커니즘은 아직 알려지지 않았다.T4SS는 박테리아에서 그램 음성 결합 요소 위에 암호화되어 있다.T4SS는 DNA와 단백질이 공여 세포의 세포질에서 수용 세포의 세포질로 이동할 수 있는 채널을 형성하는 세포 외피 스팬링 복합체, 즉 11-13개의 핵심 단백질이다.또한 T4SS는 자연변환 중에 독성인자 단백질을 직접 숙주세포에 분비함과 동시에 배지에서 DNA를 흡수하여 고분자분비장치의 [14]다용도를 나타낸다.
구조.
위 그림에서 보듯이 TraC는 특히 3개의 나선 다발과 느슨한 구상 [13]부속물로 구성되어 있습니다.
상호 작용
T4SS는 2개의 이펙터 단백질을 가진다.첫 번째는 Anaplasma translocated 기판 1을 나타내는 ATS-1과 두 번째는 Ankyrin repeat domain 함유 단백질 A를 나타내는 AnkA이다.또한 T4SS 결합 단백질은 VirE2에 [15]결합하는 VirD4이다.
V형 분비계(T5SS)
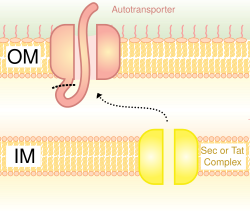
자동수송기 [16]시스템이라고도 불리는 V형 분비물은 내막을 가로지르기 위해 Sec 시스템을 사용하는 것을 포함한다.이 경로를 사용하는 단백질은 외부 막에 삽입되는 C 말단과 베타 배럴을 형성할 수 있는 능력을 가지고 있으며, 나머지 펩타이드(승객 도메인)가 세포 외부에 도달하도록 한다.종종 자동 수송기가 절단되어 베타 배럴 도메인이 외막에 남아 승객 도메인이 해방됩니다.일부 연구원들은 자동 전달기의 잔해가 유사한 베타 배럴 [citation needed]구조를 형성하는 포린을 발생시켰다고 믿고 있다.이 분비 시스템을 사용하는 자동 운반기의 일반적인 예는 Trimeric 자동 운반기 접착제입니다.[17]
타입 VI 분비계(T6SS)
VI형 분비 시스템은 2006년 하버드 의과대학(미국 보스턴)의 존 메칼라노스 그룹이 Vibrio cholerae와 Pseudomonas [18][19]aeruginosa라는 두 가지 세균 병원균에서 처음 확인되었습니다.이것들은 Vibrio Cholerae의 Hcp와 VrgG 유전자의 돌연변이가 독성과 병원성을 감소시켰을 때 확인되었다.그 이후로, VI형 분비 시스템은 토양,[20][21] 환경 또는 해양 박테리아뿐만 아니라 동물, 식물, 인간 병원균을 포함한 모든 단백질 박테리아의 4분의 1에서 발견되었다.VI형 분비에 대한 초기 연구의 대부분은 고등 유기체의 병리 형성에 대한 그것의 역할에 초점을 맞췄지만, 보다 최근의 연구는 단순한 진핵 생물 포식자에 대한 방어와 박테리아 간 [22][23]상호작용에서의 그것의 역할을 더 넓게 제시했다.VI형 분비계 유전자 클러스터는 15~20개 이상의 유전자를 포함하고 있으며, 그 중 Hcp와 VgrG 두 개는 거의 보편적으로 분비되는 시스템 기질인 것으로 나타났다.이 시스템의 이들 및 다른 단백질의 구조적 분석은 T4 파지의 꼬리 스파이크와 현저하게 유사하며, 시스템의 활동은 기능적으로 파지 [24]감염과 유사하다고 생각된다.
외막 소포의 방출
상기 다단백질 복합체의 사용 외에 그람음성균은 물질의 방출을 위한 또 다른 방법인 세균 외막 소포의 [25]형성을 가지고 있다.외막의 일부는 떼어내, 주위 증배 재료를 둘러싸는 나노 규모의 구면 구조를 형성해, 환경을 조작하거나 호스트-병원체 계면에서 침입하는 막낭트래픽을 위해서 전개된다.많은 세균종의 소포는 독성 인자를 포함하고 있으며, 일부는 면역 조절 효과를 가지고 있으며, 일부는 숙주 세포에 직접 달라붙어 중독시킬 수 있다.소포의 방출은 스트레스 조건에 대한 일반적인 반응으로 입증되었으며, 화물 단백질을 적재하는 과정은 [26]선택적인 것으로 보인다.
그램 양성균의 분비물
일부 포도상구균 및 스트렙토코커스 종에서 보조분비계는 고도로 반복적인 접착당단백질의 수출을 취급한다.
「 」를 참조해 주세요.
레퍼런스
- ^ Lee JS, Jeremic A, Shin L, Cho WJ, Chen X, Jena BP (July 2012). "Neuronal porosome proteome: Molecular dynamics and architecture". Journal of Proteomics. 75 (13): 3952–62. doi:10.1016/j.jprot.2012.05.017. PMC 4580231. PMID 22659300.
- ^ Anderson LL (2006). "Discovery of the 'porosome'; the universal secretory machinery in cells". Journal of Cellular and Molecular Medicine. 10 (1): 126–31. doi:10.1111/j.1582-4934.2006.tb00294.x. PMC 3933105. PMID 16563225.
- ^ Nickel W, Seedorf M (2008). "Unconventional mechanisms of protein transport to the cell surface of eukaryotic cells". Annual Review of Cell and Developmental Biology. 24: 287–308. doi:10.1146/annurev.cellbio.24.110707.175320. PMID 18590485.
- ^ McNeil PL, Steinhardt RA (2003). "Plasma membrane disruption: repair, prevention, adaptation". Annual Review of Cell and Developmental Biology. 19: 697–731. doi:10.1146/annurev.cellbio.19.111301.140101. PMID 14570587.
- ^ Chirico WJ (October 2011). "Protein release through nonlethal oncotic pores as an alternative nonclassical secretory pathway". BMC Cell Biology. 12: 46. doi:10.1186/1471-2121-12-46. PMC 3217904. PMID 22008609.
- ^ Wooldridge, K, ed. (2009). Bacterial Secreted Proteins: Secretory Mechanisms and Role in Pathogenesis. Caister Academic Press. ISBN 978-1-904455-42-4.[페이지 필요]
- ^ Boyd CD, Smith TJ, El-Kirat-Chatel S, Newell PD, Dufrêne YF, O'Toole GA (August 2014). "Structural features of the Pseudomonas fluorescens biofilm adhesin LapA required for LapG-dependent cleavage, biofilm formation, and cell surface localization". Journal of Bacteriology. 196 (15): 2775–88. doi:10.1128/JB.01629-14. PMC 4135675. PMID 24837291.
- ^ Salyers, A. A. & Whitt, D. D. (2002)세균 발생: A Molecular approach, 2ed, 워싱턴 D.C.ASM 프레스ISBN 1-55581-171-X[page needed]
- ^ Hatakeyama M, Higashi H (December 2005). "Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis". Cancer Science. 96 (12): 835–43. doi:10.1111/j.1349-7006.2005.00130.x. PMID 16367902. S2CID 5721063.
- ^ Cascales E, Christie PJ (November 2003). "The versatile bacterial type IV secretion systems". Nature Reviews. Microbiology. 1 (2): 137–49. doi:10.1038/nrmicro753. PMC 3873781. PMID 15035043.
- ^ Christie PJ, Atmakuri K, Krishnamoorthy V, Jakubowski S, Cascales E (2005). "Biogenesis, architecture, and function of bacterial type IV secretion systems". Annual Review of Microbiology. 59: 451–85. doi:10.1146/annurev.micro.58.030603.123630. PMC 3872966. PMID 16153176.
- ^ Christie PJ (November 2004). "Type IV secretion: the Agrobacterium VirB/D4 and related conjugation systems". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1694 (1–3): 219–34. doi:10.1016/j.bbamcr.2004.02.013. PMC 4845649. PMID 15546668.
- ^ a b Yeo HJ, Yuan Q, Beck MR, Baron C, Waksman G (December 2003). "Structural and functional characterization of the VirB5 protein from the type IV secretion system encoded by the conjugative plasmid pKM101". Proceedings of the National Academy of Sciences of the United States of America. 100 (26): 15947–52. Bibcode:2003PNAS..10015947Y. doi:10.1073/pnas.2535211100. JSTOR 3149111. PMC 307673. PMID 14673074.
- ^ Lawley TD, Klimke WA, Gubbins MJ, Frost LS (July 2003). "F factor conjugation is a true type IV secretion system". FEMS Microbiology Letters. 224 (1): 1–15. doi:10.1016/S0378-1097(03)00430-0. PMID 12855161.
- ^ Rikihisa Y, Lin M, Niu H (September 2010). "Type IV secretion in the obligatory intracellular bacterium Anaplasma phagocytophilum". Cellular Microbiology. 12 (9): 1213–21. doi:10.1111/j.1462-5822.2010.01500.x. PMC 3598623. PMID 20670295.
- ^ Thanassi DG, Stathopoulos C, Karkal A, Li H (2005). "Protein secretion in the absence of ATP: the autotransporter, two-partner secretion and chaperone/usher pathways of gram-negative bacteria (review)". Molecular Membrane Biology. 22 (1–2): 63–72. doi:10.1080/09687860500063290. PMID 16092525. S2CID 2708575.
- ^ Gerlach RG, Hensel M (October 2007). "Protein secretion systems and adhesins: the molecular armory of Gram-negative pathogens". International Journal of Medical Microbiology. 297 (6): 401–15. doi:10.1016/j.ijmm.2007.03.017. PMID 17482513.
- ^ Pukatzki S, Ma AT, Sturtevant D, Krastins B, Sarracino D, Nelson WC, Heidelberg JF, Mekalanos JJ (January 2006). "Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system". Proceedings of the National Academy of Sciences of the United States of America. 103 (5): 1528–33. Bibcode:2006PNAS..103.1528P. doi:10.1073/pnas.0510322103. JSTOR 30048406. PMC 1345711. PMID 16432199.
- ^ Mougous JD, Cuff ME, Raunser S, Shen A, Zhou M, Gifford CA, Goodman AL, Joachimiak G, Ordoñez CL, Lory S, Walz T, Joachimiak A, Mekalanos JJ (June 2006). "A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus". Science. 312 (5779): 1526–30. Bibcode:2006Sci...312.1526M. doi:10.1126/science.1128393. PMC 2800167. PMID 16763151.
- ^ Bingle LE, Bailey CM, Pallen MJ (February 2008). "Type VI secretion: a beginner's guide" (PDF). Current Opinion in Microbiology. 11 (1): 3–8. doi:10.1016/j.mib.2008.01.006. PMID 18289922.
- ^ Cascales E (August 2008). "The type VI secretion toolkit". EMBO Reports. 9 (8): 735–41. doi:10.1038/embor.2008.131. PMC 2515208. PMID 18617888.
- ^ Schwarz S, Hood RD, Mougous JD (December 2010). "What is type VI secretion doing in all those bugs?". Trends in Microbiology. 18 (12): 531–7. doi:10.1016/j.tim.2010.09.001. PMC 2991376. PMID 20961764.
- ^ Coulthurst SJ (2013). "The Type VI secretion system - a widespread and versatile cell targeting system". Research in Microbiology. 164 (6): 640–54. doi:10.1016/j.resmic.2013.03.017. PMID 23542428.
- ^ Silverman JM, Brunet YR, Cascales E, Mougous JD (2012). "Structure and regulation of the type VI secretion system". Annual Review of Microbiology. 66: 453–72. doi:10.1146/annurev-micro-121809-151619. PMC 3595004. PMID 22746332.
- ^ Kuehn MJ, Kesty NC (November 2005). "Bacterial outer membrane vesicles and the host-pathogen interaction". Genes & Development. 19 (22): 2645–55. doi:10.1101/gad.1299905. PMID 16291643.
- ^ McBroom AJ, Kuehn MJ (January 2007). "Release of outer membrane vesicles by Gram-negative bacteria is a novel envelope stress response". Molecular Microbiology. 63 (2): 545–58. doi:10.1111/j.1365-2958.2006.05522.x. PMC 1868505. PMID 17163978.
- ^ Z. 에스나 아샤리, 노스 다스굽타, K.Brayton & S. Broschat, "다단계 특징 선택 접근법에 기초한 종의 하위 집합에 대한 유형 IV 분비 시스템 이펙터 단백질을 예측하기 위한 최적의 특징 세트", PLOS ONE Journal, 2018, 13, e07041. (doi.org/10.1371/journal.pone.0197041.)
추가 정보
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P, eds. (2002). "Search: Secretion". Molecular Biology of the Cell (4th ed.). New York: Garland Science. ISBN 978-0-8153-3218-3.
- White D (2000). The Physiology and Biochemistry of Prokaryotes (2nd ed.). Oxford University Press. ISBN 978-0-19-512579-5.
- Avon D. "Home page". Cells alive!.
외부 링크
- 미국 국립 의학 도서관 의학 주제 제목(MeSH)의 분비물
- Uni Münster의 T5SS/오토트랜스포터 일러스트