이부루티니브
Ibrutinib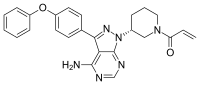 | |
| 임상 데이터 | |
|---|---|
| 상호 | 임브루비카 등 |
| 기타 이름 | PCI-32765, CRA-032765 |
| AHFS/Drugs.com | 모노그래프 |
| Medline Plus | a614007 |
| 라이선스 데이터 | |
| 임신 카테고리 |
|
| 루트 행정부. | 입으로 (캡슐) |
| ATC 코드 | |
| 법적 상태 | |
| 법적 상태 | |
| 약동학 데이터 | |
| 단백질 결합 | 97.3% |
| 대사 | 간(CYP3A 및 CYP2D6) |
| 반감기 제거 | 4 ~ 6 시간 |
| 배설물 | 대변(80%), 소변(10%) |
| 식별자 | |
| |
| CAS 번호 | |
| PubChem CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 첸블 | |
| PDB배위자 | |
| CompTox 대시보드 (EPA ) | |
| ECHA 정보 카드 | 100.232.543 |
| 화학 및 물리 데이터 | |
| 공식 | C25H24N6O2 |
| 몰 질량 | 440.507g/표준−1 |
| 3D 모델(JSmol) | |
| |
| |
Ibrutinib은 브랜드명 Imbruvica로 판매되는 작은 분자 약물로 브루톤의 티로신인산화효소(BTK) 단백질과 불가역적으로 결합함으로써 B세포의 증식과 생존을 억제한다.BTK를 차단하면 B세포 암에서 비정상적으로 활성화되는 B세포 수용체 경로가 억제된다.따라서 이브루티닙은 맨틀 세포 림프종, 만성 림프구 백혈병,[4][5] 발덴스트롬의 매크로글로불린혈증을 포함한 그러한 암 치료에 사용된다.
그것은 세계보건기구의 필수 [6]의약품 목록에 있다.
의료 용도
이브루티닙은 만성 림프구 백혈병(CLL), 발덴스트롬의 매크로글로불린혈증, 맨틀 세포 림프종, 주변부 림프종, 만성 이식편 대 숙주 [3][4]질환의 2차 치료제로 사용된다.ibrutinib에 의한 BTK 억제는 악성 B세포의 주요 의존관계인 BCR 시그널링 경로를 손상시키지만, BTK 억제는 CD40 시그널링, B세포 접착 및 이동을 방해하는 것으로 나타났다.
미국에서 ibrutinib는 적어도 하나의 사전 치료를 받은 맨틀 세포 림프종(MCL) 성인의 치료, 만성 림프구 백혈병(CLL)/소형 림프종(SLL) 17p 결실이 있거나 결실이 없는 성인, Waldenström의 매크로글로불린혈증(MW 주변 림프종) 성인의 치료로 표시된다.하나 이상의 [4][7][8][9][10]전신요법 실패 후 만성 이식편 대 숙주 질환(cGVHD)을 가진 성인 중 적어도 한 가지 이상의 항CD20 기반 치료를 받은 적이 있는 사람.
치료가 필요하고 새로 진단된 [11]CLL 환자에게는 첫 번째 치료입니다.재발하는 [11]CLL에서도 사용할 수 있습니다.
부작용
아주 흔한(>10%주파수)부작용 화상, 상부 호흡기 감염, 축농증, 피부 감염, 낮은 neutrophil 수, 낮은 혈소판 수치는, 두통, 출혈, 타박상, 설사, 구토, 입의 염증 및 입술, 메스꺼움, 변비, 경솔하게, 관절 통증, 근육 경련들, 근골격계 통증, 발열, 부종 등이 있다.[3]
일반(1–10%주파수)부작용, 즉 패혈증 요로 감염,non-melanoma 피부 암(basal-cell 암, 편평 세포암), 낮은 백혈구 수, 낮은 림프구 수, 간질성 폐 질환, 종양 용해 syndrome,[12] 높은 요산 수치, 현기증, 흐릿한 시야, 심방 세동, 경막 하혈종, noseblee을 포함한다.ds,혈관 파열, 고혈압, 두드러기, 피부 홍조 또는 [3]홍조로 인한 작은 멍들.
약리학
Ibrutinib 경구 생체이용률은 공복상태에서 3.9%, 사료상태에서 8.4%, 자몽주스 [13]섭취 후 15.9%이다.
메커니즘
이브루티닙은 브루톤의 티로신인산화효소(BTK)의 강력하고 돌이킬 수 없는 억제제이다.이는 BTK 활성 부위에서 시스테인 잔류물 C481과 공유 결합을 형성하여 BTK 효소 활성을 지속적으로 억제한다.BTK는 B세포 항원 수용체(BCR) 경로의 중요한 신호 전달 분자로, 맨틀 세포 림프종(MCL), 확산성 B세포 림프종(DLBCL), 모낭 림프종 및 만성 림프성 백혈병(CLL)을 포함한 여러 B세포 악성 종양의 병원 형성에 역할을 한다.이브루티니브는 생체 내 악성 B세포 증식과 생존은 물론 [5]세포 이동과 생체 내 기질 유착을 효과적으로 억제하는 것으로 임상 전 연구에서 밝혀졌다.
초기 임상 연구에서 ibrutinib의 활성은 일시적인 림프구 증세를 동반하는 림프절 장애의 급격한 감소를 포함하는 것으로 설명되었으며, 이는 이 약이 세포 호밍 또는 조직 미세 환경의 [14]인자로의 이동에 직접적인 영향을 미칠 수 있음을 시사한다.
만성 림프구 백혈병(CLL) 세포에 대한 임상 전 연구에서 이브루티니브는 아포토시스를 촉진하고 증식을 억제하며 또한 미세 [15]환경에 의해 제공되는 생존 자극에 대한 CLL 세포의 반응을 막는 것으로 보고되었다.이것은 또한 악성 B세포에서 [15]MCL1 수치(항아포토시스 단백질)의 감소로 이어진다.활성 CLL 세포를 ibrutinib로 처리한 결과 BTK 티로신 인산화 억제가 이루어졌으며 ERK1/2, PI3K 및 NF-δB를 포함한 해당 키나제에 의해 활성화된 하류 생존 경로가 효과적으로 폐기되었다.또한 ibrutinib는 CLL 세포의 체외 증식을 억제하여 수용성 인자(BAFF, IL-6, IL-4, TNF-α), 섬유넥틴 결합 및 스트롬 세포 접촉을 포함한 미세 환경으로부터 CLL 세포에 외부에서 제공되는 생존 신호를 효과적으로 차단하였다.
이브루티닙은 또한 케모카인 CXCL12 및 CXCL13에 대한 만성 림프구 백혈병 세포 화학축성을 감소시키고 B세포 수용체(BCR)[16][17]에서의 자극에 따른 세포 유착을 억제하는 것으로 보고되었다.또, ibrutinib는, CXCR4/[15]SDF1축을 목표로 하는 것으로, CD20(리턱시맵/오파탐의 표적)의 발현을 다운 변조한다.이들 데이터는 ibrutinib가 BCR 시그널링을 차단하는 기계학적 모델과 일치하며, 이 모델은 세포를 아포토시스 상태로 유도하거나 세포 이동을 방해하고 보호종양 미세환경에 대한 부착을 방해한다.
역사
Ibrutinib는 Celera Genomics의 과학자들에 의해 BTK 기능을 연구하기 위한 도구 화합물로 만들어졌다. 이것은 시약에는 이상적이지만 일반적으로 [18]약물에는 이상적이지 않은 표적과 공유 결합한다.
2006년, 초기 검출 프로그램이 실패한 후 Celera로부터 HDAC에 초점을 맞춘 프로그램을 인수하는 과정에서 Pharmacyclics는 Celera의 소분자 BTK 억제제 검출 프로그램을 현금 200만달러와 재고 100만달러에 인수하여 이 툴 컴파운드를 PCI-32765라고 [18][19]명명했습니다.이 약이 2단계 시험을 완료한 후 2011년 존슨앤드존슨과 파머시클릭스는 이 약을 공동 개발하기로 합의했고 J&J는 파머시클릭스에 1억5천만 달러의 선불금과 8억2천500만 달러의 [20]이정표를 지불했다.2015년 5월 약국유통회사가 AbbVie에 인수되었으며, Abbvie는 2016년 10억 달러, [21]2020년 50억 달러의 글로벌 매출을 예상하고 있습니다.
2013년 11월 13일 미국 식품의약국(FDA)이 맨틀 세포 림프종 치료를 [7]승인했다.2014년 2월 12일 FDA는 ibrutinib 사용을 만성 림프구성 백혈병(CLL)[22][23]으로 확대했다.2015년 [8][24]발덴스트롬의 매크로글로불린혈증에 대해 승인되었다.
2015년 3월, Farmacyclics와 AbbVie는 Abbvie가 Farmacyclics를 [25]210억달러에 인수하기로 합의하고, 그 해 [26]5월에 거래가 완료되었다.
2016년 3월, 이브루티닙의 새로운 지표가 만성 림프구성 백혈병(CLL)[27] 환자를 위해 미국에서 승인되었다.
2016년 5월, 이브루티닙의 새로운 지표가 미국에서 만성 림프구 백혈병(CLL)과 소림프구 림프종(SLL)[28]에 대해 승인되었다.
2017년 1월 미국에서 ibrutinib에 대한 새로운 지표가 전신 치료가 필요하고 적어도 한 번의 사전 항CD20 [29]기반 치료를 받은 적이 있는 재발/환원(R/R) 한계부 림프종(MZL) 성인의 치료에 대해 승인되었다.
2017년 8월, FDA는 이브루티닙이 이식편 대 숙주 질환을 치료하기 위한 새로운 지표를 승인했다.그것은 FDA에 의해 이 [9][10][30]상태에 대해 승인된 첫 번째 약이었다.
2018년 2월,[31] ibrutinib의 태블릿 배합물이 미국에서 사용이 승인되었습니다.
2018년 8월, 이브루티닙과 리툭시맙의 조합으로 미국에서 희귀하고 불치의 비호지킨 림프종(NHL)[32] 유형인 Waldenström의 매크로글로불린혈증(WM) 성인의 치료를 승인받았다.
2019년 1월, 오비누투즈맵과 함께 ibrutinib가 이전에 치료되지 않은 만성 림프구성 백혈병/소형 림프종(CLL/SLL)[33] 성인의 치료에 대해 승인되었다.
2020년 4월 FDA는 만성 림프구 백혈병(CLL) 또는 소림프구 림프종(SLL)[34] 성인의 초기 치료를 위해 리턱시맙과의 조합을 포함하도록 이브루티닙의 표시를 확대했다.승인은 529명의 성인 피험자에서 70세 이하의 치료되지 않은 CLL 또는 전신 [34]치료가 필요한 529명의 플루다라빈, 시클로포스파미드, 리투시맵(FCR)과 비교하여 리투시맵을 사용한 2:1 무작위화, 다중 입력, 개방 라벨인 E1912 시험(NCT02048813)에 기초했다.
비용.
미국에서 ibrutinib의 일반적인 비용은 연간 약 148,000달러이다.PK/PD에 초점을 맞춘 예비 연구는 사람들이 효율성을 잃지 않고 저비용 ibrutinib의 요법을 잠재적으로 사용할 수 있다는 것을 발견했다. 그러나, 저선량의 효율성을 보여주는 데이터는 발표되지 않았다.
얀센 파마세우티카와 파머시클릭스는 2018년 상반기에 균일 가격 구조의 새로운 단일 용량 태블릿 제제를 선보였고 캡슐 제제를 중단했다.이것은 일반 [35]환자에 대한 약값의 3배가 되는 것으로 인식되었기 때문에 격렬한 항의를 불러일으켰다.FDA의 승인 및 권장 용량을 받은 환자는 태블릿 가격 구조에 따라 가격 변동이 없거나 가격이 하락했을 것이다.
얀센 파마세우티카와 파머시클릭스는 그 [36]이후 캡슐과 정제 양면에서 현재 이용 가능한 약으로 캡슐 제조를 중단하기로 한 결정을 번복했다.
Ibrutinib은 2018년 [37]호주 제약 혜택 계획에 추가되었다.
일반 ibrutinib은 [38]2020년에 인도 의약품 유익성 제도에 추가되었다.
레퍼런스
- ^ "Ibrutinib (Imbruvica) Use During Pregnancy". Drugs.com. 3 December 2019. Retrieved 28 March 2020.
- ^ "Imbruvica 140 mg Film-Coated Tablets - Summary of Product Characteristics (SmPC)". (emc). 16 January 2020. Retrieved 28 March 2020.
- ^ a b c d "UK Ibrutinib label". UK Electronic Medicines Compendium. 25 August 2016.
- ^ a b c d "Imbruvica- ibrutinib capsule Imbruvica- ibrutinib tablet, film coated". DailyMed. 8 April 2020. Retrieved 21 April 2020.
- ^ a b c "Imbruvica EPAR". European Medicines Agency (EMA). 8 July 2021. Retrieved 14 July 2021.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- ^ a b "FDA approves Imbruvica for rare blood cancer". U.S. Food and Drug Administration (FDA) (Press release). 13 November 2013. Archived from the original on 13 November 2013.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b "FDA expands approved use of Imbruvica for rare form of non-Hodgkin lymphoma" (Press release). U.S. Food and Drug Administration (FDA). January 29, 2015. Archived from the original on February 1, 2015.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b "FDA approves treatment for chronic graft versus host disease" (Press release). U.S. Food and Drug Administration (FDA). 2 August 2017. Retrieved 28 March 2020.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ a b "FDA expands ibrutinib indications to chronic GVHD". U.S. Food and Drug Administration (FDA). 2 August 2017. Retrieved 21 April 2020.
- ^ a b "Chronic Lymphocytic Leukemia Treatment". National Cancer Institute. 1 January 1980. Retrieved 19 February 2019.
- ^ Kaur V, Mehta P, Johnsurd J, Govindarajan R (November 2014). "Ibrutinib-associated tumor lysis syndrome in a patient with chronic lymphocytic leukemia". Blood. 124 (23): 3503–5. doi:10.1182/blood-2014-08-591875. PMID 25431479.
- ^ deVries R (2016). "Stable isotope-labelled intravenous microdose for absolute bioavailability and effect of grapefruit juice on ibrutinib in healthy adults". Br J Clin Pharmacol. 81 (2): 235–45. doi:10.1111/bcp.12787. PMC 4833163. PMID 26382728.
- ^ Brown JR (2013). "Ibrutinib (PCI-32765), the first BTK (Bruton's tyrosine kinase) inhibitor in clinical trials". Curr Hematol Malig Rep. 8 (1): 1–6. doi:10.1007/s11899-012-0147-9. PMC 3584329. PMID 23296407.
- ^ a b c Pavlasova, G; et al. (22 September 2016). "Ibrutinib inhibits CD20 upregulation on CLL B cells mediated by the CXCR4/SDF-1 axis". Blood. 128 (12): 1609–13. doi:10.1182/blood-2016-04-709519. PMC 5291297. PMID 27480113.
- ^ Ponader S, Chen SS, Buggy JJ, Balakrishnan K, Gandhi V, Wierda WG, Keating MJ, O'Brien S, Chiorazzi N, Burger JA (February 2012). "The Bruton tyrosine kinase inhibitor PCI-32765 thwarts chronic lymphocytic leukemia cell survival and tissue homing in vitro and in vivo". Blood. 119 (5): 1182–1189. doi:10.1182/blood-2011-10-386417. PMC 4916557. PMID 22180443.
- ^ de Rooij MF, Kuil A, Geest CR, Eldering E, Chang BY, Buggy JJ, Pals ST, Spaargaren M (Mar 2012). "The clinically active BTK inhibitor PCI-32765 targets B-cell receptor- and chemokine-controlled adhesion and migration in chronic lymphocytic leukemia". Blood. 119 (11): 2590–2594. doi:10.1182/blood-2011-11-390989. PMID 22279054.
- ^ a b Shaywitz, David (April 5, 2013). "The Wild Story Behind A Promising Experimental Cancer Drug". Forbes.
- ^ Langreth, Robert; Coffey, Brendan (26 February 2015). "Cancer Drug Once Bought for $7 Million May Now Fetch $18 Billion". Bloomberg.com.
- ^ Sheridan, C (7 March 2012). "Companies in rapid pursuit of Btk immunokinase". Nature Biotechnology. 30 (3): 199–200. doi:10.1038/nbt0312-199. PMID 22398595. S2CID 205266502.
- ^ Walker, Joseph (1 January 2016). "Patients Struggle With High Drug Prices: Out-of-pocket costs for pricey new drugs leave even some insured and relatively affluent patients with hard choices on how to afford them". The Wall Street Journal. Retrieved 31 January 2019.
- ^ "Imbruvica (ibrutinib) Capsules". U.S. Food and Drug Administration (FDA). 8 April 2015. Retrieved 21 April 2020.
- ^ Azvolinsky, Anna. "FDA Approves Ibrutinib for Chronic Lymphocytic Leukemia". Cancer Network. Retrieved 14 February 2014.
- ^ "Imbruvica (ibrutinib) Now Approved to Treat Waldenstrom's Macroglobulinemia in Europe". AbbVie. 10 July 2015. Retrieved 21 April 2020.
- ^ Rockoff, Jonathan D.; Loftus, Peter (5 March 2015). "AbbVie to Buy Pharmacyclics in $21 Billion Deal". The Wall Street Journal.
- ^ Sachdev, Ameet (May 26, 2015). "AbbVie closes $21 billion deal for Pharmacyclics". Chicago Tribune.
- ^ "Imbruvica (ibrutinib) Approved by U.S. FDA for the First-line Treatment of Chronic Lymphocytic Leukemia". AbbVie (Press release). 4 March 2016. Retrieved 21 April 2020.
- ^ "U.S. FDA Expands Imbruvica (ibrutinib) Label to Include Overall Survival Data in Previously Untreated Chronic Lymphocytic Leukemia (CLL) and New Indication for Small Lymphocytic Lymphoma (SLL) Patients". AbbVie (Press release). 9 May 2016. Retrieved 21 April 2020.
- ^ "U.S. FDA Approves Imbruvica (ibrutinib) as First Treatment Specifically Indicated for Relapsed/Refractory Marginal Zone Lymphoma (MZL) - a Rare Type of Non-Hodgkin's Lymphoma". AbbVie (Press release). 19 January 2017. Retrieved 21 April 2020.
- ^ "U.S. FDA Approves Imbruvica (ibrutinib) as First Approved Treatment Specifically for Adults with Chronic Graft-Versus-Host-Disease (cGVHD) -- A Serious, Potentially Life-Threatening Condition -- After Failure of One or More Lines of Systemic Therapy". AbbVie (Press release). 2 August 2017. Retrieved 21 April 2020.
- ^ "Drug Approval Package: Imbruvica (ibrutinib)". U.S. Food and Drug Administration (FDA). 26 October 2018. Retrieved 22 April 2020.
- ^ "AbbVie Announces Imbruvica (ibrutinib) Plus Rituximab Approval by U.S. FDA as First Chemotherapy-Free Combination Treatment in Adults with Waldenström's Macroglobulinemia, a Rare Type of Blood Cancer". AbbVie (Press release). 27 August 2018. Retrieved 21 April 2020.
- ^ "AbbVie Announces U.S. FDA Approval of Imbruvica (ibrutinib) Plus Obinutuzumab (GAZYVA) - First Chemotherapy-Free, Anti-CD20 Combination Regimen Approved for Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma (CLL/SLL) in Previously Untreated Patients". AbbVie (Press release). 28 January 2019. Retrieved 21 April 2020.
- ^ a b "FDA approves ibrutinib plus rituximab for chronic lymphocytic leukemia". U.S. Food and Drug Administration (FDA). 21 April 2020. Retrieved 21 April 2020.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ Johnson, Carolyn Y. (2018-04-18). "Science hinted that cancer patients could take less of a $148,000-a-year drug. Its maker tripled the price of a pill". The Washington Post. Retrieved 2018-04-19.
- ^ Johnson, Carolyn Y. (2018-05-15). "After outcry, drugmakers decide not to triple the price of a cancer pill". The Washington Post. Retrieved 2018-06-13.
- ^ "MIL-OSI Australia: $250 million investment in life changing cancer medicines – ForeignAffairs.co.nz". Foreignaffairs.co.nz. 16 July 2018. Retrieved 20 July 2018.
- ^ "Cost-effectiveness Ibrutinib [Imbruvica] In India, USA, UK, And Australia – Medixocentre.com". Medixocentre.com. 10 February 2020. Retrieved 15 February 2020.
외부 링크
- "Ibrutinib". Drug Information Portal. U.S. National Library of Medicine.
- 이브루티닙 국립암연구소 약물사전