HIV
HIV
| 인간면역결핍바이러스 | |
|---|---|
 | |
| 배양된 림프구에서 싹트고 있는 HIV-1(녹색)의 전자 현미경을 스캔합니다.세포 표면에 있는 여러 개의 둥근 돌기는 비리온의 집합과 싹트기 장소를 나타냅니다. | |
| 과학적 분류 | |
| (순위 미지정): | 바이러스 |
| 영역: | 리보비리아 |
| 왕국: | 파라나비래 |
| 문: | 아르베르비리코타 |
| 클래스: | 레브트라비케테스 |
| 주문: | 오르테빌라스 |
| 패밀리: | 레트로바이러스과 |
| 서브패밀리: | 오르토레브로바이러스아과 |
| 속: | 렌티바이러스 |
| 포함된 그룹 | |
| 기타 렌티바이러스 | |
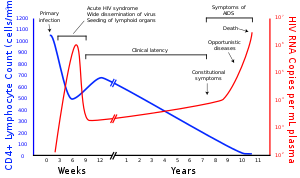
인간면역결핍바이러스(HIV)는 인간을 감염시키는 렌티바이러스의 2종이다.시간이 지남에 따라, 그것들은 후천성 면역 결핍 증후군을 유발하는데,[1][2] 이것은 면역 시스템의 점진적인 기능 상실이 생명을 위협하는 기회주의 감염과 암이 [3]번성하도록 하는 질환이다.치료를 받지 않으면 HIV 감염 후 평균 생존기간은 HIV 아형에 [4]따라 9년에서 11년으로 추정된다.
대부분의 경우 HIV는 성병에 감염되며 혈액, 사전 사정,[5][6] 정액 및 질액과의 접촉 또는 전달에 의해 발생합니다.임신 중, 출산 중 혈액이나 질액에 노출됨과 동시에 [7][8][9][10]모유를 통해 감염된 산모로부터 아기에게 전염될 수 있습니다.이러한 체액 속에서 HIV는 자유 바이러스 입자와 감염된 면역 세포 내에서 바이러스로 존재한다.연구에 따르면 HIV 양성 파트너가 지속적으로 검출할 수 없는 바이러스 [5][6]부하를 가지고 있다면 (동성 커플과 이성 커플 모두에게) HIV는 콘돔 없는 성관계를 통해 전염되지 않는다.
HIV는 도우미 T 세포(특히+ CD4 T 세포), 대식세포, 수지상 [11]세포와 같은 인체 면역 시스템의 중요한 세포를 감염시킵니다.HIV 감염은 낙태로 감염된 [12]T세포의 화농증, 감염되지 않은 [13]방관자세포의 아포토시스, 감염된 세포의 직접 바이러스 사멸, [14]감염된 세포를 인식하는+ CD8 세포독성 림프구에 의한+ CD4 T세포의 사멸을 포함한 많은 메커니즘을 통해+ CD4 T세포의 낮은 수준으로 이어진다.CD4+ T세포 수가 위험 수준 이하로 떨어지면 세포 매개 면역력이 상실되고 신체는 점차 기회주의 감염에 취약해져 에이즈로 발전한다.
바이러스학
분류
| 종. | 독성 | 감염성 | 유병률 | 추정원점 |
|---|---|---|---|---|
| HIV-1 | 높은 | 높은 | 세계적인 | 침팬지 |
| HIV-2 | 더 낮게 | 낮다 | 서아프리카 | 수티망가베이 |
HIV는 레트로바이러스과에 [16]속하는 [15]렌티바이러스속이다.렌티바이러스는 많은 형태학과 생물학적 특성을 가지고 있다.많은 종들이 렌티바이러스에 감염되는데, 렌티바이러스는 오랜 잠복기를 [17]가진 장기간의 질병을 일으키는 특징이 있다.렌티바이러스는 단가닥, 양성 감각, 포락형 RNA 바이러스로 전염된다.표적 세포에 들어갈 때, 바이러스 RNA 게놈은 바이러스 입자의 바이러스 게놈과 함께 운반되는 바이러스 코드 효소인 역전사 효소에 의해 이중 가닥 DNA로 변환된다(역전사).그 결과 생성된 바이러스 DNA는 세포핵으로 수입되고 바이러스 코드화된 효소, 인테그라아제 및 숙주 공동 [18]인자에 의해 세포 DNA로 통합된다.일단 바이러스가 통합되면, 바이러스와 숙주 세포가 면역 체계에 의한 탐지를 피할 수 있게 하면서, 불확실한 시간 [19]동안 잠복할 수 있다.HIV 바이러스는 1차 감염 후 최대 10년간 인체에서 휴면할 수 있다.이 기간 동안 바이러스는 증상을 일으키지 않는다.또는 통합된 바이러스 DNA를 전사하여 숙주 세포 자원을 사용하여 새로운 RNA 게놈과 바이러스 단백질을 생성하며, 이들은 새로운 복제 사이클을 시작하는 새로운 바이러스 입자로 세포에서 패키징되어 방출된다.
HIV-1과 HIV-2의 두 가지 유형이 특징지어졌습니다. HIV-1은 처음에 발견되어 림프절 관련 바이러스(LAV)와 인간 T림프트로픽 바이러스 3(HTLV-II)로 불렸던 바이러스입니다.HIV-1은 HIV-2보다 [20]더 치명적이고 감염성이 높으며 전 세계적으로 HIV 감염의 대부분을 일으키는 원인입니다.HIV-2의 감염률이 HIV-1에 비해 낮다는 것은 HIV-2에 노출된 사람 중 노출될 때마다 감염되는 사람이 적다는 것을 의미합니다.HIV-2는 상대적으로 전염력이 낮기 때문에 주로 서아프리카에 [21]한정되어 있다.
구조와 게놈
HIV는 다른 레트로바이러스와 구조가 비슷하다.그것은 [23]적혈구보다 부피가 약 100,000배 작은 지름 120 nm의 대략적인[22] 구형이다.그것은 바이러스 단백질 [24]p24의 2,000개의 복사본으로 구성된 원추형 캡시드로 둘러싸인 바이러스의 9개의 유전자를 코드하는 두 개의 양감각 단일 가닥 RNA 복사본으로 구성되어 있다.단가닥 RNA는 핵캡시드 단백질, p7 및 역전사효소, 단백질분해효소, 리보핵산가수분해효소, 인테그레이스 등 바이러스 발생에 필요한 효소에 단단히 결합되어 있다.바이러스 단백질 p17로 이루어진 매트릭스는 비리온 [24]입자의 무결성을 보증하는 캡시드를 둘러싸고 있다.
이것은, 차례로, 새롭게 형성된 바이러스 입자 싹이 세포에서 나올 때 인간 숙주 세포의 막에서 채취한 지질 이중층으로 구성된 바이러스 외피로 둘러싸여 있다.바이러스 외피에는 숙주 세포로부터의 단백질과 당단백(gp) 120으로 알려진 세 개의 분자로 구성된 뚜껑과 바이러스 [25][26]외피 안에 구조를 고정시키는 세 개의 gp41 분자로 구성된 줄기가 비교적 적은 수의 HIV 외피 [24]단백질의 복사본이 포함되어 있습니다.HIV 환경 유전자에 의해 암호화된 외피 단백질은 바이러스가 표적 세포에 부착되어 표적 세포의 막과 융합하여 세포에 바이러스 성분을 방출하고 감염 [25]주기를 시작하게 합니다.
바이러스 표면의 유일한 바이러스 단백질로서, 외피 단백질은 HIV 백신 노력의 주요 [27]목표물이다.삼량체 외피 스파이크의 질량의 절반 이상이 N-연결 글리칸이다.글리칸은 항체에 의한 중성화로부터 기초 바이러스 단백질을 보호하므로 밀도가 높다.이것은 알려진 가장 조밀한 글리코실화 분자 중 하나이며, 밀도는 충분히 높아서 내핵 및 골지 [28][29]기구의 생물 형성 중에 글리칸의 정상적인 성숙 과정을 막을 수 있다.따라서 글리칸의 대부분은 세포 [30]표면에 분비되거나 존재하는 인간의 당단백질에는 일반적으로 존재하지 않는 미성숙한 '고만노스' 글리칸으로 정체된다.비정상적인 처리와 고밀도는 지금까지 확인된 거의 모든(수개월에서 수년간 감염된 환자의 하위 집합으로부터) 광범위하게 중화되는 항체가 이러한 외피 [31]글리칸에 결합하거나 이에 대처하기 위해 적응한다는 것을 의미한다.
바이러스 스파이크의 분자 구조는 이제 X선[32] 결정학과 극저온 전자 [33]현미경으로 결정되었다.구조생물학의 이러한 발전은 gp41에서 [34]돌연변이(아미노산의 급진적 치환)를 프롤린하기 위한 서브유닛 간 이황화 결합과 이소류신의 도입으로 바이러스 스파이크의 안정적인 재조합 형태가 개발되었기 때문에 가능했다.이른바 SOSIP 트리머는 토종 바이러스 스파이크의 항원 특성을 재현할 뿐만 아니라 토종 [35]바이러스와 같은 정도의 미성숙한 글리칸을 나타낸다.재조합 삼량체 바이러스 스파이크는 표적 에피토프에 [36]대한 면역반응을 억제하는 역할을 하는 재조합 단량체 gp120보다 덜 중화 에피토프를 나타내기 때문에 유망한 백신 후보이다.
RNA 게놈은 최소 7개의 구조적 랜드마크(LTR, TAR, RRE, PE, SLIP, CRS, INS)와 9개의 유전자(개그, 폴, 그리고 env, tat, rev, nef, vif, vpr, vpu, 그리고 때로는 tat, env의 융합인 10번째 tev)로 구성되어 단백질을 암호화한다.이 유전자 중 세 개인 gag, pol, env는 새로운 바이러스 [24]입자를 위한 구조 단백질을 만드는데 필요한 정보를 포함하고 있다.예를 들어, env는 gp160이라고 불리는 단백질을 코드화하고, gp120과 gp41을 형성하기 위해 세포단백질가수분해효소에 의해 두 동강 난다.나머지 6개의 유전자, tat, rev, nef, vif, vpr, 그리고 vpu는 HIV가 세포를 감염시키고, 바이러스의 새로운 복사본을 생성하거나,[24] 질병을 일으키는 능력을 제어하는 단백질의 조절 유전자이다.
두 개의 tat 단백질(p16 및 p14)은 TAR RNA 원소와 결합함으로써 작용하는 LTR 프로모터의 전사 활성제이다.TAR는 또한 아포토시스 유전자 ERCC1과 IER3를 [37][38]조절하는 마이크로RNA로 처리될 수 있다.rev 단백질(p19)은 RRE RNA 원소에 결합함으로써 핵과 세포질에서 RNA를 차단하는 데 관여합니다.vif 단백질(p23)은 APOBEC3G(단가닥 바이러스 DNA에서 시티딘에서 우리딘으로 탈아미닌화 및/또는 역전사를[39] 방해하는 세포 단백질)의 작용을 방해한다.vpr단백질(p14)은 G2/M에서 세포분열을 억제한다.네프 단백질(p27)은 CD4(주요 바이러스 수용체)와 MHC 클래스 I 및 클래스 II [40][41][42]분자를 하향 조절합니다.
Nef는 SH3 도메인과도 상호작용합니다.vpu 단백질(p16)은 감염된 [24]세포에서 새로운 바이러스 입자의 방출에 영향을 미칩니다.HIV RNA의 각 가닥의 끝에는 긴 말단 반복(LTR)이라고 불리는 RNA 서열이 포함되어 있습니다.LTR의 영역은 새로운 바이러스의 생성을 제어하는 스위치 역할을 하며 HIV 또는 숙주 세포로부터의 단백질에 의해 유발될 수 있습니다.Psi 원소는 바이러스 게놈 패키징에 관여하며 재갈과 리브 단백질에 의해 인식된다.SLIP 요소()TTTTTT는 기능적인 [24]정책을 만드는 데 필요한 개그 폴 판독 프레임의 프레임 시프트에 관여합니다.
트로피즘
바이러스성 대류증이라는 용어는 바이러스가 감염시키는 세포 유형을 가리킨다.HIV는 CD4+ T 세포, 대식세포, 그리고 미세아교세포와 같은 다양한 면역세포를 감염시킬 수 있다.대식세포 및 CD4+ T세포에 대한 HIV-1 진입은 바이러스온 외피당단백질(gp120)과 표적세포막상의 CD4분자의 상호작용 및 케모카인 [25][43]공동수용체와의 상호작용을 통해 매개된다.
HIV-1 또는 비합성유도주(NSI, 현재 R5 바이러스[44])의 대식세포-트로픽(M-트로픽) 변종은 진입을 위해 β-케모카인 수용체 CCR5를 사용하므로 대식세포와 CD4+ [45]T 세포 모두에서 복제할 수 있다.이 CCR5 공동수용체는 바이러스 유전자의 아형에 관계없이 거의 모든 1차 HIV-1 분리자에 의해 사용됩니다.실제로 대식세포는 HIV 감염의 몇 가지 중요한 측면에 중요한 역할을 한다.그것들은 HIV에 감염된 첫 번째 세포로 보이며 아마도 환자의 CD4 세포가 고갈될 때 HIV를+ 생산하는 원천으로 보인다.대식세포와 소교세포는 중추신경계의 HIV에 감염된 세포이다.HIV에 감염된 환자들의 편도와 아데노이드에서 대식세포는 다핵화된 거대 세포로 융합되어 엄청난 양의 바이러스를 생성한다.
HIV-1의 T-트로픽 변종 또는 Syncytia 유도 변종(SI; 현재 X4[44] 바이러스)은 대식세포뿐만 아니라 1차+ CD4 T 세포에서 복제되며, [45][46][47]진입을 위해 α-케모카인 수용체 CXCR4를 사용한다.
이중로피 HIV-1 변종은 HIV-1의 과도기 변종이라고 생각되기 때문에 CCR5와 CXCR4를 모두 바이러스 침입의 공동 수용체로 사용할 수 있다.
CXCR4의 리간드인 α-케모카인 SDF-1은 T-트로피 HIV-1 분리체의 복제를 억제한다.이것은 HIV 표적 세포 표면의 CXCR4의 발현을 하향 조절함으로써 이루어집니다.CCR5 수용체만을 사용하는 M-트로픽 HIV-1 분리체를 R5, CXCR4만을 사용하는 분리체를 X4, 둘 다 사용하는 분리체를 X4R5라고 한다.유명하지 않은 모든 R5 바이러스 대식 세포에 생산적인 infection[45]고 HIV또한었을 때 CD4+ T세포 숫자를 극도로 낮은 수준으로 감소하고 있는 감염을 유지하고 저수지를 구성하는 골수성 수지상 cells,[48]의 하위 유형을 감염시킬 수 있CCR5를 사용할 수 있그러나 co-receptors는 사용, 바이러스 친화성을 설명하지 않는다.s.
어떤 사람들은 특정 종류의 [49]HIV에 저항한다.예를 들어 CCR5-δ32 돌연변이를 가진 사람들은 R5 바이러스에 의한 감염에 내성이 있는데, 이는 돌연변이가 HIV를 이 공동 수용체에 결합할 수 없게 만들고 표적 세포를 감염시키는 능력을 감소시키기 때문이다.
성관계는 HIV 전염의 주요 방식이다.X4와 R5 HIV는 모두 남성으로부터 성적인 파트너에게 바이러스를 전염시킬 수 있는 정액에 존재한다.그리고 나서 바이러스들은 수많은 세포 표적을 감염시키고 전체 유기체에 퍼질 수 있다.그러나 선택 과정은[further explanation needed] 이 [50][51][52]경로를 통해 R5 바이러스의 주요 전염으로 이어진다.B형 HIV-1에 감염된 환자에서는 CXCR4를 [53]통해 다양한 T세포를 감염시킬 수 있는 말기 질환과 T-트로픽 변종에서 종종 공동 수용체 스위치가 있다.이 변형한 다음 보다 적극적으로 빠른 T세포의 고갈, 면역 체계 붕괴, 그리고 AIDS.[54]이 HIV환자들의 출현이 특히 전 HAART하려면 코트 샘플 및 팁을 시작으로 문제가 있는 기회 감염의 엄청나게 넓은 스펙트럼을 얻게 하는 기회 감염의 원인이 높아지고 있는 독성과 복제된다.시대그러나 항레트로바이러스 [3]치료제 시작 후 사후에 검사된 HIV 감염 환자들 사이에서도 동일한 감염이 보고되고 있다.따라서 감염 과정에서 CCR5 대신 CXCR4를 사용하는 것에 대한 바이러스 적응은 AIDS 진행의 중요한 단계가 될 수 있습니다. B형 감염자를 대상으로 한 많은 연구에서 에이즈 환자의 40~50%가 SI와 X4 표현형 [55][56]바이러스를 가지고 있을 수 있다고 밝혀졌습니다.
HIV-2는 HIV-1보다 병원성이 훨씬 낮고 서아프리카로의 전세계 분포가 제한된다.HIV-2에 의한 "부속 유전자"의 채택과 더 문란한 공동 수용체 사용 패턴(CD4-독립 포함)은 숙주 세포에 존재하는 선천적인 제한 인자를 피하기 위해 바이러스가 적응하는 데 도움을 줄 수 있다.전염과 생산적인 감염을 가능하게 하기 위해 일반 세포 기계를 사용하는 적응은 또한 인체에서 HIV-2 복제를 확립하는 데 도움을 주었다.어떤 감염원이라도 생존 전략은 숙주를 죽이는 것이 아니라 궁극적으로는 상생의 유기체가 되는 것이다.낮은 병원성을 달성한 후에는 시간이 지남에 따라 변속기에 더 성공적인 모델이 [57]선택될 것입니다.
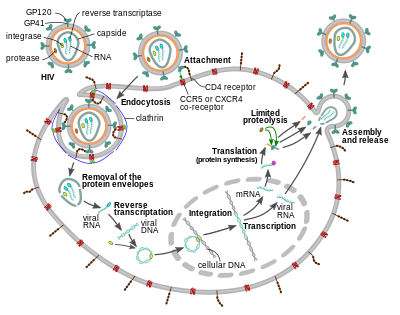
레플리케이션 사이클
셀 입력
HIV바이리온은 표면의 당단백질이 표적세포의 수용체에 흡착되어 대식세포와 CD4+ T세포로 들어가고, 이어서 표적세포막과 바이러스 외피를 융합하여 HIV캡시드를 [58][59]세포로 방출한다.
세포로의 진입은 HIV 바이러스 엔벨로프 상의 삼량체 외피 복합체(gp160 스파이크)와 표적 세포 [58][59]표면 상의 CD4 및 케모카인 공동 수용체(일반적으로 CCR5 또는 CXCR4 중 하나이지만 다른 것들은 상호작용하는 것으로 알려져 있음)의 상호작용을 통해 시작된다.Gp120은 바이러스학적 시냅스 확립에 관여하는 중심 인테그린인 LFA-1을 활성화하는 인테그린α에47 결합하며, 이는 HIV-1의 [60]효율적인 세포간 확산을 촉진한다.gp160 스파이크는 CD4 수용체와 케모카인 [58][59]수용체 모두에 대한 결합 도메인을 포함합니다.
융합의 첫 번째 단계는 gp120의 CD4 결합 도메인을 CD4에 고친화도로 부착하는 것을 포함한다.gp120이 CD4 단백질과 결합하면 외피복합체는 구조변화를 겪으며, gp120의 케모카인 수용체 결합 도메인을 노출하고 표적 케모카인 [58][59]수용체와 상호작용할 수 있다.이것은 N-말단 융합 펩타이드 gp41이 세포막을 [58][59]관통할 수 있도록 하는 보다 안정적인 두 갈래 부착을 가능하게 한다.그런 다음 gp41, HR1, HR2의 반복 배열을 상호 작용시켜 gp41의 세포외 부분을 헤어핀 모양으로 붕괴시킨다.이 루프 구조는 바이러스와 세포막을 서로 가깝게 하여 세포막의 융합과 바이러스 캡시드의 [58][59]후속 진입을 가능하게 합니다.
HIV가 표적 세포에 결합하면 HIV RNA와 역전사효소, 인테그레이스, 리보핵산가수분해효소, 단백질분해효소를 포함한 다양한 효소가 [58][failed verification]세포에 주입된다.마이크로튜브를 기반으로 핵으로 이동하는 동안 바이러스 단일 가닥 RNA 게놈은 이중 가닥 DNA로 전사되고, 그 후 숙주 염색체에 통합된다.
HIV는 이 CD4-CCR5 경로를 통해 수상세포(DCs)를 감염시킬 수 있지만 DC-SIGN과 같은 만노스 특이적 C형 렉틴 수용체를 사용하는 다른 경로도 사용할 [61]수 있다.DC는 성병 전염 중에 바이러스가 가장 먼저 접하는 세포 중 하나이다.현재 그들은 바이러스가 DC에 [61]의해 점막에서 포착될 때 HIV를 T세포로 전달함으로써 중요한 역할을 하는 것으로 생각된다.뉴런에서 자연적으로 발생하는 FEZ-1의 존재는 HIV에 [62]의한 세포의 감염을 막는 것으로 여겨진다.
HIV-1의 침입과 다른 많은 레트로바이러스의 침입은 혈장막에서만 일어나는 것으로 오랫동안 믿어져 왔다.그러나 최근에는 HIV-1의 pH의존성 클라트린 매개성 엔도사이토시스에 의한 생산적 감염도 보고되어 생산적 [63][64][65][66][67]진입의 유일한 경로를 구성하는 것이 제안되었다.
레플리케이션과 문자 변환
바이러스 캡시드가 세포에 들어간 직후, 역전사효소라고 불리는 효소는 부착된 바이러스 단백질로부터 양성 감각의 단일 가닥 RNA 게놈을 해방시키고 그것을 보완 DNA [68]분자로 복제한다.역전사의 과정은 매우 오류가 발생하기 쉬우며, 결과적인 돌연변이는 약물에 대한 내성을 유발하거나 바이러스가 몸의 면역 체계를 회피하도록 할 수 있다.역전사효소는 또한 cDNA [69]합성 중에 바이러스 RNA를 분해하는 리보핵산가수분해효소 활성과 반센스 cDNA로부터 감각 DNA를 생성하는 DNA 의존성 DNA 중합효소 활성을 가지고 있다.cDNA와 그 보체는 함께 이중 가닥 바이러스 DNA를 형성하고 세포핵으로 운반된다.바이러스 DNA의 숙주 세포의 게놈으로의 통합은 [68]인테그라아제라고 불리는 또 다른 바이러스 효소에 의해 수행됩니다.
통합된 바이러스 DNA는 HIV [68]감염의 잠복기에 잠복해 있을 수 있다.바이러스를 적극적으로 생산하기 위해서는 특정 세포 전사인자가 존재해야 하며, 그 중 가장 중요한 것은 T세포가 [70]활성화되면 상향 조절되는 NF-δB(핵인자 카파B)이다.이것은 HIV에 의해 표적이 되고, 침입하고, 그 후에 사망할 가능성이 가장 높은 세포가 적극적으로 감염과 싸우는 세포라는 것을 의미합니다.
바이러스 복제 중에, 통합된 DNA 프로바이러스는 RNA로 전사된다.전장 유전체 RNA(gRNA)는 의사 증배체 형태로 새로운 바이러스 입자로 포장될 수 있다.포장의 선택성은 gRNA의 이합체 컨포머의 구조적 특성에 의해 설명됩니다.gRNA 이합체는 gRNA 단량체 내의 탠덤 삼원 접합을 특징으로 하며, 이 때 스플라이싱 및 번역을 담당하는 SD 및 AUG 헤어핀이 격리되어 DIS(이합 개시 신호) 헤어핀이 노출된다.gRNA 이합체의 형성은 gRNA 단량체의 DIS 헤어핀 루프 사이의 '키싱' 상호작용에 의해 매개된다.동시에 gRNA 내의 특정 구아노신 잔기는 후속 비리온 [71]조립체로 이어지는 뉴클레오캡시드(NC) 단백질의 결합에 이용할 수 있다.또한 유연한 gRNA 이합체는 DIS와 U5가 모두 다음과 같은 NC 결합에 따라 보다 안정적인 규격을 달성하는 것으로 보고되었다.gRNA의 AUG 영역은 광범위한 염기쌍에 [72]참여합니다.
RNA는 또한 성숙한 메신저 RNA(mRNA)를 생성하기 위해 처리될 수 있다.대부분의 경우, 이 과정은 전장 게놈보다 짧은 mRNA를 생산하기 위해 RNA 스플라이싱을 포함한다.RNA 스플라이싱 중에 제거되는 RNA의 어느 부분이 어떤 HIV 단백질 코딩 시퀀스를 [73]번역할지를 결정합니다.
성숙한 HIV mRNA는 핵에서 세포질로 수출되어 Rev를 포함한 HIV 단백질을 생산하기 위해 번역됩니다.새로 생성된 Rev 단백질이 생성되면, 그것은 핵으로 이동하며, 거기서 바이러스 RNA의 완전한 길이, 정제되지 않은 복사본에 결합하고 그들이 [74]핵을 떠날 수 있게 합니다.이러한 전장 RNA 중 일부는 구조 단백질 Gag와 Env를 생성하기 위해 번역되는 mRNA로 기능합니다.개그 단백질은 새로운 바이러스 [75]입자로 포장하기 위해 바이러스 RNA 게놈의 복사본에 결합합니다.HIV-1과 HIV-2는 그들의 RNA를 [76][77]다르게 포장하는 것으로 보인다.HIV-1은 적절한 [78]RNA에 결합합니다.HIV-2는 Gag 단백질 [79]자체를 생성하기 위해 사용된 mRNA에 우선적으로 결합합니다.
재결합
각 HIV-1 입자에는 2개의 RNA 게놈이 캡슐화되어 있습니다(HIV의 구조와 게놈 참조).역전사효소에 의해 감염 및 복제가 촉매되면 두 게놈 간의 재조합이 [80][81]발생할 수 있다.재조합은 단일 가닥, 양성 감각의 RNA 게놈이 DNA를 형성하기 위해 역전사되면서 발생합니다.역전사하는 동안, 초기 DNA는 바이러스 RNA의 두 복사본 사이에서 여러 번 전환될 수 있습니다.이런 형태의 재조합을 카피-선택이라고 합니다.재조합 사건은 게놈 전체에서 발생할 수 있다.각 복제 주기마다 게놈당 2개에서 20개의 재조합 사건이 일어날 수 있으며, 이러한 사건들은 부모로부터 [81]자손에게 전달되는 유전 정보를 빠르게 섞을 수 있다.
바이러스 재조합은 항레트로바이러스 [82]치료에 대한 내성의 진화에 기여할 수 있는 유전적 변이를 일으킨다.재조합은 또한 원칙적으로 숙주의 면역 방어를 극복하는 데 기여할 수 있다.그러나 유전자 변이의 적응적 이점을 실현하기 위해서는 개별 감염 바이러스 입자에 포장된 두 개의 바이러스 게놈이 서로 다른 유전자 구성을 가진 별개의 조상 부모 바이러스로부터 발생해야 한다.자연 [83]조건 하에서 이러한 혼합 포장이 얼마나 자주 발생하는지는 알려지지 않았다.
Bonhoffer et al.[84]은 역전사효소에 의한 템플릿 전환이 단일 가닥 RNA 게놈의 파괴를 다루기 위한 복구 과정으로 작용한다고 제안했다.게다가, Hu와 Temin은[80] 재조합이 RNA 게놈의 손상을 복구하기 위한 적응이라고 제안했다.역전사 효소에 의한 가닥 전환(복사 선택 재조합)은 손상된 두 개의 단일 가닥 RNA 게놈 복사본에서 손상되지 않은 게놈 DNA 복사본을 생성할 수 있다.HIV 재조합의 적응적 이점에 대한 이러한 견해는 각 HIV 입자가 하나의 게놈이 아닌 두 개의 완전한 게놈을 가지고 있는 이유를 설명할 수 있을 것이다.또, 재조합은 수복 프로세스라고 하는 견해는, 수복의 메리트는 복제 사이클 마다 발생할 수 있어 유전적으로 2개의 게놈이 다른지 아닌지에 관계없이 실현될 수 있다는 것을 시사하고 있다.HIV의 재조합은 복구 과정이라는 관점에서 재조합 변이의 발생은 템플릿 [84]전환의 진화의 원인이 아니라 결과일 것이다.
HIV-1 감염은 만성 염증과 활성산소의 [85]생성을 일으킨다.따라서 HIV 게놈은 외가닥 RNA의 파괴를 포함한 산화적 손상에 취약할 수 있습니다. HIV뿐만 아니라 일반적인 바이러스의 경우 성공적인 감염은 종종 게놈을 손상시키는 활성산소 종의 생산을 포함하는 숙주 방어 전략을 극복하는 데 달려 있습니다.따라서, Michod [86]등은 바이러스에 의한 재조합은 게놈 손상을 복구하기 위한 적응이며, 재조합 변이는 별도의 이점을 제공할 수 있는 부산물이라고 제안했다.
조립 및 릴리스
바이러스 순환의 마지막 단계인 새로운 HIV-1 바이러스들의 집합은 숙주 세포의 혈장 막에서 시작됩니다.Env 폴리단백질(gp160)은 내플라스미컬 레티큘럼을 통과하여 골지 기기로 운반되며, 골지 기구는 퓨린에 의해 분해되어 2개의 HIV 포락선 당단백질 gp41, gp120이 [87]된다.이것들은 gp41이 감염된 세포의 막에 gp120을 고정하는 숙주 세포의 혈장막으로 운반된다.Gag (p55)와 Gag-Pol (p160) 폴리단백질 또한 숙주 세포에서 바이러스 이온이 싹트기 시작할 때 HIV 게놈 RNA와 함께 혈장막의 내부 표면과 결합합니다.개그 폴리단백질이 실제 기질, 캡시드, 뉴클레오캡시드 단백질로 분해될 필요가 있기 때문에 싹이 튼 비리온은 아직 미성숙하다.이 분열은 포장된 바이러스 단백질 분해 효소에 의해 매개되며 단백질 분해효소 억제제 클래스의 항레트로바이러스제에 의해 억제될 수 있다.그리고 나서 다양한 구조 요소들이 모여서 성숙한 HIV [88]바이러스들을 생산한다.성숙한 바이러스들만이 다른 세포를 감염시킬 수 있다.
체내에 퍼지다
바이러스리에 의한 세포의 감염의 고전적인 과정은 "무세포 확산"이라고 불릴 수 있으며, 이것은 "세포 대 세포 확산"[89]이라고 불리는 보다 최근에 인식된 과정과 구별된다.무세포 확산(그림 참조)에서는 감염된 T세포에서 바이러스 입자가 싹트고 혈액 또는 세포외 액체로 들어간 후 우연한 [89]만남 후에 또 다른 T세포를 감염시킨다.HIV는 또한 세포에서 세포로 확산되는 과정에 의해 한 세포에서 다른 세포로 직접 전파될 수 있으며, 이 과정에서 두 가지 경로가 설명되었다.우선 감염된 T세포는 바이러스학적 시냅스를 통해 [60][90]대상 T세포에 직접 바이러스를 전달할 수 있다.둘째, 대식세포 또는 수상세포와 같은 항원제시세포(APC)는 생산적인 감염(대식세포의 [91]경우) 또는 트랜스 중의 바이러스이온을 포획하여 이전하는 과정에 의해 HIV를 T세포에 전달할 수 있다.어떤 경로를 사용하든, 세포 간 전달에 의한 감염은 무세포 바이러스 [92]확산보다 훨씬 더 효율적인 것으로 보고되었다.세포간 접촉 부위로의 편광 바이러스 발아, 바이러스의 유동상 확산을 최소화하는 세포의 근접 배치, 접촉 [90]부위로 향하는 표적 세포상의 HIV 진입 수용체 군집화를 포함한 많은 요인들이 이러한 효율성 증대에 기여한다.세포간 확산은 CD4+ T세포가 촘촘히 채워져 있고 [89]자주 상호작용할 가능성이 있는 림프조직에서 특히 중요한 것으로 생각된다.생체 내 HIV 바이러스학적 시냅스의 개념을 뒷받침하는 생체 [93]내 영상 연구.HIV가 이용할 수 있는 많은 전파 메커니즘은 항레트로바이러스 [89][94]치료에도 불구하고 바이러스의 지속적인 복제에 기여한다.
유전적 변이성

HIV는 유전적 다양성이 매우 높다는 점에서 많은 바이러스와 다르다.이러한 다양성은 매일 약 10개의10 비리온이 생성되는 빠른 복제 주기의 결과이며, 복제 주기당 뉴클레오티드 염기당 약 3 x−5 10의 높은 돌연변이율과 역전사 [95][96][97]효소의 재조합 특성으로 결합된다.
이 복잡한 시나리오는 하루 [95]만에 한 명의 감염 환자에게서 많은 변종 HIV를 발생시킵니다.이러한 변화는 단일 세포가 두 개 이상의 다른 종류의 HIV에 동시에 감염될 때 더욱 복잡해진다.동시 감염이 발생할 때, 자손 바이러스들의 게놈은 두 개의 다른 변종에서 나온 RNA 가닥으로 구성될 수 있다.이 잡종 바이러스온은 복제를 하는 새로운 세포를 감염시킨다.이것이 일어나면서, 역전사효소는 두 개의 다른 RNA 템플릿 사이를 왔다 갔다 하면서, 두 부모 [95]게놈 사이의 재조합인 새로 합성된 레트로바이러스 DNA 서열을 생성하게 될 것이다.이 재조합은 [95]아형들 사이에서 일어날 때 가장 명백하다.
밀접한 관련이 있는 Simian 면역 결핍 바이러스(SIV)는 자연 숙주 종으로 분류되는 많은 변종으로 진화했다.아프리카녹색원숭이와 수티망가베이의 SIV 변종은 숙주와 함께 오랜 진화 역사를 가지고 있는 것으로 생각된다.이들 숙주는 [98]숙주의 혈액에 고농도로 존재하지만 가벼운 [99]면역반응만 일으키며, 단순 에이즈의 [100]발병을 일으키지 않으며,[101] 인체 HIV 감염의 전형적인 광범위한 돌연변이와 재조합을 겪지 않는다.
이와는 대조적으로, 이 변종들이 SIV에 적응하지 못한 종들을 감염시킬 때, 동물들은 에이즈를 발생시키고 바이러스는 인간의 HIV [102]감염에서 보이는 것과 유사한 유전적 다양성을 생성한다.HIV-1의 가장 가까운 유전적 친척인 침팬지 SIV(SIVcpz)는 자연 [103]숙주의 사망률과 에이즈 유사 증상과 관련이 있다.SIVcpz는 비교적 최근에 침팬지와 사람에게 전염된 것으로 보여 숙주가 아직 바이러스에 [98]적응하지 못했다.이 바이러스는 또한 대부분의 SIV에 존재하는 네프 유전자의 기능을 잃었다.비병원성 SIV 변종의 경우 nef는 CD3 마커를 통해 T세포 활성화를 억제한다.SIV의 비병원적 형태에서 Nef의 기능은 염증성 사이토카인, MHC-1 및 T세포 밀매에 영향을 미치는 신호의 발현을 하향 조절하는 것이다.HIV-1과 SIVcpz에서는 nef가 T세포 활성화를 억제하지 않아 이 기능을 상실했다.이 기능이 없으면 T세포가 고갈될 가능성이 높아 면역결핍을 [103][104]초래할 수 있다.
HIV-1의 3개 그룹은 엔벨로프(env) 영역의 차이에 근거해 식별되었다.M, N,[105] O.그룹 M은 가장 널리 퍼져 있으며 지리적으로 [106]구별되는 전체 게놈에 기초하여 8개의 하위 유형(또는 분류군)으로 세분화된다.가장 일반적인 것은 아형 B(주로 북미와 유럽에서 발견), A와 D(주로 아프리카에서 발견), C(주로 아프리카와 아시아에서 발견)이다.이 아형들은 HIV-1의 M그룹의 계보를 나타내는 계통수에서 가지를 형성한다.다른 아형과의 Co-감염은 재조합 형태(CRF)를 일으킨다.전지구적 아형 유병률 분석이 이루어진 마지막 해인 2000년에는 전 세계 감염의 47.2%가 아형 C, 26.7%가 아형 A/CRF02_AG, 12.3%가 아형 B, 5.3%가 아형 D, 3.2%가 CRF_AE, 나머지 5.3%가 구성되어 있었다.대부분의 HIV-1 연구는 B형 아형에 초점을 맞추고 있지만 다른 [108]아형에 초점을 맞춘 연구실은 거의 없다.네 [109]번째 그룹인 "P"의 존재는 2009년에 분리된 바이러스를 바탕으로 가정되었다.이 변종은 2006년 [109]서부 저지대 고릴라로부터 처음 분리된 고릴라 SIV에서 유래한 것으로 보인다.
HIV-2의 가장 가까운 친척은 수티망가비에서 발견되는 SIV의 일종인 SIVsm이다.HIV-1은 SIVcpz에서, HIV-2는 SIVsm에서 유래하기 때문에 HIV-2의 유전자 배열은 HIV-1과 부분적으로만 상동하고 SIVsm의 [110][111]유전자 배열과 더욱 유사하다.
진단.
HIV 양성인 많은 사람들은 자신이 바이러스에 [112]감염되었다는 것을 알지 못한다.예를 들어 2001년 아프리카 성활동 도시 인구의 1% 미만이 테스트되었으며, 이 비율은 시골 [112]인구에서 더 낮다.또한 2001년에는 도시 보건 시설에 다니는 임산부의 0.5%만이 상담, 검사 또는 검사 [112]결과를 받았다.다시 말씀드리지만, 시골 [112]보건 시설에서는 이 비율이 더 낮습니다.따라서 기증자는 감염 사실을 모를 수 있기 때문에 의료 및 의학 연구에 사용되는 기증자의 혈액 및 혈액제제는 정기적으로 HIV [113]검사를 받습니다.
HIV-1 테스트는 처음에 효소연계면역흡수체검사(ELISA)를 사용하여 HIV-1에 대한 항체를 검출합니다.초기 ELISA에서 반응하지 않는 결과가 나온 샘플은 감염된 파트너 또는 HIV 상태를 알 수 없는 파트너에 대한 새로운 노출이 발생하지 않는 한 HIV 음성으로 간주됩니다.반응성 ELISA 결과가 있는 검체는 두 [114]번 재시험한다.중복 테스트의 결과가 반응성이면 검체는 반복적으로 반응성이 있는 것으로 보고되며 보다 구체적인 보충 테스트(PCR), 웨스턴 블롯 또는 드물게는 면역 형광 검사(IFA)를 통해 확인 테스트를 받습니다.ELISA에 의해 반복적으로 반응하고 IFA 또는 PCR에 의해 양성 또는 웨스턴 블롯에 의해 반응하는 검체만이 HIV 양성이고 HIV 감염을 나타낸다.ELISA 반응을 반복하는 검체는 때때로 불확실한 웨스턴 블롯 결과를 제공하는데, 이는 감염된 사람의 HIV에 대한 불완전한 항체 반응 또는 감염되지 않은 사람의 [115]비특이적 반응일 수 있다.
이러한 애매한 경우 IFA를 사용하여 감염을 확인할 수 있지만, 이 검사는 널리 사용되지 않습니다.일반적으로 두 번째 시료는 한 달 이상 후에 채취하여 웨스턴 블롯 결과가 불확실한 사람에 대해 재시험해야 한다.핵산 테스트(예: 바이러스 RNA 또는 프로바이러스 DNA 증폭 방법)는 훨씬 흔하지 않지만 특정 [114]상황에서 진단에 도움이 될 수 있습니다.또한 시료의 양이 적기 때문에 일부 시료는 결정적이지 않은 결과를 얻을 수 있다.이러한 상황에서는 두 번째 검체를 채취하여 HIV 감염 여부를 검사합니다.
현대의 HIV 검사는 윈도우 기간을 고려할 때 매우 정확합니다.한 번의 스크리닝 테스트가 [117]99% 이상 정확합니다.표준 2단계 테스트 프로토콜에서 거짓 양성 결과가 나올 확률은 낮은 위험 [118]모집단에서 250,000분의 1로 추정된다.노출 후 테스트를 즉시 수행하고 6주, 3개월 [119]및 6개월에 수행하는 것이 좋습니다.
미국 질병통제예방센터(CDC)의 최근 권고에 따르면 HIV 테스트는 HIV-1과 HIV-2 항체 및 p24 항원에 대한 면역측정 조합 테스트부터 시작해야 한다.음성 결과는 HIV 노출을 배제하는 반면 양성 결과는 HIV-1/2 항체 분화 면역 측정 후에 존재하는 항체를 검출해야 합니다.이를 통해 다음 4가지 시나리오를 생각할 수 있습니다.
- 1. HIV-1(+) 및 HIV-2(-) : HIV-1 항체가 검출됨
- 2. HIV-1(-) 및 HIV-2(+): HIV-2 항체가 검출됨
- 3. HIV-1(+) 및 HIV-2(+) : HIV-1 및 HIV-2 항체 검출
- 4. HIV-1(-) 또는 부정 & HIV-2(-) : HIV-1의 급성 감염 또는 HIV-1의 [120]부재를 검출하기 위해 핵산 검사를 실시해야 한다.
조사.
HIV/AIDS의 연구에는, HIV/AIDS의 예방, 치료, 또는 치료를 시도하는 모든 의학 연구, 감염원으로서의 HIV와 HIV에 의한 질병으로서의 AIDS에 관한 기초 연구가 포함됩니다.
많은 정부나 연구기관이 HIV/AIDS 연구에 참여하고 있습니다.이 연구에는 성교육 연구 등 행동건강 개입과 성병 살균제 연구, HIV 백신, 항레트로바이러스제 [121]연구 등이 포함된다.다른 의학 연구 분야에는 노출 전 예방, 노출 후 예방, 포경수술과 HIV, 가속 노화 효과의 주제가 포함된다.
치료 및 전염
HIV/AIDS의 관리는 일반적으로 여러 항레트로바이러스제의 사용을 포함한다.세계의 많은 지역에서 HIV는 에이즈에의 진행이 점점 더 드문 만성 질환이 되었다.
HIV의 잠복기와 그에 따른 CD4 T 세포, 수지상 세포 및 대식세포의 바이러스+ 저장소는 바이러스 [19][122]박멸의 주요 장벽이다.
HIV는 매우 치명적이지만 HIV 양성자가 항레트로바이러스 치료로 인해 지속적으로 검출되지 않는 바이러스 부하(<50 카피/ml)를 가지고 있을 때 성관계를 통해 전염되지 않는다는 점에 유의해야 한다.이것은 2008년 스위스 에이즈/HIV 연방위원회에 의해 스위스 성명서에서 처음 주장되었지만,[123][124] 그 성명은 당시 논란이 있었다.그러나 여러 연구를 통해 HIV 양성자가 지속적으로 검출할 수 없는 바이러스 부하를 가지고 있는 경우 성관계를 통해 HIV가 전염될 가능성은 사실상 제로라는 것이 명백해졌다. 이는 U=U, "검출 불가능="로 알려져 있다.Untransmitable(전송 불가), "전송 불가"[125][126]라고도 표현됩니다.U=U를 입증하는 연구는 "HIV를 가진 파트너가 바이러스 [130]부하를 오래 억제했을 때" Opposites Attract,[127] PARTNER [128]1, PARTNER [5][129]2, (남성 [130]커플용) 및 HPTN052[131] (이성 커플용)이다.이들 연구에서는 한쪽 파트너가 HIV 양성이고 한쪽 파트너가 HIV 음성인 커플이 등록되고 정기적인 HIV 테스트가 완료되었습니다.4개의 연구에서 총 4097쌍이 4개 대륙에 걸쳐 등록되었고 151,880개의 콘돔 없는 성관계 행위가 보고되었다. 양성 파트너가 검출할 수 없는 바이러스 [132]부하를 가진 HIV의 계통적으로 연관된 전염은 없었다.그 후, 미국 CDC, 영국 HIV 협회 및 Lancet [133]의학 저널을 포함한 수백 명의 개인과 조직이 "위험 제로" 사용을 옹호하는 U=U 합의문에 서명했다.PARTNER 2 연구의 최종 결과의 중요성은 Terrence Higgins Trust의 의료 책임자에 의해 "과잉 진술은 불가능하다"고 설명되었습니다.또한 수석 저자인 Alison Rodger는 "검출 불가능한 바이러스 부하가 HIV의 [134]전염을 막는 것으로 HIV의 대유행을 막을 수 있다"고 선언했습니다.저자들은 The Lancet에서 발견한 내용을 다음과 [5]같이 요약했다.
우리의 결과는 이전에 이성 커플에게 발생했던 것과 유사한 수준의 바이러스 억제와 동성애자 남성의 HIV 전염 위험에 대한 증거를 제공하며, HIV 바이러스 부하가 억제되었을 때 콘돔 없는 성관계를 통해 동성애 커플에서 HIV가 전염될 위험은 사실상 제로임을 시사한다.당사의 연구결과는 U=U(검출 불가능=전염 불가능) 캠페인의 메시지와 HIV [5]조기 테스트 및 치료의 이점을 뒷받침합니다.
이 결과는 앤서니 S가 제시한 결론과 일치한다. 미국 국립 보건원의 국립 알레르기 및 전염병 연구소 소장인 Fauci와 그의 팀은 미국 의학 협회 저널에 발표된 관점에서 U=U는 검출 불가능한 바이러스 부하가 [6][130]유지될 때 효과적인 HIV 예방 방법이라고 말했다.
바이러스에 감염된 사람들의 생식기 헤르페스(HSV-2) 재활성화는 생식기 피하의 점막하 염증성 수지상 세포뿐만 아니라 CCR-5 농축 CD4+T 세포와 관련된 증가를 가진다.CCR-5 양성 세포에 대한 HIV의 대류성은 생식기 헤르페스를 가진 사람들 사이에서 HIV 감염이 2~3배 증가하는 것을 설명한다.매일 항바이러스제(예: 아시클로빌)는 재활성화 후 임상적 후 염증을 감소시키지 않으므로 HIV [135][136]감염 위험을 감소시키지 않습니다.
역사
검출
"이색적인 새로운 질병"에 대한 첫 번째 뉴스는 1981년 5월 18일 동성애 신문 뉴욕 [137]네이티브에 실렸다.
에이즈는 1981년 미국에서 [138]임상적으로 처음 관찰되었다.초기 사례는 폐렴(Pneumocystis pneumonia, 현재 원인물질이 폐렴으로 불리고 있음을 인식하는 후자 용어) 증상을 보이는 약물을 투여한 약물과 면역력 저하 원인을 알 수 없는 게이 남성 집단이었다. 이는 매우 손상된 사람에게 발생하는 것으로 알려진 드문 기회성 감염이다.mmune [139]시스템얼마 지나지 않아 미국 뉴욕대 의대 연구진은 [142]카포시 육종(KS)[140][141]으로 불리는 희귀한 피부암에 걸린 게이 남성을 연구했다.소급해서 기술된 최초의 에이즈 환자는 [143]1966년부터 노르웨이에서 발생한 것으로 추정된다.
처음에 CDC는 그 질병의 공식 명칭을 가지고 있지 않았다.예를 들어, HIV의 발견자가 원래 [144][145]바이러스의 이름을 붙인 병인 림프절 장애와 같은 그것과 관련된 질병들을 통해 종종 그것을 언급한다.그들은 [146]또한 1981년에 태스크 포스가 꾸려진 카포시의 육종과 기회주의 감염을 사용했다.일반 언론에서는 동성애 관련 면역 결핍을 뜻하는 GRID라는 용어가 [147]생겨났다.CDC는 이름을 찾고 감염된 커뮤니티를 조사하면서 동성애자, 헤로인 사용자, 혈우병 환자,[148][149] 아이티인을 선별하는 것처럼 보이자 "4H 질병"을 만들었다.그러나 에이즈가 게이 [146]커뮤니티에 국한된 것이 아니라는 것을 알게 된 후 GRID라는 용어는 오해를 불러일으키고 1982년 [150]7월 회의에서 에이즈가 도입되었다.1982년 9월 CDC는 [151]에이즈라는 이름을 사용하기 시작했다.
1983년 미국인 로버트 갈로와 프랑스인 연구자 프랑수아즈 바레 시누시와 뤽 몽타니에가 이끄는 두 개의 별도 연구 그룹은 독립적으로 새로운 레트로바이러스가 에이즈 환자들을 감염시켰을 수 있다고 선언하고 그들의 연구 결과를 [152][145][153]사이언스지 같은 호에 발표했다.갈로는 자신이 속한 그룹이 에이즈에 걸린 사람에게서 분리한 바이러스가 그의 그룹이 최초로 분리한 다른 인간 T림프트로픽 바이러스(HTLV)와 모양이 현저하게 유사하다고 주장했다.갈로는 1987년 1984년 자신이 발견했다고 주장한 바이러스가 실제로는 그 [154]전 프랑스에서 보낸 바이러스라고 시인했다.갈로 박사팀은 새로 격리된 바이러스 HTLV-III라고 불렀다. 몽타니에 박사팀은 환자로부터 목의 림프절이 붓고 신체적으로 쇠약해진 바이러스를 분리했는데, 이는 1차 HIV 감염의 전형적인 증상이다.갈로의 그룹으로부터의 보고와 모순되게, 몽타니에와 그의 동료들은 이 바이러스의 핵심 단백질이 면역학적으로 HTLV-I와 다르다는 것을 보여주었다.몽타니에의 그룹은 그들의 고립된 바이러스 림프절 관련 바이러스(LAV)[142]를 명명했다.이 두 바이러스가 같은 것으로 판명됨에 따라 1986년 LAV와 HTLV-III는 HIV로 [155]이름이 변경되었습니다.
몽타니에와 갈로 그룹과 동시에 일하는 또 다른 그룹은 제이 A의 그룹이었다. 샌프란시스코에 있는 캘리포니아 대학의 부담금입니다.그는 1983년에 독립적으로 에이즈 바이러스를 발견했고 그것을 에이즈 관련 [156]레트로바이러스라고 명명했다.이 바이러스는 몽타니에와 갈로 그룹이 보고한 바이러스와는 매우 달랐다.ARV 변종은 처음으로 HIV 분리체의 이질성을 나타내며 이들 중 일부는 미국에서 [157]발견된 에이즈 바이러스의 전형적인 사례로 남아 있다.
오리진스
HIV-1과 HIV-2는 둘 다 서중부 아프리카의 비인간 영장류에서 유래한 것으로 여겨지며,[158][159] 20세기 초에 인간에게 옮겨진 것으로 믿어진다.
HIV-1은 야생 침팬지를 감염시키는 SIV인 SIVcpz의 [160][161]진화를 통해 카메룬 남부에서 유래한 것으로 보인다.HIV-2의 가장 가까운 친척은 서아프리카 연안(세네갈 남부에서 코트디부아르 [21]서부)에 사는 구세계 원숭이인 수티망가베이(Cercocebus atys atys)의 바이러스인 SIVsmm이다.부엉이 원숭이와 같은 신세계 원숭이들은 HIV-1 감염에 내성이 있는데, 아마도 두 개의 바이러스 내성 [162]유전자의 게놈 융합 때문일 것이다.
HIV-1은 적어도 세 차례에 걸쳐 종의 장벽을 뛰어넘어 바이러스의 세 그룹인 M, N, [163]O를 발생시킨 것으로 생각된다.
사냥꾼이나 부시미트 판매상으로서 부시미트 활동에 참여하는 사람들이 일반적으로 SIV를 [164]획득한다는 증거가 있다.하지만, SIV는 약한 바이러스이고, 일반적으로 감염 후 몇 주 안에 인간의 면역 체계에 의해 억제된다.바이러스가 [165]HIV로 변이하기 위해서는 개인에서 개인으로 빠르게 여러 번 전염될 필요가 있다고 생각된다.또한 사람 대 사람 전염률이 비교적 낮기 때문에, 20세기 이전에는 아프리카에 없었던 것으로 생각되는 하나 이상의 고위험 전염 채널이 존재하는 경우에만 인구 전체로 확산될 수 있다.
바이러스가 인간에 적응하고 사회 전반으로 확산될 수 있도록 하는 제안된 고위험 전염 경로는 제안된 동물 대 인간 교배 시기에 달려 있다.이 바이러스의 유전자 연구는 HIV-1M 그룹의 가장 최근의 공통 조상이 [166]1910년 경으로 거슬러 올라간다는 것을 시사한다.이 데이트의 지지자들은 HIV 전염병을 식민주의의 출현과 큰 식민지 아프리카 도시의 성장으로 연결시키고, 성적 접촉의 다른 패턴(특히 여러 개의 동시 파트너십), 매춘의 확산, 그리고 그에 수반되는 높은 빈도의 생식기 궤양 질병(sy와 같은)을 포함한 사회적 변화를 이끈다.초기 식민지 [167]도시에서요질 성관계 중 HIV의 전염률은 일반적으로 낮지만, 파트너 중 한 명이 성병에 감염되어 생식기 궤양을 일으키면 감염률이 몇 배로 증가한다.1900년대 초반 식민지 도시들은 1928년 동부 레오폴드빌(현 킨샤사)의 여성 거주자의 45%가 매춘부라고 생각될 정도로 매춘과 성기 궤양의 높은 유병률로 유명했고 1933년 같은 도시의 모든 거주자의 약 15%가 sy의 형태 중 하나에 감염되었다.필리스[167]
인류 최초의 HIV 감염 사례는 1959년 벨기에 [168]콩고로 거슬러 올라간다.이 바이러스는 로버트 레이포드라는 이름의 16세 남성이 1966년에 증상을 보이고 [169]1969년에 사망했기 때문에 1960년대 중후반 미국에서 발견되었을지도 모른다.
대안적이고 가능성이 높은 보완 가설은 대량 백신 접종, 항생제 및 말라리아 치료 캠페인 [165][170][171]중 일회용 주사기의 무균 재사용과 같은 2차 세계대전 이후 수년간 아프리카에서 안전하지 않은 의료 행위를 광범위하게 사용했다는 것을 지적한다.HIV-2 그룹 A와 B뿐만 아니라 HIV-1 그룹 M과 O의 가장 최근의 공통 조상의 시기에 대한 연구는 SIV가 20세기 [172]내내 전염 가능한 HIV 계통을 발생시켰다는 것을 보여준다.인간에 대한 이러한 전염의 분산 시기는 HIV의 이종 간 전염을 설명하기 위해 하나의 외부 요인이 필요하지 않다는 것을 의미한다.이러한 관찰은 HIV 전염의 기원에 대한 두 가지 견해, 즉 감염된 영장류의 도살이나 도살 중에 인간에게 SIV가 전염되는 것과 사하라 이남 아프리카 [172]도시의 식민지 확장 둘 다와 일치한다.
「 」를 참조해 주세요.
레퍼런스
- ^ Weiss RA (May 1993). "How does HIV cause AIDS?". Science. 260 (5112): 1273–9. Bibcode:1993Sci...260.1273W. doi:10.1126/science.8493571. PMID 8493571.
- ^ Douek DC, Roederer M, Koup RA (2009). "Emerging Concepts in the Immunopathogenesis of AIDS". Annual Review of Medicine. 60: 471–84. doi:10.1146/annurev.med.60.041807.123549. PMC 2716400. PMID 18947296.
- ^ a b Powell MK, Benková K, Selinger P, Dogoši M, Kinkorová Luňáčková I, Koutníková H, Laštíková J, Roubíčková A, Špůrková Z, Laclová L, Eis V, Šach J, Heneberg P (2016). "Opportunistic Infections in HIV-Infected Patients Differ Strongly in Frequencies and Spectra between Patients with Low CD4+ Cell Counts Examined Postmortem and Compensated Patients Examined Antemortem Irrespective of the HAART Era". PLOS ONE. 11 (9): e0162704. Bibcode:2016PLoSO..1162704P. doi:10.1371/journal.pone.0162704. PMC 5017746. PMID 27611681.
- ^ UNAIDS; WHO (December 2007). "2007 AIDS epidemic update" (PDF). p. 16.
- ^ a b c d e Rodger AJ, Cambiano V, Bruun T, Vernazza P, Collins S, Degen O, et al. (June 2019). "Risk of HIV transmission through condomless sex in serodifferent gay couples with the HIV-positive partner taking suppressive antiretroviral therapy (PARTNER): final results of a multicentre, prospective, observational study". Lancet. 393 (10189): 2428–2438. doi:10.1016/S0140-6736(19)30418-0. PMC 6584382. PMID 31056293.
- ^ a b c Eisinger RW, Dieffenbach CW, Fauci AS (February 2019). "HIV Viral Load and Transmissibility of HIV Infection: Undetectable Equals Untransmittable". JAMA. 321 (5): 451–452. doi:10.1001/jama.2018.21167. PMID 30629090. S2CID 58599661.
- ^ Mabuka J, Nduati R, Odem-Davis K, Peterson D, Overbaugh J (2012). Desrosiers RC (ed.). "HIV-Specific Antibodies Capable of ADCC Are Common in Breastmilk and Are Associated with Reduced Risk of Transmission in Women with High Viral Loads". PLOS Pathogens. 8 (6): e1002739. doi:10.1371/journal.ppat.1002739. PMC 3375288. PMID 22719248.
- ^ Hahn RA, Inhorn MC, eds. (2009). Anthropology and public health : bridging differences in culture and society (2nd ed.). Oxford: Oxford University Press. p. 449. ISBN 978-0-19-537464-3. OCLC 192042314.
- ^ Mead MN (2008). "Contaminants in human milk: weighing the risks against the benefits of breastfeeding". Environmental Health Perspectives. 116 (10): A426–34. doi:10.1289/ehp.116-a426. PMC 2569122. PMID 18941560. Archived from the original on 6 November 2008.
- ^ "Preventing Mother-to-Child Transmission of HIV". HIV.gov. May 15, 2017. Retrieved December 8, 2017.
 이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다..
이 문서에는 퍼블릭 도메인에 있는 이 소스로부터의 텍스트가 포함되어 있습니다.. - ^ Cunningham AL, Donaghy H, Harman AN, Kim M, Turville SG (August 2010). "Manipulation of dendritic cell function by viruses". Current Opinion in Microbiology. 13 (4): 524–9. doi:10.1016/j.mib.2010.06.002. PMID 20598938.
- ^ Doitsh G, Galloway NL, Geng X, Yang Z, Monroe KM, Zepeda O, et al. (January 2014). "Cell death by pyroptosis drives CD4 T-cell depletion in HIV-1 infection". Nature. 505 (7484): 509–14. Bibcode:2014Natur.505..509D. doi:10.1038/nature12940. PMC 4047036. PMID 24356306.
- ^ Garg H, Mohl J, Joshi A (November 2012). "HIV-1 induced bystander apoptosis". Viruses. 4 (11): 3020–43. doi:10.3390/v4113020. PMC 3509682. PMID 23202514.
- ^ Kumar V (2012). Robbins Basic Pathology (9th ed.). p. 147. ISBN 978-1-4557-3787-1.
- ^ International Committee on Taxonomy of Viruses (2002). "61.0.6. Lentivirus". National Institutes of Health. Retrieved February 28, 2006.
- ^ International Committee on Taxonomy of Viruses (2002). "61. Retroviridae". National Institutes of Health. Retrieved February 28, 2006.
- ^ Levy JA (November 1993). "HIV pathogenesis and long-term survival". AIDS. 7 (11): 1401–10. doi:10.1097/00002030-199311000-00001. PMID 8280406.
- ^ Smith JA, Daniel R (May 2006). "Following the path of the virus: the exploitation of host DNA repair mechanisms by retroviruses". ACS Chemical Biology. 1 (4): 217–26. doi:10.1021/cb600131q. PMID 17163676.
- ^ a b Siliciano RF, Greene WC (September 2011). "HIV latency". Cold Spring Harbor Perspectives in Medicine. 1 (1): a007096. doi:10.1101/cshperspect.a007096. PMC 3234450. PMID 22229121.
- ^ Gilbert PB, McKeague IW, Eisen G, Mullins C, Guéye-NDiaye A, Mboup S, Kanki PJ (February 28, 2003). "Comparison of HIV-1 and HIV-2 infectivity from a prospective cohort study in Senegal". Statistics in Medicine. 22 (4): 573–593. doi:10.1002/sim.1342. PMID 12590415. S2CID 28523977.
- ^ a b Reeves JD, Doms RW (2002). "Human Immunodeficiency Virus Type 2". Journal of General Virology. 83 (Pt 6): 1253–65. doi:10.1099/0022-1317-83-6-1253. PMID 12029140.
- ^ McGovern SL, Caselli E, Grigorieff N, Shoichet BK (2002). "A common mechanism underlying promiscuous inhibitors from virtual and high-throughput screening". Journal of Medicinal Chemistry. 45 (8): 1712–22. doi:10.1021/jm010533y. hdl:11380/977912. PMID 11931626.
- ^ 개요와 비교:
- ^ a b c d e f g Various (2008). HIV Sequence Compendium 2008 Introduction (PDF). Retrieved March 31, 2009.
- ^ a b c Chan DC, Fass D, Berger JM, Kim PS (April 1997). "Core structure of gp41 from the HIV envelope glycoprotein" (PDF). Cell. 89 (2): 263–73. doi:10.1016/S0092-8674(00)80205-6. PMID 9108481. S2CID 4518241.
- ^ Klein JS, Bjorkman PJ (May 2010). "Few and far between: how HIV may be evading antibody avidity". PLOS Pathogens. 6 (5): e1000908. doi:10.1371/journal.ppat.1000908. PMC 2877745. PMID 20523901.
- ^ National Institute of Health (June 17, 1998). "Crystal structure of key HIV protein reveals new prevention, treatment targets" (Press release). Archived from the original on February 19, 2006. Retrieved September 14, 2006.
- ^ Behrens AJ, Vasiljevic S, Pritchard LK, Harvey DJ, Andev RS, Krumm SA, et al. (March 2016). "Composition and Antigenic Effects of Individual Glycan Sites of a Trimeric HIV-1 Envelope Glycoprotein". Cell Reports. 14 (11): 2695–706. doi:10.1016/j.celrep.2016.02.058. PMC 4805854. PMID 26972002.
- ^ Pritchard LK, Spencer DI, Royle L, Bonomelli C, Seabright GE, Behrens AJ, et al. (June 2015). "Glycan clustering stabilizes the mannose patch of HIV-1 and preserves vulnerability to broadly neutralizing antibodies". Nature Communications. 6: 7479. Bibcode:2015NatCo...6.7479P. doi:10.1038/ncomms8479. PMC 4500839. PMID 26105115.
- ^ Pritchard LK, Harvey DJ, Bonomelli C, Crispin M, Doores KJ (September 2015). "Cell- and Protein-Directed Glycosylation of Native Cleaved HIV-1 Envelope". Journal of Virology. 89 (17): 8932–44. doi:10.1128/JVI.01190-15. PMC 4524065. PMID 26085151.
- ^ Crispin M, Doores KJ (April 2015). "Targeting host-derived glycans on enveloped viruses for antibody-based vaccine design". Current Opinion in Virology. 11: 63–9. doi:10.1016/j.coviro.2015.02.002. PMC 4827424. PMID 25747313.
- ^ Julien JP, Cupo A, Sok D, Stanfield RL, Lyumkis D, Deller MC, et al. (December 2013). "Crystal structure of a soluble cleaved HIV-1 envelope trimer". Science. 342 (6165): 1477–83. Bibcode:2013Sci...342.1477J. doi:10.1126/science.1245625. PMC 3886632. PMID 24179159.
- ^ Lyumkis D, Julien JP, de Val N, Cupo A, Potter CS, Klasse PJ, et al. (December 2013). "Cryo-EM structure of a fully glycosylated soluble cleaved HIV-1 envelope trimer". Science. 342 (6165): 1484–90. Bibcode:2013Sci...342.1484L. doi:10.1126/science.1245627. PMC 3954647. PMID 24179160.
- ^ Sanders RW, Derking R, Cupo A, Julien JP, Yasmeen A, de Val N, et al. (September 2013). "A next-generation cleaved, soluble HIV-1 Env trimer, BG505 SOSIP.664 gp140, expresses multiple epitopes for broadly neutralizing but not non-neutralizing antibodies". PLOS Pathogens. 9 (9): e1003618. doi:10.1371/journal.ppat.1003618. PMC 3777863. PMID 24068931.
- ^ Pritchard LK, Vasiljevic S, Ozorowski G, Seabright GE, Cupo A, Ringe R, et al. (June 2015). "Structural Constraints Determine the Glycosylation of HIV-1 Envelope Trimers". Cell Reports. 11 (10): 1604–13. doi:10.1016/j.celrep.2015.05.017. PMC 4555872. PMID 26051934.
- ^ de Taeye SW, Ozorowski G, Torrents de la Peña A, Guttman M, Julien JP, van den Kerkhof TL, et al. (December 2015). "Immunogenicity of Stabilized HIV-1 Envelope Trimers with Reduced Exposure of Non-neutralizing Epitopes". Cell. 163 (7): 1702–15. doi:10.1016/j.cell.2015.11.056. PMC 4732737. PMID 26687358.
- ^ Ouellet DL, Plante I, Landry P, Barat C, Janelle ME, Flamand L, Tremblay MJ, Provost P (April 2008). "Identification of functional microRNAs released through asymmetrical processing of HIV-1 TAR element". Nucleic Acids Research. 36 (7): 2353–65. doi:10.1093/nar/gkn076. PMC 2367715. PMID 18299284.
- ^ Klase Z, Winograd R, Davis J, Carpio L, Hildreth R, Heydarian M, Fu S, McCaffrey T, Meiri E, Ayash-Rashkovsky M, Gilad S, Bentwich Z, Kashanchi F (2009). "HIV-1 TAR miRNA protects against apoptosis by altering cellular gene expression". Retrovirology. 6 (1): 18. doi:10.1186/1742-4690-6-18. PMC 2654423. PMID 19220914.
- ^ Vasudevan AA, Smits SH, Höppner A, Häussinger D, Koenig BW, Münk C (November 2013). "Structural features of antiviral DNA cytidine deaminases". Biological Chemistry (Submitted manuscript). 394 (11): 1357–70. doi:10.1515/hsz-2013-0165. PMID 23787464. S2CID 4151961.
- ^ Garcia JV, Miller AD (April 1991). "Serine phosphorylation-independent downregulation of cell-surface CD4 by nef". Nature. 350 (6318): 508–11. Bibcode:1991Natur.350..508G. doi:10.1038/350508a0. PMID 2014052. S2CID 1628392.
- ^ Schwartz O, Maréchal V, Le Gall S, Lemonnier F, Heard JM (March 1996). "Endocytosis of major histocompatibility complex class I molecules is induced by the HIV-1 Nef protein". Nature Medicine. 2 (3): 338–42. doi:10.1038/nm0396-338. PMID 8612235. S2CID 7461342.
- ^ Stumptner-Cuvelette P, Morchoisne S, Dugast M, Le Gall S, Raposo G, Schwartz O, Benaroch P (October 2001). "HIV-1 Nef impairs MHC class II antigen presentation and surface expression". Proceedings of the National Academy of Sciences of the United States of America. 98 (21): 12144–9. Bibcode:2001PNAS...9812144S. doi:10.1073/pnas.221256498. PMC 59782. PMID 11593029.
- ^ Arrildt KT, Joseph SB, Swanstrom R (March 2012). "The HIV-1 env protein: a coat of many colors". Current HIV/AIDS Reports. 9 (1): 52–63. doi:10.1007/s11904-011-0107-3. PMC 3658113. PMID 22237899.
- ^ a b Berger EA, Doms RW, Fenyö EM, Korber BT, Littman DR, Moore JP, Sattentau QJ, Schuitemaker H, Sodroski J, Weiss RA (1998). "A new classification for HIV-1". Nature. 391 (6664): 240. Bibcode:1998Natur.391..240B. doi:10.1038/34571. PMID 9440686. S2CID 2159146.
- ^ a b c Coakley E, Petropoulos CJ, Whitcomb JM (2005). "Assessing ch vbgemokine co-receptor usage in HIV". Current Opinion in Infectious Diseases. 18 (1): 9–15. doi:10.1097/00001432-200502000-00003. PMID 15647694. S2CID 30923492.
- ^ Deng H, Liu R, Ellmeier W, Choe S, Unutmaz D, Burkhart M, Di Marzio P, Marmon S, Sutton RE, Hill CM, Davis CB, Peiper SC, Schall TJ, Littman DR, Landau NR (1996). "Identification of a major co-receptor for primary isolates of HIV-1". Nature. 381 (6584): 661–6. Bibcode:1996Natur.381..661D. doi:10.1038/381661a0. PMID 8649511. S2CID 37973935.
- ^ Feng Y, Broder CC, Kennedy PE, Berger EA (1996). "HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane, G protein-coupled receptor". Science. 272 (5263): 872–7. Bibcode:1996Sci...272..872F. doi:10.1126/science.272.5263.872. PMC 3412311. PMID 8629022. S2CID 44455027.
- ^ Knight SC, Macatonia SE, Patterson S (1990). "HIV I infection of dendritic cells". International Review of Immunology. 6 (2–3): 163–75. doi:10.3109/08830189009056627. PMID 2152500.
- ^ Tang J, Kaslow RA (2003). "The impact of host genetics on HIV infection and disease progression in the era of highly active antiretroviral therapy". AIDS. 17 (Suppl 4): S51–S60. doi:10.1097/00002030-200317004-00006. PMID 15080180.
- ^ Zhu T, Mo H, Wang N, Nam DS, Cao Y, Koup RA, Ho DD (1993). "Genotypic and phenotypic characterization of HIV-1 patients with primary infection". Science. 261 (5125): 1179–81. Bibcode:1993Sci...261.1179Z. doi:10.1126/science.8356453. PMID 8356453.
- ^ van't Wout AB, Kootstra NA, Mulder-Kampinga GA, Albrecht-van Lent N, Scherpbier HJ, Veenstra J, Boer K, Coutinho RA, Miedema F, Schuitemaker H (1994). "Macrophage-tropic variants initiate human immunodeficiency virus type 1 infection after sexual, parenteral, and vertical transmission". Journal of Clinical Investigation. 94 (5): 2060–7. doi:10.1172/JCI117560. PMC 294642. PMID 7962552.
- ^ Zhu T, Wang N, Carr A, Nam DS, Moor-Jankowski R, Cooper DA, Ho DD (1996). "Genetic characterization of human immunodeficiency virus type 1 in blood and genital secretions: evidence for viral compartmentalization and selection during sexual transmission". Journal of Virology. 70 (5): 3098–107. doi:10.1128/JVI.70.5.3098-3107.1996. PMC 190172. PMID 8627789.
- ^ Clevestig P, Maljkovic I, Casper C, Carlenor E, Lindgren S, Navér L, Bohlin AB, Fenyö EM, Leitner T, Ehrnst A (2005). "The X4 phenotype of HIV type 1 evolves from R5 in two children of mothers, carrying X4, and is not linked to transmission". AIDS Research and Human Retroviruses. 21 (5): 371–8. doi:10.1089/aid.2005.21.371. PMID 15929699.
- ^ Moore JP (1997). "Coreceptors: implications for HIV pathogenesis and therapy". Science. 276 (5309): 51–2. doi:10.1126/science.276.5309.51. PMID 9122710. S2CID 33262844.
- ^ Karlsson A, Parsmyr K, Aperia K, Sandström E, Fenyö EM, Albert J (1994). "MT-2 cell tropism of human immunodeficiency virus type 1 isolates as a marker for response to treatment and development of drug resistance". The Journal of Infectious Diseases. 170 (6): 1367–75. doi:10.1093/infdis/170.6.1367. PMID 7995974.
- ^ Koot M, van 't Wout AB, Kootstra NA, de Goede RE, Tersmette M, Schuitemaker H (1996). "Relation between changes in cellular load, evolution of viral phenotype, and the clonal composition of virus populations in the course of human immunodeficiency virus type 1 infection". The Journal of Infectious Diseases. 173 (2): 349–54. doi:10.1093/infdis/173.2.349. PMID 8568295.
- ^ Cheney K, McKnight A (2010). "HIV-2 Tropism and Disease". Lentiviruses and Macrophages: Molecular and Cellular Interactions. Caister Academic Press. ISBN 978-1-904455-60-8.[페이지 필요]
- ^ a b c d e f g Chan DC, Kim PS (1998). "HIV entry and its inhibition". Cell. 93 (5): 681–4. doi:10.1016/S0092-8674(00)81430-0. PMID 9630213. S2CID 10544941.
- ^ a b c d e f Wyatt R, Sodroski J (1998). "The HIV-1 envelope glycoproteins: fusogens, antigens, and immunogens". Science. 280 (5371): 1884–8. Bibcode:1998Sci...280.1884W. doi:10.1126/science.280.5371.1884. PMID 9632381.
- ^ a b Arthos J, Cicala C, Martinelli E, Macleod K, Van Ryk D, Wei D, Xiao Z, Veenstra TD, Conrad TP, Lempicki RA, McLaughlin S, Pascuccio M, Gopaul R, McNally J, Cruz CC, Censoplano N, Chung E, Reitano KN, Kottilil S, Goode DJ, Fauci AS (2008). "HIV-1 envelope protein binds to and signals through integrin alpha(4)beta(7), the gut mucosal homing receptor for peripheral T cells". Nature Immunology. 9 (3): 301–9. doi:10.1038/ni1566. PMID 18264102. S2CID 205361178.
- ^ a b Pope M, Haase AT (2003). "Transmission, acute HIV-1 infection and the quest for strategies to prevent infection". Nature Medicine. 9 (7): 847–52. doi:10.1038/nm0703-847. PMID 12835704. S2CID 26570505.
- ^ Haedicke J, Brown C, Naghavi MH (August 2009). "The brain-specific factor FEZ1 is a determinant of neuronal susceptibility to HIV-1 infection". Proceedings of the National Academy of Sciences. 106 (33): 14040–14045. Bibcode:2009PNAS..10614040H. doi:10.1073/pnas.0900502106. PMC 2729016. PMID 19667186.
- ^ Daecke J, Fackler OT, Dittmar MT, Kräusslich HG (2005). "Involvement of clathrin-mediated endocytosis in human immunodeficiency virus type 1 entry". Journal of Virology. 79 (3): 1581–1594. doi:10.1128/jvi.79.3.1581-1594.2005. PMC 544101. PMID 15650184.
- ^ Miyauchi K, Kim Y, Latinovic O, Morozov V, Melikyan GB (2009). "HIV Enters Cells via Endocytosis and Dynamin-Dependent Fusion with Endosomes". Cell. 137 (3): 433–444. doi:10.1016/j.cell.2009.02.046. PMC 2696170. PMID 19410541.
- ^ Koch P, Lampe M, Godinez WJ, Müller B, Rohr K, Kräusslich HG, Lehmann MJ (2009). "Visualizing fusion of pseudotyped HIV-1 particles in real time by live cell microscopy". Retrovirology. 6: 84. doi:10.1186/1742-4690-6-84. PMC 2762461. PMID 19765276.
- ^ Thorley JA, McKeating JA, Rappoport JZ (2010). "Mechanis ms of viral entry: sneaking in the front door". Protoplasma. 244 (1–4): 15–24. doi:10.1007/s00709-010-0152-6. PMC 3038234. PMID 20446005.
- ^ Permanyer M, Ballana E, Esté JA (2010). "Endocytosis of HIV: anything goes". Trends in Microbiology. 18 (12): 543–551. doi:10.1016/j.tim.2010.09.003. PMID 20965729.
- ^ a b c Zheng YH, Lovsin N, Peterlin BM (2005). "Newly identified host factors modulate HIV replication". Immunology Letters. 97 (2): 225–34. doi:10.1016/j.imlet.2004.11.026. PMID 15752562.
- ^ "IV. Viruses> F. Animal Virus Life Cycles > 3. The Life Cycle of HIV". Doc Kaiser's Microbiology Home Page. Community College of Baltimore County. January 2008. Archived from the original on July 26, 2010.
- ^ Hiscott J, Kwon H, Génin P (2001). "Hostile takeovers: viral appropriation of the NF-kB pathway". Journal of Clinical Investigation. 107 (2): 143–151. doi:10.1172/JCI11918. PMC 199181. PMID 11160127.
- ^ Keane, Sarah C.; Heng, Xiao; Lu, Kun; Kharytonchyk, Siarhei; Ramakrishnan, Venkateswaran; Carter, Gregory; Barton, Shawn; Hosic, Azra; Florwick, Alyssa; Santos, Justin; Bolden, Nicholas C. (May 22, 2015). "Structure of the HIV-1 RNA packaging signal". Science. 348 (6237): 917–921. Bibcode:2015Sci...348..917K. doi:10.1126/science.aaa9266. ISSN 0036-8075. PMC 4492308. PMID 25999508.
- ^ Keane, Sarah C.; Van, Verna; Frank, Heather M.; Sciandra, Carly A.; McCowin, Sayo; Santos, Justin; Heng, Xiao; Summers, Michael F. (October 10, 2016). "NMR detection of intermolecular interaction sites in the dimeric 5′-leader of the HIV-1 genome". Proceedings of the National Academy of Sciences. 113 (46): 13033–13038. doi:10.1073/pnas.1614785113. ISSN 0027-8424. PMC 5135362. PMID 27791166.
- ^ Ocwieja KE, Sherrill-Mix S, Mukherjee R, Custers-Allen R, David P, Brown M, et al. (November 2012). "Dynamic regulation of HIV-1 mRNA populations analyzed by single-molecule enrichment and long-read sequencing". Nucleic Acids Research. 40 (20): 10345–55. doi:10.1093/nar/gks753. PMC 3488221. PMID 22923523.
- ^ Pollard VW, Malim MH (1998). "The HIV-1 Rev protein". Annual Review of Microbiology. 52: 491–532. doi:10.1146/annurev.micro.52.1.491. PMID 9891806.
- ^ Butsch M, Boris-Lawrie K (April 2002). "Destiny of unspliced retroviral RNA: ribosome and/or virion?". Journal of Virology. 76 (7): 3089–94. doi:10.1128/JVI.76.7.3089-3094.2002. PMC 136024. PMID 11884533.
- ^ Hellmund C, Lever AM (July 2016). "Coordination of Genomic RNA Packaging with Viral Assembly in HIV-1". Viruses. 8 (7): 192. doi:10.3390/v8070192. PMC 4974527. PMID 27428992.
- ^ Soto-Rifo R, Limousin T, Rubilar PS, Ricci EP, Décimo D, Moncorgé O, et al. (March 2012). "Different effects of the TAR structure on HIV-1 and HIV-2 genomic RNA translation". Nucleic Acids Research. 40 (6): 2653–67. doi:10.1093/nar/gkr1093. PMC 3315320. PMID 22121214.
- ^ Saad JS, Muriaux DM (July 28, 2015). Role of Lipids in Virus Assembly. Frontiers Media SA. ISBN 9782889195824.
- ^ Ricci EP, Herbreteau CH, Decimo D, Schaupp A, Datta SA, Rein A, et al. (July 2008). "In vitro expression of the HIV-2 genomic RNA is controlled by three distinct internal ribosome entry segments that are regulated by the HIV protease and the Gag polyprotein". RNA. 14 (7): 1443–55. doi:10.1261/rna.813608. PMC 2441975. PMID 18495939.
- ^ a b Hu WS, Temin HM (1990). "Retroviral recombination and reverse transcription". Science. 250 (4985): 1227–33. Bibcode:1990Sci...250.1227H. doi:10.1126/science.1700865. PMID 1700865.
- ^ a b Charpentier C, Nora T, Tenaillon O, Clavel F, Hance AJ (2006). "Extensive recombination among human immunodeficiency virus type 1 quasispecies makes an important contribution to viral diversity in individual patients". Journal of Virology. 80 (5): 2472–82. doi:10.1128/JVI.80.5.2472-2482.2006. PMC 1395372. PMID 16474154.
- ^ Nora T, Charpentier C, Tenaillon O, Hoede C, Clavel F, Hance AJ (2007). "Contribution of recombination to the evolution of human immunodeficiency viruses expressing resistance to antiretroviral treatment". Journal of Virology. 81 (14): 7620–8. doi:10.1128/JVI.00083-07. PMC 1933369. PMID 17494080.
- ^ Chen J, Powell D, Hu WS (2006). "High frequency of genetic recombination is a common feature of primate lentivirus replication". Journal of Virology. 80 (19): 9651–8. doi:10.1128/JVI.00936-06. PMC 1617242. PMID 16973569.
- ^ a b Bonhoeffer S, Chappey C, Parkin NT, Whitcomb JM, Petropoulos CJ (2004). "Evidence for positive epistasis in HIV-1". Science. 306 (5701): 1547–50. Bibcode:2004Sci...306.1547B. doi:10.1126/science.1101786. PMID 15567861. S2CID 45784964.
- ^ Israël N, Gougerot-Pocidalo MA (1997). "Oxidative stress in human immunodeficiency virus infection". Cellular and Molecular Life Sciences. 53 (11–12): 864–70. doi:10.1007/s000180050106. PMID 9447238. S2CID 22663454.
- ^ Michod RE, Bernstein H, Nedelcu AM (May 2008). "Adaptive value of sex in microbial pathogens" (PDF). Infection, Genetics and Evolution. 8 (3): 267–85. doi:10.1016/j.meegid.2008.01.002. PMID 18295550.
- ^ Hallenberger S, Bosch V, Angliker H, Shaw E, Klenk HD, Garten W (November 26, 1992). "Inhibition of furin-mediated cleavage activation of HIV-1 glycoprotein gp160". Nature. 360 (6402): 358–61. Bibcode:1992Natur.360..358H. doi:10.1038/360358a0. PMID 1360148. S2CID 4306605.
- ^ Gelderblom HR (1997). "Fine structure of HIV and SIV" (PDF). In Los Alamos National Laboratory (ed.). HIV sequence compendium. Los Alamos National Laboratory. pp. 31–44.
- ^ a b c d Zhang C, Zhou S, Groppelli E, Pellegrino P, Williams I, Borrow P, Chain BM, Jolly C (2015). "Hybrid Spreading Mechanisms and T Cell Activation Shape the Dynamics of HIV-1 Infection". PLOS Computational Biology. 11 (4): e1004179. arXiv:1503.08992. Bibcode:2015PLSCB..11E4179Z. doi:10.1371/journal.pcbi.1004179. PMC 4383537. PMID 25837979.
- ^ a b Jolly C, Kashefi K, Hollinshead M, Sattentau QJ (2004). "HIV-1 cell to cell transfer across an Env-induced, actin-dependent synapse". Journal of Experimental Medicine. 199 (2): 283–293. doi:10.1084/jem.20030648. PMC 2211771. PMID 14734528.
- ^ Sattentau Q (2008). "Avoiding the void: cell-to-cell spread of human viruses". Nature Reviews Microbiology. 6 (11): 815–826. doi:10.1038/nrmicro1972. PMID 18923409. S2CID 20991705.
- ^ Duncan CJ, Russell RA, Sattentau QJ (2013). "High multiplicity HIV-1 cell-to-cell transmission from macrophages to CD4+ T cells limits antiretroviral efficacy". AIDS. 27 (14): 2201–2206. doi:10.1097/QAD.0b013e3283632ec4. PMC 4714465. PMID 24005480.
- ^ Sewald X, Gonzalez DG, Haberman AM, Mothes W (2012). "In vivo imaging of virological synapses". Nature Communications. 3: 1320. Bibcode:2012NatCo...3.1320S. doi:10.1038/ncomms2338. PMC 3784984. PMID 23271654.
- ^ Sigal A, Kim JT, Balazs AB, Dekel E, Mayo A, Milo R, Baltimore D (2011). "Cell-to-cell spread of HIV permits ongoing replication despite antiretroviral therapy". Nature. 477 (7362): 95–98. Bibcode:2011Natur.477...95S. doi:10.1038/nature10347. PMID 21849975. S2CID 4409389.
- ^ a b c d Robertson DL, Hahn BH, Sharp PM (1995). "Recombination in AIDS viruses". Journal of Molecular Evolution. 40 (3): 249–59. Bibcode:1995JMolE..40..249R. doi:10.1007/BF00163230. PMID 7723052. S2CID 19728830.
- ^ Rambaut A, Posada D, Crandall KA, Holmes EC (January 2004). "The causes and consequences of HIV evolution". Nature Reviews Genetics. 5 (52–61): 52–61. doi:10.1038/nrg1246. PMID 14708016. S2CID 5790569.
- ^ Perelson AS, Ribeiro RM (October 2008). "Estimating drug efficacy and viral dynamic parameters: HIV and HCV". Statistics in Medicine. 27 (23): 4647–57. doi:10.1002/sim.3116. PMID 17960579. S2CID 33662579.
- ^ a b Sodora DL, Allan JS, Apetrei C, Brenchley JM, Douek DC, Else JG, Estes JD, Hahn BH, Hirsch VM, Kaur A, Kirchhoff F, Muller-Trutwin M, Pandrea I, Schmitz JE, Silvestri G (2009). "Toward an AIDS vaccine: lessons from natural simian immunodeficiency virus infections of African nonhuman primate hosts". Nature Medicine. 15 (8): 861–865. doi:10.1038/nm.2013. PMC 2782707. PMID 19661993.
- ^ Holzammer S, Holznagel E, Kaul A, Kurth R, Norley S (2001). "High virus loads in naturally and experimentally SIVagm-infected African green monkeys". Virology. 283 (2): 324–31. doi:10.1006/viro.2001.0870. PMID 11336557.
- ^ Kurth, R.; Norley, S. (1996). "Why don't the natural hosts of SIV develop simian AIDS?". The Journal of NIH Research. 8: 33–37.
- ^ Baier M, Dittmar MT, Cichutek K, Kurth R (1991). "Development of vivo of genetic variability of simian immunodeficiency virus". Proceedings of the National Academy of Sciences of the United States of America. 88 (18): 8126–30. Bibcode:1991PNAS...88.8126B. doi:10.1073/pnas.88.18.8126. PMC 52459. PMID 1896460.
- ^ Daniel MD, King NW, Letvin NL, Hunt RD, Sehgal PK, Desrosiers RC (1984). "A new type D retrovirus isolated from macaques with an immunodeficiency syndrome". Science. 223 (4636): 602–5. Bibcode:1984Sci...223..602D. doi:10.1126/science.6695172. PMID 6695172.
- ^ a b Keele BF, Jones JH, Terio KA, Estes JD, Rudicell RS, Wilson ML, Li Y, Learn GH, Beasley TM, Schumacher-Stankey J, Wroblewski E, Mosser A, Raphael J, Kamenya S, Lonsdorf EV, Travis DA, Mlengeya T, Kinsel MJ, Else JG, Silvestri G, Goodall J, Sharp PM, Shaw GM, Pusey AE, Hahn BH (2009). "Increased mortality and AIDS-like immunopathology in wild chimpanzees infected with SIVcpz". Nature. 460 (7254): 515–519. Bibcode:2009Natur.460..515K. doi:10.1038/nature08200. PMC 2872475. PMID 19626114.
- ^ Schindler M, Münch J, Kutsch O, Li H, Santiago ML, Bibollet-Ruche F, Müller-Trutwin MC, Novembre FJ, Peeters M, Courgnaud V, Bailes E, Roques P, Sodora DL, Silvestri G, Sharp PM, Hahn BH, Kirchhoff F (2006). "Nef-mediated suppression of T cell activation was lost in a lentiviral lineage that gave rise to HIV-1". Cell. 125 (6): 1055–67. doi:10.1016/j.cell.2006.04.033. PMID 16777597. S2CID 15132918.
- ^ Thomson MM, Pérez-Alvarez L, Nájera R (2002). "Molecular epidemiology of HIV-1 genetic forms and its significance for vaccine development and therapy". The Lancet Infectious Diseases. 2 (8): 461–471. doi:10.1016/S1473-3099(02)00343-2. PMID 12150845.
- ^ Carr JK, Foley BT, Leitner T, Salminen M, Korber B, McCutchan F (1998). "Reference sequences representing the principal genetic diversity of HIV-1 in the pandemic" (PDF). In Los Alamos National Laboratory (ed.). HIV sequence compendium. Los Alamos, New Mexico: Los Alamos National Laboratory. pp. 10–19.
- ^ Osmanov S, Pattou C, Walker N, Schwardländer B, Esparza J (2002). "Estimated global distribution and regional spread of HIV-1 genetic subtypes in the year 2000". Journal of Acquired Immune Deficiency Syndromes. 29 (2): 184–190. doi:10.1097/00042560-200202010-00013. PMID 11832690. S2CID 12536801.
- ^ Perrin L, Kaiser L, Yerly S (2003). "Travel and the spread of HIV-1 genetic variants". The Lancet Infectious Diseases. 3 (1): 22–27. doi:10.1016/S1473-3099(03)00484-5. PMID 12505029.
- ^ a b Plantier JC, Leoz M, Dickerson JE, De Oliveira F, Cordonnier F, Lemée V, Damond F, Robertson DL, Simon F (August 2009). "A new human immunodeficiency virus derived from gorillas". Nature Medicine. 15 (8): 871–2. doi:10.1038/nm.2016. PMID 19648927. S2CID 76837833. Lay summary.
{{cite journal}}:Cite는 사용되지 않는 매개 변수를 사용합니다.lay-url=(도움말) - ^ Sharp PM, Hahn BH (August 2010). "The evolution of HIV-1 and the origin of AIDS". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 365 (1552): 2487–94. doi:10.1098/rstb.2010.0031. PMC 2935100. PMID 20643738.
- ^ Keele BF, Van Heuverswyn F, Li Y, Bailes E, Takehisa J, Santiago ML, et al. (July 2006). "Chimpanzee reservoirs of pandemic and nonpandemic HIV-1". Science. 313 (5786): 523–6. Bibcode:2006Sci...313..523K. doi:10.1126/science.1126531. PMC 2442710. PMID 16728595.
- ^ a b c d Kumaranayake L, Watts C (2001). "Resource allocation and priority setting of HIV/AIDS interventions: addressing the generalized epidemic in sub-Saharan Africa". Journal of International Development. 13 (4): 451–466. doi:10.1002/jid.797.
- ^ Kleinman S (September 2004). "Patient information: Blood donation and transfusion". Uptodate. Archived from the original on April 12, 2008.
- ^ a b Centers for Disease Control and Prevention (2001). "Revised guidelines for HIV counseling, testing, and referral". MMWR Recommendations and Reports. 50 (RR–19): 1–57. PMID 11718472.
- ^ Celum CL, Coombs RW, Lafferty W, Inui TS, Louie PH, Gates CA, McCreedy BJ, Egan R, Grove T, Alexander S (1991). "Indeterminate human immunodeficiency virus type 1 western blots: seroconversion risk, specificity of supplemental tests, and an algorithm for evaluation". The Journal of Infectious Diseases. 164 (4): 656–664. doi:10.1093/infdis/164.4.656. PMID 1894929.
- ^ "Country Comparison :: HIV/AIDS - Deaths". The World Factbook, Central Intelligence Agency. Archived from the original on April 30, 2017. Retrieved November 22, 2015.
- ^ Chou R, Selph S, Dana T, Bougatsos C, Zakher B, Blazina I, Korthuis PT (November 2012). "Screening for HIV: systematic review to update the 2005 U.S. Preventive Services Task Force recommendation". Annals of Internal Medicine. 157 (10): 706–18. doi:10.7326/0003-4819-157-10-201211200-00007. PMID 23165662. S2CID 27494096.
- ^ Chou R, Huffman LH, Fu R, Smits AK, Korthuis PT (July 2005). "Screening for HIV: a review of the evidence for the U.S. Preventive Services Task Force". Annals of Internal Medicine. 143 (1): 55–73. doi:10.7326/0003-4819-143-1-200507050-00010. PMID 15998755.
- ^ Tolle MA, Schwarzwald HL (July 2010). "Postexposure prophylaxis against human immunodeficiency virus". American Family Physician. 82 (2): 161–6. PMID 20642270.
- ^ "Quick Reference Guide—Laboratory Testing for the Diagnosis of HIV Infection: Updated Recommendations" (PDF). cdc.gov. New York State Department of Health. June 27, 2014. pp. 1–2. Archived from the original (PDF) on March 2, 2017. Retrieved April 13, 2017.
- ^ "HIV Treatment: FDA-Approved HIV Medicines". AIDSinfo.
- ^ Rodari, Anthony; Darcis, Gilles; Van Lint, Carine M. (September 29, 2021). "The Current Status of Latency Reversing Agents for HIV-1 Remission". Annual Review of Virology. 8 (1): 491–514. doi:10.1146/annurev-virology-091919-103029. ISSN 2327-056X. PMID 34586875.
- ^ Swiss National AIDS Commission (October 15, 2016). "The Swiss statement". HIV i-Base. Retrieved April 2, 2019.
- ^ Vernazza P, Bernard EJ (January 29, 2016). "HIV is not transmitted under fully suppressive therapy: The Swiss Statement--eight years later". Swiss Medical Weekly. 146: w14246. doi:10.4414/smw.2016.14246. PMID 26824882.
- ^ The Lancet HIV (November 2017). "U=U taking off in 2017". Editorial. The Lancet. HIV. 4 (11): e475. doi:10.1016/S2352-3018(17)30183-2. PMID 29096785.
- ^ "Can't Pass It On". Terrence Higgins Trust. 2019. Archived from the original on April 7, 2019. Retrieved April 2, 2019.
- ^ Bavinton BR, Pinto AN, Phanuphak N, Grinsztejn B, Prestage GP, Zablotska-Manos IB, et al. (August 2018). "Viral suppression and HIV transmission in serodiscordant male couples: an international, prospective, observational, cohort study". The Lancet. HIV. 5 (8): e438–e447. doi:10.1016/S2352-3018(18)30132-2. PMID 30025681. S2CID 51702998.
- ^ Rodger AJ, Cambiano V, Bruun T, Vernazza P, Collins S, van Lunzen J, et al. (July 2016). "Sexual Activity Without Condoms and Risk of HIV Transmission in Serodifferent Couples When the HIV-Positive Partner Is Using Suppressive Antiretroviral Therapy". JAMA. 316 (2): 171–81. doi:10.1001/jama.2016.5148. PMID 27404185.
- ^ Rodger, A. (for the PARTNER study group) (July 2018). Risk of HIV transmission through condomless sex in MSM couples with suppressive ART: The PARTNER2 Study extended results in gay men. AIDS2018: 22nd International AIDS Conference. Amsterdam, the Netherlands. Retrieved April 2, 2019.
- ^ a b c Hoffman H (January 10, 2019). "The science is clear: with HIV, undetectable equals untransmittable" (Press release). National Institutes of Health. National Institute of Allergy and Infectious Diseases. Retrieved May 3, 2019.
NIAID Director Anthony S. Fauci, M.D., and colleagues summarize results from large clinical trials and cohort studies validating U=U. The landmark NIH-funded HPTN 052 clinical trial showed that no linked HIV transmissions occurred among HIV serodifferent heterosexual couples when the partner living with HIV had a durably suppressed viral load. Subsequently, the PARTNER and Opposites Attract studies confirmed these findings and extended them to male-male couples. ... The success of U=U as an HIV prevention method depends on achieving and maintaining an undetectable viral load by taking ART daily as prescribed.
- ^ Cohen MS, Chen YQ, McCauley M, Gamble T, Hosseinipour MC, Kumarasamy N, et al. (September 2016). "Antiretroviral Therapy for the Prevention of HIV-1 Transmission". The New England Journal of Medicine. 375 (9): 830–9. doi:10.1056/NEJMoa1600693. PMC 5049503. PMID 27424812.
- ^ Hodson M (November 17, 2017). U=U: Talking to patients about transmission risk (PDF). British HIV Association Autumn Conference 2017. Retrieved May 3, 2019. (NAM/Aidsmap을 대신하여 프레젠테이션을 위한 발췌)
- ^ "합의 성명:성폭력 전송 HIV의 PersonHIV와 사는 것은 대안적으로 찾아낼 수 바이러스 부하를 가진 위험".예방한 캠페인입니다.7월 21일 2016년.Retrieved 4월 2일 2019년.참고:홍보의 성명과 목록 검색되었는지, 월마트는 지난 23일 8월 2018년에 업데이트되고"거의 100개국에서 850개 단체이다."이 포함되어 있었다.
- ^ Boseley S, Devlin H (May 3, 2019). "End to AIDS in sight as huge study finds drugs stop HIV transmission". The Guardian. Retrieved May 3, 2019.
- ^ Zhu J, Hladik F, Woodward A, Klock A, Peng T, Johnston C, et al. (August 2009). "Persistence of HIV-1 receptor-positive cells after HSV-2 reactivation is a potential mechanism for increased HIV-1 acquisition". Nature Medicine. 15 (8): 886–92. doi:10.1038/nm.2006. PMC 2723183. PMID 19648930.
- ^ Looker KJ, Elmes JA, Gottlieb SL, Schiffer JT, Vickerman P, Turner KM, Boily MC (December 2017). "Effect of HSV-2 infection on subsequent HIV acquisition: an updated systematic review and meta-analysis". The Lancet. Infectious Diseases. 17 (12): 1303–1316. doi:10.1016/S1473-3099(17)30405-X. PMC 5700807. PMID 28843576.
- ^ "On this day". News & Record. May 18, 2020. pp. 2A.
- ^ Mandell GL, Bennett JE, Dolin R, eds. (2010). "Chapter 169". Mandell, Douglas, and Bennett's principles and practice of infectious diseases (7th ed.). Philadelphia: Churchill Livingstone/Elsevier. ISBN 978-0-443-06839-3.[페이지 필요]
- ^ Gottlieb MS (2006). "Pneumocystis pneumonia—Los Angeles. 1981". American Journal of Public Health. 96 (6): 980–1, discussion 982–3. doi:10.2105/AJPH.96.6.980. PMC 1470612. PMID 16714472. Archived from the original on April 22, 2009.
- ^ Friedman-Kien AE (October 1981). "Disseminated Kaposi's sarcoma syndrome in young homosexual men". Journal of the American Academy of Dermatology. 5 (4): 468–71. doi:10.1016/S0190-9622(81)80010-2. PMID 7287964.
- ^ Hymes KB, Cheung T, Greene JB, Prose NS, Marcus A, Ballard H, William DC, Laubenstein LJ (September 1981). "Kaposi's sarcoma in homosexual men — a report of eight cases". The Lancet. 2 (8247): 598–600. doi:10.1016/S0140-6736(81)92740-9. PMID 6116083. S2CID 43529542.
- ^ a b Basavapathruni A, Anderson KS (December 2007). "Reverse transcription of the HIV-1 pandemic". The FASEB Journal. 21 (14): 3795–3808. doi:10.1096/fj.07-8697rev. PMID 17639073. S2CID 24960391.
- ^ Lederberg J, ed. (2000). Encyclopedia of Microbiology (2nd ed.). Burlington: Elsevier. p. 106. ISBN 978-0-08-054848-7. Retrieved June 9, 2016.
- ^ Centers for Disease Control (1982). "Persistent, generalized lymphadenopathy among homosexual males". Morbidity and Mortality Weekly Report. 31 (19): 249–251. PMID 6808340.
- ^ a b Barré-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, Dauguet C, Axler-Blin C, Vézinet-Brun F, Rouzioux C, Rozenbaum W, Montagnier L (1983). "Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)". Science. 220 (4599): 868–871. Bibcode:1983Sci...220..868B. doi:10.1126/science.6189183. PMID 6189183. S2CID 390173.
- ^ a b Centers for Disease Control (1982). "Opportunistic infections and Kaposi's sarcoma among Haitians in the United States". Morbidity and Mortality Weekly Report. 31 (26): 353–354, 360–361. PMID 6811853.
- ^ Altman LK (May 11, 1982). "New homosexual disorder worries health officials". The New York Times. Retrieved August 31, 2011.
- ^ Gilman SL (1987). GilmanSL (ed.). "AIDS and Syphilis: The Iconography of Disease". October. 43: 87–107. doi:10.2307/3397566. JSTOR 3397566.
- ^ "Making Headway Under Hellacious Circumstances" (PDF). American Association for the Advancement of Science. July 28, 2006. Archived from the original (PDF) on June 24, 2008. Retrieved June 23, 2008.
- ^ Kher U (July 27, 1982). "A Name for the Plague". Time. Archived from the original on March 7, 2008. Retrieved March 10, 2008.
- ^ Centers for Disease Control (1982). "Update on acquired immune deficiency syndrome (AIDS)—United States". Morbidity and Mortality Weekly Report. 31 (37): 507–508, 513–514. PMID 6815471.
- ^ Gallo RC, Sarin PS, Gelmann EP, Robert-Guroff M, Richardson E, Kalyanaraman VS, Mann D, Sidhu GD, Stahl RE, Zolla-Pazner S, Leibowitch J, Popovic M (1983). "Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome (AIDS)". Science. 220 (4599): 865–867. Bibcode:1983Sci...220..865G. doi:10.1126/science.6601823. PMID 6601823.
- ^ "The 2008 Nobel Prize in Physiology or Medicine - Press Release". www.nobelprize.org. Retrieved January 28, 2018.
- ^ Crewdson J (May 30, 1991). "GALLO ADMITS FRENCH DISCOVERED AIDS VIRUS". Chicago Tribune. Retrieved April 25, 2020.
- ^ Aldrich R, Wotherspoon G, eds. (2001). Who's who in gay and lesbian history. London: Routledge. p. 154. ISBN 978-0-415-22974-6.
- ^ Levy JA; et al. (1984). "Isolation of lymphocytopathic retroviruses from San Francisco patients with AIDS". Science. 225 (4664): 840–842. Bibcode:1984Sci...225..840L. doi:10.1126/science.6206563. PMID 6206563.
- ^ Levy JA, Kaminsky LS, Morrow WJ, Steimer K, Luciw P, Dina D, Hoxie J, Oshiro L (1985). "Infection by the retrovirus associated with the acquired immunodeficiency syndrome". Annals of Internal Medicine. 103 (5): 694–699. doi:10.7326/0003-4819-103-5-694. PMID 2996401.
- ^ Sharp PM, Hahn BH (2011). "Origins of HIV and the AIDS Pandemic". Cold Spring Harbor Perspectives in Medicine. 1 (1): a006841. doi:10.1101/cshperspect.a006841. PMC 3234451. PMID 22229120.
- ^ Faria NR, Rambaut A, Suchard MA, Baele G, Bedford T, Ward MJ, Tatem AJ, Sousa JD, Arinaminpathy N, Pépin J, Posada D, Peeters M, Pybus OG, Lemey P (2014). "The early spread and epidemic ignition of HIV-1 in human populations". Science. 346 (6205): 56–61. Bibcode:2014Sci...346...56F. doi:10.1126/science.1256739. PMC 4254776. PMID 25278604.
- ^ Gao F, Bailes E, Robertson DL, Chen Y, Rodenburg CM, Michael SF, Cummins LB, Arthur LO, Peeters M, Shaw GM, Sharp PM, Hahn BH (1999). "Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes". Nature. 397 (6718): 436–41. Bibcode:1999Natur.397..436G. doi:10.1038/17130. PMID 9989410. S2CID 4432185.
- ^ Keele BF, Van Heuverswyn F, Li Y, Bailes E, Takehisa J, Santiago ML, Bibollet-Ruche F, Chen Y, Wain LV, Liegeois F, Loul S, Ngole EM, Bienvenue Y, Delaporte E, Brookfield JF, Sharp PM, Shaw GM, Peeters M, Hahn BH (2006). "Chimpanzee reservoirs of pandemic and nonpandemic HIV-1". Science. 313 (5786): 523–6. Bibcode:2006Sci...313..523K. doi:10.1126/science.1126531. PMC 2442710. PMID 16728595.
- ^ Goodier JL, Kazazian HH (2008). "Retrotransposons revisited: the restraint and rehabilitation of parasites". Cell. 135 (1): 23–35. doi:10.1016/j.cell.2008.09.022. PMID 18854152. S2CID 3093360.
- ^ Sharp PM, Bailes E, Chaudhuri RR, Rodenburg CM, Santiago MO, Hahn BH (2001). "The origins of acquired immune deficiency syndrome viruses: where and when?". Philosophical Transactions of the Royal Society B. 356 (1410): 867–76. doi:10.1098/rstb.2001.0863. PMC 1088480. PMID 11405934.
- ^ Kalish ML, Wolfe ND, Ndongmo CB, McNicholl J, Robbins KE, Aidoo M, Fonjungo PN, Alemnji G, Zeh C, Djoko CF, Mpoudi-Ngole E, Burke DS, Folks TM (2005). "Central African hunters exposed to simian immunodeficiency virus". Emerging Infectious Diseases. 11 (12): 1928–30. doi:10.3201/eid1112.050394. PMC 3367631. PMID 16485481.
- ^ a b Marx PA, Alcabes PG, Drucker E (2001). "Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa". Philosophical Transactions of the Royal Society B. 356 (1410): 911–20. doi:10.1098/rstb.2001.0867. PMC 1088484. PMID 11405938.
- ^ Worobey M, Gemmel M, Teuwen DE, Haselkorn T, Kunstman K, Bunce M, Muyembe JJ, Kabongo JM, Kalengayi RM, Van Marck E, Gilbert MT, Wolinsky SM (2008). "Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960". Nature. 455 (7213): 661–4. Bibcode:2008Natur.455..661W. doi:10.1038/nature07390. PMC 3682493. PMID 18833279.
- ^ a b de Sousa JD, Müller V, Lemey P, Vandamme AM (2010). Martin DP (ed.). "High GUD incidence in the early 20th century created a particularly permissive time window for the origin and initial spread of epidemic HIV strains". PLOS ONE. 5 (4): e9936. Bibcode:2010PLoSO...5.9936S. doi:10.1371/journal.pone.0009936. PMC 2848574. PMID 20376191.
- ^ Zhu T, Korber BT, Nahmias AJ, Hooper E, Sharp PM, Ho DD (1998). "An African HIV-1 Sequence from 1959 and Implications for the Origin of the epidemic". Nature. 391 (6667): 594–7. Bibcode:1998Natur.391..594Z. doi:10.1038/35400. PMID 9468138. S2CID 4416837.
- ^ Kolata G (October 28, 1987). "Boy's 1969 death suggests AIDS invaded U.S. several times". The New York Times. Retrieved February 11, 2009.
- ^ Chitnis A, Rawls D, Moore J (January 2000). "Origin of HIV type 1 in colonial French Equatorial Africa?". AIDS Research and Human Retroviruses. 16 (1): 5–8. doi:10.1089/088922200309548. PMID 10628811. S2CID 17783758.
- ^ Donald McNeil, Jr. (September 16, 2010). "Precursor to H.I.V. was in monkeys for millennia". The New York Times. Archived from the original on January 3, 2022. Retrieved September 17, 2010.
Dr. Marx believes that the crucial event was the introduction into Africa of millions of inexpensive, mass-produced syringes in the 1950s. ... suspect that the growth of colonial cities is to blame. Before 1910, no Central African town had more than 10,000 people. But urban migration rose, increasing sexual contacts and leading to red-light districts.
- ^ a b Wertheim JO, Worobey M (May 2009). "Dating the age of the SIV lineages that gave rise to HIV-1 and HIV-2". PLOS Computational Biology. 5 (5): e1000377. Bibcode:2009PLSCB...5E0377W. doi:10.1371/journal.pcbi.1000377. PMC 2669881. PMID 19412344.
추가 정보
- Berlier W, Bourlet T, Lawrence P, Hamzeh H, Lambert C, Genin C, Verrier B, Dieu-Nosjean MC, Pozzetto B, Delézay O (2005). "Selective sequestration of X4 isolates by human genital epithelial cells: Implication for virus tropism selection process during sexual transmission of HIV". Journal of Medical Virology. 77 (4): 465–74. doi:10.1002/jmv.20478. PMID 16254974. S2CID 25762969.
- Joint United Nations Programme on HIV/AIDS (UNAIDS) (2011). Global HIV/AIDS Response, Epidemic update and health sector progress towards universal access (PDF). Joint United Nations Programme on HIV/AIDS.
- Muciaccia B, Padula F, Vicini E, Gandini L, Lenzi A, Stefanini M (2005). "Beta-chemokine receptors 5 and 3 are expressed on the head region of human spermatozoon". The FASEB Journal. 19 (14): 2048–50. doi:10.1096/fj.05-3962fje. PMID 16174786. S2CID 7928126.