호사육종바이러스
Rous sarcoma virus| 호사육종바이러스 | |
|---|---|
| 바이러스 분류 | |
| (랭킹되지 않음): | 바이러스 |
| 영역: | 리보비리아 |
| 킹덤: | 파라나비레아과 |
| 망울: | 아르트베르비리코타 |
| 클래스: | 레브트라비리케테스 |
| 순서: | 오르테르비르목 |
| 패밀리: | 레트로바이러스과 |
| 속: | 알파레트로바이러스 |
| 종: | 호사육종바이러스 |
호사육종바이러스(RSV) (/raws/)는 레트로바이러스로서, 최초로 기술된 온코바이러스다. 그것은 닭에게 육종을 유발한다.
모든 레트로바이러스와 마찬가지로 숙주 DNA에 통합되기 전에 RNA 게놈을 cDNA로 역전송한다.
역사
RSV는 1911년 뉴욕 록펠러 대학에서 일하는 페이튼 루스에 의해 건강한 플리머스 록 닭에 닭 종양의 세포 프리 추출물을 주입함으로써 발견되었다. 그 추출물은 산란을 유발하는 것으로 밝혀졌다. 종양은 결합조직(육종)으로 구성된 것으로 밝혀졌다.[1][2] 따라서, RSV는 분자적으로 암의 발달을 연구하는데 사용될 수 있는 최초의 인공적인 레트로바이러스로 알려지게 되었다.[3]
1958년, 해리 루빈과 하워드 테민은 RSV 감염에 의해 닭 배아 섬유화합물이 형태적으로 변형될 수 있는 검사를 개발했다. 2년 후 테민은 세포의 변형된 형태학이 RSV의 유전적 특성에 의해 통제된다는 결론을 내렸다. 당시에는 알 수 없었으나 나중에 src 유전자가 건강한 세포의 형태변환에 책임이 있는 것으로 확인되었다. 1960년대 동안, 복제 경쟁적 격리된 바이러스는 RSV와 관련되었지만 비변환적이었고, 격리된 복제 결함적 RSV 변종은 변환 경쟁적이었다. 이 두 가지 발견은 바이러스 복제와 악성 변환은 RSV에서 별개의 과정이라는 개념을 낳았다.[4]
루스는 1966년 발견의 의의로 노벨 생리의학상을 받았다.[5] 그 후, 엡스타인-바르 바이러스와 같은 다른 인공적인 인간 바이러스가 발견되었다. 게다가, 온코겐은 처음에 역바이러스와 세포에서 발견되었다.[3]
구조와 게놈
| 레트로바이러스 3'UTR 안정성 요소 | |
|---|---|
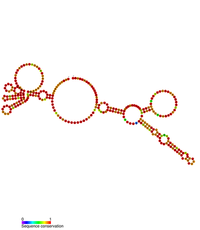 호사육종 바이러스 레트로바이러스 3'의 예측 이차구조UTR 안정성 요소 | |
| 식별자 | |
| Rfam | RF01417 |
| 기타자료 | |
| RNA형 | 시스 지역 |
| PDB 구조 | PDBe |
RSV는 DNA 중간을 가진 양성 감각 RNA 게놈을 가진 6급 감춰진 바이러스다.
RSV에는 네 가지 유전자가 있다.
- 개그 – 캡시드 단백질 인코딩
- 폴 – 역성분해효소 인코딩
- Envi – 봉투 유전자를 부호화하다
- src – 숙주 세포 단백질의 아미노산 타이로신에 인산염 그룹을 부착하는 타이로신 키나아제를 인코딩한다.
RSV 게놈은 숙주 게놈으로의 통합을 가능하게 하고 RSV 유전자의 과도한 억제를 가능하게 하는 단자 반복을 가지고 있다.
Src유전자
src 유전자는 비정상적인 숙주세포에서 통제되지 않는 성장을 유발하기 때문에 인공적인 것이다. 그것은 처음으로 발견된 역바이러스성 종양종이었다.[6] 후천 유전자로, 종간 보존 수준이 높은 동물 왕국 전체에 존재하는 것으로 밝혀졌다.
src 유전자는 RSV에 의해 채택되어 숙주세포의 조절되지 않은 유사분열을 자극할 수 있다는 장점을 가지고 그것을 부여한 게놈에 통합되어 신선한 감염을 위한 풍부한 세포를 제공한다.[citation needed]
src 유전자는 RSV 증식에 필수적이지는 않지만 존재했을 때 독성을 크게 증가시킨다.[citation needed]
src는 세포 성장과 분화 규제에 관여하는 티로신 키나아제다. 활성화와 비활성화를 담당하는 SH2와 SH3 도메인을 가지고 있다.[4]
RNA 이차 구조
RSV의 RNA 게놈은 길이가 5~7kb에 이르는 매우 긴 3' UTR을 포함하며, 이는 보통 진핵 숙주세포 내의 난센스 매개 붕괴(NMD)로 유도한다. 보존된 2차 구조 요소는 3'의 범위 내에서 확인되었다.UTR이며 호사육종 바이러스 안정 요소(RSE)로 알려져 있다.[7] 이 원소는 미채취 바이러스 RNA의 열화를 방지하는 것으로 나타났다.[7]
RSE 요소는 호사육종 바이러스의 게놈에서 처음 확인되었지만 조류 레트로바이러스 계열에 걸쳐 광범위하게 보존되어 있는 것으로 보인다. RSE 요소는 길이가 약 300bp이며 개그 자연 변환 종료 코돈의 하류에 위치한다. RSE 요소의 이차 구조는 RNAVse 소화와 SHAPE 화학 분석에 의해 결정되었다.[8]
RSV에서 확인된 다른 요소에는 프라이머 결합 부위가 포함된다.[9]
개그단백질
개그 단백질은 숙주세포의 바이러스 감염과 처녀자리 조립에 필요하다. RSV용 개그 단백질(Pr76)은 701개의 아미노산을 함유하고 있다. 바이러스로 암호화된 프로테아제로 분해되어 전염성 바이러스에서 발견된 제품을 방출한다. 이 분해된 제품들은 새로운 세포를 감염시키기 위한 다른 경로로 들어갈 수 있는 매트릭스(MA), 캡시드(CA), 뉴클레오캡시드(NC)를 포함한다.[10][11]
RSV 봉투
RSV는 하나의 당단백질을 가진 봉투가 있다: Env. Env는 gp85와 gp37로 구성되어 있는데, 이들은 과두부로 조립되는 당단백질이다. env의 기능은 숙주세포 수용체에 RSV를 결합하고 pH 독립 방식으로 대상 세포와의 융합을 유도하는 것이다. 그 봉투는 난포증일 때 획득된다. 바이러스가 싹을 틔우거나 플라즈마 막을 밀어내 숙주 세포에서 새로운 외부 막으로 세포를 떠날 수 있게 한다.[10][12]
복제 주기
셀 입력
바이러스가 숙주세포에 침투할 수 있는 방법은 두 가지가 있는데, 세포수용체 내세포 분열과 융합이다. 내분포증은 바이러스가 대상 세포막에 수용체를 묶고, 바이러스를 세포 안으로 혹은 세포로 내분하는 과정이다. 내분포증은 pH 독립적이거나 pH 의존적일 수 있다. 핵융합은 바이러스가 대상 세포막과 함께 융합되어 그 게놈을 세포에 방출할 때 일어난다. RSV는 숙주세포막의 융합을 통해 숙주세포로 들어간다.[13]
전사
RSV 게놈 전사가 일어나려면 프라이머가 필요하다. 4S RNA는 RSV의 프라이머로 70S RNA는 DNA 합성을 위한 템플릿 역할을 한다. RNA 의존성 DNA 중합효소인 역분해효소는 바이러스성 RNA를 전체 길이의 DNA 보충물로 변환한다.[14]
참조
- ^ Rous P (September 1910). "A Transmissible Avian Neoplasm (Sarcoma of the Common Fowl)". J. Exp. Med. 12 (5): 696–705. doi:10.1084/jem.12.5.696. PMC 2124810. PMID 19867354.
- ^ Rous P (April 1911). "A Sarcoma of the Fowl Transmissible by an Agent Separable from the Tumor Cells". J. Exp. Med. 13 (4): 397–411. doi:10.1084/jem.13.4.397. PMC 2124874. PMID 19867421.
- ^ a b Weiss RA, Vogt PK (November 2011). "100 years of Rous sarcoma virus". J. Exp. Med. 208 (12): 2351–5. doi:10.1084/jem.20112160. PMC 3256973. PMID 22110182.
- ^ a b Martin GS (June 2001). "The hunting of the Src". Nat. Rev. Mol. Cell Biol. 2 (6): 467–75. doi:10.1038/35073094. PMID 11389470. S2CID 205016442.
- ^ Nobelprize.org 노벨 생리의학상 1966: Peyton Rous, 2012년 7월 1일
- ^ Vogt PK (September 2012). "Retroviral oncogenes: a historical primer". Nat. Rev. Cancer. 12 (9): 639–48. doi:10.1038/nrc3320. PMC 3428493. PMID 22898541.
- ^ a b Weil JE, Beemon KL (January 2006). "A 3' UTR sequence stabilizes termination codons in the unspliced RNA of Rous sarcoma virus". RNA. 12 (1): 102–10. doi:10.1261/rna.2129806. PMC 1370890. PMID 16301601.
- ^ Weil JE, Hadjithomas M, Beemon KL (March 2009). "Structural characterization of the Rous sarcoma virus RNA stability element". J. Virol. 83 (5): 2119–29. doi:10.1128/JVI.02113-08. PMC 2643715. PMID 19091866.
- ^ Johnson M, Morris S, Chen A, Stavnezer E, Leis J (2004). "Selection of functional mutations in the U5-IR stem and loop regions of the Rous sarcoma virus genome". BMC Biol. 2: 8. doi:10.1186/1741-7007-2-8. PMC 428589. PMID 15153244.
- ^ a b Wills JW, Cameron CE, Wilson CB, Xiang Y, Bennett RP, Leis J (October 1994). "An assembly domain of the Rous sarcoma virus Gag protein required late in budding". J. Virol. 68 (10): 6605–18. doi:10.1128/JVI.68.10.6605-6618.1994. PMC 237081. PMID 8083996.
- ^ Nadaraia-Hoke S, Bann DV, Lochmann TL, Gudleski-O'Regan N, Parent LJ (March 2013). "Alterations in the MA and NC domains modulate phosphoinositide-dependent plasma membrane localization of the Rous sarcoma virus Gag protein". J. Virol. 87 (6): 3609–15. doi:10.1128/JVI.03059-12. PMC 3592118. PMID 23325682.
- ^ Einfeld D, Hunter E (November 1988). "Oligomeric structure of a prototype retrovirus glycoprotein". Proc. Natl. Acad. Sci. U.S.A. 85 (22): 8688–92. Bibcode:1988PNAS...85.8688E. doi:10.1073/pnas.85.22.8688. PMC 282525. PMID 2847170.
- ^ Gilbert JM, Mason D, White JM (October 1990). "Fusion of Rous sarcoma virus with host cells does not require exposure to low pH". J. Virol. 64 (10): 5106–13. doi:10.1128/JVI.64.10.5106-5113.1990. PMC 248002. PMID 2168989.
- ^ Dahlberg JE, Sawyer RC, Taylor JM, Faras AJ, Levinson WE, Goodman HM, Bishop JM (May 1974). "Transcription of DNA from the 70S RNA of Rous sarcoma virus. I. Identification of a specific 4S RNA which serves as primer". J. Virol. 13 (5): 1126–33. doi:10.1128/JVI.13.5.1126-1133.1974. PMC 355423. PMID 4132919.
외부 링크
- 호사육종 바이러스(RSV) rcn.com[데드링크]
- 분자표현 magnet.fsu.edu[데드링크]
- 미국 국립 의학 도서관의 호스+사르코마+바이러스(MeSH(MesH)
- 레트로바이러스 3'에 대한 Rfam 입력UTR 안정성 요소


