비대칭세포분할
Asymmetric cell division비대칭 세포분할은 세포의 운명이 다른 두 개의 딸 세포를 생산한다.이것은 동등한 운명의 딸 세포를 낳는 대칭 세포 분열과는 대조적이다.특히, 줄기세포는 비대칭적으로 분열되어 두 개의 뚜렷한 딸세포를 낳는데, 그것은 원래 줄기세포의 사본과 비줄기세포의 운명으로 분화되도록 프로그램된 둘째 딸이다.(성장이나 재생의 시기에는 줄기세포도 대칭적으로 분할하여 원래의 세포와 동일한 두 개의 복제본을 만들 수 있다.)[1]
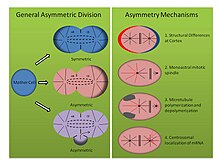
원칙적으로는, 분단 세포의 딸들에게 구별되는 성질을 부여할 수 있는 두 가지 메커니즘이 있다.1에서, 딸 세포는 처음에는 동등하지만, 세포들 사이, 주변 세포들 또는 전구 세포로부터 신호를 보내 차이를 유도한다.이 메커니즘은 외측 비대칭 세포분열로 알려져 있다.두 번째 메커니즘에서, 모세포의 분열 시기에 예비 딸세포는 본질적으로 다르다.이 후자의 메커니즘은 서로 또는 그들의 환경과의 세포의 상호작용에 의존하지 않기 때문에, 본질적인 비대칭성에 의존해야 한다.비대칭 세포분할이라는 용어는 일반적으로 그러한 내재된 비대칭 분열을 가리킨다.[2]
내적 비대칭성
비대칭 분열이 일어나기 위해서는 모세포가 양극화되어야 하며, 유사분열 스핀들은 극성의 축과 정렬되어야 한다.이 사건들의 세포 생물학은 세 가지 동물 모델에서 가장 많이 연구되었다: 쥐, 새꼬마선충, 그리고 초파리 드로필라 멜라노가스터.나중에 나선형 개발에 초점을 맞추었다.
C. 에글레건 개발에서
C. 엘레간에서는 초기 배아에서 일련의 비대칭 세포 분열은 신체 계획의 전/후배, 등/후배, 좌/우 축을 설정하는 데 매우 중요하다.[3]수정 후, 제1차 비대칭 세포분열을 허용하는 사건이 이미 지고테에서 일어나고 있다.이 1차분할은 AB와 P1이라고 불리는 뚜렷하게 다른 두 개의 폭발물을 생산한다.정자세포가 난자를 수정하면 난자 안에 정자와 센트로솜이 침전되어 세포질 유속이 일어나 프로뉴클레오스와 센트로솜이 하나의 극을 향해 움직이게 된다.[4]정자가 퇴적한 센트로솜은 지고테 내 후극의 성립을 담당한다.[5]돌연변이나 부재중인 정자는 후극의 성립에 실패한다.[6][7][8]이 극성의 확립은 발달 중 세포 극성을 확립하는 데 기능하는 보존 단백질 그룹인 PARD 단백질(파티션 불량)이라는 지고테에 존재하는 단백질 그룹의 편극 분배를 개시한다.[9]이 단백질들은 처음에는 지고테 전체에 균일하게 분포되었다가 후극의 생성과 함께 극성이 된다.이 일련의 사건들은 단일 셀이 있는 zygote가 여러 인자의 불평등한 분포를 통해 극성을 얻을 수 있게 한다.
단일 셀은 현재 비대칭 세포분열을 거치도록 설정되어 있지만, 분열이 일어나는 방향도 중요한 요소다.체세포 스핀들은 적절한 세포 운명 결정요소가 딸세포에 적절하게 분포되도록 올바른 방향을 정해야 한다.스핀들 정렬은 PARD 단백질에 의해 매개되며, PARD 단백질은 A/P 축을 따라 센트로놈의 위치뿐만 아니라 A/P 축을 따라 미토틱 스핀들의 이동을 조절한다.[10]이 1차 비대칭분할에 이어 AB딸세포가 대칭적으로 분할되어 ABA와 ABp가 발생하며 P1딸세포는 또 다른 비대칭분할을 거쳐 P2와 EMS를 생산한다.이 분열은 또한 PAR 단백질의 분포에 의존한다.[11]
드로소필라 신경 발달에 있어

드로필라 멜라노가스터에서는 비대칭 세포분열이 신경발달에 중요한 역할을 한다.신경블라스트는 또 다른 신경블라스트와 갱년기 모세포(GMC)를 발생시키기 위해 비대칭적으로 분열하는 생식기 세포다.신경블라스트는 이 비대칭적인 세포분열을 반복하는 반면 GMC는 한 쌍의 뉴런을 계속 생산한다.두 개의 단백질은 신경병인 프로스페로와 저음의 비대칭성을 설정하는데 중요한 역할을 한다.이 단백질들은 둘 다 신경블라스트에서 합성되어 분열중에 오직 GMC로 분리된다.[12]저림이란 노치의 억제기로서, 따라서 저음의 비대칭적인 분리는 노치 신호에 대한 딸 세포의 반응을 편향시켜 두 개의 뚜렷한 세포 운명을 낳는다.[13]프로스페로는 GMC의 유전자 조절에 필요하다.신경블라스틱 세포질 전체에 균등하게 분포하지만 신경블라스틱이 유사분열을 겪기 시작하면 기저피질에서 국부화된다.일단 GMC가 기저 피질에서 싹이 트면 프로스페로는 GMC 핵으로 번역되어 전사 인자의 역할을 하게 된다.[12]
신경블라스트에 존재하는 다른 단백질은 저브와 프로스페로의 비대칭 국산화 작용을 중재한다.미란다는 프로스페로와 결합하여 기저피질에 보관하는 정박 단백질이다.미란다는 GMC의 세대에 이어 프로스페로를 방출하고 나서 퇴화한다.[12][14]저음의 분리는 폰(저음의 단백질 파트너)에 의해 매개된다.폰은 저림과 결합하고 신경세포 분열 동안 그것과 함께 콜로칼라화한다.[12]
또한 유사분포 세포 운명 결정요인에 평행하게 정렬하여 다른 세포가 아닌 하나의 딸세포로 분리되도록 해야 한다.미토틱 스핀들 방향은 신경블라스트의 무피질 피질에 분리되어 있는 인프레듀티블에 의해 매개된다.내접성이 없으면 서로 관계된 유사성 스핀들과 세포 운명의 결정요인의 위치가 무작위로 결정된다.내접할 수 있는 돌연변이는 피질에서 미란다와 저음의 균일한 분포를 보이고, 그 결과 딸 세포는 동일한 뉴런 운명을 나타낸다.[12]
스파이럴 개발로
스피랄리아(일반적으로 로포트로초아와 동의어)는 오늘날 존재하는 다변측정학 동물의 대부분을 종으로 하는 다양한 동물군을 나타낸다.예를 들면 연체동물, 아넬리드 웜, 엔토프로cta 등이 있다.비록 많은 것이 다른 양자의 성단(에키소조아 및 중수체)에 대해 세포와 분자 수준에서 알려져 있지만, 포유류의 발전을 지배하는 과정에 대한 연구는 상대적으로 부족하다.그러나 나선형 사이에 공유되는 한 가지 통일적 특징은 나선형 갈라짐이라고 알려진 초기 배아의 갈라짐 패턴이다.[15]
비대칭 분할 메커니즘(그림, 오른쪽 패널 참조):
- Tubifex tubifex:슬러지 웜 투비펙스 튜비펙스는 첫 배아 갈라짐 지점에서 흥미로운 비대칭 세포 분열을 입증하는 것으로 나타났다.선충 배아에서 스핀들 비대칭성을 결정하는 지혈막의 피질적 차이라는 고전적 발상과 달리, 관골의 첫 번째 갈라짐은 센트로솜의 수에 의존한다.[16]배아는 잠재적인 더 큰 CD 세포 세포질에 국소화되고 아나파제 동안 방사상 미세관절을 방출하여 피질 아스테르뿐만 아니라 유사성 스핀들에 모두 기여한다.그러나 미래형 AB세포의 미세관 조직 중심은 피질 결합형 아스터가 아닌 유사체 스핀들에 맡기는 미세관만 방출한다.배아가 압축되거나 변형될 때 비대칭 스핀들이 여전히 형성되고 감마 튜불린에 대한 얼룩은 제2 미세관 조직 센터에 센트로솜의 분자 서명이 결여되어 있음을 드러낸다.더욱이, 중심 수를 두 배로 늘렸을 때, 튜브섹스 배아는 대칭적으로 갈라지게 되는데, 비대칭 세포 분할의 이 일원성 메커니즘은 중심성에 의존한다는 것을 시사한다.[16]
- 헬로벨라 로부스타:거머리 헬로벨라 로부스타는 제1 배아분열에서 C. 엘레강스, 튜비펙스와 유사한 비대칭을 보이지만, 변형된 메커니즘에 의존한다.로부스타 배아에 대한 압축 실험은 비대칭 분할에 영향을 주지 않으며, 튜브펙스와 같은 메커니즘이 피질 독립 분자 경로를 사용한다는 것을 시사한다.로부스타에서 항체 얼룩은 은유효소가 있을 때까지 유사성 스핀들이 대칭적으로 형성되고 두 개의 생물학적 중심체에서 유래한다는 것을 보여준다.[17]은유효소가 시작될 때, 비대칭성은 피질적 아스터가 길어지는 반면, 미래의 더 작은 AB 셀의 아스터는 하향 조절되면서 명백해진다.노코다졸과 택솔을 이용한 실험은 이러한 관찰을 뒷받침한다.미세관을 안정화시킨 택솔은 적당한 농도로 사용했을 때 상당수의 배아가 대칭적으로 갈라지도록 했다.게다가, 누코다졸로 처리된 배아는 튜불린 조광기를 분리하고 미세관 고하를 촉진하는 것으로, 유사하게 상당수의 배아에서 대칭 분열을 강요한다.이러한 농도에서 두 약물을 사용한 치료는 정상적인 중추역학을 방해하지 못하며, 미세관 중합과 고층화의 균형은 유사 개발에서 비대칭 세포분열을 확립하기 위한 또 다른 메커니즘을 나타낸다는 것을 시사한다.[17]
- 일리야나사 오브셀레타:세 번째 덜 전통적인 메커니즘이 연체동물에서 발견되었는데, 이것은 비정상적인 세포 분열에 기여하는 나선형 발달에 있어서 비대칭적인 세포 분열에 기여하고 있다.현장에서 잡종화와 면역유동성 실험은 mRNA 대본이 초기 갈라짐 동안 센트로솜과 공동 국부화한다는 것을 보여준다.[18]결과적으로, 이러한 성적 증명서는 별개의 세포에 정형화된 방식으로 유전된다.뒤따르는 모든 mRNA 대본은 차체 축 패터닝에 관여했으며, 다른 기능과 연관된 대본의 혼합화는 그러한 현지화를 보여주지 못한다.더욱이 노코다졸에 의한 미세관 중합과 시토찰리신 B에 의한 액틴 중합의 붕괴는 이러한 비대칭에도 시토스켈레톤이 중요하다는 것을 보여준다.마이크로튜브는 mRNA를 센트로솜에 모집해야 하고, 액틴은 센트로솜을 피질에 부착해야 하는 것으로 보인다.마지막으로 사이토키네시스를 억제하여 하나의 세포에 여러 개의 센트로솜을 도입하는 것은 mRNA가 각 센트로놈 구성 사이의 내적 차이를 제시하면서 정확한 센트로놈에 의존적으로 국소화한다는 것을 보여준다.이러한 결과는 처음 두 눈금 후에 수행된 실험을 반영하지만, 여전히 분열 세포에서 비대칭성을 확립하는 다른 분자 방법을 증명한다는 점에 유의해야 한다.[18]
줄기세포 및 시조에서
동물들은 수많은 구별되는 세포 유형으로 이루어져 있다.발달하는 동안, 지고테는 배아줄기세포를 포함한 다양한 종류의 세포들을 발생시키는 많은 세포 분열을 겪는다.이러한 배아세포의 비대칭 분열은 동일한 효력(자체 재생)의 한 세포와 동일한 효력(자체 재생)의 또 다른 세포를 발생시켜 뉴런과 같은 전문화된 세포 유형으로 더욱 분화시킬 수 있는 또 다른 세포를 만들어 낸다.이렇게 자극된 분화는 두 가지 광범위한 범주로 나눌 수 있는 많은 요소에서 발생한다: 내인성 및 외인성.내적 요인은 일반적으로 각 딸 세포에 분포하는 서로 다른 양의 세포 운명의 결정요인을 포함한다.외인 요인은 주변 세포와의 상호작용과 전구세포의 미시적 및 거시적 환경을 포함한다.[19]
앞서 언급한 드로소필라 뉴런의 예 외에도, 드로소필라의 매크로센서리 기관, 특히 활엽세포는 노치 신호 경로 및 전사 인자의 규제에 의해 단일 조제세포로부터 유사한 비대칭 분할의 집합에서 발생한다고 제안되었다.[20]외인적 요인이 이러한 현상을 어떻게 초래하는지를 보여주는 예로는 딸 세포 중 하나가 원래 줄기세포 틈새에서 물리적으로 변위하여 그것을 연드로이틴 황산염과 같은 신호 분자에 노출시키는 것이다.[21]이런 식으로 딸세포는 황화도가 높은 분자와 상호작용할 수밖에 없는데, 이것은 딸세포를 자극하여 분화시키는 반면 다른 딸세포는 대기상태에서 원래의 틈새에 머물러 있다.
질병에서의 역할
정상적인 줄기 세포와 생식기 세포에서 비대칭 세포분열은 세포 주기 출구 및 분화와 함께 증식과 자기 재생의 균형을 맞춘다.비대칭 세포분열의 붕괴는 비정상적인 자기갱생을 초래하고 분화를 저해하며, 따라서 줄기 세포와 생식기 세포의 종양 유발 변환의 초기 단계를 구성할 수 있다.정상적인 비투모 줄기세포에서는 Bmi-1, Wnt, Natch와 같이 플뤼리포텐시(plurlipotency)를 담당하는 많은 유전자가 설명되어 왔다.이러한 유전자들은 암 줄기세포의 경우에도 발견되었으며, 그들의 이상 발현이 종양 세포 질량 형성에 필수적이라는 것을 보여준다.[22]예를 들어, 위장암은 비대칭적으로 분열이 가능한 희귀 암 줄기세포의 아군을 포함하고 있는 것으로 나타났다.이들 세포의 비대칭 분할은 암 틈새(마이크로 환경)와 Wnt 경로에 의해 조절된다.IWP2(WNT 길항제) 또는 siRNA-TCF4로 Wnt 경로를 차단하면 비대칭 셀 분할의 높은 억제가 초래되었다.[23]
종양 성장에 관여하는 비대칭 세포분열에서 또 다른 돌연변이는 기능상실 돌연변이다.비대칭 세포분열의 상실이 종양에 관여할 수 있다는 첫 번째 제안은 드로소필라 연구로부터 나왔다.lgl, aura, 폴로, 무감각, brat 등 비대칭 세포분열 핵심 규제기관의 기능상실 돌연변이에 대한 연구결과에 따르면 고프로필리프(hyperproflife) 표현형태를 현장에서 발견했다.이 돌연변이들에서 세포는 더 대칭적으로 분열되고 잘못 지정된 유전자를 생성하는데, 세포 주기에서 벗어나 분화하지 못하고 오히려 계속적으로 증식하여 종양 세포 질량을 형성한다.[24]
참조
- ^ Morrison, S. J.; Kimble, J. (2006). "Asymmetric and symmetric stem-cell divisions in development and cancer" (PDF). Nature. 441 (7097): 1068–74. doi:10.1038/nature04956. hdl:2027.42/62868. PMID 16810241.
- ^ Hawkins, Nancy; Garriga, Gian (1998). "Asymmetric cell division: from A to Z". Genes Dev. 12 (23): 3625–38. doi:10.1101/gad.12.23.3625. PMID 9851969.
- ^ 괴크지, P, 로즈, L.S. 비대칭 세포 분열 및 배아에서의 축 형성(2005년 10월 15일), 웜북, 에드.C. 엘레건 연구 공동체, 웜북, doi/10.1895/wormbook.1.30.1, [1]
- ^ 골드스타인, B, 히르드, SN. "새너하브디트 선충의 안테로포스테리어 축 지정"개발 1996. 122:1467–74.
- ^ Cowan, C; Hyman, A (2004). "Centrosomes direct cell polarity independently of microtubule assembly in C. elegans embryos". Nature. 431 (7004): 92–96. doi:10.1038/nature02825. PMID 15343338.
- ^ O'; Connell, K. Maxwell; White, J. (2000). "The spd-2 gene is required for polarization of the anteroposterior axis and formation of the sperm asters in the Caenorhabditis elegans zygote". Developmental Biology. 222 (1): 55–70. doi:10.1006/dbio.2000.9714. PMID 10885746.
- ^ Hamill, DR; Severson, AF; Carter, JC; Bowerman, B (2002). "Centrosome maturation and mitotic spindle assembly in C. elegans require SPD-5, a protein with multiple coiled-coil domains". Dev. Cell. 3 (5): 673–84. doi:10.1016/s1534-5807(02)00327-1. PMID 12431374.
- ^ Sadler, PL; Shakes, DC (2000). "Anucleate Caenorhabditis elegans sperm can crawl, fertilize oocytes and direct anterior-posterior polarization of the 1-cell embryo". Development. 127 (2): 355–66. PMID 10603352.
- ^ Cheeks, RJ; Canman, JC; Gabriel, WN; Meyer, N; Strome, S; Goldstein, B (2004). "C. elegans PAR proteins function by mobilizing and stabilizing asymmetrically localized protein complexes". Curr Biol. 14 (10): 851–62. doi:10.1016/j.cub.2004.05.022. PMID 15186741.
- ^ 괴크지, P, 로즈, L.S. 비대칭 세포 분열 및 배아에서의 축 형성(2005년 10월 15일), 웜북, 에드.선충 연구 공동체 웜북, doi:10.1895/wormbook.1.30.1
- ^ Schneider, SQ; Bowerman, B (2003). "Cell polarity and the cytoskeleton in the Caenorhabditis elegans zygote". Annu Rev Genet. 37: 221–49. doi:10.1146/annurev.genet.37.110801.142443. PMID 14616061.
- ^ a b c d e Matsuzaki, F (2000). "Asymmetric division of Drosophila neural stem cells: a basis for neural diversity". Current Opinion in Neurobiology. 10 (1): 38–44. doi:10.1016/s0959-4388(99)00052-5. PMID 10679433.
- ^ Guo, M; Jan, LY; Jan, YN (1996). "Control of daughter cell fates during asymmetric division: interaction of Numb and Notch". Neuron. 17 (1): 27–41. doi:10.1016/s0896-6273(00)80278-0. PMID 8755476.
- ^ Ikeshima-Kataoka, H; Skeath, JB; Nabeshima, Y; Doe, CQ; Matsuzaki, F (1997). "Miranda directs Prospero to a daughter cell during Drosophila asymmetric divisions". Nature. 390 (6660): 625–29. doi:10.1038/37641. PMID 9403694.
- ^ Henry, Jonathan J.; Martindale, Mark Q. (1999). "Conservation and innovation in spiralian development". Hydrobiologia. 402: 255–65. doi:10.1007/978-94-017-2887-4_15. ISBN 978-90-481-5340-4.
- ^ a b Shimizu, T.; et al. (1998). "Unequal Cleavage in the early Tubifex Embryo". Develop. Growth Differ. 40 (3): 257–66. doi:10.1046/j.1440-169x.1998.00001.x.
- ^ a b Ren, Xiaoyun; Weisblat, David A. (2006). "Asymmetrization of first cleavage by transient disassembly of one spindle pole aster in the leech Helobdella robusta". Developmental Biology. 292 (1): 103–15. doi:10.1016/j.ydbio.2005.12.049. PMID 16458880.
- ^ a b Lambert, J. David; Nagy, Lisa M. (2002). "Asymmetric inheritance of centrosomally localized mRNAs during embryonic cleavages". Nature. 420 (6916): 682–86. doi:10.1038/nature01241. PMID 12478296.
- ^ Jan, Y. N. & Jan, L. Y. (1998). "Asymmetric cell division". Nature. 392 (6678): 775–778. doi:10.1038/33854. PMID 9572136.
- ^ Gho, M.; Bellaiche, Y.; Schweisguth, F. (1999). "Revisiting the Drosophila microchaete lineage: a novel intrinsically asymmetric cell division generates a glial cell". Development. 126: 573–3584.
- ^ Hayes, A. J.; Tudor, D.; Nowell, M. A.; Caterson, B.; Hughes, C. E (2008). "Chondroitin sulfate sulfation motifs as putative biomarkers for isolation of articular cartilage progenitor cells". J Histochem Cytochem. 56 (2): 125–138. doi:10.1369/jhc.7a7320.2007. PMC 2324172. PMID 17938280.
- ^ Gómez-López, Sandra; Lerner, Robin G.; Petritsch, Claudia (2013). "Asymmetric cell division of stem and progenitor cells during homeostasis and cancer". Cellular and Molecular Life Sciences. 71 (4): 575–97. doi:10.1007/s00018-013-1386-1. PMC 3901929. PMID 23771628.
- ^ Xin, H. W.; Ambe, C. M.; Ray, S.; Kim, B. K.; Koizumi, T.; Wiegand, G. W.; Hari, D.; Mullinax, J. E.; Jaiswal, K. R.; Garfield, S. H.; Stojadinovic, A.; Rudloff, U.; Thorgeirsson, S. S.; Avital, I. (2013). "Wnt and the cancer niche: paracrine interactions with gastrointestinal cancer cells undergoing asymmetric cell division". J Cancer. 4 (6): 447–57. doi:10.7150/jca.6896. PMC 3726705. PMID 23901343.
- ^ Gonzalez, C. (2007). "Spindle orientation, asymmetric division and tumour suppression in Drosophila stem cells". Nat Rev Genet. 8 (6): 462–72. doi:10.1038/nrg2103. PMID 17510666.
추가 읽기
- 비대칭 세포분열, 분자 및 아세포 생물학의 진보, 제45권, A권.마키에이라 코엘류 편집장스프링거 베를라크, 베를린, 하이델베르크, 뉴욕(2007) ISBN 978-3-540-69160-0