이식(배아학)
Implantation (embryology)| 이식(배아학) | |
|---|---|
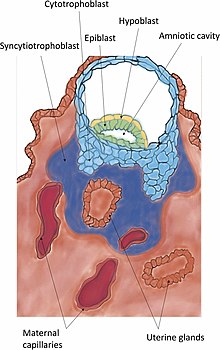
 인간 배아 발달의 초기 단계 중 하나로 이식 | |
| 세부 사항 | |
| 카네기 무대 | 3 |
| 날들 | 5–9 |
| 발생하다 | 가스트룰라 |
| 해부학 용어 | |
착상(배아)은 포유동물의 배아 발달 단계에서 배반포가 태아로 부화해 암컷 [1]자궁의 벽에 달라붙어 침입하는 과정이다.임플란트는 임신의 첫 단계이며, 성공하면 암컷은 [2]임신한 것으로 간주됩니다.여성의 경우 [2]임신 테스트에서 인간 융모성 성선 자극 호르몬(hCG)이 증가하여 이식된 배아를 검출한다.이식된 태아는 자라기 위해 산소와 영양분을 공급받을 것이다.
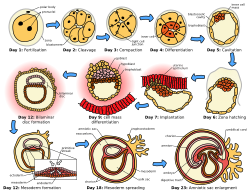
영양아세포의 종류와 [3]포유류의 다른 종에 걸친 태반의 구조에는 많은 변화가 있다.태반 태반 전에 2개의 착상 전 단계를 포함한 임플란트의 인식된 5단계 중 첫 4단계는 종 전체에서 유사하다.5단계는 이동과 부화, 사전 접촉, 부착, 부착, [3]침입이다.두 가지 착상 전 단계는 착상 전 [4][5]배아와 관련이 있다.
인간의 경우 수정 후 4, 5일 정도 지나면 착상 과정이 시작된다.첫째 주 말에는 배반포가 자궁내막에 표면적으로 부착된다.2주째가 되면 [6]임플란트가 완성됩니다.
착상 단계
포유류의 이식에는 태반 형성에 앞서 두 번의 이식 전 단계를 포함하여 5개의 인지된 단계가 있습니다.이동 및 부화, 사전 접촉, 부착, 접착 및 침입이 그것입니다.처음 4단계는 침입의 과정이 [3][7]다양하기 때문에 종에 걸쳐 유사하다.이 세 단계의 부착, 부착 및 침입은 접촉(부착), 부착(부착), 침투(침입)[5][4]라고도 불리며 자궁이 가장 수용적인 상태로 있을 때 임플란트 창으로 알려진 제한된 시간 동안에만 발생할 수 있습니다.
이행 및 부화
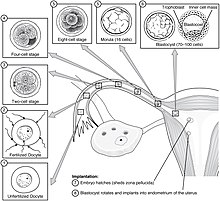
이식에는 두 단계가 있는데 첫째는 접합자 이동이고 둘째는 영양아세포 [8]이동이다.
접합자라고 불리는 단일 이배체 세포를 만드는 난모세포의 수정에 이어 접합자는 자궁으로 이동하기 시작한다.수정은 나팔관의 앰풀라에서 이루어지며 접합자는 튜브를 따라 자궁으로 운반된다.접합자는 수정한 나팔관에 있는 섬모 덕분에 자궁으로 이동한다.
이 이동 동안 접합자는 모룰라라고 [9]불리는 16개의 압축된 블라스트롬의 공을 만드는 많은 세포분열을 겪습니다.모룰라는 3, 4일 후에 자궁으로 들어가므로, 모룰라에 블라스토콜이라고 하는 충치가 형성되어 배반포를 형성합니다.배반포는 배아로 발달하는 내부 세포 덩어리와 태아외막으로 [10]발달하는 영양아세포의 외부 세포층을 포함합니다.
배반포는 여전히 Zona pelllucida로 알려진 계란 코팅에 둘러싸여 있고, 그것이 자궁 벽에 이식되기 위해서는 이 덮개를 스스로 제거해야 합니다.이 단계는 zona 부화라고 알려져 있으며, 충분한 용해가 있을 때 배반포는 주입의 배치 단계를 시작할 수 있습니다.자궁강 내 용혈인자뿐만 아니라 배반포 자체로부터의 인자는 난모의 분해에 필수적이다.후자의 메커니즘은 수정되지 않은 난자를 같은 [11]조건에서 자궁에 넣으면 조나 펠루시다가 온전하게 유지된다는 것을 나타낸다.
부화를 촉진하는 것으로 알려진 분자조절제 중에는 주로 다양한 성장인자에 [12]의해 자극되는 단백질 분해효소들이 있습니다.배반포는 또한 임플란트와 임신의 다른 단계에서 중요한 역할을 하는 소염과 항염증 둘 다인 사이토카인을 생산한다.두 종류의 사이토카인은 MMP, 플라즈미노겐 활성제,[12] 카테핀을 포함한 단백질 분해 효소의 활성을 조절합니다.부화에 관여하는 사이토카인이 소염증인지 항염증인지, 어떤 단백질 분해 효소가 관여하는지는 알려져 있지 않다.그러나 임플란트 시 염증성 사이토카인이 우세하다는 것은 잘 알려져 있다.사이토카인은 자궁 모유에도 존재하며 이는 배반포의 발달과 기능을 조절할 수 있지만 부화에 관여하는 것을 뒷받침하는 증거는 없다.백혈병 억제인자(LIF)는 생리 주기의 황체 단계 동안 자궁 내막에서 발현되는 소염성 사이토카인으로, 이식 기간 동안 가장 높은 발현을 보인다.LIF는 유착과 [12]침입에 역할을 합니다.
보조 조나 부화는 보조 번식을 통해 이루어질 수 있으며, 여기서 [13]조나 펠루키다는 부화를 용이하게 하기 위해 인공적으로 뚫릴 수 있다.
어소시에이션
Zona 부화에 이어, 배반포와 자궁내막 사이의 첫 번째 느슨한 연결이나 접촉을 어소시에이션이라고 합니다.일반적으로 자궁 내막 내에 작은 움푹 패인 곳이 있고, 또한 배반포 영양세포가 자궁 밑바닥에 직접 접촉할 수 있도록 조나 펠루시다가 충분히 파괴된 곳이 배치된다.궁극적으로, 영양아세포층 안에 있는 내부 세포 덩어리(또한 배아아세포)는 데시두아에 가장 가깝게 정렬됩니다.내부 세포 덩어리가 데시두아와 위치 맞추기가 되지 않으면 영양아세포 내에서 자유롭게 회전할 수 있는 능력이 있어 이 위치 맞추기를 달성할 수 있다.부착은 대류세포와 자궁 상피의 약한 상호작용으로 전단 응력에 불안정하다.배치는 [9]또한 자궁에서 배반포를 재배치할 수 있도록 가역적이다.
접착
유착은 느슨한 위치보다 자궁내막에 대한 부착력이 훨씬 더 강하다.
영양아세포는 자궁 내부를 관통하여 영양아세포의 돌출부와 함께 부착된다.
이 접착 활동은 영양아세포에 있는 마이크로빌리에 의한 것입니다.영양아세포는 결합 섬유 연결, 라미닌, 콜라겐 타입 IV, 그리고 이 접착 [14]과정을 돕는 인테그린을 가지고 있습니다.
뮤신-16은 자궁상피 꼭대기 표면에서 발현되는 트랜스막 뮤신이다.이 뮤신은 배반포가 상피에 위치한 바람직하지 않은 곳에 이식되는 것을 방지한다.따라서 MUC-16은 세포간 유착을 억제한다.피노포드가 형성되는 동안 그것의 제거는 [15]체외 영양아세포 침입을 용이하게 하는 것으로 나타났다.
영양아세포와 자궁내막상피에서 양자간의 초기 상호작용을 매개하는 분자의 정체는 확인되지 않았다.그러나, 많은 연구 그룹은 글리코실화 단백질 뮤신 계열의 구성원인 MUC1이 관여한다고 [16]제안했다.MUC1은 사람에게 이식하는 기간 동안 자궁내막상피세포의 꼭대기 표면에서 발현되는 경막당단백질이며,[16] 이 기간 동안 가임피험자와 불임피험자 간에 다르게 발현되는 것으로 나타났다.MUC1은 영양아세포 [17][18]표면의 세포접착분자인 L-셀렉틴의 배위자인 세포외 도메인에 탄수화물 부분을 표시한다.체외 이식 모델은 L-셀렉틴이 배위자와 [19]상호작용함으로써 자궁상피에 대한 배반포의 배치를 매개한다는 가설을 뒷받침하는 증거를 제공했다.
침략
침윤은 자궁내막으로 배반포를 더욱 확립하는 것이다.자궁내막에 달라붙는 영양아세포의 돌출은 계속 증식하고 젤라틴화효소 A와 [20]B를 사용하여 자궁내부로 침투한다.영양아세포는 태아의 [21]혈류 기반을 마련하기 위해 모체의 혈액 공급에 도달하려고 자궁에 침입한다.이 영양아세포들이 침투하면서, 그들은 말단적으로 다핵 조직으로 분화되는데, 이것은 합성세포영양아세포로 알려진 합성세포이다.이 층과 배반포 사이에 세포영양세포가 [22]있다.
신세포영양세포가 십이지장세포 아래의 기저막에 도달하면 자궁 기질에 침입하기 위해 세포들을 제거한다.탈구는 십이지장 세포와 관련된 세포외 매트릭스를 연결하는 세포접착분자(CAM)를 분해함으로써 이루어진다.CAM과 베타카테닌의 발현을 억제하는 신시토프로폴라스트로부터의 종양괴사인자 알파의 분비에 의해 분해된다.세포외 기질은 콜라겐화효소, 젤라틴화효소, 매트릭스메탈로프로테아제 등의 금속단백질가수분해효소 [23]및 세린단백질가수분해효소에 의해 분해된다.콜라겐 분해효소는 타입 I, II, III, VII 및 X [23]콜라겐을 소화한다.젤라틴화효소는 두 가지 형태로 존재한다. 하나는 타입-IV 콜라겐을 소화시키는 것이고 다른 하나는 [23]젤라틴을 소화시키는 것이다.세포외 기질은 세린 엔도펩티다아제 및 메탈로프로테이나아제에 의해 분해된다.신세포영양아세포는 자궁내막으로 침입하여 배아를 [23]내장시킬 수 있다.결국, 신세포영양세포는 모체의 혈액과 접촉하여 융모막을 형성하는데, 이것은 태반의 시작이다.침입 후 배반포의 침입으로 생긴 자궁 상피의 균열은 섬유소 마개로 봉인된다.섬유소 플러그는 혈전 및 세포 [6]부스러기의 응고입니다.
호화로운 영양아세포
호화로운 영양아세포는 침입한 융모 세포에서 모체의 자궁근막으로 이동하는 세포이다.이 세포들은 성장 중인 태아에 대한 모체의 혈류를 개선하고 안전하게 하기 위해 나선 동맥을 개조합니다.자궁정맥에서 이 과정이 일어나 태아의 혈액과 대사성 [24]노폐물의 배수를 개선하기 위해 자궁정맥을 안정화시킨다는 증거도 있다.영양아세포는 또한 모체의 다양한 조직으로 이동하는 것으로 기록되었다.이러한 영양아세포로 인해 태아세포가 [25]모체조직에 세포주를 형성하는 태아모성 미세모세포증이라고 알려진 현상에 관련되었다.
분비물
배반포는 침입 중에 다양한 목적을 위해 인자를 분비한다.그것은 자신을 목표로 하고 자궁 내막을 더 침범하도록 자극하면서 몇 가지 자기분비 인자를 분비한다.인간 융모성 성선종양로핀은 배반포의 자가분비증식인자이며 인슐린 유사증식인자 2는 그 [23]침투를 자극한다.또한 분비물은 서로 십이지장 세포를 느슨하게 하여 모체에 의해 배아가 거부되는 것을 방지하고 최종 십이지장화를 유발하여 월경을 방지한다.
면역 억제제
배아는 모체의 세포와 달라 면역억제제를 분비하지 않으면 모체의 면역체계에 의해 기생충으로 거부된다.이러한 약물은 혈소판활성화인자, 인간 융모성 성선자, 조기임신인자, 프로스타글란딘E2, 인터류킨-1α, 인터류킨6, 간섭알파, 백혈병억제인자 및 콜로니자극인자를 포함한다.
월경 방지
인간 융모성 성선절제([23]hCG)는 면역억제제 역할을 할 뿐만 아니라 산모에게 임신 신호를 보내 황체 용해를 방지하고 황체 기능을 유지함으로써 월경을 방지한다.
기타 요인
배반포에서 분비되는 기타 인자는 다음과 같다.
자궁 수용성
임플란트를 하기 위해 자궁은 콘셉투스를 받을 수 있도록 변화를 겪는다.수용성에는 자궁액 흡수를 돕는 피노포드의 형성에 있어서의 자궁내막세포의 변화, 자궁내막 두께의 변화 및 혈액공급의 발달, 십이지장 형성이 포함된다.총칭하여 이러한 변화는 플라즈마막 변환으로 알려져 있으며, 배반포를 자궁내막에 가깝게 하여 고정시킵니다.이 단계에서 배반포를 [27][28]자궁 밖으로 내보냄으로써 제거할 수 있다.
성공적인 착상은 배아의 생존력과 [29]자궁 수용력에 달려있다.중요한 관련 요인은 태아와 [30]자궁 사이의 발달 동기화이다.동기화는 이식 창으로 알려진 짧은 수용 기간을 제공하며, 이 [31][32][33]단계에서 배반포와 자궁내막 사이에 많은 크로스톡을 포함합니다.접착 중에 이 통신은 수용체-리간드-상호작용, 인테그린 매트릭스 및 프로테오글리칸 상호작용에 의해 전달된다.프로테오글리칸 수용체는 데시두아의 표면에서 발견되며, 그 상대물인 프로테오글리칸은 배반포의 영양세포 주변에서 발견됩니다.이 리간드 수용체 시스템은 이식 [23]창구 바로에도 존재합니다.배반포는 자궁내막으로 신호를 보내서 자궁내막의 존재에 더 적응하게 되는데, 예를 들어 십이지장세포의 세포골격의 변화에 의해서이다.이것은 차례로 기저층과의 연결에서 십이지장세포를 제거하는데, 이것은 배반포가 다음 [23]침입을 수행할 수 있게 한다.
이식창
이식 기간은 배반포의 [34]성공적인 부착을 위한 제한된 기간이다.인간의 자궁 수용성은 황체화 호르몬 수치가 [4][35]최고조에 달할 때 생리 주기의 분비 단계 중 20일에서 24일에 최적이다.인간의 경우 이식 기간은 24-36시간 [36]동안만 가능하다.
자궁내막 마이크로바이옴은 자궁내막세포 기능을 제어하고 병원체 성장을 막는 국소 면역체계의 기능을 성공적으로 이식하는데 중요한 역할을 하는 것으로 나타났다.이는 [37][38]보호물질의 분비와 관련이 있다.
피노포드
피노포드는 이식창의 시작 부분에서 형성되며 많은 [39][34]종에서 발견된다.자궁 상피 [34]세포의 꼭대기 세포막에서 나온 버섯 모양의 돌기입니다.피노포드는 상피세포의 팽창과 다수의 마이크로빌리의 융합에 의해 형성되어 최대 [39]치수에 이른다.임신 19일에서 21일 사이에 나타나며 [34]20일에 완전히 형성됩니다.이는 약 5~7일의 수정 연령에 해당하며, 이는 착상 시기와 잘 일치한다.피노포드는 최대 이틀 동안만 지속되며 [39]수용성을 나타내는 초미세 구조 마커로 간주됩니다.
프로게스테론에 의해 발달이 촉진되고 에스트로겐에 의해 억제된다.주입창 동안 글리코칼릭스에 속하는 세포표면당단백질 MUC1에 의해 세포간 접착이 억제된다.피노포드는 마이크로빌리보다 높고 글리코칼릭스를 통해 돌출되어 부착 영양아세포와 직접 접촉할 수 있습니다.피노포드의 가장 중요한 속성은 자궁 상피 세포의 [4]세포 표면에서 당단백질을 제거하는 것이다.또한 MUC16은 피노포드의 발달과 함께 세포 표면에서 사라지는 것으로 나타났습니다.일부 연구는 배아의 움직임을 막고 착상하는 동안 [34]배아의 밀착과 밀착을 가능하게 하는 핀오포드가 섬모에 침입하는 것을 보고했습니다.
피노포데스는 자궁액과 그 고분자를 세포내 형성 과정에 의해 세포로 가져온다.이것은 자궁의 부피를 감소시켜, 벽을 그 안에 떠 있는 배반포에 더 가깝게 만듭니다.따라서 활성 피노포드의 기간은 삽입 기간을 제한할 수 있습니다.[23]피노포드는 체액을 계속 흡수하여 이식 초기 단계에서 체액의 대부분을 제거한다.
사전 실현
자궁내막은 두께를 증가시키고, 혈관을 형성하며, 그 분비샘은 구부러지고 분비물로 증가하게 됩니다.이러한 변화는 배란 후 약 7일 후에 최대치에 도달한다.
게다가 자궁내막의 표면은 일종의 둥근 세포를 만들어 자궁강을 향해 전체 영역을 덮는다.이것은 [23]배란 후 약 9일에서 10일 후에 일어납니다.이 세포들은 낙엽성 나무의 잎처럼 임신이 일어나지 않으면 생리가 끝날 때마다 전체 층이 벗겨진다는 것을 강조하는 십이지장 세포라고 불린다.반면 자궁샘은 임신하지 않으면 배란 후 8~9일[23] 정도 활동량이 감소하고 퇴화된다.
십이지장 세포는 자궁 내막에 항상 존재하는 기질 세포에서 유래하며, 새로운 층인 십이지장을 구성한다.자궁내막의 나머지 부분들은, 추가로, 내강과 기저부 사이의 차이를 표현합니다.내강 세포는 다소 스폰지 같은 간질 [23]세포로 구성된 기저외측 해면 지층과 대조적으로 자궁 내막 지층을 형성합니다.
탈규격화
임신이 일어나면 탈각화가 확대되어 자궁선, 조나 콤팩트, 그리고 그 안에 늘어선 십상세포의 상피가 더욱 발달한다.십이지장 세포는 지질과 글리코겐으로 채워져 십이지장 세포 특유의 다면체 형태를 취한다.배반포의 인자는 또한 십이지장 세포의 최종 형성을 유발한다.반대로, 배반포 근처에 있는 일부 십이지장 세포는 변성되어 [23]영양분을 공급한다.태아의 영향의 징후는 비예외 [23]사이클보다 태아 사이클에서 더 높은 수준으로 탈문화화가 발생한다는 것이다.또한,[23] 태아의 자연 침투를 모방한 자극을 줄 때 유사한 변화가 관찰된다.
배아는 상피 세포막을 탈분극시키고 상피 나트륨 채널을 활성화시키는 세린 단백질 분해효소를 방출한다.이것은 칼슘 이온(Ca)의2+ 유입과 CREB의 인산화를 유발한다.CREB의 인산화는 상피 세포에서 프로스타글란딘 E2(PGE2)의 방출로 이어지는 COX2의 발현을 상향 조절한다.PGE2는 간질세포에서 cAMP 관련 경로를 활성화하는 간질세포에 작용하여 탈수화를 [40]유도한다.
데시두아의 일부
데시두아는 같은 구성을 가지고 있지만 별도의 섹션으로 나눌 수 있습니다.
- Decidua basalis – 이것은 착상 후 배아의 기저외측에 위치한 데시두아의 일부입니다.
- 갑각류 – 갑각류는 자궁 내막으로 둘러싸인 채 내강 쪽에 있는 배아 위에서 자란다.그것은 데시두아 기저와 함께 배아를 둘러싸고 있다.
- Decidua parietalis – 자궁 표면의 다른 모든 십이지장은 십이지장에 속합니다.
임신 중 데시두아
착상 후에도 데시두아는 최소한 임신 [23]초기까지 남아 있다.그러나 가장 눈에 띄는 시기는 임신 초기, 착상 기간이다.주변 조직으로서의 기능은 최종 태반으로 대체된다.그러나 탈수화의 일부 요소는 [23]임신 기간 내내 남아 있다.
콤팩트 층과 스폰지 층은 임신 중 데시두아 아래에서 여전히 관찰할 수 있다.스펀지오사 층의 분비샘은 퇴화되는 첫 3개월 동안 계속 분비된다.하지만, 그 사라지기 전에, 일부 분비샘은 불균등하게 많이 분비된다.이 과잉 분비 현상은 병리학자인 하비에르 아리아스텔라의 이름을 따서 아리아스텔라 [23]현상이라고 불립니다.
분비물의 적응
| 단백질, 당단백질 및 펩타이드 |
| 매트릭스 관련: |
| 피브로넥틴 |
| 라미닌 |
| 엔탁틴 |
| IV형 콜라겐 |
| 헤파란 황산염 |
| 프로테오글리칸 |
| 인테그린 |
| – |
| 기타: |
| 뮤신스 |
| 프로락틴 |
| IGFBP-1 |
| 글리코델린 |
| 자궁내막단백질 15 |
| 알부민 |
| 베타 리포단백질 |
| 릴랙신 |
| 섬유아세포증식인자1 |
| 섬유아세포증식인자2 |
| 파팔리신-1 |
| 스트레스 응답 단백질 27(SRP-27) |
| CA-125 |
| 베타엔도르핀 |
| 류엔케팔린 |
| 디아민산화효소 |
| 조직플라스미노겐활성화제 |
| 레닌 |
| 프로게스테론의존성 탄산무수분해효소 |
| 락토페린 |
자궁 내벽뿐만 아니라 분비물도 변한다.이러한 변화는 황체로부터 프로게스테론의 증가된 수치에 의해 유발된다.분비물의 표적은 배아아세포이며, 여러 가지 기능을 가지고 있다.
영양
태아는 착상하기 전에 자궁강에서 약 72시간을 보낸다.이때는 엄마의 혈액에서 직접 영양분을 섭취할 수 없고 철분과 지용성 비타민 [23]등 자궁강으로 분비되는 영양소에 의존해야 한다.
성장과 이식
자궁내막은 영양분 외에도 성장과 착상에 중요한 여러 스테로이드 의존성 단백질을 분비합니다.콜레스테롤과 스테로이드도 [23]분비됩니다.기질물질, 부착분자 및 기질물질에 대한 표면수용체의 합성에 의해 착상이 더욱 촉진된다.
임상적 의의
인간의 생식은 그다지 효율적이지 않다.자연개념의 약 30%만이 성공적인 임신을 가져온다.실패한 임신 중 약 85%는 착상 실패에 [41]기인한다.착상 실패는 3분의 2의 경우 부적절한 자궁 수용성으로 인해, 나머지 [42]3분의 1의 경우 배아 자체의 문제로 인해 발생하는 것으로 간주된다.대부분의 체외수정은 모든 임신 실패의 [41]거의 절반을 차지하는 착상 실패 때문에 실패한다.
부적절한 자궁 수용성은 비정상적인 사이토카인과 호르몬 신호 전달뿐만 아니라 후생유전학적 [43]변화에 의해 야기될 수 있다.반복적인 착상 실패는 여성 불임의 원인이다.따라서 [43]임플란트를 위해 자궁내막 수용성을 최적화함으로써 임신률을 향상시킬 수 있다.임플란트 마커 평가는 임신 결과를 예측하고 잠재 [43]임플란트 결함을 발견하는 데 도움이 될 수 있습니다.장기 온 어 칩 프로그램의 일부로, 자궁내막은 이식 실패의 원인을 [44]더 명확하게 식별할 수 있는 자궁내막의 기능을 모델링하기 위해 개발되었습니다.유기체는 또한 자궁내막과 [45]이식에서의 그 역할을 모델링하기 위해 개발되었다.
보조 생식에 3개 이상의 착상 실패가 있는 여성의 경우, 여러 소규모 무작위 대조 연구를 검토한 결과, 보조 저분자량 헤파린의 사용이 정상 출산율을 약 80%[46] 향상시킨 것으로 추정되었다.황체상 지원은 성공적인 이식 [47]가능성을 개선하기 위해 프로게스테론과 인간 융모막성 성선 자극제(hCG)의 사용을 포함할 수 있다.
아연 결핍증
아연은 임신 전, 그리고 성공적인 임신에 매우 중요하며, 아연의 결핍은 배반포 발달을 무능하게 할 수 있습니다.일단 수정란이 되면 아연 스파크에서 아연이 방출되는데, 아연 스파크는 다배아를 예방하는 [48]조나 펠루시다의 경화를 포함한 변화를 촉진합니다.
이식 출혈
임플란트 출혈은 자궁에 [49][50]착상된 수정란으로 인해 임신 초기에 발생할 수 있는 소량의 가벼운 질 출혈이나 반점입니다.출혈과 반점은 생리 주기의 황체 단계와 임신 초기 단계에서 흔하며 이식과는 관련이 없습니다.착상 출혈은 수정 [51]후 7~14일 사이에 발생하며 경련, 메스꺼움, 유방 압통, [52]두통 등의 증상을 동반할 수 있다.착상 출혈은 색상, 응고, 강도 및 [53][54]흐름 지속 시간으로 주기 출혈과 구분할 수 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Niringiyumukiza JD, Cai H, Xiang W (May 2018). "Prostaglandin E2 involvement in mammalian female fertility: ovulation, fertilization, embryo development and early implantation". Reproductive Biology and Endocrinology. 16 (1): 43. doi:10.1186/s12958-018-0359-5. PMC 5928575. PMID 29716588.
- ^ a b Wilcox AJ, Harmon Q, Doody K, Wolf DP, Adashi EY (April 2020). "Preimplantation loss of fertilized human ova: estimating the unobservable". Human Reproduction. 35 (4): 743–750. doi:10.1093/humrep/deaa048. PMC 8287936. PMID 32296829.
- ^ a b c Imakawa K, Bai R, Fujiwara H, Kusama K (January 2016). "Conceptus implantation and placentation: molecules related to epithelial-mesenchymal transition, lymphocyte homing, endogenous retroviruses, and exosomes". Reproductive Medicine and Biology. 15 (1): 1–11. doi:10.1007/s12522-015-0215-7. PMC 5715838. PMID 29259417.
- ^ a b c d Kim SM, Kim JS (December 2017). "A Review of Mechanisms of Implantation". Development & Reproduction. 21 (4): 351–359. doi:10.12717/DR.2017.21.4.351. PMC 5769129. PMID 29359200.
- ^ a b McGowen MR, Erez O, Romero R, Wildman DE (2014). "The evolution of embryo implantation". The International Journal of Developmental Biology. 58 (2–4): 155–161. doi:10.1387/ijdb.140020dw. PMC 6053685. PMID 25023681.
- ^ a b Moore KL (2020). The developing human: clinically oriented embryology (Eleventh ed.). Edinburgh. pp. 35–42. ISBN 978-0-323-61154-1.
- ^ Cakmak H, Taylor HS (March 2011). "Implantation failure: molecular mechanisms and clinical treatment". Human Reproduction Update. 17 (2): 242–253. doi:10.1093/humupd/dmq037. PMC 3039220. PMID 20729534.
- ^ Ochoa-Bernal MA, Fazleabas AT (March 2020). "Physiologic Events of Embryo Implantation and Decidualization in Human and Non-Human Primates". International Journal of Molecular Sciences. 21 (6): 1973. doi:10.3390/ijms21061973. PMC 7139778. PMID 32183093.
- ^ a b Gauster M, Moser G, Wernitznig S, Kupper N, Huppertz B (June 2022). "Early human trophoblast development: from morphology to function". Cellular and Molecular Life Sciences. 79 (6): 345. doi:10.1007/s00018-022-04377-0. PMC 9167809. PMID 35661923.
- ^ Sadler TW (2010). Langman's medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 45. ISBN 9780781790697.
- ^ 보론 2004, 페이지 1172
- ^ a b c Seshagiri PB, Vani V, Madhulika P (March 2016). "Cytokines and Blastocyst Hatching". American Journal of Reproductive Immunology. 75 (3): 208–17. doi:10.1111/aji.12464. PMID 26706391. S2CID 11540123.
- ^ IVF-infertility.com
- ^ Singh H, Aplin JD (July 2009). "Adhesion molecules in endometrial epithelium: tissue integrity and embryo implantation". Journal of Anatomy. 215 (1): 3–13. doi:10.1111/j.1469-7580.2008.01034.x. PMC 2714633. PMID 19453302.
- ^ Gipson IK, Blalock T, Tisdale A, Spurr-Michaud S, Allcorn S, Stavreus-Evers A, Gemzell K (January 2008). "MUC16 is lost from the uterodome (pinopode) surface of the receptive human endometrium: in vitro evidence that MUC16 is a barrier to trophoblast adherence". Biology of Reproduction. 78 (1): 134–142. doi:10.1095/biolreprod.106.058347. PMID 17942799. S2CID 44999196.
- ^ a b Margarit L, Taylor A, Roberts MH, Hopkins L, Davies C, Brenton AG, et al. (December 2010). "MUC1 as a discriminator between endometrium from fertile and infertile patients with PCOS and endometriosis". The Journal of Clinical Endocrinology and Metabolism. 95 (12): 5320–5329. doi:10.1210/jc.2010-0603. PMID 20826587.
- ^ Carson DD, Julian J, Lessey BA, Prakobphol A, Fisher SJ (September 2006). "MUC1 is a scaffold for selectin ligands in the human uterus". Frontiers in Bioscience. 11 (1): 2903–2908. doi:10.2741/2018. PMID 16720361.
- ^ Francis LW, Yao SN, Powell LC, Griffiths S, Berquand A, Piasecki T, et al. (February 2021). "Highly glycosylated MUC1 mediates high affinity L-selectin binding at the human endometrial surface". Journal of Nanobiotechnology. 19 (1): 50. doi:10.1186/s12951-021-00793-9. PMC 7890821. PMID 33596915.
- ^ Genbacev OD, Prakobphol A, Foulk RA, Krtolica AR, Ilic D, Singer MS, et al. (January 2003). "Trophoblast L-selectin-mediated adhesion at the maternal-fetal interface". Science. 299 (5605): 405–408. Bibcode:2003Sci...299..405G. doi:10.1126/science.1079546. PMID 12532021. S2CID 15462671.
- ^ Zhu JY, Pang ZJ, Yu YH (2012). "Regulation of trophoblast invasion: the role of matrix metalloproteinases". Reviews in Obstetrics & Gynecology. 5 (3–4): e137–e143. PMC 3594863. PMID 23483768.
- ^ Carter AM, Enders AC, Pijnenborg R (March 2015). "The role of invasive trophoblast in implantation and placentation of primates". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 370 (1663): 20140070. doi:10.1098/rstb.2014.0070. PMC 4305171. PMID 25602074.
- ^ Gardiner C, Tannetta DS, Simms CA, Harrison P, Redman CW, Sargent IL (2011). "Syncytiotrophoblast microvesicles released from pre-eclampsia placentae exhibit increased tissue factor activity". PLOS ONE. 6 (10): e26313. Bibcode:2011PLoSO...626313G. doi:10.1371/journal.pone.0026313. PMC 3194796. PMID 22022598.
- ^ a b c d e f g h i j k l m n o p q r s t u Boron W, Boulpaep E (2004). Medical Physiology: A Cellular And Molecular Approaoch. Oxford: Elsevier. ISBN 1-4160-2328-3. OCLC 61527528.[페이지 필요]
- ^ Moser G, Weiss G, Sundl M, Gauster M, Siwetz M, Lang-Olip I, Huppertz B (March 2017). "Extravillous trophoblasts invade more than uterine arteries: evidence for the invasion of uterine veins". Histochemistry and Cell Biology. 147 (3): 353–366. doi:10.1007/s00418-016-1509-5. PMC 5344955. PMID 27774579.
- ^ Dawe GS, Tan XW, Xiao ZC (January 2007). "Cell migration from baby to mother". Cell Adhesion & Migration. 1 (1): 19–27. doi:10.4161/cam.4082. PMC 2633676. PMID 19262088.
- ^ Ai Z, Jing W, Fang L (2015). "Cytokine-Like Protein 1(Cytl1): A Potential Molecular Mediator in Embryo Implantation". PLOS ONE. 11 (1): e0147424. doi:10.1371/journal.pone.0147424. PMC 4723121. PMID 26800213.
- ^ Murphy CR (August 2004). "Uterine receptivity and the plasma membrane transformation". Cell Research. 14 (4): 259–267. doi:10.1038/sj.cr.7290227. PMID 15353123. S2CID 24023502.
- ^ Murphy CR, Shaw TJ (December 1994). "Plasma membrane transformation: a common response of uterine epithelial cells during the peri-implantation period". Cell Biology International. 18 (12): 1115–1128. doi:10.1006/cbir.1994.1038. PMID 7703952. S2CID 22769575.
- ^ Yang Y, Zhu QY, Liu JL (November 2021). "Deciphering mouse uterine receptivity for embryo implantation at single-cell resolution". Cell Proliferation. 54 (11): e13128. doi:10.1111/cpr.13128. PMC 8560620. PMID 34558134.
- ^ Teh WT, McBain J, Rogers P (November 2016). "What is the contribution of embryo-endometrial asynchrony to implantation failure?". Journal of Assisted Reproduction and Genetics. 33 (11): 1419–1430. doi:10.1007/s10815-016-0773-6. PMC 5125144. PMID 27480540.
- ^ Sternberg AK, Buck VU, Classen-Linke I, Leube RE (August 2021). "How Mechanical Forces Change the Human Endometrium during the Menstrual Cycle in Preparation for Embryo Implantation". Cells. 10 (8): 2008. doi:10.3390/cells10082008. PMC 8391722. PMID 34440776.
- ^ Wu HM, Chen LH, Hsu LT, Lai CH (November 2022). "Immune Tolerance of Embryo Implantation and Pregnancy: The Role of Human Decidual Stromal Cell- and Embryonic-Derived Extracellular Vesicles". Int J Mol Sci. 23 (21): 13382. doi:10.3390/ijms232113382. PMC 9658721. PMID 36362169.
- ^ Liang J, Wang S, Wang Z (November 2017). "Role of microRNAs in embryo implantation". Reprod Biol Endocrinol. 15 (1): 90. doi:10.1186/s12958-017-0309-7. PMC 5699189. PMID 29162091.
- ^ a b c d e Quinn KE, Matson BC, Wetendorf M, Caron KM (February 2020). "Pinopodes: Recent advancements, current perspectives, and future directions". Molecular and Cellular Endocrinology. 501: 110644. doi:10.1016/j.mce.2019.110644. PMC 6962535. PMID 31738970.
- ^ Xiao Y, Sun X, Yang X, Zhang J, Xue Q, Cai B, Zhou Y (June 2010). "Leukemia inhibitory factor is dysregulated in the endometrium and uterine flushing fluid of patients with adenomyosis during implantation window". Fertility and Sterility. 94 (1): 85–89. doi:10.1016/j.fertnstert.2009.03.012. PMID 19361790.
- ^ Ng SW, Norwitz GA, Pavlicev M, Tilburgs T, Simón C, Norwitz ER (June 2020). "Endometrial Decidualization: The Primary Driver of Pregnancy Health". Int J Mol Sci. 21 (11): 4092. doi:10.3390/ijms21114092. PMC 7312091. PMID 32521725.
- ^ Crha I, Ventruba P, Žáková J, Ješeta M, Pilka R, Lousová E, Papíková Z (2019). "Uterine microbiome and endometrial receptivity". Ceska Gynekologie. 84 (1): 49–54. PMID 31213058.
- ^ Moreno I, Codoñer FM, Vilella F, Valbuena D, Martinez-Blanch JF, Jimenez-Almazán J, et al. (December 2016). "Evidence that the endometrial microbiota has an effect on implantation success or failure". American Journal of Obstetrics and Gynecology. 215 (6): 684–703. doi:10.1016/j.ajog.2016.09.075. PMID 27717732.
- ^ a b c Zhao Y, He D, Zeng H, Luo J, Yang S, Chen J, Abdullah RK, Liu N (September 2021). "Expression and significance of miR-30d-5p and SOCS1 in patients with recurrent implantation failure during implantation window". Reprod Biol Endocrinol. 19 (1): 138. doi:10.1186/s12958-021-00820-2. PMC 8425163. PMID 34496883.
- ^ Ruan YC, Guo JH, Liu X, Zhang R, Tsang LL, Dong JD, et al. (July 2012). "Activation of the epithelial Na+ channel triggers prostaglandin E₂ release and production required for embryo implantation". Nature Medicine. 18 (7): 1112–1117. doi:10.1038/nm.2771. PMID 22729284. S2CID 5116022.
- ^ a b Wang Y, Jiang X, Jia L, Wu X, Wu H, Wang Y, et al. (2022). "A Single-Cell Characterization of Human Post-implantation Embryos Cultured In Vitro Delineates Morphogenesis in Primary Syncytialization". Frontiers in Cell and Developmental Biology. 10: 835445. doi:10.3389/fcell.2022.835445. PMC 9240912. PMID 35784461.
- ^ Melford SE, Taylor AH, Konje JC (2013). "Of mice and (wo)men: factors influencing successful implantation including endocannabinoids". Human Reproduction Update. 20 (3): 415–428. doi:10.1093/humupd/dmt060. PMID 24306146.
- ^ a b c Cakmak H, Taylor HS (2010). "Implantation failure: molecular mechanisms and clinical treatment". Human Reproduction Update. 17 (2): 242–253. doi:10.1093/humupd/dmq037. PMC 3039220. PMID 20729534.
- ^ Ahn J, Yoon MJ, Hong SH, Cha H, Lee D, Koo HS, et al. (September 2021). "Three-dimensional microengineered vascularised endometrium-on-a-chip". Human Reproduction. 36 (10): 2720–2731. doi:10.1093/humrep/deab186. PMC 8450871. PMID 34363466.
- ^ Rawlings TM, Makwana K, Tryfonos M, Lucas ES (July 2021). "Organoids to model the endometrium: implantation and beyond". Reprod Fertil. 2 (3): R85–R101. doi:10.1530/RAF-21-0023. PMC 8801025. PMID 35118399.
- ^ Potdar N, Gelbaya TA, Konje JC, Nardo LG (2013). "Adjunct low-molecular-weight heparin to improve live birth rate after recurrent implantation failure: a systematic review and meta-analysis". Human Reproduction Update. 19 (6): 674–684. doi:10.1093/humupd/dmt032. PMID 23912476.
- ^ Farquhar C, Marjoribanks J (August 2018). "Assisted reproductive technology: an overview of Cochrane Reviews". The Cochrane Database of Systematic Reviews. 2018 (8): CD010537. doi:10.1002/14651858.CD010537.pub5. PMC 6953328. PMID 30117155.
- ^ Garner TB, Hester JM, Carothers A, Diaz FJ (May 2021). "Role of zinc in female reproduction". Biology of Reproduction. 104 (5): 976–994. doi:10.1093/biolre/ioab023. PMC 8599883. PMID 33598687.
- ^ Sheiner E (2011). Bleeding during pregnancy a comprehensive guide. New York: Springer. p. 9. ISBN 978-1-441-99810-1.
- ^ Harville EW, Wilcox AJ, Baird DD, Weinberg CR (September 2003). "Vaginal bleeding in very early pregnancy". Human Reproduction. 18 (9): 1944–1947. doi:10.1093/humrep/deg379. PMID 12923154.
- ^ "Implantation Bleeding vs A Period: How To Tell The Difference". ReUnite Rx. 2020-12-09. Retrieved 2021-07-29.
- ^ Heger, L. Demosthenes E (ed.). "What do implantation cramps feel like? How to tell the difference between implantation and menstrual cramping". Insider. Retrieved 2021-07-29.
- ^ Aggarwal K (2020). "Vaginal Bleeding in Early Pregnancy". In Sharma A (ed.). Labour Room Emergencies. Singapore: Springer. pp. 155–161. doi:10.1007/978-981-10-4953-8_18. ISBN 978-981-10-4953-8. S2CID 212812977.
- ^ "How Do I Know if It's Implantation Bleeding?". MedicineNet. Retrieved 2021-07-29.
책들
- Boron W, Boulpaep E (2004). Medical Physiology: A Cellular And Molecular Approaoch. Oxford: Elsevier. ISBN 1-4160-2328-3. OCLC 61527528.