배반포
Blastocyst| 배반포 | |
|---|---|
 착상 직전의 배반포 | |
 | |
| 세부 사항 | |
| 카네기 무대 | 3 |
| 날들 | 5–9 |
| 발생하다 | 가스트룰라 |
| 식별자 | |
| 라틴어 | 배반포진 |
| 메쉬 | D001755 |
| TE | E2.0.1.2.0.12 |
| FMA | 83041 |
| 해부학 용어 | |
배반포는 포유류의 초기 발달 과정에서 형성된 구조이다.그것은 배아를 형성하는 내부 세포질량(ICM)을 가지고 있다.배반포의 바깥쪽 층은 총칭하여 영양아세포라고 불리는 세포들로 구성되어 있다.이 층은 내부 세포 덩어리와 블라스토콜로 [1]알려진 액체로 채워진 공동을 둘러싸고 있습니다.영양아세포는 태아를 둘러싸고 있는 융모막과 양막을 생성한다.태반은 융모를 발달시키는 융모막의 태아 부분과 모체의 [2][3]자궁 조직으로부터 유래합니다."아포기"라는 이름은 그리스어 ββααβββββββαβββββαββββββββββββαββββββββαβββββββββαβββββαβββββαβαααβαααβααααα다른 동물들에게 이것은 분화되지 않은 세포의 공으로 구성된 구조이며, 포배라고 불립니다.
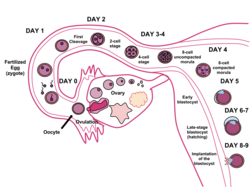
사람의 경우 수정 후 약 5일 후 16개의 세포로 이루어진 공의 초기 배아 단계인 모룰라에서 체액으로 채워진 공동이 열리면 배반포 형성이 시작된다.배반포는 직경이 약 0.1~0.2mm이고 빠른 분열(세포 분열) 후 200~300개의 세포로 구성됩니다.수정 [4]후 약 7일 후에, 배반포는 자궁벽의 자궁 내막에 박히는 착상을 받는다.거기서 그것은 위경화를 포함한 더 발전적인 과정을 거치게 될 것이다.자궁내막에 배반포를 삽입하려면 자궁내막(Zona pelllucida)에서 부화해야 하는데, 이는 태아 전기가 자궁으로 이동하면서 나팔관에 부착되는 것을 방지한다.
체외수정(IVF)에서의 배반포 사용은 수정란을 자궁으로 옮기기 전에 5일 동안 배양하는 것을 포함한다.그것은 전통적인 체외수정보다 더 실행 가능한 불임치료 방법이 될 수 있다.배반포의 내부 세포 덩어리는 배아줄기세포의 원천으로 세포 복구, 교체, 재생을 포함한 줄기세포 치료에 광범위하게 적용된다.
개발 주기
배아 발달 중 수정 후(인간의 경우 약 5~6일), 모룰라 세포는 세포 분화를 시작하고 모룰라는 배반포(lastocyst)로 변한다.자궁에서는 배반포를 둘러싸고 있는 융모세포가 분해되어 자궁벽에 삽입됩니다.착상술은 배아 [5]발생의 발아 단계의 끝을 나타낸다.
배반포 형성
접합자는 유사분열로 발달하고 16개의 세포로 발달하면 모룰라로 알려지게 된다.이 발달 단계까지 모든 세포(블라스토미어)는 자율적이며 어떤 운명에도 지정되지 않습니다.많은 동물에서, 모룰라는 캐비테이션에 의해 발달하여 소포가 된다.세포 분화는 그 후 배반포를 둘러싸고 있는 영양아세포와 세포 내부 덩어리의 두 가지 유형으로 발전시킨다.컨셉투스는 [6]배반포라고 알려져 있다.내부 세포 덩어리가 형성되는 배반포의 측면을 동물극이라고 하고, 반대쪽을 식물극이라고 합니다.압축된 영양아세포의 바깥쪽 층은 나트륨 이온을 배반포에 펌핑하여 물이 침투하여 내부 액체로 채워진 배반포 공동(블라스토켈)을 형성합니다.배반포,[7] 영양아세포, 그리고 내부 세포 덩어리는 배반포의 특징이다.
착상
착상은 초기 인간 배아의 생존과 발육에 매우 중요하다.그것은 임신의 남은 기간 동안 계속될 모체와 초기 배아 사이의 연결을 확립한다.배반포와 자궁내벽의 [8]구조적 변화를 통해 이식할 수 있다.배반포의 균열을 둘러싸고 있는 조나 펠루시다를 부화라고 합니다.이것은 배아 덩어리의 물리적 크기에 대한 제약을 제거하고 배반포의 외부 세포를 자궁 내부에 노출시킵니다.또한 모체의 호르몬 변화, 특히 황체화호르몬(LH)의 피크에 의해 자궁내막이 배반포를 받아 감쌀 준비를 한다.면역체계는 또한 외래 배아세포의 침입을 허용하도록 조절된다.일단 자궁내막의 세포외 기질에 결합되면, 영양아세포는 자궁벽에 배반포를 박기 위해 효소와 다른 요소들을 분비합니다.방출된 효소는 자궁내막을 분해하는 반면, 인간 융모막 성선 성장인자(hCG)와 인슐린 유사 성장인자(IGF)와 같은 자가분비 성장인자는 배반포가 자궁내막을 [9]더욱 침범하도록 한다.
자궁벽에 착상하는 것은 태반을 영양세포에서 형성하고 내세포 덩어리를 양낭과 상피세포로 분화하는 것을 포함한 배아 발생, 위경화의 다음 단계를 가능하게 한다.
구조.
배반체 [10]세포에는 두 가지 유형이 있습니다.
- 배아아세포라고도 알려진 내부 세포 덩어리는 원시 내배엽과 적절한 배아를 낳는다.
- 영양아세포는 배반포의 바깥쪽 고리를 형성하는 세포층으로, 태반을 형성하기 위해 모체 자궁내막과 결합합니다.영양아세포는 또한 블라스토콜을 [12]만드는 인자를 분비한다.
블라스토콜 유체 공동은 아미노산, 성장인자, 그리고 세포 [14]분화에 필요한 다른 분자들을 포함합니다.
셀 사양
여러 프로세스가 배반포의 세포 계보 종별을 제어하여 영양아세포, 상피아세포 및 원시 내배엽을 생산합니다.이러한 과정들은 유전자 발현, 세포 신호 전달, 세포-세포 접촉과 위치 관계, 그리고 후생유전학을 포함한다.
일단 ICM이 배반포 내에서 확립되면, 이 세포 덩어리는 상피세포와 원시 내배엽에 대한 추가 분해를 준비합니다.이 특정 과정은 부분적으로 세포 [15]게놈을 변화시키는 MAP 키나제 경로를 생성하는 섬유아세포 성장인자(FGF) 시그널링에 의해 결정된다.호메오도메인 단백질인 Cdx2에 의해 영양아세포 및 내부세포질량으로의 블라스트롬의 추가 분리가 조절된다.이 전사 인자는 영양아세포에서 [16]Oct4 및 Nanog 전사 인자의 발현을 억제합니다.이러한 게놈 변화는 위배 전 발달의 배반포 단계 말기에 상피세포와 원시 내배엽 계통의 점진적인 사양을 가능하게 한다.이러한 초기 태아 단계에서 수행된 연구의 대부분은 쥐 배아에 관한 것이며 포유류마다 특정한 요소들이 다를 수 있다.
이식하는 동안, 영양아세포는 태아 태반의 대부분을 형성할 태아 외막과 세포 유형을 발생시킵니다. 태아는 이후 기하급수적인 [17]성장에 필요한 모성 영양을 얻는 특수 기관입니다.영양아세포의 사양은 세포 극성으로부터 발생하는 형태학적 신호와 히포나 노치 등의 신호경로의 차이적 활성의 조합과 CDX2와 [18]같은 계통특정자의 외부세포에 대한 제한에 의해 제어된다.
생쥐에서 원시배아세포는 전 게놈 후생유전 재프로그래밍을 [19]수반하는 과정인 후생아세포에서 특정된다.재프로그래밍은 전지구적인 DNA 탈메틸화와 염색질 재구성을 수반하여 세포의 전능성을 [19]일으킨다.게놈 전체의 탈메틸화 과정은 DNA 염기 제거 복구 [20]경로를 포함한다.
영양아세포는 세포 표면에 인테그린을 발현하여 자궁벽의 세포외 기질에 부착할 수 있게 합니다.이 상호작용은 착상을 허용하고 세 가지 다른 세포 유형으로 추가 분해를 유발하여 낭포를 [21]위배용으로 준비합니다.
임상적 영향
이 섹션은 확인을 위해 추가 인용문이 필요합니다.(2013년 12월 (이 및 ) |
임신 테스트
착상 중에 배반포에서 분비되는 인간 융모막 성선 자극 호르몬의 수치는 임신 테스트에서 측정된 인자입니다.여성의 임신 여부를 판단하기 위해 혈액과 소변 모두에서 hCG를 측정할 수 있다.다발성 임신에서는 더 많은 hCG가 분비된다.hCG의 혈액 검사는 또한 비정상적인 [22]임신을 확인하기 위해 사용될 수 있다.
체외수정
체외수정(IVF)은 난자를 정자로 수정하고 그 배아를 여성의 자궁에 이식하기 위한 전통적인 체내 수정의 대안이다.수 년 동안 수정 후 2~3일 후에 태아가 자궁에 삽입되었다.그러나 이 발달 단계에서 어떤 배아가 가장 잘 발달할지를 예측하는 것은 매우 어려우며, 몇 개의 배아는 전형적으로 이식되었다.여러 개의 착상된 배아는 태아의 발육 가능성을 높였지만 다태아의 발육으로 이어졌다.이것은 체외수정에서 배아를 사용하는 데 있어 중요한 문제이자 단점이었다.
인간 체외수정을 위한 배반포의 사용은 성공적인 것으로 입증되었다.배반포는 수정 후 [23]5~6일 후에 이식된다.5, 6일 후에 어떤 배아가 건강한 정상 출산을 가져올지 결정하는 것이 훨씬 더 쉽다.어떤 배아가 성공할지 아는 것은 단 한 개의 배반포를 이식할 수 있게 해주며, 건강상의 위험과 다산의 비용을 극적으로 줄여준다.이제 배아와 배반포 발달을 위한 영양소 요구 사항이 결정되었으므로, 배아에게 배반포 단계로 지속시키기 위한 올바른 영양소를 제공하는 것이 훨씬 더 쉽다.
체외수정에 따른 배반포 이식술은 자궁경부를 통해 초음파를 통해 카테터를 질에 삽입하고 자궁에 배반포를 삽입하는 자궁에 카테터를 삽입하는 시술이다.
배반포는 또한 유전적 문제를 확인하기 위해 세포를 유전적으로 검사하는데 사용될 수 있기 때문에 이점을 제공한다.배반포에는 발달하는 배반포를 방해하지 않고 소수의 대류세포세포를 제거할 수 있을 만큼 충분한 세포가 있다.이 세포들은 이식 전 유전자 검사(PGS) 또는 종종 이식 전 유전자 진단(PGD)[24]으로 알려진 낭포성 섬유증과 같은 특정 조건을 사용하여 염색체 배수를 테스트할 수 있습니다.
배아 이식 과정
초기 초음파 후의 배아 이송 절차에서는 질벽을 개방하기 위해 검경을 사용하고 카테터를 사용하여 자궁에 [25]배치하기 위해 배아를 튜브를 통과시킨다.
「 」를 참조해 주세요.
레퍼런스
![]() 이 기사는 공공 영역의 텍스트를 포함하고 있습니다. 그레이 아나토미 (1918)
이 기사는 공공 영역의 텍스트를 포함하고 있습니다. 그레이 아나토미 (1918)
- ^ Gilbert, Scott F. (2000). "Early Mammalian Development". Developmental Biology. 6th edition. Retrieved 13 May 2022.
- ^ "trophoblast embryology". Encyclopedia Britannica. Retrieved 2021-11-01.
- ^ Solomon, Eldra (2018). Biology 11th Edition. Cengage Learning. ISBN 978-1337392938.
- ^ VanPutte C (2020). Seeley's Anatomy & Physiology. New York: McGraw-Hill. p. 1092. ISBN 978-1-260-56596-6. OCLC 1099344977.
- ^ Sherk, Stephanie Dionne (2006). "Prenatal Development". Gale Encyclopedia of Children's Health. Archived from the original on 2013-12-01. Retrieved 2013-12-07.
- ^ Nissen SB, Perera M, Gonzalez JM, Morgani SM, Jensen MH, Sneppen K, et al. (July 2017). "Four simple rules that are sufficient to generate the mammalian blastocyst". PLOS Biology. 15 (7): e2000737. doi:10.1371/journal.pbio.2000737. PMC 5507476. PMID 28700688.
- ^ Gilbert SF (2000). "Early Mammalian Development". Developmental Biology (6th ed.). Sunderland (MA): Sinauer Associates.
- ^ Zhang S, Lin H, Kong S, Wang S, Wang H, Wang H, Armant DR (October 2013). "Physiological and molecular determinants of embryo implantation". Molecular Aspects of Medicine. 34 (5): 939–80. doi:10.1016/j.mam.2012.12.011. PMC 4278353. PMID 23290997.
- ^ Srisuparp S, Strakova Z, Fazleabas AT (2001). "The role of chorionic gonadotropin (CG) in blastocyst implantation". Archives of Medical Research. 32 (6): 627–34. doi:10.1016/S0188-4409(01)00330-7. PMID 11750740.
- ^ Gilbert SF (15 July 2013). Developmental Biology. Sinauer Associates, Incorporated. ISBN 978-1-60535-173-5.[페이지 필요]
- ^ Schoenwolf GC, Larsen WJ (2009). Larsen's Human Embryology (4th ed.). Philadelphia: Churchill Livingstone/Elsevier.[페이지 필요]
- ^ James JL, Stone PR, Chamley LW (July 2005). "Cytotrophoblast differentiation in the first trimester of pregnancy: evidence for separate progenitors of extravillous trophoblasts and syncytiotrophoblast". Reproduction. 130 (1): 95–103. doi:10.1530/rep.1.00723. PMID 15985635.
- ^ Vićovac L, Aplin JD (1996). "Epithelial-mesenchymal transition during trophoblast differentiation". Acta Anatomica. 156 (3): 202–16. doi:10.1159/000147847. PMID 9124037.
- ^ Gasperowicz M, Natale DR (April 2011). "Establishing three blastocyst lineages--then what?". Biology of Reproduction. 84 (4): 621–30. doi:10.1095/biolreprod.110.085209. PMID 21123814.
- ^ Yamanaka Y, Lanner F, Rossant J (March 2010). "FGF signal-dependent segregation of primitive endoderm and epiblast in the mouse blastocyst". Development. 137 (5): 715–24. doi:10.1242/dev.043471. PMID 20147376.
- ^ Strumpf D, Mao CA, Yamanaka Y, Ralston A, Chawengsaksophak K, Beck F, Rossant J (May 2005). "Cdx2 is required for correct cell fate specification and differentiation of trophectoderm in the mouse blastocyst". Development. 132 (9): 2093–102. doi:10.1242/dev.01801. PMID 15788452.
- ^ Menchero S, Sainz de Aja J, Manzanares M (2018). "Our First Choice: Cellular and Genetic Underpinnings of Trophectoderm Identity and Differentiation in the Mammalian Embryo". Current Topics in Developmental Biology. Elsevier. 128: 59–80. doi:10.1016/bs.ctdb.2017.10.009. hdl:20.500.12105/10490. ISBN 978-0-12-804252-6. PMID 29477171.
- ^ Menchero S, Rollan I, Lopez-Izquierdo A, Andreu MJ, Sainz de Aja J, Kang M, et al. (April 2019). "Transitions in cell potency during early mouse development are driven by Notch". eLife. 8: e42930. doi:10.7554/eLife.42930. PMC 6486152. PMID 30958266.
- ^ a b Hackett JA, Sengupta R, Zylicz JJ, Murakami K, Lee C, Down TA, Surani MA (January 2013). "Germline DNA demethylation dynamics and imprint erasure through 5-hydroxymethylcytosine". Science. 339 (6118): 448–52. Bibcode:2013Sci...339..448H. doi:10.1126/science.1229277. PMC 3847602. PMID 23223451.
- ^ Hajkova P, Jeffries SJ, Lee C, Miller N, Jackson SP, Surani MA (July 2010). "Genome-wide reprogramming in the mouse germ line entails the base excision repair pathway". Science. 329 (5987): 78–82. Bibcode:2010Sci...329...78H. doi:10.1126/science.1187945. PMC 3863715. PMID 20595612.
- ^ Damsky CH, Librach C, Lim KH, Fitzgerald ML, McMaster MT, Janatpour M, et al. (December 1994). "Integrin switching regulates normal trophoblast invasion". Development. 120 (12): 3657–66. doi:10.1242/dev.120.12.3657. PMID 7529679. Archived from the original on 2020-05-27. Retrieved 2013-12-10.
- ^ "Human Chorionic Gonadotropin (hCG)". WebMD. 2010. Retrieved 2013-12-07.
- ^ Fong CY, Bongso A, Ng SC, Anandakumar C, Trounson A, Ratnam S (March 1997). "Ongoing normal pregnancy after transfer of zona-free blastocysts: implications for embryo transfer in the human". Human Reproduction. 12 (3): 557–60. doi:10.1093/humrep/12.3.557. PMID 9130759.
- ^ Wang J, Sauer MV (December 2006). "In vitro fertilization (IVF): a review of 3 decades of clinical innovation and technological advancement". Therapeutics and Clinical Risk Management. 2 (4): 355–64. doi:10.2147/tcrm.2006.2.4.355. PMC 1936357. PMID 18360648.
- ^ "Embryo transfer process".
외부 링크