감수 분열
Meiosis감수 분열(/maɪosʊs/![]() (listen); 고대 그리스 μμεωmeme(meiosis)의 '축소 분열'[1][2]은 정자나 난자 세포와 같이 생식체를 생성하는 성 생식 유기체의 특별한 세포 분열 유형이다.그것은 궁극적으로 각 염색체의 복사본이 하나만 있는 4개의 세포를 만드는 두 번의 분열을 수반한다.또한 분할 전에 각 염색체의 부계 및 모계 복사본에서 나온 유전 물질이 교차되어 각 [3]염색체에 새로운 코드 조합이 생성된다.나중에 수정하는 동안, 수컷과 암컷으로부터 감수분열로 생성된 반수체 세포는 융합하여 각 염색체의 두 복사본인 접합체를 가진 세포를 다시 만들 것입니다.
(listen); 고대 그리스 μμεωmeme(meiosis)의 '축소 분열'[1][2]은 정자나 난자 세포와 같이 생식체를 생성하는 성 생식 유기체의 특별한 세포 분열 유형이다.그것은 궁극적으로 각 염색체의 복사본이 하나만 있는 4개의 세포를 만드는 두 번의 분열을 수반한다.또한 분할 전에 각 염색체의 부계 및 모계 복사본에서 나온 유전 물질이 교차되어 각 [3]염색체에 새로운 코드 조합이 생성된다.나중에 수정하는 동안, 수컷과 암컷으로부터 감수분열로 생성된 반수체 세포는 융합하여 각 염색체의 두 복사본인 접합체를 가진 세포를 다시 만들 것입니다.
감수분열 오류는 유산의 주요 원인이고 발달 [4]장애의 가장 빈번한 유전적 원인이다.
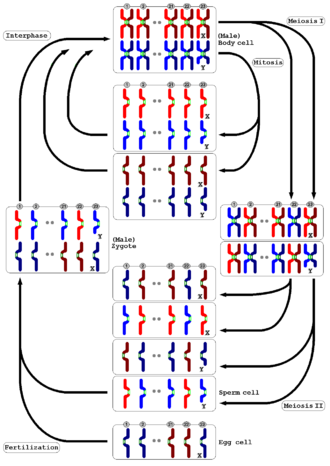
감수분열에서 DNA 복제는 두 번의 세포분열을 거쳐 네 개의 딸세포를 생성하는데, 각각의 세포는 [3]원래 부모세포의 염색체 수의 절반이다.두 감수분열은 감수분열 I과 감수분열 II로 알려져 있다.감수분열이 시작되기 전, 세포주기의 S단계 동안, 각 염색체의 DNA는 자매 염색체 응집을 통해 함께 유지되는 두 개의 동일한 자매 염색체로 구성되도록 복제된다.이 S상을 "미생물 S상" 또는 "미생물 S상"이라고 할 수 있다.DNA 복제 직후, 감수 분열 세포는 감수 분열 전기로 알려진 장기 G-양2 단계로 진입한다.이 기간 동안, 상동 염색체들은 서로 짝을 이루어 유전자 재조합을 겪는다. 이것은 DNA가 절단되고 복구되는 프로그램된 과정으로, 그들이 그들의 유전자 정보의 일부를 교환할 수 있게 해준다.재조합 이벤트의 서브셋은 상동 염색체 사이에 키아스마타(chiasma, 그리스 문자 Chi( chi)의 경우)로 알려진 물리적 연결을 만드는 크로스오버를 초래한다.대부분의 유기체에서, 이러한 연결은 감수 분열 I 동안 각각의 상동 염색체 쌍이 서로 분리되도록 유도할 수 있고, 부모 세포로서 염색체 수의 반을 가진 두 개의 반수체 세포를 만들 수 있습니다.
감수분열II에서는 자매염색체간의 응집력이 방출되어 유사분열시처럼 서로 분리된다.어떤 경우에는, 네 개의 감수생물 생성물 모두가 정자, 포자, 꽃가루와 같은 생식체를 형성한다.암컷 동물에서, 네 개의 감수생성 생성물 중 세 개는 전형적으로 극지방으로 압출되어 제거되고, 오직 한 개의 세포만이 난자를 생성하기 위해 발달합니다.감수 분열 동안 염색체의 수가 반으로 줄어들기 때문에, 배우자는 융합(즉 수정)하여 각 염색체의 두 개의 복사본, 즉 부모로부터 하나씩을 포함하는 이배체 접합체를 형성할 수 있다.따라서, 감수 분열과 수정의 교대로 일어나는 주기는 성적인 번식을 가능하게 하며, 다음 세대는 같은 수의 염색체를 유지한다.예를 들어, 이배체 인간 세포는 1쌍의 성염색체(총 46개), 모계 기원의 절반, 부계 기원의 절반을 포함한 23쌍의 염색체를 포함한다.감수분열은 23개의 염색체를 가진 반수체 생식체를 생성한다.두 개의 생식체(난자와 정자)가 결합할 때, 그 결과로 생긴 접합자는 다시 한 번 이중배수가 되며, 엄마와 아빠는 각각 23개의 염색체를 기여한다.감수분열을 이용하는 모든 생물에서 같은 수의 염색체가 아니라 같은 패턴이 나타난다.
감수분열은 동물, 식물 그리고 [5][6][7]곰팡이를 포함한 성적으로 재생되는 단세포와 다세포 생물에서 발생합니다.그것은 발아 및 정자 형성에 필수적인 과정이다.
개요
감수분열 과정은 유사분열의 보다 일반적인 세포분열 과정과 관련이 있지만, 두 가지 중요한 측면에서 다르다.
| 재결합 | 감수 분열 | 각 쌍의 두 염색체 사이의 유전자를 섞는 것(각 부모로부터 받은 것)으로, 모든 생식체에서 독특한 유전자 조합을 가진 재조합 염색체를 생성한다. | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 유사 분열 | DNA 손상을 복구하는 데 필요한 경우에만 발생한다. 보통 동일한 자매 염색체 사이에 발생하며 유전적 변화를 일으키지 않는다 | ||||||||||
| 염색체수(배체) | 감수 분열 | 부모처럼 각각 염색체 수의 절반인 유전적으로 독특한 4개의 세포를 생산한다 | |||||||||
| 유사 분열 | 부모 세포와 같은 수의 염색체를 가진 두 개의 유전적으로 동일한 세포를 생성한다 | ||||||||||
감수분열은 호몰로지라고 불리는 각 염색체의 두 개의 복사본을 포함하는 이배체 세포에서 시작된다.첫째, 세포는 DNA 복제를 거친다. 그래서 각각의 상동물은 이제 두 개의 동일한 자매 염색체로 구성된다.그리고 나서, 각각의 상동체 세트는 서로 짝을 이루어 상동체 재조합에 의해 유전 정보를 교환하고 종종 상동체들 사이의 물리적 연결(크로소버)로 이어진다.제1 감수분할에서는 방추장치에 의해 상동세포를 분리하여 분리한다.그리고 나서 세포들은 DNA 복제의 중간 라운드 없이 두 번째 분열을 진행합니다.자매 염색체는 분리되어 딸세포를 분리하여 총 4개의 반수체 세포를 생성한다.암컷 동물들은 이 패턴에 약간의 변화를 가지고 하나의 큰 알과 두 개의 작은 극체를 생산한다.재조합으로 인해, 개별 염색분체는 모성 유전 정보와 부성 유전 정보의 새로운 조합으로 구성될 수 있고, 그 결과 유전적으로 부모로부터 구별되는 자손을 낳을 수 있다.또한 개별 배우자는 모계, 부계 및 재조합 크로마토이드 모종을 포함할 수 있다.성적 번식에서 비롯되는 이러한 유전적 다양성은 자연 선택이 작용할 수 있는 특징의 변화에 기여합니다.
감수분열은 하나의 세포를 두 개의 동일한 딸 세포로 나누기 위해 진핵 생물이 사용하는 세포 분열의 종류인 유사분열과 같은 메커니즘을 많이 사용한다.몇몇 식물, 곰팡이, 그리고 원생동물에서 감수분열은 포자의 형성을 야기한다: 수정 없이 식물적으로 분열할 수 있는 반수체 세포.bdelloid 로티퍼와 같은 일부 진핵생물들은 감수분열을 수행할 능력이 없고 처녀생식으로 번식할 수 있는 능력을 가지고 있다.
감수분열은 고세균이나 박테리아에서는 일어나지 않으며, 일반적으로 2분열을 통해 무성생식을 한다.하지만, 수평 유전자 이동으로 알려진 "성" 과정은 한 박테리아나 시조류에서 다른 박테리아로 DNA를 옮기고 다른 부모 기원의 DNA 분자들의 재결합을 포함합니다.
역사
감수분열은 1876년 독일 생물학자 오스카 헤르트위그에 의해 성게알에서 처음으로 발견되고 기술되었다.1883년 벨기에 동물학자 에두아르 반 베네덴이 아스카리스 회충 알을 염색체 수준으로 다시 기술했다.그러나 감수분열이 생식과 유전에서 차지하는 중요성은 1890년에야 독일 생물학자 아우구스트 바이즈만에 의해 설명되었는데, 그는 염색체 수가 유지되어야 한다면 하나의 이배체 세포를 4개의 반수체 세포로 변환하기 위해 2개의 세포 분열이 필요하다고 지적했다.1911년, 미국의 유전학자 토마스 헌트 모건은 초파리 드로소필라 멜라노가스터에서 감수 분열의 교차자를 발견했는데, 이것은 유전적인 특성이 염색체에 전달된다는 것을 입증하는 데 도움을 주었다.
"meiosis"라는 용어는 '임대'를 뜻하는 그리스어 μμδδδδδα에서 유래했다.그것은 J.B.에 의해 생물학에 소개되었다. 농부와 J.E.S. 1905년 Moore는 독특한 렌더링 "maiosis"를 사용하여 다음과 같이 표현했습니다.
우리는 Maiosis 또는 Maiotic phase라는 용어를 Flemming에 [8]의해 Hetherype과 Homotype으로 지정된 두 중분류에서 포함된 핵변화의 전체 시리즈를 커버하기 위해 적용할 것을 제안한다.
철자는 [9]케르니케(1905)와 판텔과 드 시네티(1906)에 의해 그리스어를 번역하는 통상적인 관례를 따르기 위해 "meiosis"로 바뀌었다.
단계
감수분열은 감수분열 I과 감수분열 II로 나뉘며, 감수분열 I과 사이토키네시스 I과 사이토키네시스 II와 사이토키네시스 II로 다시 나뉜다.감수분열로 이어지는 준비단계는 유사분열 세포주기의 [10]중간단계와 패턴과 이름이 같다.상간은 3가지 상으로 나뉩니다.
- 성장 1(G1) 단계:이 매우 활동적인 단계에서, 세포는 성장을 위해 필요한 효소와 구조 단백질을 포함한 방대한 단백질의 배열을 합성합니다.G에서1 각각의 염색체는 DNA의 단일 선형 분자로 구성됩니다.
- 합성(S) 단계:그 유전 물질은 복제된다; 세포의 각각의 염색체는 복제되어 동원체에 붙어있는 두 개의 동일한 자매 염색체가 된다.이 복제는 동원체 수를 동일하게 유지하므로 세포의 배율을 변경하지 않습니다.동일한 자매 염색체는 아직 빛 현미경으로 볼 수 있는 밀집된 염색체로 응축되지 않았다.이것은 감수 분열의 1단계 전기에 일어날 것이다.
- Growth 2 (G2) phase : 유사분열2 전에 본 G phase는 감수분열에는 존재하지 않는다.감수생물학적 전기는 유사분열 세포 주기의2 G 단계에 가장 가깝다.
중간단계는 감수분열 I과 감수분열 II로 이어진다.감수 분열 I은 각각 여전히 두 개의 자매 염색체로 구성된 복제된 상동 염색체를 두 개의 딸 세포로 분리하여 염색체 수를 절반으로 줄인다.감수분열II 중에 자매염색체가 분리되고 그 결과 얻은 딸염색체가 4개의 딸세포로 분리된다.이배체 유기체의 경우 감수분열로 인한 딸세포는 반수체이며 각 염색체의 복사본 하나만 포함한다.몇몇 종에서 세포는 감수분열 I과 감수분열 II 사이의 운동간으로 알려진 휴식기에 들어간다.
감수분열 I과 II는 각각 유사분열 세포 주기에서의 유사한 하위 단계와 유사한 전상, 중기, 후상, 말기 단계로 나뉜다.따라서 감수분열은 감수분열 I단계(단계 I, 중기 I, 단계 I, 단계 I)와 감수분열 II단계(단계 II, 중기 II, 단계 II, 단계 II)의 단계를 포함한다.
감수분열 동안, 특정 유전자는 더 [11][12]많이 전사된다.mRNA의 강한 감수 분열 단계 특이적 발현 외에도, 감수 분열 [13]중 유전자의 궁극적인 감수 분열 단계 특이적 단백질 발현을 조절하는 광범위한 번역 제어(예: 사전 형성된 mRNA의 선택적 사용)가 있다.따라서, 전사 제어와 번역 제어 모두 감수분열을 수행하기 위해 필요한 감수세포의 광범위한 재구성을 결정한다.
감수 분열 I
감수분열 I은 각각 염색체 쌍(1n, 2c)을 포함하는 2개의 반수체 세포(2n, 4c)를 생성하며, 상동 염색체를 분리한다.이배체에서 반배체로 환원되기 때문에 감수분열 I을 환원분열이라고 한다.감수분열 II는 유사분열과 유사한 균등분열로 자매 염색체가 분리되어 4개의 반수체 딸세포(1n, 1c)[14]를 생성한다.
프로 단계 I
1단계는 감수 분열의 가장 긴 단계이다(14일 중 13일 지속[15]).1상 동안, 상동 모계 및 부계 염색체 쌍, 시냅스 및 (상동 재조합에 의해) 유전 정보를 교환하여 염색체 [16]당 적어도 하나의 교차점을 형성한다.이러한 교차로는 키아스마타(복수, 단수 키아즈마)[17]로 볼 수 있습니다.이 과정은 상동 염색체 간의 안정적인 쌍을 촉진하고 따라서 첫 번째 감수 분열에서 염색체의 정확한 분리를 가능하게 한다.쌍을 이루고 복제된 염색체는 쌍생체 또는 4염색체라고 불리며, 각각의 부모로부터 하나의 염색체가 나온다.전상 I은 염색체의 외관에 따라 이름이 붙여지는 일련의 하위 물질로 나뉩니다.
렙토텐
전기의 첫 단계는 "얇은 실"[18]: 27 을 뜻하는 그리스어에서 유래한 렙토텐 단계입니다.전상 I의 이 단계에서, 각각 2개의 복제된 자매 염색체로 구성된 개별 염색체는 [18]: 27 [19]: 353 핵 내에서 가시적인 가닥을 형성하기 위해 "개별화"된다.염색체는 각각 응집체에 의해 매개되는 루프의 선형 배열을 형성하고, 시냅토네말 복합체의 측면 요소들은 루프가 나오는 [20]"축 요소"를 형성합니다.재조합은 프로그램된 이중 가닥 절단을 생성하는 효소 SPO11에 의해 이 단계에서 시작됩니다([21]마우스에서 감수 분열당 약 300).이 과정은 RAD51과 DMC1에 의해 코팅된 단일 가닥 DNA 필라멘트를 생성하며, 이 필라멘트는 상동 염색체에 침입하여 축간 브릿지를 형성하고 상동 염색체의 쌍/공정렬을 초래한다([20][22]마우스에서 약 400nm 거리까지).
지고텐
렙토텐은 "쌍의 실"[18]: 27 을 뜻하는 그리스 단어에서 zygonema라고도 알려진 zygotene 단계 뒤에 오는데,[23] 이것은 또한 어떤 유기체에서는 핵의 한쪽 끝에 텔로미어가 뭉치는 방식 때문에 꽃다발 단계라고도 불린다.이 단계에서 상동 염색체들은 훨씬 더 가까워지고(~100 nm), 시냅스 [20]복합체의 횡방향 및 중심 요소의 설치에 의해 안정적으로 쌍을 이룬다(시냅시스라고 불리는 과정).시냅시스는 재조합 결절부터 지퍼처럼 생긴다고 생각됩니다.쌍을 이룬 염색체는 2가 또는 4가 염색체라고 불린다.
빠치텐
파치틴 스테이지, 파치네마라고도 불리는 파치틴 스테이지(/ meaningick"[18]: 27 ː/ pak pak pak-----),),),), the the meaning ( ( ( the the the the the the the the the the the the the)모든 상염색체가 합쳐지는 단계입니다.이 단계에서 염색체 크로스오버(크로스오버)를 포함한 상동 재조합은 [20]렙토텐에서 형성된 이중 가닥 절단 수복을 통해 완료된다.대부분의 파손은 유전자 [24]변환을 야기하는 크로스오버를 형성하지 않고 복구된다.그러나, 파괴의 서브셋(염색체당 최소 1개)은 비 자매(상동) 염색체 간에 교차로를 형성하여 유전자 정보를 [25]교환한다.그러나 성염색체는 완전히 동일하지는 않으며, 유사 자가 염색체 [26]영역이라고 불리는 호몰로지의 작은 영역에서만 정보를 교환한다.상동 염색체 간의 정보 교환은 정보의 재조합을 야기한다; 각각의 염색체는 이전에 가지고 있던 완전한 정보 세트를 가지고 있고, 그 과정의 결과로 형성된 틈은 없다.시냅토네마 복합체에서는 염색체를 구별할 수 없기 때문에 실제로 교차하는 행위는 일반 광현미경으로는 느낄 수 없고 키아스마타는 다음 단계까지 볼 수 없다.
디플로텐
디플로텐 단계,[18]: 30 또한 "두 개의 실"을 의미하는 그리스 단어로부터, 디플로네마로 알려진 동안, 시냅토네말 복합체는 분해되고 상동 염색체는 서로 조금 분리된다.그러나 각 2가의 상동 염색체는 교차이 일어난 부위인 키아스마타에 단단히 묶여 있다.키아스마타는 상동 염색체가 세포의 반대 극으로 이동할 수 있도록 하기 위해 무지외상 I기로 전환될 때 절단될 때까지 염색체 위에 남아 있다.
인간의 태아 발육에서 모든 난모세포는 이 단계까지 발달하여 출생 [27]전 단계 I에서 정지된다.이 일시정지 상태를 딕티오텐 단계 또는 딕티케이트라고 합니다.감수분열이 재개될 때까지 지속되며 사춘기나 그 이후에 배란을 위한 난모세포를 준비한다.
디아키네시스
염색체는 디아키네시스 단계에서 "움직임"[18]: 30 을 의미하는 그리스어에서 더 많이 응축된다.이것은 감수 분열의 첫 번째 지점이며, 4개의 사각형 부분이 실제로 보입니다.교차하는 부위가 서로 얽히고 설켜 효과적으로 겹치면서 키아스마타가 선명하게 보입니다.이러한 관찰을 제외하고, 나머지 단계는 유사 분열의 프로메타기와 매우 유사하다; 핵은 사라지고, 핵막은 소포로 분해되고, 감수 분열 방추는 형성되기 시작한다.
감수성 스핀들 형성
유사분열세포와 달리 인간과 생쥐 난모세포는 감수성 방추체를 생성하기 위한 중심체를 가지고 있지 않다.생쥐의 경우, 약 80개의 마이크로튜브 조직 센터(MTOCs)가 OOplasm에 구를 형성하고 염색체 쪽으로 뻗어나가는 핵소관을 형성하기 시작합니다.시간이 지남에 따라 두 개의 극이 형성될 때까지 MTOC가 합쳐져 배럴 모양의 [28]스핀들이 생성됩니다.인간의 난모세포에서 방추 미세관 핵생성이 염색체에서 시작되어 결국 [29]염색체를 둘러싸기 위해 확장되는 별 모양을 형성한다.그리고 나서 염색체는 미소관을 따라 방추의 적도를 향해 미끄러져, 염색체 키네토코어는 미소관에 [30]끝부분의 부착을 형성합니다.
메타페이즈 I
상동성 쌍은 메타페이즈 플레이트를 따라 함께 이동합니다.양쪽 스핀들 극으로부터의 키네토코어 마이크로튜브가 각각의 키네토코어에 부착될 때, 한 쌍의 상동 염색체는 상동 염색체의 2개의 키네토코어에서 나오는 미소튜브에 의해 쌍생체에 가해지는 지속적인 균형력에 의해 스핀들을 양분하는 적도면을 따라 정렬된다.이 첨부 파일을 바이폴라 첨부 파일이라고 합니다.염색체의 독립적 분류의 물리적 기초는 같은 적도선을 [17]따라 있는 다른 이원체의 방향과 관련하여 메타기판과 함께 각 이원체의 무작위 방향이다.단백질 복합체 응집제는 자매 염색체를 복제 시점부터 아나phase까지 함께 유지합니다.유사분열에서는 반대 방향으로 당기는 키네토코어 미세관의 힘이 장력을 일으킨다.세포는 이 긴장을 감지하고 모든 염색체가 제대로 쌍방향으로 배치될 때까지 무지외상기와 함께 진행되지 않는다.감수분열에서 긴장을 확립하는 것은 자매 염색체 사이의 응집소 외에 일반적으로 염색체 쌍당 적어도 하나의 교차점을 필요로 한다(염색체 분리 참조).
아나페이즈 1
키네토코어 미세관은 상동 염색체 (각각 자매 염색체 쌍으로 구성됨)를 반대 극으로 끌어당기면서 짧아진다.키네토코어가 아닌 미세튜브가 늘어나면서 중심체를 더 멀리 밀어냅니다.세포는 중앙 [17]아래쪽으로 분열하기 위해 연장됩니다.유사분열과는 달리 염색체 팔의 응집체만 분해되고 동원체를 둘러싼 응집체는 자매 염색체의 [31]분리를 막는 슈고신이라는 단백질에 의해 보호된다.이것은 호몰로지가 분리되는 동안 자매 염색체가 함께 남아 있게 해줍니다.
텔로페이즈 I
첫 번째 감수분열은 염색체가 극에 도달하면 사실상 끝난다.각각의 딸 세포는 현재 염색체 수의 절반을 가지고 있지만 각각의 염색체는 한 쌍의 염색체들로 구성되어 있다.스핀들 네트워크를 구성하는 미세관은 사라지고 새로운 핵막이 각 반수체 세트를 둘러싸고 있습니다.염색체는 다시 염색질로 풀린다.동물 세포에서 세포막이 꼬집히거나 식물 세포에서 세포벽이 형성되는 사이토키네시스(Cytokinesis)가 일어나 두 개의 딸세포가 생성된다.그러나 세포 분열이 끝날 때까지 세포질이 딸 세포 간에 공유될 수 있는 세포질 브릿지(cytoplasmic bridge)는 완전히 완성되지 않는다.[32]자매 염색체들은 말기 I 동안 붙어있다.
세포는 인터키네시스 또는 인터페이즈 II로 알려진 휴지기에 들어갈 수 있다.이 단계에서는 DNA 복제가 발생하지 않습니다.
감수 분열 II
감수분열II는 두 번째 감수분열로 보통 균등분열 또는 자매염색체의 분리를 포함한다.기계적으로, 그 과정은 유사분열과 유사하지만 유전적인 결과는 근본적으로 다르다.최종 결과는 감수분열 I에서 생성된 두 개의 반수체 세포(각각 n개의 염색체를 가지고, 2개의 자매 염색체로 구성됨)에서 4개의 반수체 세포(n개의 염색체, 인간의 23개)를 생산한다.감수 분열 II의 네 가지 주요 단계는 전상 II, 중상 II, 후상 II, 말단 II이다.
제2상에서는 염색분체의 단축과 비후뿐만 아니라 핵과 핵 외피의 소실을 다시 볼 수 있다.중심체는 극지방으로 이동하며 두 번째 감수분할을 위해 방추섬유를 배열한다.
중기 II에서, 동원체는 반대 극의 중심체에서 방추 섬유에 부착되는 2개의 키네토코어를 포함한다.새로운 적도 중기의 판은 이전 [33]판과 수직인 감수 분열 I과 비교하여 90도 회전합니다.
이어서 아나페기II가 있는데, 아나페기II에서는 슈고신에 의해 보호되지 않는 나머지 중심체 응집체가 분해되어 자매 염색체가 분리된다.관례상 자매 염색체는 반대 [31]극으로 이동하기 때문에 자매 염색체라고 불립니다.
이 과정은 텔로페이즈 I과 유사한 텔로페이즈 II로 끝나며, 염색체의 축합과 연장, 방추의 분해로 특징지어진다.핵 외피가 다시 형성되고 분열 또는 세포판 형성은 결국 각각 반수체 염색체를 가진 총 4개의 딸 세포를 생성한다.
감수분열은 이제 완료되었고 결국 4개의 새로운 딸세포가 생기게 된다.
원점 및 기능
감수분열 동안 만들어진 DNA의 새로운 조합은 돌연변이와 함께 유전자 변이의 중요한 원천이며, 이로울 수 있는 새로운 대립 유전자의 조합을 만들어낸다.감수분열은 두 가지 방법으로 배우자의 유전적 다양성을 생성한다: (1) 독립적 분류의 법칙.중기의 I와 II의 자매 염색체의 방향 중기의 I와 II의 자매 염색체의 방향을 따라 상동 염색체 쌍의 독립적 방향, 이것은 후기의 I와 II 동안 상동 염색체와 자매 염색체의 분리이다. 이것은 각 딸 세포에 염색체의 무작위적이고 독립적인 분배를 가능하게 한다(그리고 최후통첩배우자에 대하여)[34] 및 (2) 교차.1상 동안 상동 재조합에 의한 상동 염색체 영역의 물리적 교환은 [35]염색체 내에서 유전 정보의 새로운 조합을 야기한다.
제1상 체포
암컷 포유동물과 조류는 미래의 배란에 필요한 모든 난모세포를 가지고 태어나며, 이러한 난모세포는 감수 [36]분열의 전 단계 I에서 멈춘다.예를 들어 인간의 경우 난모세포는 태아의 임신 3개월에서 4개월 사이에 형성되어 출생 시에 존재한다.이 전단계에서 나는 수십 년 동안 지속될 수 있는 단계(dictyate)를 체포했다. 게놈의 복사본은 난모세포에 4개 있다.4개의 게놈 복사 단계에서 octeyes의 체포는 생식선 [36]DNA의 손상을 복구하는 데 필요한 정보 중복성을 제공하기 위해 제안되었다.사용된 복구 과정은 상동 재조합[36][37] 복구와 관련된 것으로 보인다. 1단계 구속 난모세포는 DNA 손상, 특히 외생적으로 유도된 이중 가닥 [37]절단을 효율적으로 복구할 수 있는 높은 능력을 가지고 있다.DNA 복구 능력은 암컷 배아 라인의 핵심 품질 관리 메커니즘이자 [37]불임성의 중요한 결정 요인인 것으로 보인다.
발생.
라이프 사이클 중
감수분열은 감수분열과 수정의 지속적인 주기적 과정으로 구성되는 성적 번식을 포함한 진핵생물 수명 주기 동안 발생합니다.이것은 정상적인 유사분열 세포 분열과 함께 일어난다.다세포 유기체에서는 유기체가 자라는 이배체와 반배체 전이 사이에 중간 단계가 있다.생명 주기의 특정한 단계에서, 생식 세포는 배우자를 생산한다.체세포는 유기체의 몸을 구성하고 배우자 생성에 관여하지 않는다.
감수분열과 수정 사건을 순환시키면 반수체와 이배체 상태가 번갈아 번갈아 번갈아 번갈아 반복된다.라이프 사이클의 유기 단계는 이배체 상태(이배체 라이프 사이클), 반배체 상태(반배체 라이프 사이클), 또는 둘 다(하나는 반배체 상태, 다른 하나는 이배체 상태) 중에 발생할 수 있습니다.이러한 의미에서 성생식을 이용하는 라이프 사이클에는 유기체 단계의 위치에 따라 구별되는 세 가지 유형이 있다.[citation needed]
인간이 일부인 이배체 라이프 사이클에서, 유기체는 접합자라고 불리는 이배체 세포에서 성장한 이배체이다.이 유기체의 이배체 배아줄기세포는 감수분열 과정을 거쳐 접합체를 형성하기 위해 수정하는 반수체 생식체(남성에게는 정자, 여성에게는 난자)를 만든다.이배체 접합자는 유기체로 성장하기 위해 세포분열을 반복한다.
반수체 라이프 사이클에서 유기체는 대신 생식체라고 불리는 단일 반수체 세포의 증식과 분화에 의해 생성된 반수체입니다.대립하는 성별의 두 유기체는 그들의 반수체 생식체를 기여시켜 이배체 접합체를 형성한다.접합자는 즉시 감수분열 과정을 거치며 4개의 반수체 세포를 생성한다.이 세포들은 유기체를 만들기 위해 유사분열 과정을 거친다.많은 균류와 원생동물들은 반수생물의 [citation needed]생명주기를 이용한다.
마지막으로, 반수체 수명 주기(포자성 또는 중간 감수분열 포함)에서, 살아있는 유기체는 반수체와 이중수체 상태를 번갈아 가며 변합니다.따라서 이 순환은 세대교체라고도 합니다.이배체 생물의 배아줄 세포는 포자를 만들기 위해 감수분열 과정을 거친다.포자는 유사분열로 증식하여 반수체로 성장한다.반수체 유기체의 생식체는 다른 반수체 유기체의 생식체와 결합해 접합체를 만든다.접합자는 다시 이배체 유기체가 되기 위해 반복적인 유사분열과 분화를 거친다.반수체 수명 주기는 이원체 수명 [38][citation needed]주기와 반수체 수명 주기의 융합으로 간주될 수 있다.
식물과 동물에서
감수분열은 모든 동물과 식물에서 일어난다.최종 결과는 부모 세포와 절반의 염색체 수를 가진 생식체의 생산은 같지만 세부적인 과정은 다르다.동물에서 감수분열은 배우자를 직접 생산한다.육지 식물이나 일부 조류에서는, 이배체 포자체 세대에서의 감수 분열이 단배체 포자를 생성하는 세대 교대가 있다.이러한 포자는 유사분열로 증식하여 반수체 배우체 생성으로 발전하고, 그 후 직접적으로 배우체를 발생시킨다(즉, 추가적인 감수분열 없이).동물과 식물에서, 마지막 단계는 생식체가 융합하는 것으로,[39] 원래의 염색체 수를 회복하는 것이다.
포유동물에서
여성의 경우, 감수분열은 난모세포로 알려진 세포에서 일어난다.각각의 1차 난모세포는 감수분열로 두 번 분열하는데, 각각의 경우에서 균등하지 않다.첫 번째 분할은 딸 세포와 두 번째 분할을 거치거나 하지 않는 훨씬 작은 극체를 생성합니다.감수분열II에서 딸세포의 분열은 제2의 극체와 하나의 반수체 세포를 생성하며, 이 세포는 확대되어 난자가 된다.그러므로, 암컷에서 감수분열을 겪는 각각의 1차 난모세포는 하나의 성숙한 난자와 하나 또는 두 개의 극체를 낳는다.
암컷은 감수분열 중에 멈춘다는 것에 유의하세요.성숙 난모세포는 감수분열 I의 전단계에서 정지되어 모낭이라고 불리는 체세포의 보호껍질 안에 잠복해 있다.각 생리 주기의 시작에서 뇌하수체 전엽으로부터의 FSH 분비는 모낭형성이라고 알려진 과정으로 몇 개의 모낭을 성숙하도록 자극합니다.이 과정 동안 성숙 난모세포는 감수분열을 재개하고 감수분열 II의 중기까지 지속되며, 여기서 배란 직전에 다시 저지된다.이 난모세포들이 정자에 의해 수정되면, 다시 시작되어 감수분열이 완료된다.인간의 모낭 형성 동안, 보통 한 개의 모낭이 지배적이 되는 반면 다른 모낭은 폐쇄증을 겪는다.여성의 감수분열 과정은 생식 중에 일어나며, 전형적인 감수분열과는 달리 딕티케이트 단계로 알려진 오랜 기간의 감수분열과 중심체의 [40][41]도움을 받지 못한다는 점에서 다릅니다.
남성에서 감수분열은 고환의 정관 내에서 정자 형성 중에 발생한다.정자 형성 중의 감수 분열은 나중에 정자가 되기 위해 성숙할 정자 세포라고 불리는 세포에 특유하다.원시배아세포의 감수분열은 여성보다 훨씬 늦은 사춘기에 일어난다.수컷 고환의 조직은 레티노산을 분해함으로써 감수분열을 억제하고 감수분열 촉진제로 제시된다.이것은 세르톨리 세포라고 불리는 정관 내의 세포들이 그들만의 레티노산을 만들기 시작하는 사춘기에 극복된다.레티노산에 대한 민감도는 또한 나노와 [42][43]DAZL이라고 불리는 단백질에 의해 조절된다.레티노인산 생성 효소에 대한 유전자 기능 상실 연구는 레티노인산이 정자 분화를 자극하기 위해 산후에 필요하며, 며칠 후 감수분열이 시작되는 [44]기간에는 레티노인산이 필요하지 않다는 것을 보여주었다.
암컷 포유동물에서 감수분열은 태초의 생식세포가 배아의 난소로 이동한 직후에 시작된다.일부 연구는 원시 신장(메소네프로스)에서 유래한 레티노산이 배아 난소성 난소성 감열증을 자극하고 배아 남성 고환의 조직이 레티노산을 [45]분해함으로써 감수분열을 억제한다는 것을 시사한다.그러나 레티노인산 생성 효소에 대한 유전자 기능 상실 연구는 레티노인산이 태생[46] 중에 발생하는 여성 감수분열 또는 [44]산후 개시되는 남성 감수분열 개시에 필요하지 않음을 보여주었다.
편모충류
대부분의 진핵생물이 2분할 감수분열인 반면, 매우 드문 형태인 1분할 감수분열은 나무를 먹는 바퀴벌레 크립토세쿠스의 [47]내장에 있는 편모충류에서 발생합니다.
인간의 유전학과 질병에서의 역할
23쌍의 인간 염색체 사이의 재조합은 실제 염색체뿐만 아니라 각각의 염색체 조각도 재배포하는 역할을 한다.또한 수컷에 비해 암컷의 재조합이 1.6배 더 많은 것으로 추정된다.또한 평균적인 여성 재조합은 동원체에서 더 높고 남성 재조합은 텔로미어에서 더 높다.평균적으로 100만 bp(1Mb)는 1cMorgan(cm = 1% 재결합 빈도)[48]에 해당합니다.크로스오버 빈도는 불확실합니다.효모, 마우스 및 인간에서는 감수생물세포 1개당 200개 이상의 이중사슬절단(DSB)이 형성되는 것으로 추정되고 있다.그러나 DSB의 하위 집합(생물에 따라 5~30%)만이 교차로를 [49]생성하며, 이는 인간 염색체당 1-2개만 교차한다.
비접속
감수분열 I의 염색체 또는 감수분열 II의 자매염색체의 정상적인 분리를 분리라고 한다.분리가 정상적이지 않은 경우 이를 비분할이라고 합니다.이것은 특정 염색체의 너무 많거나 너무 적은 수의 생식체를 생산하게 되며, 삼출술이나 단출술의 일반적인 메커니즘이다.무접합은 감수분열 I 또는 감수분열 II, 세포 재생 단계 또는 유사분열 중에 발생할 수 있습니다.
대부분의 단염색체 및 삼염색체 인간 배아는 생존할 수 없지만, 가장 작은 염색체인 21번 염색체에 대한 삼염색체와 같은 일부 배수는 허용될 수 있다.이러한 배수의 표현형은 심각한 발달 장애에서 무증상까지 다양하다.의학적 조건은 다음을 포함하지만 이에 한정되지 않습니다.
- 다운증후군– 21번 염색체의 삼분절제술
- 파타우 증후군 – 13번 염색체의 삼분열
- 에드워즈 증후군 – 18번 염색체의 삼분절제술
- 클라인펠터 증후군 – XXY, XXXY, XXXY 등 남성의 추가 X염색체.
- 터너 증후군 – 여성 X 염색체 1개 없음 – 즉 X0
- 트리플 X 증후군 – 여성의 추가 X 염색체
- 제이콥스 증후군 – 남성의 추가 Y 염색체.
인간 난모세포에서 비접합 가능성은 모성 [50]연령이 증가함에 따라 증가하며,[51] 이는 시간이 지남에 따라 응집소의 손실 때문일 것으로 추정된다.
유사분열과의 비교
감수분열을 이해하기 위해서는 유사분열과의 비교가 도움이 된다.아래 표는 감수분열과 유사분열 [52]사이의 차이를 보여준다.
| 감수 분열 | 유사분열 | |
|---|---|---|
| 최종 결과 | 보통 네 개의 세포는 각각 염색체 수의 절반을 부모로 가지고 있다. | 부모 세포와 같은 수의 염색체를 가진 두 개의 세포 |
| 기능. | 이중 라이프 사이클을 가진 진핵생물을 성적으로 번식시키는 생식체(성세포)의 생산 | 세포 재생, 성장, 복구, 무성 생식 |
| 어디서 일어나는 일입니까? | 거의 모든 진핵생물(동물, 식물, 곰팡이 및 원생동물)[53][47] 생식선, 생식체 이전(이형 라이프 사이클) 접합자 후(하플론틱) 포자가 생기기 전(하수체 증배 시) | 모든 진핵 생물의 모든 증식 세포 |
| 순서 | 1단계, 1단계, 1단계, 1단계, 1단계, 1단계, 1단계 Prophase II, Metaphase II, Anaphase II, Telophase II | 전상, 프로메타베이스, 메타베이스, 아나베이스, 텔로베이스 |
| 유전적으로 부모와 같다고요? | 아니요. | 네. |
| 넘어가는 일은? | 네, 보통 상동 염색체 쌍 사이에서 발생합니다 | 극히 드물게 |
| 상동 염색체의 짝짓기? | 네. | 아니요. |
| 사이토키네시스 | Telophase I 및 Telophase II에서 발생 | Telophase에서 발생하다 |
| 동원체 분할 | Anaphase I에서는 발생하지 않지만 Anaphase II에서는 발생합니다. | Anaphase에서 발생하다 |
분자 조절
이 섹션은 확장해야 합니다.추가해서 도움을 줄 수 있습니다. (2020년 8월) |
감수세포 분열에서 세포가 감수분열로 어떻게 진행되는지는 잘 알려져 있지 않다.개구리 난모세포 감수분열에는 성숙촉진인자(MPF)가 관여하는 것으로 보인다.곰팡이 S. 폼브에.감수 세포 [54]분열에 들어가는 MeiRNA 결합 단백질의 역할이 있다.
센트로머 영역 CDE1과 결합하는 효모 CEP1 유전자 생성물이 감수 분열-I [55]동안 염색체 짝짓기에 역할을 할 수 있다는 것이 제안되었다.
감수성 재조합은 Spo11 단백질에 의해 촉매되는 이중가닥 절단을 통해 매개된다.또한 Mre11, Sae2, Exo1은 파괴와 재결합에 있어 역할을 한다.파손이 발생한 후 재조합이 이루어지며, 이는 일반적으로 동질적이다.재조합은 이중 홀리데이 접합(dHJ) 경로 또는 합성 의존성 스트랜드 아닐(SDSA) 경로 중 하나를 통과할 수 있습니다. (두 번째 재조합은 교차하지 않는 [56]생성물에 부여됩니다.)
감수 세포 분열을 위한 체크 포인트도 있는 것 같습니다.S. pombe, Rad 단백질, S. pombe Mek1, Cdc25, Cdc2 및 알려지지 않은 인자는 체크포인트를 [57]형성하는 것으로 생각된다.
척추동물의 발아에서 세포정적인자(CSF)에 의해 유지되는 것은 감수분열 [55]II로 전환하는 역할을 한다.
「 」를 참조해 주세요.
레퍼런스
- ^ "4.1: Meiosis". Biology LibreTexts. 2019-10-01. Retrieved 2021-05-29.
- ^ "Definition of Reduction division". MedicineNet. Retrieved 2021-05-29.
- ^ a b Freeman S (2011). Biological Science (6th ed.). Hoboken, NY: Pearson. p. 210.
- ^ Hassold T, Hunt P (April 2001). "To err (meiotically) is human: the genesis of human aneuploidy". Nature Reviews Genetics. 2 (4): 280–91. doi:10.1038/35066065. PMID 11283700. S2CID 22264575.
- ^ Letunic I, Bork P (2006). "Interactive Tree of Life". Archived from the original on 29 January 2018. Retrieved 23 July 2011.
- ^ Bernstein H, Bernstein C (2010). "Evolutionary origin of recombination during meiosis". BioScience. 60 (7): 498–505. doi:10.1525/bio.2010.60.7.5. S2CID 86663600.
- ^ Lodé T (June 2011). "Sex is not a solution for reproduction: the libertine bubble theory". BioEssays. 33 (6): 419–22. doi:10.1002/bies.201000125. PMID 21472739.
- ^ J.B. 파머와 J.E.S.Moore, Quarterly Journal of Microscopic Science 48:489(1905) 옥스포드 영어사전 제3판, 2001년 6월 s.v.에 인용되어 있다.
- ^ 바타글리아 E.(1985년)감수분열과 유사분열: 용어적 비평.Ann Bot (ROM) 43 : 101 ~140 링크
- ^ Carter JS (2012-10-27). "Mitosis". University of Cincinnati. Archived from the original on 2012-10-27. Retrieved 2018-02-09.
- ^ Zhou A, Pawlowski WP (August 2014). "Regulation of meiotic gene expression in plants". Frontiers in Plant Science. 5: 413. doi:10.3389/fpls.2014.00413. PMC 4142721. PMID 25202317.
- ^ Jung M, Wells D, Rusch J, Ahmad S, Marchini J, Myers SR, Conrad DF (June 2019). "Unified single-cell analysis of testis gene regulation and pathology in five mouse strains". eLife. 8: e43966. doi:10.7554/eLife.43966. PMC 6615865. PMID 31237565.
- ^ Brar GA, Yassour M, Friedman N, Regev A, Ingolia NT, Weissman JS (February 2012). "High-resolution view of the yeast meiotic program revealed by ribosome profiling". Science. 335 (6068): 552–7. Bibcode:2012Sci...335..552B. doi:10.1126/science.1215110. PMC 3414261. PMID 22194413.
- ^ Freeman 2005, 244-45페이지
- ^ Cohen PE, Pollack SE, Pollard JW (June 2006). "Genetic analysis of chromosome pairing, recombination, and cell cycle control during first meiotic prophase in mammals". Endocrine Reviews. 27 (4): 398–426. doi:10.1210/er.2005-0017. PMID 16543383.
- ^ Hunter N (October 2015). "Meiotic Recombination: The Essence of Heredity". Cold Spring Harbor Perspectives in Biology. 7 (12): a016618. doi:10.1101/cshperspect.a016618. PMC 4665078. PMID 26511629.
- ^ a b c Freeman 2005, 249~250페이지
- ^ a b c d e f Snustad DP, Simmons MJ (December 2008). Principles of Genetics (5th ed.). Wiley. ISBN 978-0-470-38825-9.
- ^ Krebs JE, Goldstein ES, Kilpatrick ST (November 2009). Lewin's Genes X (10th ed.). Jones & Barlett Learning. ISBN 978-0-7637-6632-0.
- ^ a b c d Zickler D, Kleckner N (May 2015). "Recombination, Pairing, and Synapsis of Homologs during Meiosis". Cold Spring Harbor Perspectives in Biology. 7 (6): a016626. doi:10.1101/cshperspect.a016626. PMC 4448610. PMID 25986558.
- ^ Baudat F, de Massy B (July 2007). "Regulating double-stranded DNA break repair towards crossover or non-crossover during mammalian meiosis". Chromosome Research. 15 (5): 565–77. doi:10.1007/s10577-007-1140-3. PMID 17674146. S2CID 26696085.
- ^ O'Connor C (2008). "Meiosis, genetic recombination, and sexual reproduction". Nature Education. 1 (1): 174.
- ^ Link J, Jantsch V (September 2019). "Meiotic chromosomes in motion: a perspective from Mus musculus and Caenorhabditis elegans". Chromosoma. 128 (3): 317–330. doi:10.1007/s00412-019-00698-5. PMC 6823321. PMID 30877366.
- ^ Chen JM, Cooper DN, Chuzhanova N, Férec C, Patrinos GP (October 2007). "Gene conversion: mechanisms, evolution and human disease". Nature Reviews. Genetics. 8 (10): 762–75. doi:10.1038/nrg2193. PMID 17846636. S2CID 205484180.
- ^ Bolcun-Filas E, Handel MA (July 2018). "Meiosis: the chromosomal foundation of reproduction". Biology of Reproduction. 99 (1): 112–126. doi:10.1093/biolre/ioy021. PMID 29385397. S2CID 38589675.
- ^ Hinch AG, Altemose N, Noor N, Donnelly P, Myers SR (July 2014). "Recombination in the human Pseudoautosomal region PAR1". PLOS Genetics. 10 (7): e1004503. doi:10.1371/journal.pgen.1004503. PMC 4102438. PMID 25033397.
- ^ Nussbaum RL, McInnes RR, Willard HF, Hamosh A (2015-05-21). Thompson & Thompson genetics in medicine (Eighth ed.). Philadelphia, PA. p. 19. ISBN 978-1437706963. OCLC 908336124.
- ^ Schuh M, Ellenberg J (August 2007). "Self-organization of MTOCs replaces centrosome function during acentrosomal spindle assembly in live mouse oocytes". Cell. 130 (3): 484–98. doi:10.1016/j.cell.2007.06.025. PMID 17693257. S2CID 5219323.
- ^ Holubcová Z, Blayney M, Elder K, Schuh M (June 2015). "Human oocytes. Error-prone chromosome-mediated spindle assembly favors chromosome segregation defects in human oocytes". Science. 348 (6239): 1143–7. Bibcode:2015Sci...348.1143H. doi:10.1126/science.aaa9529. PMC 4477045. PMID 26045437.
- ^ Kitajima TS, Ohsugi M, Ellenberg J (August 2011). "Complete kinetochore tracking reveals error-prone homologous chromosome biorientation in mammalian oocytes". Cell. 146 (4): 568–81. doi:10.1016/j.cell.2011.07.031. PMID 21854982. S2CID 5637615.
- ^ a b 피어스, 벤자민(2009년).【염색체와 세포 재생】유전학: 개념적 접근법, 제3판W.H. Freeman & CO.ISBN 9780716779285 페이지 32
- ^ Haglund K, Nezis IP, Stenmark H (January 2011). "Structure and functions of stable intercellular bridges formed by incomplete cytokinesis during development". Communicative & Integrative Biology. 4 (1): 1–9. doi:10.4161/cib.13550. PMC 3073259. PMID 21509167.
- ^ "BioCoach Activity: Concept 11: Meiosis II: Metaphase II". The Biology Place. Pearson. Archived from the original on 2018-02-28. Retrieved 2018-02-10.
- ^ Monaghan F, Corcos A (1984-01-01). "On the origins of the Mendelian laws". The Journal of Heredity. 75 (1): 67–9. doi:10.1093/oxfordjournals.jhered.a109868. PMID 6368675.
- ^ Saleem M, Lamb BC, Nevo E (December 2001). "Inherited differences in crossing over and gene conversion frequencies between wild strains of Sordaria fimicola from "Evolution Canyon"". Genetics. 159 (4): 1573–93. doi:10.1093/genetics/159.4.1573. PMC 1461899. PMID 11779798.
- ^ a b c Mira A (September 1998). "Why is meiosis arrested?". Journal of Theoretical Biology. 194 (2): 275–87. Bibcode:1998JThBi.194..275M. doi:10.1006/jtbi.1998.0761. PMID 9778439.
- ^ a b c Stringer JM, Winship A, Zerafa N, Wakefield M, Hutt K (May 2020). "Oocytes can efficiently repair DNA double-strand breaks to restore genetic integrity and protect offspring health". Proceedings of the National Academy of Sciences of the United States of America. 117 (21): 11513–11522. doi:10.1073/pnas.2001124117. PMC 7260990. PMID 32381741.
- ^ South GR, Whittick A (2009-07-08). An Introduction to Phycology. John Wiley & Sons. ISBN 9781444314205.
- ^ Bidlack JE (2011). Introductory Plant Biology. New York, NY: McGraw HIll. pp. 214–29.
- ^ Brunet S, Verlhac MH (2010). "Positioning to get out of meiosis: the asymmetry of division". Human Reproduction Update. 17 (1): 68–75. doi:10.1093/humupd/dmq044. PMID 20833637. S2CID 13988521.
- ^ Rosenbusch B (November 2006). "The contradictory information on the distribution of non-disjunction and pre-division in female gametes". Human Reproduction. 21 (11): 2739–42. doi:10.1093/humrep/del122. PMID 16982661.
- ^ Lin Y, Gill ME, Koubova J, Page DC (December 2008). "Germ cell-intrinsic and -extrinsic factors govern meiotic initiation in mouse embryos". Science. 322 (5908): 1685–7. Bibcode:2008Sci...322.1685L. doi:10.1126/science.1166340. PMID 19074348. S2CID 11261341.
- ^ Suzuki A, Saga Y (February 2008). "Nanos2 suppresses meiosis and promotes male germ cell differentiation". Genes & Development. 22 (4): 430–5. doi:10.1101/gad.1612708. PMC 2238665. PMID 18281459.
- ^ a b Teletin M, Vernet N, Yu J, Klopfenstein M, Jones JW, Féret B, Kane MA, Ghyselinck NB, Mark M (January 2019). "Two functionally redundant sources of retinoic acid secure spermatogonia differentiation in the seminiferous epithelium". Development. 146 (1): dev170225. doi:10.1242/dev.170225. PMC 6340151. PMID 30487180.
- ^ Bowles J, Knight D, Smith C, Wilhelm D, Richman J, Mamiya S, Yashiro K, Chawengsaksophak K, Wilson MJ, Rossant J, Hamada H, Koopman P (April 2006). "Retinoid signaling determines germ cell fate in mice". Science. 312 (5773): 596–600. Bibcode:2006Sci...312..596B. doi:10.1126/science.1125691. PMID 16574820. S2CID 2514848.
- ^ Kumar S, Chatzi C, Brade T, Cunningham TJ, Zhao X, Duester G (January 2011). "Sex-specific timing of meiotic initiation is regulated by Cyp26b1 independent of retinoic acid signalling". Nature Communications. 2 (1): 151. Bibcode:2011NatCo...2..151K. doi:10.1038/ncomms1136. PMC 3034736. PMID 21224842.
- ^ a b Raikov IB (1995). "Meiosis in protists: recent advances and persisting problems". Europ J Protistol. 31: 1–7. doi:10.1016/s0932-4739(11)80349-4.
- ^ Hegde MR, Crowley MR (2019-01-01). "Genome and Gene Structure". Emery and Rimoin's Principles and Practice of Medical Genetics and Genomics: 53–77. doi:10.1016/B978-0-12-812537-3.00004-4. ISBN 9780128125373. S2CID 92480716.
- ^ Hunter N (2013-01-01). "Meiosis". Encyclopedia of Biological Chemistry (Second ed.): 17–23. doi:10.1016/B978-0-12-378630-2.00474-6. ISBN 9780123786319.
- ^ Hassold T, Jacobs P, Kline J, Stein Z, Warburton D (July 1980). "Effect of maternal age on autosomal trisomies". Annals of Human Genetics. 44 (1): 29–36. doi:10.1111/j.1469-1809.1980.tb00943.x. PMID 7198887. S2CID 24469567.
- ^ Tsutsumi M, Fujiwara R, Nishizawa H, Ito M, Kogo H, Inagaki H, Ohye T, Kato T, Fujii T, Kurahashi H (May 2014). "Age-related decrease of meiotic cohesins in human oocytes". PLOS ONE. 9 (5): e96710. Bibcode:2014PLoSO...996710T. doi:10.1371/journal.pone.0096710. PMC 4013030. PMID 24806359.
- ^ "How Cells Divide". PBS. Public Broadcasting Service. Archived from the original on 1 November 2012. Retrieved 6 December 2012.
- ^ Heywood P, Magee PT (March 1976). "Meiosis in protists. Some structural and physiological aspects of meiosis in algae, fungi, and protozoa". Bacteriological Reviews. 40 (1): 190–240. doi:10.1128/mmbr.40.1.190-240.1976. PMC 413949. PMID 773364.
- ^ Kimble J (August 2011). "Molecular regulation of the mitosis/meiosis decision in multicellular organisms". Cold Spring Harbor Perspectives in Biology. 3 (8): a002683. doi:10.1101/cshperspect.a002683. PMC 3140684. PMID 21646377.
- ^ a b Honigberg SM, McCarroll RM, Esposito RE (April 1993). "Regulatory mechanisms in meiosis". Current Opinion in Cell Biology. 5 (2): 219–25. doi:10.1016/0955-0674(93)90106-z. PMID 8389567.
- ^ Lam I, Keeney S (October 2014). "Mechanism and regulation of meiotic recombination initiation". Cold Spring Harbor Perspectives in Biology. 7 (1): a016634. doi:10.1101/cshperspect.a016634. PMC 4292169. PMID 25324213.
- ^ Pérez-Hidalgo L, Moreno S, San-Segundo PA (January 2003). "Regulation of meiotic progression by the meiosis-specific checkpoint kinase Mek1 in fission yeast". Journal of Cell Science. 116 (Pt 2): 259–71. doi:10.1242/jcs.00232. hdl:10261/62904. PMID 12482912. S2CID 14608163.
인용문
- Freeman S (2005). Biological Science (3rd ed.). Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 9780131409415.