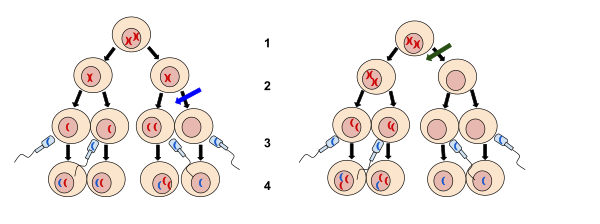
불연속
Nondisjunction비조영술은 세포분열(mitosis/meiosis) 중에 균질 염색체나 자매 크로마티드가 적절하게 분리되지 않는 것이다. 불연속은 세 가지 형태가 있는데, 한 쌍의 동질 염색체가 감수분열 I에서 분리되지 않는 것, 감수분열 II에서 자매 크로마티드가 분리되지 않는 것, 그리고 유사분열 시 자매 크로마티드가 분리되지 않는 것이다.[1][2][3] 분리를 하지 않으면 비정상적인 염색체 번호를 가진 딸 세포가 생긴다.
캘빈 브리지스와 토마스 헌트 모건은 컬럼비아 대학의 동물학 연구소에서 일하면서 1910년 봄에 드로필라 멜라노가스터 성염색체에서 불연결을 발견한 공로를 인정받고 있다.[4]
종류들
일반적으로 비접합은 염색체 물질의 순서 분포를 수반하는 어떤 형태의 세포 분열에서도 발생할 수 있다. 고등 동물들은 다음과 같은 세 가지 뚜렷한 형태의 세포 분열을 가지고 있다. 감수분열Ⅰ과 감수분열Ⅱ는 생식세포(난자와 정자) 생성 중에 발생하는 세포분열의 특화된 형태로서, 유사분열은 신체의 다른 모든 세포가 사용하는 세포분열의 형태다.
감수분열 II
난자는 수정이 제2의 감수분열을 촉발할 때까지 은유효소 2에서 체포된다.[5] 감수분열 1에서 이발체의 분리에 따른 자매 크로마티드의 쌍은 감수분열 II의 아나파제로 더욱 분리된다. 난모세포에서는 한 자매 크로마티드가 두 번째 극지체로 분리되고 다른 자매는 난자 안에 머무른다. 정자생식 동안 각 감수분열은 대칭적이어서 각 1차 정조세포는 감수분열Ⅰ 이후 2차 정조세포 2개, 결국 감수분열Ⅱ 이후 4개의 정자체가 생긴다. 감수분열 II-연관절제술도 무극성 증후군을 일으킬 수 있지만, 감수분열 I에서 분리 실패를 하는 것보다 훨씬 작은 정도까지만 가능하다.[6]
유사분열
체세포 분열을 통한 체세포 분열은 S상 유전물질 복제가 선행된다. 그 결과, 각각의 염색체는 중앙에서 함께 있는 두 자매 크로마티드로 구성된다. 유사분열의 아나파아제에서는 세포가 분열하기 전에 자매 크로마티드가 분리되어 반대편 세포극으로 이동한다. 유사분열 중 절제는 한 딸이 영향을 받은 염색체의 염색체 자매 모두를 받는 반면 다른 딸은 전혀 받지 않게 된다.[2][3] 이것은 염색체 다리 또는 아나파아제 다리라고 알려져 있다. 미토틱 불연속은 체성 모자이즘을 낳는데, 이는 불연속 현상이 발생한 세포에서 유래한 딸세포만이 비정상적인 수의 염색체를 갖게 되기 때문이다.[3] 유사분열 중 절제를 하지 않으면 일부 형태의 암(예: 망막성형종)의 발병에 기여할 수 있다(아래 참조).[7] 유사분열에서 염색체 불연속은 topoisomerase II, condensin 또는 분리효소의 불활성화에 기인할 수 있다.[8] 감수분열 불절제는 사카로마이오스 세뇌에서 잘 연구되어 왔다. 이 효모는 다른 진핵생물들과 유사하게 유사하게 유사분열을 겪는다. 염색체 교량은 DNA-DNA 위상학적 얽힘과 응집 복합체에 의한 복제 후 자매 크로마티드가 함께 결합될 때 발생한다.[9] 아나파제 동안 응집력은 분리제로 갈라진다.[10] Topoisomerase II와 콘덴신은 포진 제거를 담당한다.[11]
분자 메커니즘
스핀들 어셈블리 체크포인트의 중앙 역할
스핀들 조립체 검문소(SAC)는 진핵 세포에서 적절한 염색체 분리를 관리하는 분자 안전 보호 메커니즘이다.[12] SAC는 모든 동질 염색체(바이벌런트 또는 테트라드)가 스핀들 기구에 적절하게 정렬될 때까지 아나파제로의 진행을 억제한다. 그때서야 SAC는 아나파제 추진 콤플렉스(APC)에 대한 억제를 해제하고, 이는 다시 아나파제를 통한 진행을 불가역적으로 촉발한다.
감수분열의 성별 차이
인간 애니플로이드 신드롬의 사례를 조사한 결과 대부분이 모태에서 파생된 것으로 나타났다.[5] 이에 의문이 제기된다. 왜 여성 감수분열은 더 오차가 많이 나는가? 여성 난모생식과 남성 정자생식의 가장 분명한 차이점은 프로페셔널 1의 늦은 단계에서 난모세포가 수 년에서 수 십 년까지 장기적으로 체포되는 것이다. 반면에 남성 생식세포는 감수분열 I과 II의 모든 단계를 빠르게 거친다. 남성 및 여성 감수분열 사이의 또 다른 중요한 차이점은 동질 염색체 간의 재조합 빈도에 관한 것이다. 남성의 경우 거의 모든 염색체 쌍이 적어도 하나의 교차점에 의해 결합되는 반면, 인간 난모세포의 10% 이상은 어떤 교차 현상도 없이 적어도 하나의 이분체를 포함하고 있다. 재결합 실패 또는 부적절하게 위치한 교차로의 실패는 인간에 대한 불연속성의 발생에 기여하는 것으로 잘 문서화되었다.[5]
인간 난모세포의 장기적 체포로 인해 염색체를 결합하는 응집력 결합의 약화와 SAC의 활동 감소는 분리 통제에 있어 산모 관련 오류의 원인이 될 수 있다.[6][13] 응집 복합체는 자매 크로마티드를 함께 보관하는 역할을 하며 스핀들 부착을 위한 결합 부지를 제공한다. 응집력은 태아 발달 과정에서 우고니아에서 새로 복제된 염색체에 탑재된다. 성숙한 난모세포는 S상 완료 후 응집력을 재장전하는 데 한계가 있을 뿐이다. 그러므로 감수분열 1세의 완성에 앞서 인간 난모세포가 장기간 체포되는 것은 시간이 지남에 따라 상당한 응집력 상실을 초래할 수 있다. 응집력의 상실은 감수분열 중 잘못된 미세관-키네토코어 부착과 염색체 분리 오류의 원인이 되는 것으로 가정한다.[6]
결과들
이 오류의 결과는 염색체의 불균형을 가진 세포다. 그런 세포는 무우플로이드라고 한다. 결함을 가진 딸 세포가 쌍 중 하나에서 한 개의 염색체가 누락되는 단일 염색체(2n-1)의 상실을 단조법이라고 한다. 결함을 가진 딸 세포가 쌍 외에 하나의 염색체를 갖는 단일 염색체를 얻는 것을 삼염색체라고 한다.[3] 무극성 생식세포가 수정되는 경우, 많은 신드롬이 발생할 수 있다.
단조법
인간에게 유일하게 생존할 수 있는 단조법으로 알려진 것은 터너 증후군인데, 여기서 영향을 받은 개인은 X염색체(아래 참조)에 대한 단조증후군이다. 다른 단모세포는 태아 초기 발육 중에 보통 치명적이며, 모사주의(아래 참조)의 경우 몸의 모든 세포가 영향을 받지 않거나 단일 단모세포 염색체("염색체 구조")의 중복을 통해 정상적인 염색체 수가 회복되는 경우에만 생존이 가능하다.[2]
터너 증후군 (X 단조증후군) (45, X0)
X염색체 전체의 완전한 상실은 터너 증후군의 약 절반을 차지한다. 배아발달 중 두 X염색체의 중요성은 X염색체(가오리형 45, X0)가 하나만 있는 태아의 압도적 다수(>99%)가 자연적으로 낙태된다는 관측에 의해 강조된다.[14]
자가 삼위일체
자가삼분법이란 성염색체 X와 Y 이외의 염색체가 두플로이드 세포에 정상수 2가 아닌 3매로 존재하는 것을 말한다.
다운증후군(삼분법 21)
21번 염색체의 삼분해인 다운증후군은 인간에게 가장 흔한 염색체 수의 변칙이다.[2] 대부분의 경우들은 산모의 감수분열 I 동안 절연에서 비롯된다.[14] 삼위일체는 신생아의 최소 0.3%와 자연 낙태를 거의 25%에서 발생한다. 그것은 임신 중 낭비의 주요 원인이며 정신지체의 가장 흔한 원인이다.[15] 산모의 나이가 높아지면 감수분열 중단이 다운증후군으로 이어질 위험이 커진다는 사실은 잘 알려져 있다. 이것은 잠재적으로 40년 이상 지속될 수 있는 인간 난모세포의 감정적 체포가 장기화되고 있는 것과 관련이 있을 수 있다.[13]
에드워드 증후군(트리소싱 18)과 파타우 증후군(트리소싱 13)
다운증후군(삼분법 21)을 제외한 라이브 출산과 호환되는 인간 삼분법은 에드워드 증후군(삼분법 18)과 파타우 증후군(삼분법 13)이다.[1][2] 다른 염색체의 완전한 삼분체는 보통 실행이 불가능하며 비교적 빈번한 유산의 원인을 나타낸다. 모자이즘의 드문 경우에 한해서, 삼원세포선 외에 정상 세포선의 존재는 다른 염색체의 생존 가능한 삼원근법의 발전을 뒷받침할 수 있을 것이다.[2]
성염색체 양극성
성염색체 양극화라는 용어는 XX(여성)나 XY(남성) 이외의 성염색체 수가 비정상적으로 많은 상태를 요약한다. 형식적으로 X염색체 단조법(Turner syndrome, 위 참조)도 성염색체 무연화성의 한 형태로 분류할 수 있다.
클라인펠터 증후군(47, XXY)
클라인펠터 증후군은 인간에게 가장 흔한 성염색체 양극성이다. 그것은 남성에게 있어 저포자극과 불임의 가장 빈번한 원인이다. 대부분의 경우는 부성 감수분열 I의 불연속 오류에 의해 발생한다.[2] 이 증후군을 가진 사람들의 약 80%는 카리오타입 XXY를 유발하는 X 염색체를 1개 더 가지고 있다. 나머지 사례에는 복수의 추가 성염색체(48,XXXY; 48,XXXY; 49,XXXXY), 모자이즘(46,XY/47,XXXY) 또는 구조적 염색체 이상이 있다.[2]
XYY 남성(47, XYY)
XYY 증후군의 발생률은 약 800–1000명의 남성 출생아 중 1명이다. 정상적인 외모와 다산성, 심각한 증상의 부재로 진단되지 않은 경우가 많다. 여분의 Y염색체는 대개 부성 감수분열 II 동안 절연되지 않은 결과물이다.[2]
삼위일체 X(47,XXX)
트라이소미 X는 여성들에게 두 개의 X 염색체가 아닌 세 개의 염색체가 있는 성염색체 애니플로이드의 일종이다. 대부분의 환자들은 신경정신과 신체적인 증상에 의해 가벼운 영향을 받는다. 엑스트라 X염색체의 기원을 조사한 연구에서는 약 58~63%가 산모 감수분열 I의 절연에 의해, 16~18%는 산모 감수분열 II의 절연에 의해, 나머지 경우는 산모 감수분열 후, 즉 유사분열, 비절연에 의한 것으로 관찰되었다.[16]
단파절제술
단엽절제술은 염색체 쌍의 두 염색체가 동일한 부모로부터 물려받아 동일한 상태를 나타낸다. 이 현상은 대부분 불임으로 인해 삼분법으로 시작된 임신의 결과일 가능성이 높다. 대부분의 삼지체는 치명적이기 때문에 태아는 세 개의 염색체 중 하나를 잃고 이질화되기 때문에 살아남는다. 예를 들어, 15번 염색체의 단파절제술은 프라더윌리 증후군과 엔젤만 증후군의 일부 사례에서 볼 수 있다.[14]
모자이크 신드롬
모자이크 신드롬은 초기 태아발달에 있어서 유사분열로 인해 발생할 수 있다. 그 결과 유기체는 서로 다른 플로이드(염색체의 수)를 가진 세포 라인의 혼합체로 진화한다. 모자이크주의는 어떤 조직에서는 존재할 수 있지만 다른 조직에서는 존재할 수 없다. 영향을 받은 개인은 뭉치거나 비대칭적인 외모를 가질 수 있다. 모자이크 신드롬의 예로는 팔리스터 킬리안 증후군과 이토의 하이포멜란증후군이 있다.[14]
악성 변형에서의 모자이즘

첫 번째 적중에서는 두 염색체 중 한 개의 종양 억제기 유전자가 유전자 생산물을 기능하지 못하게 만드는 돌연변이에 의해 영향을 받는다. 이 돌연변이는 DNA 복제 오류로 자연발생적으로 발생하거나 DNA 손상요소에 의해 유발될 수 있다. 두 번째 타격은 예를 들어, 유사분열방지 이벤트를 통해 나머지 야생형 염색체를 제거한다. 두 단계 각각에는 몇 가지 다른 잠재적 메커니즘이 있는데, 예를 들어 추가 돌연변이, 불균형한 변환 또는 재조합에 의한 유전자 삭제 등이 그것이다. 이중 병변의 결과, 종양 억제기 단백질을 더 이상 표현할 수 없기 때문에 세포가 악성이 될 수 있다.
암의 발달에는 세포 게놈(Knudson 가설)을 여러 번 수정하는 경우가 많다. 인간 망막성종은 유사분열 미봉합이 악성 변형에 기여할 수 있는 암 유형의 잘 연구된 예다. 13번 염색체에 위치하며 종양 억제기 레티노블라스모종 단백질을 암호화하는 RB1 유전자의 돌연변이는 많은 레티노블라스모종의 경우 세포유전학적 분석으로 검출될 수 있다. 13번 염색체의 한 복사본에서 RB1 위치의 돌연변이는 때때로 유사 분리를 통해 다른 13번 야생형 염색체의 상실을 동반한다. 이 병변의 조합에 의해, 영향을 받은 세포들은 기능하는 종양 억제 단백질의 발현을 완전히 잃게 된다.[7]
진단
이식전유전자진단
이식 전 유전자 진단(PGD 또는 PIGD)은 유전적으로 정상적인 배아를 식별하는 데 사용되는 기술로 유전적 질환의 가족력이 있는 부부에게 유용하다. 이것은 체외수정을 통해 생식을 선택하는 사람들을 위한 선택사항이다. PGD는 시간이 많이 걸리고 성공률이 일상적인 IVF에 비할 뿐이어서 어려운 것으로 여겨진다.[17]
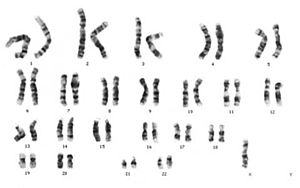
카리오타이핑
카리오타이핑은 은유효소 1 동안 태아의 세포를 연구하기 위해 양수신경을 수행하는 것을 포함한다. 가벼운 현미경 검사를 사용하여 무영양성이 문제인지 여부를 시각적으로 판단할 수 있다.[18]
극체진단
극체신체진단(PBD)은 난모세포의 변환뿐만 아니라 모태에서 파생된 염색체 양극화를 검출하는 데 사용될 수 있다. PGD 대비 PBD의 장점은 단기간에 달성할 수 있다는 점이다. 이것은 조나 드릴링이나 레이저 드릴링을 통해 이루어진다.[19]
블라스토메르 생검
블라스토메르 생검은 조나 펠루치다에서 블라스토메르를 제거하는 기법이다. 그것은 보통 무극성을 감지하는 데 사용된다.[20] 유전자 분석은 일단 절차가 완료되면 실시한다. 절차와 관련된 위험을 평가하기 위해 추가적인 연구가 필요하다.[21]
라이프스타일/환경 위험
생활습관, 환경 및/또는 직업적 위험에 대한 정자조아의 노출은 양극화의 위험을 증가시킬 수 있다. 담배연기는 알려진 아뉴겐이다. 그것은 1.5배에서 3.0배까지의 양극성 증가와 관련이 있다.[22][23] 다른 연구들은 알코올 소비,[24] 벤젠에 대한 직업적 노출,[25] 살충제 펜밸레이트[26] 및 카바릴에[27] 대한 노출과 같은 요소들도 무우플로이드를 증가시킨다는 것을 보여준다.
참조
- ^ a b Simmons, D. Peter Snustad, Michael J. (2006). Principles of genetics (4th ed.). New York, NY [u.a.]: Wiley. ISBN 9780471699392.
- ^ a b c d e f g h i Bacino, C.A.; Lee, B. (2011). "Chapter 76: Cytogenetics". In Kliegman, R.M.; Stanton, B.F.; St. Geme, J.W.; Schor, N.F.; Behrman, R.E. (eds.). Nelson Textbook of Pediatrics, 19th Edition (19th ed.). Philadelphia: Saunders. pp. 394–413. ISBN 9781437707557.
- ^ a b c d Strachan, Tom; Read, Andrew (2011). Human molecular genetics (4th ed.). New York: Garland Science. ISBN 9780815341499.
- ^ Thomas Hunt Morgan (August 31, 2012). Sex-Linked Inheritance in Drosophila. Ulan Press. pp. 10–11.
- ^ a b c Nagaoka, SI; Hassold, TJ; Hunt, PA (Jun 18, 2012). "Human aneuploidy: mechanisms and new insights into an age-old problem". Nature Reviews Genetics. 13 (7): 493–504. doi:10.1038/nrg3245. PMC 3551553. PMID 22705668.
- ^ a b c Jones, K. T.; Lane, S. I. R. (27 August 2013). "Molecular causes of aneuploidy in mammalian eggs". Development. 140 (18): 3719–3730. doi:10.1242/dev.090589. PMID 23981655.
- ^ a b eds, Charles R. Scriver ... []; et al. (2005). The online metabolic & molecular bases of inherited disease (8th ed.). New York: McGraw-Hill. ISBN 9780079130358.
- ^ Quevedo, O; García-Luis, J; Matos-Perdomo, E; Aragón, L; Machín, F (2012). "Nondisjunction of a single chromosome leads to breakage and activation of DNA damage checkpoint in G2". PLOS Genetics. 8 (2): e1002509. doi:10.1371/journal.pgen.1002509. PMC 3280967. PMID 22363215.
- ^ Vaahtokari, A; Aberg, T; Thesleff, I (Jan 1996). "Apoptosis in the developing tooth: association with an embryonic signaling center and suppression by EGF and FGF-4". Development. 122 (1): 121–9. doi:10.1242/dev.122.1.121. PMID 8565823.
- ^ Banks, P (Feb 1977). "Pulp changes after anterior mandibular subapical osteotomy in a primate model". Journal of Maxillofacial Surgery. 5 (1): 39–48. doi:10.1016/s0301-0503(77)80074-x. PMID 0403247.
- ^ Holm, C; Goto, T; Wang, JC; Botstein, D (Jun 1985). "DNA topoisomerase II is required at the time of mitosis in yeast". Cell. 41 (2): 553–63. doi:10.1016/s0092-8674(85)80028-3. PMID 2985283. S2CID 715110.
- ^ Sun, S.-C.; Kim, N.-H. (14 November 2011). "Spindle assembly checkpoint and its regulators in meiosis". Human Reproduction Update. 18 (1): 60–72. doi:10.1093/humupd/dmr044. PMID 22086113.
- ^ a b Eichenlaub-Ritter, Ursula (2012). "Oocyte ageing and its cellular basis". The International Journal of Developmental Biology. 56 (10–11–12): 841–852. doi:10.1387/ijdb.120141ue. PMID 23417406.
- ^ a b c d Gleason, H. William; Taeusch, Roberta A.; Ballard, Christine A., eds. (2005). Avery's diseases of the newborn (8th ed.). Philadelphia, Pa.: W.B. Saunders. ISBN 978-0721693477.
- ^ Koehler, KE; Hawley, RS; Sherman, S; Hassold, T (1996). "Recombination and nondisjunction in humans and flies". Human Molecular Genetics. 5 Spec No: 1495–504. doi:10.1093/hmg/5.Supplement_1.1495. PMID 8875256.
- ^ Tartaglia, NR; Howell, S; Sutherland, A; Wilson, R; Wilson, L (May 11, 2010). "A review of trisomy X (47,XXX)". Orphanet Journal of Rare Diseases. 5: 8. doi:10.1186/1750-1172-5-8. PMC 2883963. PMID 20459843.
- ^ Harper, JC; Harton G (2010). "The use of arrays in preimplantation genetic diagnosis and screening". Fertil Steril. 94 (4): 1173–1177. doi:10.1016/j.fertnstert.2010.04.064. PMID 20579641.
- ^ "Karyotyping". National Institute of Health. Retrieved 7 May 2014.
- ^ Montag, M; van der Ven, K; Rösing, B; van der Ven, H (2009). "Polar body biopsy: a viable alternative to preimplantation genetic diagnosis and screening". Reproductive Biomedicine Online. 18 Suppl 1: 6–11. doi:10.1016/s1472-6483(10)60109-5. PMID 19281658.
- ^ Parnes, YM (Mar–Apr 1989). "RCT controversy". Journal of Obstetric, Gynecologic, & Neonatal Nursing. 18 (2): 90. doi:10.1111/j.1552-6909.1989.tb00470.x. PMID 2709181.
- ^ Yu, Y; Zhao, Y; Li, R; Li, L; Zhao, H; Li, M; Sha, J; Zhou, Q; Qiao, J (Dec 6, 2013). "Assessment of the risk of blastomere biopsy during preimplantation genetic diagnosis in a mouse model: reducing female ovary function with an increase in age by proteomics method". Journal of Proteome Research. 12 (12): 5475–86. doi:10.1021/pr400366j. PMID 24156634.
- ^ Shi Q, Ko E, Barclay L, Hoang T, Rademaker A, Martin R (2001). "Cigarette smoking and aneuploidy in human sperm". Mol. Reprod. Dev. 59 (4): 417–21. doi:10.1002/mrd.1048. PMID 11468778. S2CID 35230655.
- ^ Rubes J, Lowe X, Moore D, Perreault S, Slott V, Evenson D, Selevan SG, Wyrobek AJ (1998). "Smoking cigarettes is associated with increased sperm disomy in teenage men". Fertil. Steril. 70 (4): 715–23. doi:10.1016/S0015-0282(98)00261-1. PMID 9797104.
- ^ Benassi-Evans B, Fenech M (2011). "Chronic alcohol exposure induces genome damage measured using the cytokinesis-block micronucleus cytome assay and aneuploidy in human B lymphoblastoid cell lines". Mutagenesis. 26 (3): 421–9. doi:10.1093/mutage/geq110. PMID 21273273.
- ^ McHale CM, Smith MT, Zhang L (2014). "Application of toxicogenomic profiling to evaluate effects of benzene and formaldehyde: from yeast to human". Ann. N. Y. Acad. Sci. 1310 (1): 74–83. Bibcode:2014NYASA1310...74M. doi:10.1111/nyas.12382. PMC 3978411. PMID 24571325.
- ^ Xia Y, Bian Q, Xu L, Cheng S, Song L, Liu J, Wu W, Wang S, Wang X (2004). "Genotoxic effects on human spermatozoa among pesticide factory workers exposed to fenvalerate". Toxicology. 203 (1–3): 49–60. doi:10.1016/j.tox.2004.05.018. PMID 15363581.
- ^ Xia Y, Cheng S, Bian Q, Xu L, Collins MD, Chang HC, Song L, Liu J, Wang S, Wang X (2005). "Genotoxic effects on spermatozoa of carbaryl-exposed workers". Toxicol. Sci. 85 (1): 615–23. doi:10.1093/toxsci/kfi066. PMID 15615886.