정자군
Spermatozoon| 정자군 | |
|---|---|
 | |
 인간의 정자 그림 | |
| 세부 사항 | |
| 식별자 | |
| 라틴어 | 정자 |
| 메쉬 | D013094 |
| 해부학 용어 | |
정자(/spərˌmétəzo)【n】【spɜrmtt】-·([1]고대 그리스어 【μα】【spérma】【spérma】「animal」)은 수컷 배우자인 운동성 정자 세포 또는 움직이는 형태이다.정자는 난자를 접합하여 접합자를 형성한다.( 접합자는 완전한 염색체를 가진 하나의 세포로 보통 배아로 발달합니다.)
정자 세포는 핵 유전 정보의 약 절반을 (대부분의 경우, 미토콘드리아 DNA를 제외하고) 이배체 자손에게 기여한다.포유동물에서, 자손의 성별은 정자 세포에 의해 결정된다: X 염색체를 가진 정자는 XX 염색체를 가진 암컷 자손을 낳는 반면 Y 염색체를 가진 정자는 XY 염색체를 가진 수컷 자손을 낳는다.정자 세포는 1677년 [2]안토니 반 리우벤훅의 실험실에서 처음 관찰되었다.
포유류의 정자 구조, 기능 및 크기
인간
인간의 정자 세포는 남성의 생식 세포이고 따뜻한 환경에서만 살아남을 것이다; 일단 정자가 남성의 몸을 떠나면, 정자의 생존 가능성이 낮아지고 죽을 수 있기 때문에 전체 정자의 질이 저하될 수 있다.정자 세포는 "여성"과 "남성"의 두 가지 유형이 있습니다.수정 후 여성(XX) 자손을 낳는 정자 세포는 X염색체를 운반하는 반면 남성(XY) 자손을 낳는 정자 세포는 Y염색체를 운반한다는 점에서 다르다.
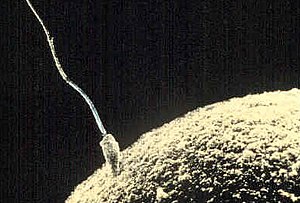
인간의 정자 세포는 5.1 µm x 3.1 µm의 납작한 원반 모양의 머리와 50 µm [3]길이의 꼬리로 구성된다.꼬리 편모충은 타원 [4]원추형으로 휘저어 정자세포를 추진시킨다.정자는 후각 유도 메커니즘을 가지고 있으며 나팔관에 도달한 후 [5]난자에 침투하기 전에 용량 기간을 거쳐야 한다.
머리: 그것은 색소 물질만을 가진 콤팩트한 핵을 가지고 있고 세포질의 얇은 테두리만으로 둘러싸여 있다.핵 위에는 골지체의 변형에 의해 형성되는 아크로솜이라고 불리는 캡 모양의 구조가 있으며, 이것은 수정에 필요한 정자(히알로니다아제, 코로나 투과효소, 조나 리신 또는 아크로신)를 분비한다.정자는 난자에 가까워지면 아크로솜을 둘러싼 막이 정자 두부의 혈장막과 융합해 [6]아크로솜의 내용물을 노출시키는 아크로솜 반응을 일으킨다.
목: 가장 작은 부분(.03㎜m)으로, 핵의 밑부분과 평행한 근위부 중심과 앞의 원위부 중심과 수직인 원위부 중심이다.근위부 중심축은 성숙한 정자에도 존재한다; 원위부 중심축은 축삭 조립 후에 사라진다.근위부 중심축은 수정 과정에서 난자에 들어가 중심축이 없는 난자의 첫 번째 분할을 시작한다.원위부 중심은 꼬리를 형성하고 (9+2) 배열의 축 필라멘트를 발생시킨다.중간 부분에는 만셰트라고 불리는 일시적인 막이 있습니다.
중간 조각:그것은 세포질의 축 필라멘트를 둘러싸고 있는 10-14개의 미토콘드리아 나선형을 가지고 있다.그것은 운동성을 제공하고, 그래서 정자의 힘이라고 불린다.또한 중간편과 주편 사이에 확산 장벽을 형성하고 꼬리 [7]강성의 안정화 구조 역할을 하는 링 중심(환형)을 가지고 있다.
꼬리: 가장 긴 부분(50㎜m)으로 세포질 및 혈장막으로 둘러싸인 축방향 필라멘트를 가지고 있지만, 후단에서는 축방향 필라멘트가 벗겨져 있습니다.꼬리의 편모는 세포를 움직이게 한다.
정자는 알칼리성 성질을 가지고 있고 정자는 질에 도달할 때까지 완전한 운동성(고운동성)에 도달하지 않으며, 여기서 알칼리성 pH는 산성 질액에 의해 중화된다.이 단계적인 과정은 20~30분 정도 걸립니다.이 기간 동안, 정낭에서 나온 피브리노겐은 응고를 형성하여 정자를 고정하고 보호합니다.전립선의 섬유리놀리신은 과운동이 되는 것처럼 혈전을 녹여 정자가 최적으로 진행되도록 한다.
정자는 최소 세포질과 진핵생물에서 알려진 가장 조밀하게 채워진 DNA로 특징지어진다.체세포의 유사분열 염색체와 비교했을 때, 정자 DNA는 적어도 6배 더 높은 [8]응축성을 보인다.
표본은 DNA/크로마틴, 중심축, 그리고 아마도 난모세포활성화인자(OAF)[9]와 함께 기여한다.그것은 또한 아버지 메신저 RNA([9]mRNA)에 기여할 수 있고, 배아 발달에도 기여할 수 있다.
인간 정자의 전자 현미경은 3140배로 확대되었다.
인간의 정자는 적어도 7500개의 다른 단백질을 포함하고 있다.[10]
2020년 연구에 따르면 인간의 정자 유전학은 인간의 진화와 연관되어 있다.[11][12][13]
DNA 손상 및 복구
감수 분열 후 수정 전 정자에 존재하는 DNA 손상은 수정란에서 수정될 수 있지만, 수정되지 않으면 생식력과 발달 중인 배아에 심각한 해로운 영향을 미칠 수 있다.인간의 정자는 특히 유리기의 공격과 산화적 DNA [14][15]손상에 취약하다.(예: 8-옥소-2'-디옥시구아노신 참조)
특정 라이프스타일, 환경적 또는 직업적 위험에 남성이 노출되면 유배체 [16]정자의 위험이 증가할 수 있다.특히 흡연과 [17][18]벤젠,[19] 살충제,[20][21][22] 과불화합물에 대한 직업적 노출에 의해 배수의 위험이 증가한다.정자의 증가된 배수는 종종 증가된 DNA 손상과 함께 발생한다.체세포의 아포토시스(apoptosis)에서 볼 수 있는 것과 유사한 특징인 DNA 조각화와 현장에서의 변성 DNA 감수성 증가는 남성 [23][24]불임의 경우 비정상적인 정자를 특징짓는다.
면역 체계 반응의 회피
사정된 정자 세포의 표면에 있는 당단백질 분자는 모든 인간 여성 면역 체계에 의해 인식되며, 세포가 거부되어서는 안 된다는 신호로 해석됩니다.그렇지 않으면 여성 면역체계가 생식기관의 정자를 공격할 수도 있다.정자세포를 코팅하는 특정 당단백질도 암세포와 세균세포, 기생충, HIV 감염 백혈구에 의해 이용되므로 숙주 유기체의 [25]면역반응을 회피할 수 있다.
혈액-고환 장벽은 정관의 세르톨리 세포 사이의 긴밀한 결합에 의해 유지되며, 간질 공간 내에서 고환에서 형성되는 정자와 혈관 사이의 통신을 막습니다.이것은 그들이 면역 반응을 이끌어내는 것을 막는다.혈액 고환 장벽은 또한 독성 물질이 정자 형성을 방해하는 것을 막는데 중요하다.
다른 유기체의 정자
동물
수정은 대부분의 유성생식동물에게 정자에 의존한다.
어떤 종류의 초파리는 [26][27]자연에서 발견된 가장 큰 정자를 생산한다.Drosophila melanogaster는 [28]최대 1.8mm의 정자를 생성하는 반면, Drosophila bifurca는 58mm가 넘는 가장 큰 [26]정자를 생산합니다.Drosophila melanogaster에서는 꼬리를 포함한 전체 정자가 난모세포질에 포함되지만, Drosophila bifurca의 경우 꼬리의 일부만 난모세포로 [29]들어갑니다.
나무쥐 아포데무스 실바티쿠스는 반달 모양의 형태를 가진 정자를 가지고 있다.이러한 생식세포를 독특하게 만드는 또 다른 특징은 정자 머리에 뾰족한 갈고리가 있다는 것이다.이 갈고리는 다른 정자의 갈고리 또는 편모에 부착하는 데 사용됩니다.집약은 이러한 부착물에 의해 발생하며 모바일 트레인 결과가 발생합니다.이러한 열차는 여성의 생식기관에서 향상된 운동성을 제공하며 수정 [30]촉진 수단이다.
생쥐 정자 형성의 감수성 후 단계는 환경 유전독성 물질에 매우 민감하다. 왜냐하면 수컷 생식세포가 성숙한 정자를 형성함에 따라 그들은 DNA 손상을 [31]회복하는 능력을 점차 잃기 때문이다.늦은 정자 형성 중 수컷 생쥐의 조사는 수정 정자에서 최소 7일간 지속되는 손상을 유도할 수 있으며, 모체 DNA 이중사슬 파괴 복구 경로의 교란은 정자 유래 염색체 이상을 [32]증가시킨다.화학요법에 자주 사용되는 2관능성 알킬화제인 멜파란을 통한 수컷 쥐의 처리는 생식세포가 정조세포 [33]발달의 DNA 수복 능력 단계를 통해 진행됨에 따라 수리되지 않은 상태로 지속될 수 있는 감수분열 중 DNA 병변을 유도한다.수정 후 정자의 이러한 미수리 DNA 손상은 자손에게 다양한 이상을 초래할 수 있다.
Arbacia puntulata와 같은 성게는 정자 연구에 사용하기에 이상적인 유기체로 바다에 많은 양의 정자를 낳기 때문에 [34]실험용 모델 유기체로 적합하다.
식물, 조류 및 곰팡이
이끼식물, 양치식물 및 일부 나체배엽의 배우체생물은 대부분의 나체배엽과 모든 혈관배엽에 사용되는 꽃가루 알갱이와 달리 운동성 정자세포를 생성한다.물은 정자와 난자가 만나는 데 필요한 매개체이기 때문에 물이 없으면 성적인 번식이 불가능해진다.조류와 하등식물 정자 세포는 종종 다편모(이미지 참조)로 동물 정자와 형태학적으로 다르다.
몇몇 조류와 곰팡이는 정조세포라고 불리는 비운동성 정자세포를 생산한다.고등 식물과 일부 조류와 곰팡이에서 수정은 수정관을 통해 정자핵이 난세포에 도달하는 것을 포함한다.
포유류의 정자 생성
정자는 정자 형성이라 불리는 과정에서 고환의 정관 안에서 생성된다.정조세포라고 불리는 둥근 세포는 결국 정자가 되기 위해 분열하고 분화한다.교미하는 동안 클로아카나 질은 수정되고, 정자는 화농을 통해 나팔관이나 자궁 안에 있는 난자로 이동합니다.
ART에서 노모동물성 혈증은 총 사출량 3900만 이상, 진행성 운동성 운동성 운동량 32%, 정상 형태학 4% 이상을 의미한다.또한 인간의 정상적인 사정량은 1.5ml가 넘어야 하며, 사정당 6ml가 넘어야 한다(고혈압).부피가 부족한 것을 저혈증이라고 한다.이러한 문제는 정자 생성의 여러 합병증과 관련이 있습니다. 예를 들어 다음과 같습니다.
- 과혈증: 보통 전립선염 때문에 유발된다.
- 저혈증: 불완전한 사정, 보통 안드로겐 결핍(고안드로겐증) 또는 사정관 일부의 폐색을 말합니다.실험실 조건에서도 샘플의 부분 손실로 인해 발생합니다.
- 아스페르미아: 사정 같은 건 없어요.역행성 사정, 해부학적 또는 신경학적 질병 또는 항고혈압 약물에 의해 발생할 수 있습니다.
정자활성화
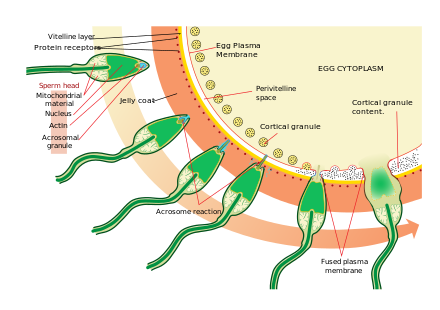
난자 세포에 접근하는 것은 개별 계통 발생 수준에서 서로 다른 화학물질/자극에 의해 유도되는 다소 복잡한 다단계 화학작용이다.이 이벤트의 가장 유의하고 일반적인 시그널링 특성 중 하나는 프로페셔널 케모택시 수용체의 프로토타입, 포밀펩타이드 수용체(60,000 수용체/세포) 및 그 리간드 포밀 Met-Leu-Phe의 활성화 능력이 인간의 [36]정자의 경우에도 표면막에서 입증되었다는 것이다.포유류의 정자 세포는 정자 활성화라고 불리는 과정에서 난자에 접근할 때 훨씬 더 활발해진다.정자 활성화는 체외 칼슘 이오노포어, 인근 적란세포에 의해 방출되고 Zona pelllucida의 ZP3에 결합하는 프로게스테론에 의해 일어나는 것으로 나타났다.적란세포는 히알루론산을 주성분으로 하는 겔상 물질에 내장되어 난소에서 난자와 함께 발달하여 성장하면서 지지한다.
초기 변화는 "과민활성화"라고 불리며, 정자의 운동성에 변화를 일으킨다.그들은 더 빨리 헤엄치고 꼬리의 움직임은 더 힘차고 불규칙해진다.
최근의 발견은 과잉 활성화가 꼬리로 갑자기 칼슘 이온이 유입되는 것과 관련이 있다.정자의 채찍 같은 꼬리에는 CatSper라고 불리는 단백질에 의해 형성된 이온 채널이 박혀 있다.이러한 채널은 선택적이므로 칼슘 이온만 통과할 수 있습니다.CatSper 채널의 개방은 칼슘의 유입의 원인이 됩니다.칼슘 수치가 갑자기 상승하면 편모가 더 깊게 구부러져 점성 환경을 통해 정자를 더 강하게 밀어냅니다.정자 과잉행동은 수정으로부터 난자를 보호하는 두 가지 물리적 장벽을 뚫기 위해 필요하다.
정자 활성화의 두 번째 과정은 아크로솜 반응이다.이것은 분산되는 아크로솜의 내용물을 방출하고 정자의 내부 아크로솜 막에 부착된 효소의 노출을 포함한다.이것은 정자가 난자를 처음 만난 후에 발생한다.이 자물쇠와 열쇠 타입의 메커니즘은 종에 따라 다르며 다른 종의 정자와 난자가 융합되는 것을 막습니다.이 결합이 정자가 난자와 융합할 수 있게 하는 효소를 분비하도록 자극하는 것이라는 증거가 있다.
ZP3는 Zona pellucida를 구성하는 단백질 중 하나로 정자의 파트너 분자와 결합합니다.내측 아크로솜막의 효소는 조나 펠루시다를 소화시킨다.정자가 조나 펠루시다를 관통한 후, 정자의 세포막의 일부가 난자 세포막과 융합하고, 머리의 내용물은 난자로 확산된다.
침투하면 난모세포가 활성화된다고 한다.그것은 2차 감수분열을 거치고, 두 개의 반수체 핵(모성 및 모성)이 접합자를 형성하기 위해 융합한다.다배체를 방지하고 3배체 접합체를 만들 가능성을 최소화하기 위해, 난자의 조나 펠루시다에 대한 몇 가지 변화는 난자에 들어간 직후 그들을 뚫을 수 없게 만든다.
인공 저장
정자는 7일 [37]이상 정자의 높은 번식력을 유지할 수 있는 것으로 보고된 일리니 가변온도(IVT) 희석제와 같은 희석제에 저장될 수 있다.IVT 희석제는 여러 가지 소금, 설탕 및 항균제로 구성되며 [37]CO가2 가스로 구성되어 있습니다.
정액 저온 보존은 훨씬 더 긴 보관 기간 동안 사용할 수 있습니다.인간 정자의 경우, 이 방법으로 가장 오래 보존된 것으로 보고된 것은 21년이다.[38]
MMP 및 용량
이 섹션은 어떠한 출처도 인용하지 않습니다. 2021년 6월 (이를 에 대해 설명합니다) |
용량 조절은 정자 발달의 마지막 단계로, 그들이 난모세포를 수정하는 능력을 획득할 때.체내에서는 정자가 질에서 나와 여성의 생식기관으로 들어오는 사정 중에 발생합니다.체외에서 정자를 세척하고 정제할 때 발생합니다.불임의 거의 30-40%는 남성 요인에 기인하기 때문에 기능성 정자를 회복하기 위한 몇 가지 전략이 만들어졌다.MMP(Million Motile Progressive cells per militer) 측정은 용량과 동의어로, 정조영상과 함께 필요한 치료의 종류를 결정하는 데 매우 유용한 매개 변수입니다.용량으로 얻은 진행성 운동성 정자의 %와 사정을 통해 얻은 진행성 운동성 정자의 % 사이의 비율을 나타낸다.이 값은 복구 비율을 기반으로 합니다.비율에 따라 우리는 운동성 정자 회복의 질을 결정할 것이다: 1500만에서 2500만 정자/ml는 최적, 500만에서 1500만 정자는 충분, 500만 미만은 불충분 또는 불충분한 것으로 간주된다.얻은 값에 대해서는, 정조영상의 결과와 함께, 다른 테크닉이 표시됩니다.
예를 들어 밀리리터당 1.0×106 이상의 진행성 운동성 정자가 발견되면 성관계를 권하고, 그렇지 못하면 다음 단계는 자궁내 수정과 추후 기존의 체외 수정이다.
진행성 운동성 정자가 밀리리터당 1.0×106 미만인 상태에서 세포질 내 정자 주입을 실시합니다.아조혈증(사정액에 정자가 없는 경우)의 경우 고환에 정자가 있는지, 정자가 생성되지 않았는지 확인하기 위해 고환 생검을 실시합니다.
역사
「 」를 참조해 주세요.
레퍼런스
- ^ "spermatozoon". Dictionary.com Unabridged (Online). n.d.
- ^ "Timeline: Assisted reproduction and birth control". CBC News. Retrieved 2006-04-06.
- ^ Smith, D. J.; Gaffney, E. A.; Blake, J. R.; Kirkman-Brown, J. C. (25 February 2009). "Human sperm accumulation near surfaces: a simulation study" (PDF). Journal of Fluid Mechanics. 621: 289–320. Bibcode:2009JFM...621..289S. doi:10.1017/S0022112008004953. S2CID 3942426.
- ^ Ishijima, Sumio; Oshio, Shigeru; Mohri, Hideo (1986). "Flagellar movement of human spermatozoa". Gamete Research. 13 (3): 185–197. doi:10.1002/mrd.1120130302.
- ^ Eisenbach, Michael; Giojalas, Laura C. (April 2006). "Sperm guidance in mammals — an unpaved road to the egg". Nature Reviews Molecular Cell Biology. 7 (4): 276–285. doi:10.1038/nrm1893. PMID 16607290. S2CID 32567894.
- ^ del Río, María José; Godoy, Ana; Toro, Alejandra; Orellana, Renán; Cortés, Manuel E.; Moreno, Ricardo D.; Vigil, Pilar (October 2007). "La reacción acrosómica del espermatozoide: avances recientes". Revista Internacional de Andrología. 5 (4): 368–373. doi:10.1016/S1698-031X(07)74086-4.
- ^ "sperm annulus SGD". www.yeastgenome.org. Retrieved 2019-02-22.
- ^ Ward WS, Coffey DS (1991). "DNA packaging and organization in mammalian spermatozoa: comparison with somatic cells". Biology of Reproduction. 44 (4): 569–74. doi:10.1095/biolreprod44.4.569. PMID 2043729.
- ^ a b Barroso, Gerardo; Valdespin, Carlos; Vega, Eva; Kershenovich, Ruben; Avila, Rosaura; Avendaño, Conrado; Oehninger, Sergio (September 2009). "Developmental sperm contributions: fertilization and beyond". Fertility and Sterility. 92 (3): 835–848. doi:10.1016/j.fertnstert.2009.06.030. PMID 19631936.
- ^ Amaral, Alexandra; Castillo, Judit; Ramalho-Santos, João; Oliva, Rafael (1 January 2014). "The combined human sperm proteome: cellular pathways and implications for basic and clinical science". Human Reproduction Update. 20 (1): 40–62. doi:10.1093/humupd/dmt046. PMID 24082039.
- ^ Xia, Bo; Yan, Yun; Baron, Maayan; Wagner, Florian; Barkley, Dalia; Chiodin, Marta; Kim, Sang Y.; Keefe, David L.; Alukal, Joseph P.; Boeke, Jef D.; Yanai, Itai (January 2020). "Widespread Transcriptional Scanning in the Testis Modulates Gene Evolution Rates". Cell. 180 (2): 248–262.e21. doi:10.1016/j.cell.2019.12.015. PMC 7891839. PMID 31978344.
- ^ "Scanning system in sperm may control rate of human evolution".
- ^ "Genetic Scanning System in Sperm May Control Rate of Human Evolution".
- ^ Gavriliouk, Dan; Aitken, Robert John (2015). "Damage to Sperm DNA Mediated by Reactive Oxygen Species: Its Impact on Human Reproduction and the Health Trajectory of Offspring". The Male Role in Pregnancy Loss and Embryo Implantation Failure. Advances in Experimental Medicine and Biology. Vol. 868. pp. 23–47. doi:10.1007/978-3-319-18881-2_2. ISBN 978-3-319-18880-5. PMID 26178844.
- ^ Lozano, G.M.; Bejarano, I.; Espino, J.; González, D.; Ortiz, A.; García, J.F.; Rodríguez, A.B.; Pariente, J.A. (2009). "Density gradient capacitation is the most suitable method to improve fertilization and to reduce DNA fragmentation positive spermatozoa of infertile men". Anatolian Journal of Obstetrics & Gynecology. 3 (1): 1–7.
- ^ Templado C, Uroz L, Estop A (2013). "New insights on the origin and relevance of aneuploidy in human spermatozoa". Molecular Human Reproduction. 19 (10): 634–43. doi:10.1093/molehr/gat039. PMID 23720770.
- ^ Shi Q, Ko E, Barclay L, Hoang T, Rademaker A, Martin R (2001). "Cigarette smoking and aneuploidy in human sperm". Molecular Reproduction and Development. 59 (4): 417–21. doi:10.1002/mrd.1048. PMID 11468778. S2CID 35230655.
- ^ Rubes J, Lowe X, Moore D, Perreault S, Slott V, Evenson D, Selevan SG, Wyrobek AJ (1998). "Smoking cigarettes is associated with increased sperm disomy in teenage men". Fertility and Sterility. 70 (4): 715–23. doi:10.1016/S0015-0282(98)00261-1. PMID 9797104.
- ^ Xing C, Marchetti F, Li G, Weldon RH, Kurtovich E, Young S, Schmid TE, Zhang L, Rappaport S, Waidyanatha S, Wyrobek AJ, Eskenazi B (2010). "Benzene exposure near the U.S. permissible limit is associated with sperm aneuploidy". Environmental Health Perspectives. 118 (6): 833–9. doi:10.1289/ehp.0901531. PMC 2898861. PMID 20418200.
- ^ Xia Y, Bian Q, Xu L, Cheng S, Song L, Liu J, Wu W, Wang S, Wang X (2004). "Genotoxic effects on human spermatozoa among pesticide factory workers exposed to fenvalerate". Toxicology. 203 (1–3): 49–60. doi:10.1016/j.tox.2004.05.018. PMID 15363581. S2CID 36073841.
- ^ Xia Y, Cheng S, Bian Q, Xu L, Collins MD, Chang HC, Song L, Liu J, Wang S, Wang X (2005). "Genotoxic effects on spermatozoa of carbaryl-exposed workers". Toxicological Sciences. 85 (1): 615–23. doi:10.1093/toxsci/kfi066. PMID 15615886.
- ^ Governini L, Guerranti C, De Leo V, Boschi L, Luddi A, Gori M, Orvieto R, Piomboni P (2014). "Chromosomal aneuploidies and DNA fragmentation of human spermatozoa from patients exposed to perfluorinated compounds". Andrologia. 47 (9): 1012–9. doi:10.1111/and.12371. hdl:11365/982323. PMID 25382683. S2CID 13484513.
- ^ Gorczyca, W; Traganos, F; Jesionowska, H; Darzynkiewicz, Z (1993). "Presence of DNA strand breaks and increased sensitivity of DNA in situ to denaturation in abnormal human sperm cells. Analogy to apoptosis of somatic cells". Exp Cell Res. 207 (1): 202–205. doi:10.1006/excr.1993.1182. PMID 8391465.
- ^ Evenson, DP; Darzynkiewicz, Z; Melamed, MR (1980). "Relation of mammalian sperm chromatin heterogeneity to fertility". Science. 210 (4474): 1131–1133. Bibcode:1980Sci...210.1131E. doi:10.1126/science.7444440. PMID 7444440.
- ^ "Sperm clue to 'disease immunity'". BBC News. 2007-12-17.
- ^ a b Pitnick, S; Spicer, GS; Markow, TA (11 May 1995). "How long is a giant sperm?". Nature. 375 (6527): 109. Bibcode:1995Natur.375Q.109P. doi:10.1038/375109a0. PMID 7753164. S2CID 4368953.
- ^ Pitnick, S; Markow, TA (27 September 1994). "Large-male advantages associated with costs of sperm production in Drosophila hydei, a species with giant sperm". Proceedings of the National Academy of Sciences of the United States of America. 91 (20): 9277–81. Bibcode:1994PNAS...91.9277P. doi:10.1073/pnas.91.20.9277. PMC 44795. PMID 7937755.
- ^ Cooper, K.W. (1950). Demerec, M. (ed.). Biology of Drosophila. New York: Wiley. pp. 1–61.
- ^ Pitnick, S.; Spicer, G. S.; Markow, T. A. (1995). "How long is a giant sperm". Nature. 375 (6527): 109. Bibcode:1995Natur.375Q.109P. doi:10.1038/375109a0. PMID 7753164. S2CID 4368953.
- ^ Moore, H; Dvoráková, K; Jenkins, N; Breed, W (2002). "Exceptional sperm cooperation in Wood Mouse" (PDF). Nature. 418 (6894): 174–177. Bibcode:2002Natur.418..174M. doi:10.1038/nature00832. PMID 12110888. S2CID 4413444.
- ^ Marchetti F, Wyrobek AJ (2008). "DNA repair decline during mouse spermiogenesis results in the accumulation of heritable DNA damage". DNA Repair. 7 (4): 572–81. doi:10.1016/j.dnarep.2007.12.011. PMID 18282746.
- ^ Marchetti F, Essers J, Kanaar R, Wyrobek AJ (2007). "Disruption of maternal DNA repair increases sperm-derived chromosomal aberrations". Proceedings of the National Academy of Sciences of the United States of America. 104 (45): 17725–9. Bibcode:2007PNAS..10417725M. doi:10.1073/pnas.0705257104. PMC 2077046. PMID 17978187.
- ^ Marchetti F, Bishop J, Gingerich J, Wyrobek AJ (2015). "Meiotic interstrand DNA damage escapes paternal repair and causes chromosomal aberrations in the zygote by maternal misrepair". Scientific Reports. 5: 7689. Bibcode:2015NatSR...5E7689M. doi:10.1038/srep07689. PMC 4286742. PMID 25567288.
- ^ Vacquier, Victor D. (August 2011). "Laboratory on sea urchin fertilization". Molecular Reproduction and Development. 78 (8): 553–564. doi:10.1002/mrd.21360. PMID 21805525.
- ^ Larry Vogelnest; Timothy Portas (1 May 2019). Current Therapy in Medicine of Australian Mammals. Csiro Publishing. ISBN 978-1-4863-0752-4.
- ^ Gnessi L, Fabbri A, Silvestroni L, Moretti C, Fraioli F, Pert CB, Isidori A (1986). "Evidence for the presence of specific receptors for N-formyl chemotactic peptides on human spermatozoa". Journal of Clinical Endocrinology and Metabolism. 63 (4): 841–6. doi:10.1210/jcem-63-4-841. PMID 3018025.
- ^ a b Watson, P. F. (1993). "The potential impact of sperm encapsulation technology on the importance of timing of artificial insemination: A perspective in the light of published work". Reproduction, Fertility and Development. 5 (6): 691–9. doi:10.1071/RD9930691. PMID 9627729.
- ^ Planer NEWS 및 프레스 릴리즈 > Planer 제어 환율 냉동기를 사용하여 21년간 정액을 보관한 후 태어난 아이 2004년 10월 14일