미토틱 재조합
Mitotic recombination체세포 재조합은 체세포에서 성생물과 무성생물의 유사분열을 준비하는 과정에서 발생할 수 있는 유전적 재조합의 일종이다.무성 생물의 경우, 미토콘드리아 재조합에 대한 연구는 그것이 개인 내에서 재조합의 유일한 원천이기 때문에 유전적 연관성을 이해하는 한 방법이다.[1]또한, 유사이성 재조합은 다른 이질적 개인에서 열성 유전자의 발현을 초래할 수 있다.이 표현은 종양 유전자와 치명적인 열성 유전자의 연구에 중요한 의미를 가진다.[1][2]유사 동질 재조합은 주로 복제 후(그러나 세포 분열 전) 자매 크로마티드 사이에서 발생한다.자매간 호몰로게이션 재결합은 일반적으로 유전적으로 조용하다.유사분열 동안 비 자매 호몰로코 크로마티스 간의 재결합 발생률은 자매 크로마티스 간의 1% 정도밖에 되지 않는다.[3]
디스커버리
유사분열 재조합의 발견은 드로소필라 멜라노가스터에서 쌍둥이가 발견되는 것을 관찰한 데서 비롯되었다.이 쌍둥이 점멸, 즉 모자이크 점멸은 일찍이 1925년에 D. 멜라노가스터에서 관찰되었지만, 1936년에야 커트 스턴이 유사 재조합의 결과로 설명하였다.스턴의 연구 이전에는 특정 유전자가 자신이 위치한 염색체를 제거할 수 있는 능력을 가지고 있기 때문에 쌍둥이 점박이 발생했다는 가설이 제기되었다.[4]나중에 이루어진 실험에서 세포 주기와 재조합 뒤의 메커니즘에서 유사 재조합이 발생할 때를 밝혀냈다.
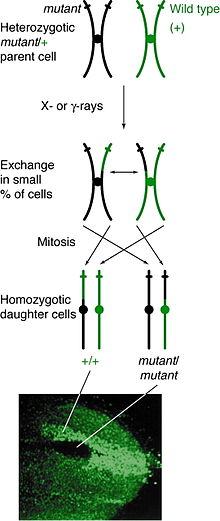
발생
미토틱 재조합은 어떤 위치에서도 일어날 수 있지만, 주어진 위치에서는 이질성인 개인에서 관찰할 수 있다.만약 비 자매 크로마티드들 사이의 교차 현상이 그 위치에 영향을 미친다면, 두 동질 염색체들은 각각의 유전자형을 포함하는 하나의 크로마티드를 가질 것이다.딸 세포의 결과적 표현형은 염색체가 어떻게 은유체 판에 정렬하는가에 따라 달라진다.만약 다른 알레르기를 포함하는 크로마티드가 판의 같은 면에 정렬한다면, 그 결과 딸 세포는 교차 사건에도 불구하고 이질성으로 나타나서 발견될 수 없을 것이다.그러나 같은 알레르기를 가진 크로마티드가 같은 면에 일렬로 늘어선다면, 딸 세포는 그 위치의 동질성이 될 것이다.이로 인해 쌍둥이 점박이(twin spotting)가 발생하는데, 여기서 한 세포는 동질 열성 표현형을 나타내고 다른 세포는 동질 야생형 표현형을 갖는다.만약 그 딸 세포들이 계속해서 복제와 분열을 한다면, 그 쌍둥이 점들은 계속해서 자라날 것이고, 차등 표현형을 반영할 것이다.
유사분열재조합은 상간에서 일어난다.재조합은 DNA가 2-스트랜드 단계에 있는 G1 기간 동안 이루어지며, DNA 합성 중에 복제되는 것이 제안되었다.[5]또한 G1 기간 동안 유사 재조합을 유도하는 DNA 파괴가 가능하지만 복제 후 복구가 이루어지도록 하는 것도 가능하다.[6][7]
DNA 손상에 대한 반응
싹트고 있는 효모 사카로마이오스 세레비시아아에서, 미토틱(그리고 감수성) 재조합에 필요한 여러 유전자의 돌연변이는 방사선 및/또는 유전독성 화학물질에 의한 불활성화에 대한 민감도를 증가시킨다.[8]예를 들어 유전자 rad52는 감수성 재조합뿐만 아니라 유사 재조합에도[9] 필요하다.[10]Rad52 돌연변이 효모세포는 X선, 메틸메탄설폰산염, DNA 교차연동제 8-메톡시술펜 플러스-UV 빛에 의한 살인에 대한 민감도를 증가시켜, 이들 물질에 의한 다른 DNA 손상을 제거하기 위해 유사 재조합 수리가 필요하다는 것을 시사했다.
메커니즘
유사성 재조합의 메커니즘은 감수성 재조합 뒤의 메커니즘과 유사하다.여기에는 자매 크로마티드 교환 및 단일 스트랜드 어닐링, 합성 의존 스트랜드 어닐링(SDSA), 이중 홀리데이 접점 중간 또는 SDSA를 통한 유전자 변환 등 호몰로코 재조합에 의한 DNA 이중 스트랜드 파괴 수리와 관련된 메커니즘이 포함된다.또한, 비호몰성 유사체 재조합은 가능성이 있으며 종종 비호몰성 종단 결합에 기인할 수 있다.[6][7][11][12]
방법
유사분열 교차 현상이 어떻게 발생하는지에 대해서는 몇 가지 이론이 있다.단순 교차 모델에서, 두 개의 동질 염색체는 공통 염색체 연약한 부위(CFS) 위 또는 근처에서 겹친다.이로 인해 이중 가닥이 끊어져 두 가닥 중 하나를 사용하여 수리된다.[13]이것은 두 크로마티드가 장소를 바꾸게 할 수 있다.또 다른 모델에서는, 겹치는 두 자매 크로마티드가 공통의 반복 사이트에서 이중 홀리데이 접점을 형성하고, 나중에 위치를 바꾸는 방식으로 깎인다.어느 모델에서든 염색체는 균등하게 거래되거나 반대편에서 다시 결합할 수 있도록 보장되지 않기 때문에 대부분의 갈라짐 패턴은 어떠한 교차 현상도 일으키지 않는다.균일하지 않은 거래는 많은 유사 교차 작용의 해로운 영향을 초래한다.
또는 광범위한 손상으로 인해 균질 염색체가 자매 크로마티드 위에 있는 템플릿으로 선택될 경우 DNA 수리[14] 중에 교차 현상이 발생할 수 있다.이것은 알레르기의 한 복사본이 동질 염색체로부터 복사되어 손상된 염색체의 균열로 합성되기 때문에 유전자 합성으로 이어진다.이것의 순효과는 이질 염색체 한 개와 동질 염색체 한 개일 것이다.
장단점
미토틱 크로스오버는 D. 멜라노가스터, 일부 무생식성 곰팡이, 그리고 정상 인간 세포에서 발생하는 것으로 알려져 있는데, 이 경우 정상적인 열성 암 유발 유전자가 발현될 수 있고 따라서 암 발병에 발생하는 세포가 발현될 가능성이 있다.또는, 세포는 종양을 억제하는 유전자의 균질 돌연변이가 되어 같은 결과를 초래할 수도 있다.[2]예를 들어 블룸 증후군은 DNA 복제와 수리에 역할을 하는 RecQ 헬리코아제의 돌연변이에 의해 발생한다.이 돌연변이는 생쥐에게 높은 비율의 유사 재결합으로 이어지며, 이 재결합률은 차례로 생쥐에게 종양 감수성을 유발하는 원인이 된다.[15]동시에, 유사분열 재조합은 유익할 수 있다: 그것은 이중 좌초된 틈을 수리하는 데 중요한 역할을 할 수 있고, 동질 지배적인 알레르기가 이질적 상태보다 더 기능적이라면 유기체에 유익할 수 있다.[2]드로소필라 멜라노가스터와 같은 모델 유기체의 게놈 실험에 사용하기 위해 X선과 FLP-FRT 재조합 시스템을 통해 유사 재조합을 유도할 수 있다.[16]
참조
- ^ a b Hartl, Daniel L. and Maryellen Ruvolo (2012). Genetics: Analysis of Genetics and Genomes. Burlington: Jones & Bartlett.
- ^ a b c Tischfield, Jay A. (November 1997). "Loss of Heterozygosity, or: How I learned to Stop Worrying and Love Mitotic Recombination". American Journal of Human Genetics. 61 (5): 995–999. doi:10.1086/301617. PMC 1716040. PMID 9345110.
- ^ Moynahan ME, Jasin M (2010). "Mitotic homologous recombination maintains genomic stability and suppresses tumorigenesis". Nat. Rev. Mol. Cell Biol. 11 (3): 196–207. doi:10.1038/nrm2851. PMC 3261768. PMID 20177395.
- ^ Stern, Curt (1936). "Somatic Crossing Over and Segregation in Drosophila Melanogaster". Genetics. 21 (6): 625–730. doi:10.1093/genetics/21.6.625. PMC 1208727. PMID 17246815.
- ^ Esposito, Michael S (September 1978). "Evidence that Spontaneous Mitotic Recombination Occurs at the Two-Strand Stage". Proceedings of the National Academy of Sciences of the USA. 75 (9): 4436–4440. doi:10.1073/pnas.75.9.4436. PMC 336130. PMID 360220.
- ^ a b Lee, Phoebe S.; Greenwell, Patricia W.; Dominska, Margaret; Gawel, Malgorzata; Hamilton, Monica; Petes, Thomas D. (2009). "A Fine-Structure Map of Spontaneous Mitotic Crossovers in the Yeast Saccharomyces cerevisiae". PLOS Genet. 5 (3): e1000410. doi:10.1371/journal.pgen.1000410. PMC 2646836. PMID 19282969.
- ^ a b LaFave, MC; J Sekelsky (2009). "Mitotic Recombination: Why? When? How? Where?". PLOS Genet. 5 (3): e1000411. doi:10.1371/journal.pgen.1000411. PMC 2648873. PMID 19282976.
- ^ Haynes, R.H. & Kunz, B.A. (1981년)효모에서 DNA 수리와 돌연변이 유발.인: Strathern, J; Jones, E; Broach J. 편집자.효모 사카로마이오스의 분자생물학.수명 주기 및 상속.뉴욕 콜드 스프링 하버 연구소 371-414
- ^ Malone RE, Esposito RE (1980). "The RAD52 gene is required for homothallic interconversion of mating types and spontaneous mitotic recombination in yeast". Proc. Natl. Acad. Sci. U.S.A. 77 (1): 503–7. doi:10.1073/pnas.77.1.503. PMC 348300. PMID 6987653.
- ^ Game JC, Zamb TJ, Braun RJ, Resnick M, Roth RM (1980). "The Role of Radiation (rad) Genes in Meiotic Recombination in Yeast". Genetics. 94 (1): 51–68. doi:10.1093/genetics/94.1.51. PMC 1214137. PMID 17248996.
- ^ Helleday, Thomas (2003). "Pathways for Mitotic Homologous Recombination in Mammalian Cells". Mutation Research. 532 (1–2): 103–115. doi:10.1016/j.mrfmmm.2003.08.013. PMID 14643432.
- ^ Pâques, Frédéric; James E. Haber (1999). "Multiple Pathways of Recombination Induced by Double-Strand Breaks in Saccharomyces cerevisiae". Microbiology and Molecular Biology Reviews. 63 (2): 349–404. doi:10.1128/MMBR.63.2.349-404.1999. PMC 98970. PMID 10357855.
- ^ Helleday, T. "Double-Strand Break Repair via Double Holliday Junctions (Szostak Model)". Animation. MIT.
- ^ Helleday, Thomas (27 November 2003). "Pathways for mitotic homologous recombination in mammalian cells" (PDF). Mutation Research. 532 (1–2): 103–115. doi:10.1016/j.mrfmmm.2003.08.013. PMID 14643432. Archived from the original (PDF) on 24 May 2014. Retrieved 2012-12-26.
- ^ Luo, Guangbin; et al. (2000). "Cancer predisposition caused by elevated mitotic recombination in Bloom mice". Nature Genetics. 26 (4): 424–429. doi:10.1038/82548. PMID 11101838. S2CID 21218975.
- ^ Xu, T; GM Rubin (April 1993). "Analysis of genetic mosaics in developing and adult Drosophila tissues". Development. 117 (4): 1223–12237. doi:10.1242/dev.117.4.1223. PMID 8404527.
- 그리피스 외 1999.현대 유전자 분석.W. H. Freeman and Company.


