에노일-CoA 가수분해효소
Enoyl-CoA hydratase| 에노일-코엔자임A, 하이드라타아제/3-히드록시아실코엔자임A탈수소효소 | |||||||
|---|---|---|---|---|---|---|---|
 활성 부위가 오렌지색, 기질이 빨간색인 랫드로부터의 Enoyl-CoA 하이드라타아제 헥사머. | |||||||
| 식별자 | |||||||
| 기호. | EHADH | ||||||
| Alt. | ECHD | ||||||
| NCBI유전자 | 1962 | ||||||
| HGNC | 3247 | ||||||
| 옴 | 607037 | ||||||
| 참조 | NM_001966 | ||||||
| 유니프로트 | Q08426 | ||||||
| 기타 데이터 | |||||||
| EC 번호 | 4.2.1.17 | ||||||
| 궤적 | 제3장 Q26.3~q28 | ||||||
| |||||||
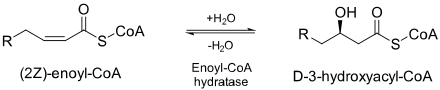
에노일-CoA 수화효소(ECH) 또는 크로토나아제는[1] 2-트랜스/시스-에노일-CoA에서 [2]두 번째와 세 번째 탄소 사이의 이중 결합을 수화시키는 효소이다.
ECH는 아세틸 CoA와 [2]ATP의 형태로 에너지를 생성하기 위해 베타 산화에서 지방산을 대사하는 데 필수적이다.
랫드의 ECH는 6가지 활성 부위가 있어 효율로 이어지는 6가지 단백질(이 특성은 보편적이지 않지만 인간의 효소도 6가지)이다.이 효소는 매우 효율적이며, 사람들이 지방산을 에너지로 매우 빠르게 대사할 수 있도록 해줍니다.사실 이 효소는 매우 효율적이기 때문에 짧은 사슬 지방산의 속도는 확산 제어 [3]반응의 속도와 동등합니다.
대사
지방산 대사
ECH는 지방산 분해의 두 번째 단계(β-산화)[4]를 촉매한다.지방산 대사는 인간의 몸이 지방을 에너지로 바꾸는 방법이다.음식 속의 지방은 일반적으로 트리글리세롤의 형태이다.지방이 사람의 몸으로 전달되기 위해서는 이것들을 분해해야 한다.그럴 때 세 가지 지방산이 방출된다.
류신 대사
메커니즘
ECH는 지방산 CoA의 불포화β탄소에 수산기 및 양성자를 첨가하기 위해 β산화에 사용된다.ECH는 촉매산 및 염기로서 글루탐산 잔류물 2개를 제공함으로써 기능을 합니다.두 개의 아미노산은 물 분자를 제자리에 고정시켜 β-탄소의 α-β 불포화 아실-CoA에 더해 공격할 수 있도록 합니다.α-탄소는 다른 양성자를 잡아 베타-히드록시 아실-CoA의 형성을 완료한다.
또한 실험 데이터를 통해 양성자의 다른 원천이 활성 부위에 존재하지 않는 것으로 알려져 있다.이것은 α-탄소가 붙잡은 양성자가 방금 β-탄소를 공격한 물에서 나온 것임을 의미한다.이것은 수산화기와 물에서 나온 양성자는 모두 이중 결합의 같은 쪽에서 첨가된다는 것을 의미합니다. 즉, 합성 첨가입니다.이를 통해 ECH는 2-트랜스-에노일-CoA에서 S 입체 이성질체를, 2-시스에노일-CoA에서 R 입체 이성질체를 만들 수 있습니다.이는 물을 α-β 불포화 이중 결합에 바로 인접한 위치에 유지하는 두 개의 글루탐산 잔류물에 의해 가능하다.이 구성에서는 아실-CoA에 관해 매우 특정한 구성으로 물을 유지하기 위해 ECH의 활성 부위가 매우 견고해야 합니다.이 반응의 메커니즘에 대한 데이터는 이 반응이 일치하는지(그림에 표시됨) 또는 연속된 단계에서 발생하는지에 대해 결정적이지 않다.연속적으로 발생하는 경우 중간은 E1cB 제거 [8]반응에서 생성되는 중간과 동일합니다.
ECH는 기계적으로 푸마라아제와 유사하다.
레퍼런스
- ^ "EC 4.2.1.17". www.sbcs.qmul.ac.uk. Retrieved 2018-09-05.
- ^ a b Allenbach, L; Poirier, Y (2000). "Analysis of the Alternative Pathways for the β-Oxidation of Unsaturated Fatty Acids Using Transgenic Plants Synthesizing Polyhydroxyalkanoates in Peroxisomes". Plant Physiology. 124 (3): 1159–1168. doi:10.1104/pp.124.3.1159. ISSN 0032-0889. PMC 59215. PMID 11080293.
- ^ Engel CK, Kiema TR, Hiltunen JK, Wierenga RK (February 1998). "The crystal structure of enoyl-CoA hydratase complexed with octanoyl-CoA reveals the structural adaptations required for binding of a long chain fatty acid-CoA molecule". Journal of Molecular Biology. 275 (5): 847–59. doi:10.1006/jmbi.1997.1491. PMID 9480773.
- ^ Cox DL, Nelson MM (2005). Lehninger principles of biochemistry (4th ed.). New York: W.H. Freeman. p. 647-43. ISBN 978-0-7167-4339-2.
- ^ a b Wilson JM, Fitschen PJ, Campbell B, Wilson GJ, Zanchi N, Taylor L, Wilborn C, Kalman DS, Stout JR, Hoffman JR, Ziegenfuss TN, Lopez HL, Kreider RB, Smith-Ryan AE, Antonio J (February 2013). "International Society of Sports Nutrition Position Stand: beta-hydroxy-beta-methylbutyrate (HMB)". Journal of the International Society of Sports Nutrition. 10 (1): 6. doi:10.1186/1550-2783-10-6. PMC 3568064. PMID 23374455.
- ^ a b Kohlmeier M (May 2015). "Leucine". Nutrient Metabolism: Structures, Functions, and Genes (2nd ed.). Academic Press. pp. 385–388. ISBN 978-0-12-387784-0. Retrieved 6 June 2016.
Energy fuel: Eventually, most Leu is broken down, providing about 6.0kcal/g. About 60% of ingested Leu is oxidized within a few hours ... Ketogenesis: A significant proportion (40% of an ingested dose) is converted into acetyl-CoA and thereby contributes to the synthesis of ketones, steroids, fatty acids, and other compounds
그림 8.57: L-류신의 대사 - ^ Bahnson BJ, Anderson VE, Petsko GA (February 2002). "Structural mechanism of enoyl-CoA hydratase: three atoms from a single water are added in either an E1cb stepwise or concerted fashion". Biochemistry. 41 (8): 2621–9. doi:10.1021/bi015844p. PMID 11851409.
외부 링크
- Enoyl-CoA+미국 국립 의학 도서관 의료 주제 제목(MeSH)의 하이드라타아제