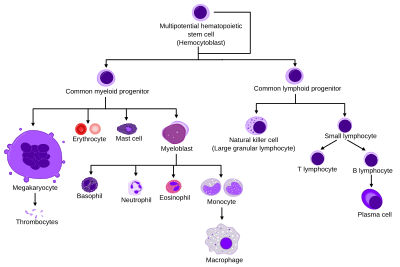
조혈
Haematopoiesis조혈(/hɪmétppɔs, hihiːmtoto-, ɛhəm/-/)[1][2]은 그리스어 αμα, '혈액' 및 '만들기'에서 유래한다. 또한 미국 영어에서 조혈은 혈액의 구성 요소이다.모든 세포혈액성분은 조혈모세포에서 [3][4]유래한다.건강한 성인의 경우 말초 [5][6][page needed]순환에서 안정된 상태를 유지하기 위해 매일 약11 10-10개의12 새로운 혈구가 생산된다.
과정
조혈줄기세포(HSC)
조혈줄기세포(HSC)는 뼈(골수)의 수질에 존재하며 다른 모든 성숙한 혈액세포 유형과 [4]조직을 발생시키는 독특한 능력을 가지고 있다.HSC는 자가 재생 세포로 분화할 때 적어도 일부 딸 세포는 HSC로 남아 줄기세포 풀이 고갈되지 않습니다.이 현상을 비대칭 [7]분할이라고 합니다.HSC의 다른 딸들(골수 및 림프 전구 세포)은 하나 이상의 특정 유형의 혈액 세포 생성으로 이어지는 다른 분화 경로를 따를 수 있지만, 스스로 재생하지는 못한다.자손의 풀은 이질적이며 두 그룹으로 나눌 수 있다. 즉, 장기 자가 재생 HSC와 단기 [8]항이라고도 불리는 일시적인 자가 재생 HSC이다.이것은 신체에서 가장 중요한 과정 중 하나이다.
셀 타입
모든 혈구는 세 개의 [9]혈통으로 나뉜다.
- 적혈구라고도 불리는 적혈구는 산소를 운반하는 세포이다.적혈구는 기능하며 혈액으로 방출된다.미숙한 적혈구인 망상 적혈구의 수는 적혈구 발생률을 추정한다.
- 림프구는 적응 면역체계의 초석이다.그들은 일반적인 림프관 조상들로부터 유래되었다.림프 계통은 T 세포, B 세포, 그리고 자연 킬러 세포로 구성되어 있다.이건 림프구예요.
- 과립구, 거핵구 및 대식세포를 포함한 골수 계통의 세포는 일반적인 골수성 전구체로부터 파생되어 선천적인 면역 및 혈액 응고와 같은 다양한 역할에 관여한다.이것은 골수성 조혈입니다.
과립구(Granulopoiesis)는 과립구이지만 골수외 [10]성숙을 가진 비만세포를 제외한 과립구의 조혈이다.
거핵구균은 [citation needed]거핵구의 조혈이다.
용어.
1948년에서 1950년 사이에 혈액 및 혈액 형성 기관의 세포 및 질병 명명 명확화 위원회는 혈액 [11][12]세포의 명명법에 대한 보고서를 발표했다.개발 초기 단계부터 최종 단계까지 용어 개요는 다음과 같습니다.
- [root] 삭제
- 친[뿌리] 세포
- [뿌리] 세포
- 메타[뿌리] 세포
- 성숙한 세포명
적혈구 콜로니 형성 단위(CFU-E)의 뿌리는 "루브리"이고 과립구 단구 콜로니 형성 단위(CFU-GM)는 "과립" 또는 "myelo" 및 "mono"이며 림프구 콜로니 형성 단위(CFU-L)는 "림프"이고 거구 콜로니 형성 단위 및 거구이 용어에 따르면 적혈구 형성의 단계는 루브리블라스트, 프로루브리시테, 루브리시테, 메타루브리시테, 적혈구입니다.그러나 현재 다음과 같은 명칭이 가장 널리 사용되고 있는 것으로 보입니다.
| 위원회. | '오토' | '루브리" | granulo 또는 myelo | "실패" | 메가카료 |
|---|---|---|---|---|---|
| 계보 | 림프구 | 골수상 | 골수상 | 골수상 | 골수상 |
| CFU | CFU-L | CFU-GEMM→CFU-E | CFU-GEMM→CFU-GM→CFU-G | CFU-GEMM→CFU-GM→CFU-M | CFU-GEMM→CFU-Meg |
| 과정 | 림프구 증가증 | 적혈구 형성 | 과립구 포이시스 | 단구성 | 혈소판성 |
| [root] 삭제 | 림프아구 | 프롤리슬라스트 | 골수아세포 | 모노블라스트 | 거대아구 |
| 친[뿌리] 세포 | 전림프구 | 다색성 적혈구 | 전골수구 | 프로모나구 | 프로메각아리아구 |
| [뿌리] 세포 | – | 노모블라스트 | 에오시노/중성/호염기성 골수구 | 거핵구 | |
| 메타[뿌리] 세포 | 대형 림프구 | 망상 적혈구 | 호산구, 호산구, 호산구, 호산구, 호산구, 호산구, 호산구, 호산구, 호산구 | 초기 단구 | - |
| 성숙한 세포명 | 소림프구 | 적혈구 | 과립구(에오시노/중성자/호염소) | 단구 | 혈소판(혈소판) |
골아세포는 또한 단구/호중구 계통의 조혈세포, 특히 CFU-GM에서 발생한다.
위치
배아를 발달시킬 때, 혈액 형성은 혈도라고 불리는 노른자낭의 혈구 집합체에서 일어납니다.발육이 진행되면서 비장, 간, 림프절에 혈액 형성이 일어난다.골수가 발달할 때, 그것은 결국 전체 [4]유기체를 위한 대부분의 혈구를 형성하는 임무를 떠맡게 된다.그러나 림프세포의 성숙, 활성화 및 증식은 비장, 흉선, 림프절에서 일어난다.어린이에서 조혈은 대퇴골과 정강이뼈와 같은 긴 뼈의 골수에서 발생한다.성인의 경우 골반, 두개골, 척추, [13]흉골 등에 주로 발생한다.
골수외
경우에 따라서는 간, 흉선, 비장이 필요에 따라 조혈 기능을 재개할 수 있다.이것은 골수외 조혈이라고 불린다.그것은 이러한 장기의 크기를 크게 증가시킬 수 있다.태아가 발달하는 동안 뼈와 골수가 나중에 발달하기 때문에 간은 주요 조혈 기관 역할을 한다.따라서,[14] 간은 발달하는 동안 커진다.골수외 조혈과 골수외 조혈은 [15][16]성인기에 심혈관 질환과 염증에 백혈구를 공급할 수 있다.비장 대식세포 및 접착 분자는 심혈관 [17][18]질환에서 골수외 골수세포 생성 조절에 관여할 수 있다.
성숙.
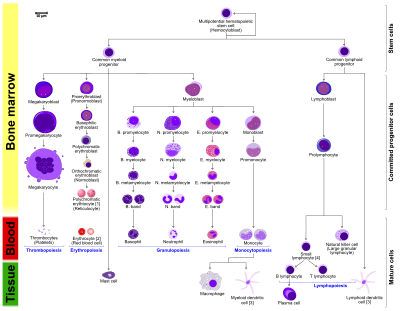
- 조혈세포의 형태학적 특성은 라이트 염색체, 메이-젬사 염색체 또는 메이-그룬발트-젬사 염색체에서 볼 수 있다.특정 셀의 대체 이름은 괄호 사이에 표시됩니다.
- 특정 셀은 여러 개의 특징적인 외관을 가질 수 있습니다.이 경우, 같은 셀의 표현이 여러 개 포함되어 있습니다.
- 단구 및 림프구는 과립구(염기성, 호중구 및 호산구)가 과립구(염기성, 호중구 및 호산구)와 반대로 무과립구를 구성한다.
- B., N., E.는 각각 호염기성, 호중구, 호산구(Basophilic promylocyte)를 나타낸다.림프구의 경우 T와 B가 실제 명칭입니다.
- 우측의 다색 적혈구(망상 적혈구)는 메틸렌블루 또는 아쥬르B로 착색되었을 때 그 특징이 나타난다.
- 오른쪽에 있는 적혈구는 현미경으로 보았을 때 실제의 모습을 더 정확하게 표현합니다.
- 단세포에서 발생하는 다른 세포: 골세포, 미세글리아(중앙신경계), 랑게르한스 세포(상피), 쿠퍼 세포(간)
- T와 B 림프구를 명확하게 하기 위해 분할하여 혈장세포가 B세포에서 발생함을 보다 잘 나타낸다.특정 염색을 적용하지 않는 한 B 셀과 T 셀의 외관에는 차이가 없다는 점에 유의하십시오.
줄기세포가 성숙함에 따라, 그것은 될 수 있는 세포 유형을 제한하고 특정 세포 유형에 더 가깝게 움직이는 유전자 발현 변화를 겪는다.이러한 변화는 종종 세포 표면에 있는 단백질의 존재를 관찰함으로써 추적할 수 있다.각각의 연속적인 변경은 셀을 최종 셀 타입에 가깝게 이동시키고 셀 [citation needed]타입이 다른 셀 타입이 될 가능성을 더욱 제한한다.
세포 운명 결정
조혈에 대한 두 가지 모델이 제안되었다: 결정론과 확률론.[19]줄기세포 및 골수 내의 다른 미분화 혈액세포에 대해, 그 결정은 일반적으로 조혈의 결정론 이론으로 설명되며, 조혈 미세환경의 콜로니 자극인자 및 다른 요인이 세포 [4]분화의 특정 경로를 따르도록 결정한다고 말한다.이것은 조혈을 설명하는 전형적인 방법이다.확률론에서, 미분화 혈액 세포는 무작위성에 의해 특정 세포 유형으로 분화된다.이 이론은 마우스 조혈 전구 세포 집단 내에서 줄기세포 인자 Sca-1 분포의 기초 확률적 변동성이 모집단을 세포 분화의 가변 속도를 나타내는 그룹으로 세분화한다는 것을 보여주는 실험에 의해 뒷받침되어 왔다.예를 들어 적혈구 분화인자(적혈구 분화인자)의 영향으로 세포군([20]Sca-1의 수치로 정의)이 나머지 모집단보다 7배 높은 속도로 적혈구로 분화했다.게다가, 만약 성장이 허용된다면, 이 하위 집단이 세포의 원래의 하위 집단을 다시 형성한다는 것이 보여졌고, 이것은 확률적이고, 되돌릴 수 있는 과정이라는 이론을 뒷받침한다.확률성이 중요할 수 있는 또 다른 수준은 아포토시스와 자가 갱신 과정이다.이 경우, 조혈 미세 환경은 살아남기 위해 세포 중 일부는 아포토시스(apoptosis)를 수행하고 다른 일부는 [4]죽는다.다른 세포들 사이의 균형을 조절함으로써, 골수는 궁극적으로 생산될 [21]다른 세포들의 양을 바꿀 수 있다.
성장 요인
적혈구 및 백혈구 생산은 건강한 사람에게 매우 정밀하게 조절되며, 감염 시 백혈구 생산은 빠르게 증가한다.이러한 세포의 증식과 자가 재생은 성장 인자에 달려 있다.자가 재생과 조혈세포 발달의 핵심 주체 중 하나는 HSC의 c-kit 수용체에 결합하는 줄기세포 인자(SCF)[24]이다.SCF의 부재는 치명적이다.인터류킨 IL-2, IL-3, IL-6, IL-7과 같이 증식과 성숙을 조절하는 다른 중요한 당단백질 성장 인자가 있다.콜로니 자극 인자(CSF)라고 불리는 다른 인자들은 특히 커밋된 세포의 생성을 자극합니다.CSF는 과립구-대식세포 CSF(GM-CSF), 과립구 CSF(G-CSF) 및 대식세포 CSF(M-CSF)[25]의 3종류이다.이것들은 과립구 형성을 자극하고 전구 세포 또는 최종 생성 세포에서 활성화된다.
골수 전구세포가 적혈구가 [22]되기 위해서는 에리트로포이에틴이 필요하다.한편 트롬보포이에틴은 골수 전구세포를 거핵구(혈소판 형성 세포)[22]로 분화시킨다.오른쪽에 있는 도표는 사이토카인과 그것이 일으키는 [26]분화된 혈구의 예를 보여줍니다.
전사 계수
성장 인자는 신호 전달 경로를 시작하여 전사 인자의 활성화를 유도합니다.성장 인자는 인자의 조합과 세포의 분화 단계에 따라 다른 결과를 도출합니다.예를 들어, PU.1의 장기 발현은 골수 결합을 초래하고, PU.1 활성의 단기 유도는 미성숙한 호산구 [27]형성을 초래한다.최근에는 NF-δB와 같은 전사 인자가 [28]조혈에서 마이크로RNA(예: miR-125b)에 의해 조절될 수 있다고 보고되었다.
HSC에서 다기능 전구체(MPP)로의 분화의 첫 번째 주요 주체는 전사인 CCAAT-enhancer 결합 단백질α(C/EBPα)이다.C/EBPα의 돌연변이는 급성 골수성 [29]백혈병과 관련이 있다.이 시점부터 세포는 적혈구-대핵구 계통을 따라 분화할 수 있고 림프관과 골수 계통을 따라 분화할 수 있으며, 림프관성 다기능 전구체라고 불리는 공통 전구체를 가지고 있다.두 가지 주요 전사 인자가 있습니다.적혈구-대핵구 계통의 PU.1과 림프구-주입 다기능 [30]전구체를 이끄는 GATA-1.
다른 전사 인자는 Ikaros[31](B 세포 발달)와 Gfi1[32](Th2 발달을 촉진하고 Th1을 억제) 또는[33] IRF8(염기구 및 비만 세포)을 포함한다.유의하게, 특정 요인들은 조혈의 다른 단계에서 다른 반응을 이끌어낸다.예를 들어 호중구 발달의 CEBPα 또는 단구 및 수지상 세포 발달의 PU.1이다.과정이 단방향적이지 않다는 것에 주목하는 것이 중요하다: 분화된 세포는 선조 [1]세포의 속성을 되찾을 수 있다.
예를 들어 PAX5 인자는 B 세포 발달에 중요하고 [34]림프종과 관련이 있다.놀랍게도, pax5 조건부 녹아웃 마우스는 말초 성숙한 B세포가 초기 골수 전구세포로 분화할 수 있도록 했다.이러한 연구결과는 전사인자가 [35]개시자뿐만 아니라 차별화 수준의 관리자로서 작용한다는 것을 보여준다.
전사인자의 돌연변이는 급성 골수성 백혈병(AML) 또는 급성 림프구성 백혈병(ALL)과 같이 혈액암과 밀접하게 연관되어 있다.예를 들어, 이카로스는 수많은 생물학적 사건의 조절자로 알려져 있다.이카로스가 없는 쥐는 B세포, 내추럴 킬러,[36] T세포가 없다.Ikaros는 6개의 아연 핑거 도메인을 가지고 있으며, 4개는 보존된 DNA 결합 도메인이고, 2개는 이합체화를 [37]위한 도메인입니다.매우 중요한 발견은 다른 아연 손가락이 DNA의 다른 위치에 결합하는 데 관여하고 이것이 Ikaros의 다원적 효과와 암에 대한 다른 관여의 이유이지만, 주로 BCR-Abl 환자와 관련된 돌연변이며 나쁜 예후 [38]표식자라는 것이다.
기타 동물
일부 척추동물에서 조혈은 내장, 비장 또는 신장과 [39]같은 결합조직의 느슨한 기질과 혈액 공급이 느린 곳이면 어디에서나 발생할 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b "hematopoiesis". Merriam-Webster Dictionary. Retrieved 16 May 2022.
- ^ "haematopoiesis". Dictionary.com Unabridged (Online). n.d. Retrieved 16 October 2019.
- ^ Monga I, Kaur K, Dhanda S (March 2022). "Revisiting hematopoiesis: applications of the bulk and single-cell transcriptomics dissecting transcriptional heterogeneity in hematopoietic stem cells". Briefings in Functional Genomics. 21 (3): 159–176. doi:10.1093/bfgp/elac002. PMID 35265979.
- ^ a b c d e Birbrair, Alexander; Frenette, Paul S. (1 March 2016). "Niche heterogeneity in the bone marrow". Annals of the New York Academy of Sciences. 1370 (1): 82–96. Bibcode:2016NYASA1370...82B. doi:10.1111/nyas.13016. ISSN 1749-6632. PMC 4938003. PMID 27015419.
- ^ Leif Jansson의 2008년 웁살라 대학교 4학기 의학 강의
- ^ Parslow TG, Stites DP, Terr AI, Imboden JB (1997). Medical Immunology (1 ed.). ISBN 978-0-8385-6278-9.
- ^ Morrison, J.; Judith Kimble (2006). "Asymmetric and symmetric stem-cell divisions in development and cancer" (PDF). Nature. 441 (7097): 1068–74. Bibcode:2006Natur.441.1068M. doi:10.1038/nature04956. hdl:2027.42/62868. PMID 16810241. S2CID 715049.
- ^ Morrison SJ, Weissman IL (November 1994). "The long-term repopulating subset of hematopoietic stem cells is deterministic and isolable by phenotype". Immunity. 1 (8): 661–73. doi:10.1016/1074-7613(94)90037-x. PMID 7541305.
- ^ "Hematopoiesis from Pluripotent Stem Cells". Antibodies Resource Library. ThermoFisher Scientific. Retrieved 25 April 2020.
- ^ Mahler (2013). Haschek, Wanda; Rousseaux, Colin G.; Wallig, Matthew A. (eds.). Haschek and Rousseaux's handbook of toxicologic pathology. associate editors, Brad Bolon and Ricardo Ochoa; illustrations editor, Beth W. (Third ed.). [S.l.]: Academic Press. p. 1863. ISBN 978-0-12-415759-0.
- ^ "FIRST report of the committee for clarification of the nomenclature of cells and diseases of the blood and blood-forming organs". American Journal of Clinical Pathology. 18 (5): 443–50. May 1948. doi:10.1093/ajcp/18.5_ts.443. PMID 18913573.
- ^ "THIRD, fourth and fifth reports of the committee for clarification of the nomenclature of cells and diseases of the blood and blood-forming organs". American Journal of Clinical Pathology. 20 (6): 562–79. June 1950. doi:10.1093/ajcp/20.6.562. PMID 15432355.
- ^ Fernández KS, de Alarcón PA (December 2013). "Development of the hematopoietic system and disorders of hematopoiesis that present during infancy and early childhood". Pediatric Clinics of North America. 60 (6): 1273–89. doi:10.1016/j.pcl.2013.08.002. PMID 24237971.
- ^ Georgiades CS, Neyman EG, Francis IR, Sneider MB, Fishman EK (November 2002). "Typical and atypical presentations of extramedullary hemopoiesis". AJR. American Journal of Roentgenology. 179 (5): 1239–43. doi:10.2214/ajr.179.5.1791239. PMID 12388506.
- ^ Swirski, Filip K.; Libby, Peter; Aikawa, Elena; Alcaide, Pilar; Luscinskas, F. William; Weissleder, Ralph; Pittet, Mikael J. (2 January 2007). "Ly-6Chi monocytes dominate hypercholesterolemia-associated monocytosis and give rise to macrophages in atheromata". Journal of Clinical Investigation. 117 (1): 195–205. doi:10.1172/JCI29950. PMC 1716211. PMID 17200719.
- ^ Swirski FK, Nahrendorf M, Etzrodt M, Wildgruber M, Cortez-Retamozo V, Panizzi P, Figueiredo JL, Kohler RH, Chudnovskiy A, Waterman P, Aikawa E, Mempel TR, Libby P, Weissleder R, Pittet MJ (30 July 2009). "Identification of Splenic Reservoir Monocytes and Their Deployment to Inflammatory Sites". Science. 325 (5940): 612–616. Bibcode:2009Sci...325..612S. doi:10.1126/science.1175202. PMC 2803111. PMID 19644120.
- ^ Dutta, P; Hoyer, FF; Grigoryeva, LS; Sager, HB; Leuschner, F; Courties, G; Borodovsky, A; Novobrantseva, T; Ruda, VM; Fitzgerald, K; Iwamoto, Y; Wojtkiewicz, G; Sun, Y; Da Silva, N; Libby, P; Anderson, DG; Swirski, FK; Weissleder, R; Nahrendorf, M (6 April 2015). "Macrophages retain hematopoietic stem cells in the spleen via VCAM-1". The Journal of Experimental Medicine. 212 (4): 497–512. doi:10.1084/jem.20141642. PMC 4387283. PMID 25800955.
- ^ Dutta, P; Hoyer, FF; Sun, Y; Iwamoto, Y; Tricot, B; Weissleder, R; Magnani, JL; Swirski, FK; Nahrendorf, M (September 2016). "E-Selectin Inhibition Mitigates Splenic HSC Activation and Myelopoiesis in Hypercholesterolemic Mice With Myocardial Infarction". Arteriosclerosis, Thrombosis, and Vascular Biology. 36 (9): 1802–8. doi:10.1161/ATVBAHA.116.307519. PMC 5001901. PMID 27470513.
- ^ Kimmel, Marek (1 January 2014). "Stochasticity and determinism in models of hematopoiesis". A Systems Biology Approach to Blood. Advances in Experimental Medicine and Biology. Vol. 844. pp. 119–152. doi:10.1007/978-1-4939-2095-2_7. ISBN 978-1-4939-2094-5. ISSN 0065-2598. PMID 25480640.
- ^ Chang, Hannah H.; Hemberg, Martin; Barahona, Mauricio; Ingber, Donald E.; Huang, Sui (2008). "Transcriptome-wide noise controls lineage choice in mammalian progenitor cells". Nature. 453 (7194): 544–547. Bibcode:2008Natur.453..544C. doi:10.1038/nature06965. PMC 5546414. PMID 18497826.
- ^ Alenzi, FQ; Alenazi, BQ; Ahmad, SY; Salem, ML; Al-Jabri, AA; Wyse, RK (March 2009). "The haemopoietic stem cell: between apoptosis and self renewal". The Yale Journal of Biology and Medicine. 82 (1): 7–18. PMC 2660591. PMID 19325941.
- ^ a b c d 분자 세포 생물학.Lodish, Harvey F. 5. ed: – 뉴욕: W. H. Freeman and Co., 2003, 973 s. b. 병.ISBN0-7167-4366-3
Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). "Cancers Originate in Proliferating Cells". Molecular Cell Biology (4th ed.). New York: W. H. Freeman. Figure 24-8: Formation of differentiated blood cells from hematopoietic stem cells in the bone marrow. ISBN 0-7167-3136-3 – via NCBI Bookshelf. - ^ Rod Flower; Humphrey P. Rang; Maureen M. Dale; Ritter, James M. (2007). Rang & Dale's pharmacology. Edinburgh: Churchill Livingstone. ISBN 978-0-443-06911-6.
- ^ Broudy, VC (15 August 1997). "Stem cell factor and hematopoiesis". Blood. 90 (4): 1345–64. doi:10.1182/blood.V90.4.1345. PMID 9269751.
- ^ Ketley, N. J.; A. C. Newland (1997). "Haemopoietic growth factors". Postgrad Med J. 73 (858): 215–221. doi:10.1136/pgmj.73.858.215. PMC 2431295. PMID 9156123.
- ^ Hauke, Ralph; Stefano R. Tarantolo (November 2000). "Hematopoietic Growth Factors". Laboratory Medicine. 31 (11): 613–5. doi:10.1309/HNTM-ELUV-AV9G-MA1P.
- ^ Engel, I; Murre, C (October 1999). "Transcription factors in hematopoiesis". Current Opinion in Genetics & Development. 9 (5): 575–9. doi:10.1016/s0959-437x(99)00008-8. PMID 10508690.
- ^ O’Connell, R; Rao, D.; Baltimore, D (2012). "microRNA Regulation of Inflammatory Responses". Annual Review of Immunology. 30: 295–312. doi:10.1146/annurev-immunol-020711-075013. PMID 22224773.
- ^ Ho, PA; Alonzo, TA; Gerbing, RB; Pollard, J; Stirewalt, DL; Hurwitz, C; Heerema, NA; Hirsch, B; Raimondi, SC; Lange, B; Franklin, JL; Radich, JP; Meshinchi, S (25 June 2009). "Prevalence and prognostic implications of CEBPA mutations in pediatric acute myeloid leukemia (AML): a report from the Children's Oncology Group". Blood. 113 (26): 6558–66. doi:10.1182/blood-2008-10-184747. PMC 2943755. PMID 19304957.
- ^ Woolthuis, Carolien M.; Park, Christopher Y. (10 March 2016). "Hematopoietic stem/progenitor cell commitment to the megakaryocyte lineage". Blood. 127 (10): 1242–1248. doi:10.1182/blood-2015-07-607945. ISSN 0006-4971.
- ^ Thompson, Elizabeth C.; Cobb, Bradley S.; Sabbattini, Pierangela; Meixlsperger, Sonja; Parelho, Vania; Liberg, David; Taylor, Benjamin; Dillon, Niall; Georgopoulos, Katia (1 March 2007). "Ikaros DNA-binding proteins as integral components of B cell developmental-stage-specific regulatory circuits". Immunity. 26 (3): 335–344. doi:10.1016/j.immuni.2007.02.010. ISSN 1074-7613. PMID 17363301.
- ^ Suzuki, Junpei; Maruyama, Saho; Tamauchi, Hidekazu; Kuwahara, Makoto; Horiuchi, Mika; Mizuki, Masumi; Ochi, Mizuki; Sawasaki, Tatsuya; Zhu, Jinfang (1 April 2016). "Gfi1, a transcriptional repressor, inhibits the induction of the T helper type 1 programme in activated CD4 T cells". Immunology. 147 (4): 476–487. doi:10.1111/imm.12580. ISSN 1365-2567. PMC 4799889. PMID 26749286.
- ^ Sasaki, Haruka; Kurotaki, Daisuke; Tamura, Tomohiko (1 April 2016). "Regulation of basophil and mast cell development by transcription factors". Allergology International. 65 (2): 127–134. doi:10.1016/j.alit.2016.01.006. ISSN 1440-1592. PMID 26972050.
- ^ O'Brien, P; Morin, P, Jr; Ouellette, RJ; Robichaud, GA (15 December 2011). "The Pax-5 gene: a pluripotent regulator of B-cell differentiation and cancer disease". Cancer Research. 71 (24): 7345–50. doi:10.1158/0008-5472.CAN-11-1874. PMID 22127921.
- ^ Cobaleda, C; Jochum, W; Busslinger, M (27 September 2007). "Conversion of mature B cells into T cells by dedifferentiation to uncommitted progenitors". Nature. 449 (7161): 473–7. Bibcode:2007Natur.449..473C. doi:10.1038/nature06159. PMID 17851532. S2CID 4414856.
- ^ Wang, JH; Nichogiannopoulou, A; Wu, L; Sun, L; Sharpe, AH; Bigby, M; Georgopoulos, K (December 1996). "Selective defects in the development of the fetal and adult lymphoid system in mice with an Ikaros null mutation". Immunity. 5 (6): 537–49. doi:10.1016/s1074-7613(00)80269-1. PMID 8986714.
- ^ Sun, L; Liu, A; Georgopoulos, K (1 October 1996). "Zinc finger-mediated protein interactions modulate Ikaros activity, a molecular control of lymphocyte development". The EMBO Journal. 15 (19): 5358–69. doi:10.1002/j.1460-2075.1996.tb00920.x. PMC 452279. PMID 8895580.
- ^ Schjerven, H; McLaughlin, J; Arenzana, TL; Frietze, S; Cheng, D; Wadsworth, SE; Lawson, GW; Bensinger, SJ; Farnham, PJ; Witte, ON; Smale, ST (October 2013). "Selective regulation of lymphopoiesis and leukemogenesis by individual zinc fingers of Ikaros". Nature Immunology. 14 (10): 1073–83. doi:10.1038/ni.2707. PMC 3800053. PMID 24013668.
- ^ Zon, LI (15 October 1995). "Developmental biology of hematopoiesis". Blood (Review). 86 (8): 2876–91. doi:10.1182/blood.V86.8.2876.2876. PMID 7579378.
추가 정보
- Godin, Isabelle; Cumano, Ana, eds. (2006). Hematopoietic stem cell development. Springer. ISBN 978-0-306-47872-7.