원자 궤도
Atomic orbital원자 이론과 양자 역학에서 원자 오비탈은 [1]원자에서 전자의 위치와 파동 같은 행동을 설명하는 함수이다.이 함수는 원자핵 주변의 특정 영역에서 원자의 전자를 찾을 확률을 계산하는데 사용될 수 있습니다.원자 궤도라는 용어는 또한 [2]오비탈의 특정한 수학적 형태에 의해 예측된 것처럼 전자가 존재하는 것으로 계산될 수 있는 물리적 영역 또는 공간을 나타낼 수 있다.
원자 내의 각 오비탈은 각각 전자의 에너지, 각운동량 및 각운동량 벡터 성분(자성 양자수)에 대응하는 3개의 양자수 n, θ, m의l 값 세트로 특징지어진다.자기 양자수 대신 궤도에는 종종 연관된 조화 다항식(예: xy, x2 - y2)으로 레이블이 지정된다.이러한 각 궤도는 최대 2개의 전자에 의해 점유될 수 있으며, 각 전자는 s{s의 자체 투영을 가지고 있습니다.단순한 명칭의 orbital, p orbital, d orbital, f orbital은 각운동량 양자수 = 0, 1, 2, 3인 궤도를 의미한다.이러한 이름은 n의 값과 함께 원자의 전자 구성을 설명하는 데 사용됩니다.초기 분광학자들이 특정 일련의 알칼리 금속 스펙트럼 라인에 대해 샤프, 주, 확산 및 기본이라고 기술한 것에서 파생되었다.> > 3의 오비탈은 알파벳 순으로 계속됩니다(예를 들어, h, i, k,[3] ...). 일부 언어는 문자 "i"와 "j"[6]를 구분하지 않기 때문에 j를 생략합니다[4][5].
원자 궤도는 원자 궤도 모델(또는 전자 구름 또는 파동 역학 모델)의 기본 구성 요소이며, 물질 내 전자의 초미세 거동을 시각화하기 위한 현대적 프레임워크입니다.이 모델에서 원자의 전자 구름은 단순한 수소 유사 원자 궤도의 산물인 전자 구성에서 (근사적으로) 축적된 것으로 보일 수 있다.주기율표의 섹션 내에서 2, 6, 10, 14개의 원소의 반복 주기성은 양자수 n의 높은 값에 대하여, 특히 원자가 양의 전하를 가질 때, 특정 서브의 에너지, 즉 s, p, d, f의 궤도 세트를 각각 점유하는 총 전자수로부터 자연적으로 발생한다.- 입자는 매우 유사하므로 전자에 의해 채워진다고 하는 순서(예: Cr = [Ar] 4s3d15 및 Cr2+ = [Ar] 3d4)는 다소 자의적으로만 합리화될 수 있다.
전자 특성
양자역학의 발전과 실험 결과(예: 전자의 두 슬릿 회절)와 함께, 핵 주위를 도는 전자는 입자로 완전히 묘사될 수 없지만, 파동-입자 이중성으로 설명될 필요가 있다는 것이 발견되었다.이런 의미에서 전자는 다음과 같은 특성을 가집니다.
파도와 같은 속성:
- 전자는 태양 주위를 도는 행성처럼 핵 주위를 도는 것이 아니라 정재파로 존재한다.따라서 전자가 취할 수 있는 가장 낮은 에너지는 실에 있는 파형의 기본 주파수와 유사합니다.높은 에너지 상태는 기본 주파수의 고조파와 유사합니다.
- 전자는 절대 한 점 위치에 있지 않지만, 한 점에서의 전자와 상호작용할 확률은 전자의 파동 함수에서 찾을 수 있습니다.전자의 전하는 마치 전자의 파동 함수의 제곱 크기에 비례하는 연속적인 분포로 우주에서 얼룩져 있는 것처럼 작용합니다.
입자 모양 속성:
- 핵 주위를 도는 전자의 수는 정수일 수 있다.
- 전자는 입자처럼 궤도 사이를 뛰어다닌다.예를 들어, 한 개의 광자가 전자에 부딪히면, 그 결과 한 개의 전자만 상태를 바꾼다.
- 전자는 입자와 같은 특성을 가지고 있습니다.각 파동 상태는 전자 입자와 같은 전하를 가집니다.각 파형 상태는 겹치는 위치에 따라 단일 이산 스핀(스핀 업 또는 스핀 다운)을 가집니다.
그러므로, 전자는 단순히 고체 입자로 묘사될 수 없다.유추는 상대적으로 작은 행성(핵) 주위에 분포된 크고 종종 이상한 모양의 "대기"의 그것일 수 있다.원자 궤도는 한 개의 전자가 존재할 때만 이 "대기"의 모양을 정확하게 묘사합니다.더 많은 전자가 추가될 때, 추가된 전자는 원자핵 주변의 공간을 더 균일하게 채우는 경향이 있기 때문에, 결과적인 집합("전자 [7]구름")은 불확실성 원리로 인해 전자의 위치를 설명하는 확률의 일반적으로 구형 영역을 향하는 경향이 있습니다.
형식 양자 역학적 정의
원자 궤도는 공식 양자역학 언어로 더 정확하게 정의될 수 있다.그것들은 원자핵의 전기장에 의해 원자에 결합되는 전자에 대한 슈뢰딩거 방정식의 대략적인 해이다.구체적으로는 양자역학에서 원자상태, 즉 원자 해밀턴의 고유상태는 1전자함수의 반대칭 산물(슬레이터 결정인자)의 선형결합으로 확장(배치상호작용 확장 및 기저세트 참조)함으로써 근사된다.이러한 1전자 함수의 공간 구성 요소는 원자 궤도라고 불립니다.(스핀 성분도 고려할 때 원자 스핀 오비탈을 말한다.)상태는 사실 모든 전자의 좌표의 함수이며, 그래서 그들의 움직임은 상관관계가 있지만, 이것은 종종 단일 전자파 [8]함수의 산물의 독립 입자 모델에 의해 근사된다.(예를 들어 런던 분산력은 전자 운동의 상관관계에 따라 달라집니다.)
원자물리학에서 원자 스펙트럼 라인은 원자의 양자 상태 사이의 변화(양자 도약)에 해당합니다.이러한 상태는 용어 기호로 요약되고 일반적으로 특정 전자 구성과 관련된 일련의 양자 번호에 의해 라벨링된다. 즉, 원자 궤도의 점유 체계에 의해(예를 들어, 신생아기 기호0: S의 지상 상태에 대해서는 1s2 2s2 2p6).
이 표기법은 대응하는 Slater 결정요인이 설정 상호작용 확장에서 명확하게 높은 가중치를 갖는 것을 의미합니다.따라서 원자 궤도 개념은 주어진 전이와 관련된 들뜸 과정을 시각화하기 위한 핵심 개념이다.예를 들어, 주어진 천이에 대해 점유된 궤도로부터 주어진 점유되지 않은 궤도로의 전자의 들뜸에 대응한다고 말할 수 있다.그러나 전자는 파울리 배타원리에 의해 지배되는 페르미온으로 [9]서로 구별할 수 없다는 것을 명심해야 한다.또한 구성 상호작용 확장이 매우 느리게 수렴되어 단순한 1결정파 함수에 대해 전혀 말할 수 없는 경우가 있습니다.이것은 전자 상관관계가 큰 경우입니다.
기본적으로 원자 오비탈은 많은 전자가 1전자 원자에 있지 않아도 1전자파 함수이므로 1전자 뷰는 근사치입니다.궤도에 대해 생각할 때, 우리는 종종 하트리(Hartree)의 영향을 많이 받는 궤도 시각화를 받는다.분자 궤도 이론의 복잡성을 줄이는 방법 중 하나인 Fock 근사.
궤도의 종류

원자 궤도는 수소 유사 "원자"에 대한 슈뢰딩거 방정식의 정확한 해인 수소 유사 "궤도"가 될 수 있습니다.또는 원자 궤도는 하나의 전자의 좌표(즉, 궤도)에 의존하지만 원자 또는 분자에 있는 모든 전자의 동시 좌표에 의존하는 근사 파동 함수의 시작점으로 사용되는 함수를 참조한다.궤도용으로 선택된 좌표계는 보통 원자의 구면 좌표계(r, θ, θ)와 다원자 분자의 데카르트 좌표계(x, y, z)이다.여기서 구면 좌표의 장점은 궤도파 함수가 각각 단일 좌표에 의존하는 세 가지 인자의 곱이라는 것이다. 즉, δ(r, θ) = R(r) δ(θ) δ(θ) δ(θ)이다.원자 궤도 δ(θ) δ(θ)의 각도 인자는 구면 고조파ℓm Y(θ, θ)의 실제 조합으로 s, p, d 등 함수를 생성한다(여기서 θ와 m은 양자수).방사 함수 R(r)에는 일반적으로 세 가지 수학적 형태가 있으며, 이는 많은 전자를 가진 원자와 분자의 특성을 계산하기 위한 시작점으로 선택될 수 있다.
- 수소 유사 궤도는 하나의 전자와 수소 유사 원자에 대한 핵에 대한 슈뢰딩거 방정식의 정확한 해로부터 도출됩니다.핵으로부터의 거리 r에 따라 달라지는 기능 부분은 방사형 노드를 가지며−(constant × distance) e로 감소합니다.
- 슬레이터형 궤도(STO)는 방사형 노드가 없는 형태이지만 수소 유사 궤도처럼 핵에서 붕괴됩니다.
- 가우스형 오비탈(가우스식)의 형태는 방사형 노드가 없으며 e- 2 {\ e r로 붕괴된다.
비록 수소와 같은 궤도가 여전히 교육학적 도구로 사용되고 있지만, STO의 조합이 수소 같은 궤도의 노드를 대체할 수 있기 때문에 컴퓨터의 등장으로 인해 STO가 원자와 이원자 분자에 더 선호되게 되었다.가우시안들은 일반적으로 3개 이상의 원자를 가진 분자에 사용된다.STO만큼 정확하지는 않지만, 많은 가우시안들의 조합은 수소 같은 궤도의 정확성을 얻을 수 있다.
역사
"궤도"라는 용어는 1932년 로버트 멀리켄에 의해 단일 전자 궤도 파동 [10]함수의 줄임말로 만들어졌습니다.하지만, 전자가 확실한 각운동량을 가진 콤팩트한 핵 주위를 회전할 수 있다는 생각은 닐스 [11]보어에 의해 설득력 있게 주장되었고,[12] 일본의 물리학자 한타로 나가오카가 1904년에 전자 거동에 대한 궤도에 기초한 가설을 발표했다.이러한 전자 "궤도"의 행동을 설명하는 것은 양자 [13]역학 발전의 원동력 중 하나였다.
초기 모델
1897년 [14]J. J. Thomson이 전자를 발견하면서 원자는 자연의 가장 작은 구성 요소가 아니라 오히려 복합 입자라는 것이 분명해졌다.원자 안에서 새롭게 발견된 구조는 많은 사람들이 원자의 구성 요소들이 서로 어떻게 상호작용할 수 있는지 상상하도록 유혹했다.톰슨은 여러 전자가 양전하를 띤 젤리 같은 [15]물질 내에서 궤도 같은 고리 안에서 회전한다는 이론을 세웠으며, 전자의 발견과 1909년 사이에 이 "플럼 푸딩 모델"은 원자 구조에 대한 가장 널리 받아들여진 설명이었다.
톰슨의 발견 직후, 나가오카 한타로(長 predicted太郞)는 전자 [12]구조의 다른 모델을 예측했다.매실 푸딩 모델과 달리 나가오카 씨의 토성 모델에서는 양전하가 중심핵에 집중돼 토성의 고리를 연상시키는 원형 궤도로 전자를 끌어당겼다.당시 [16]나가오카 씨의 연구에 주목한 사람은 거의 없었고, 나가오카 씨 자신도 그 개념조차 이론의 근본적인 결함, 즉 고전적인 하전 물체는 가속하고 있기 때문에 궤도 운동을 지속할 수 없기 때문에 전자기 [17]복사에 의해 에너지가 손실된다는 것을 인식했습니다.그럼에도 불구하고, 토성 모형은 현대 이론과 동시대의 어떤 것들보다 더 많은 공통점을 가지고 있는 것으로 밝혀졌다.
보어 원자
1909년, 어니스트 러더포드는 원자 질량의 대부분이 양전하를 띠는 것으로 밝혀진 핵에 단단히 응축되어 있다는 것을 발견했다.1911년 그의 분석에서 매실 푸딩 모델은 원자 구조를 설명할 수 없다는 것이 분명해졌다.1913년 러더포드의 박사 후 학생 닐스 보어는 전자가 고전적인 주기로 핵 주위를 도는 새로운 원자 모형을 제안했지만, 단위 [11]θ로 양자화된 각운동량의 이산값만을 갖는 것이 허용되었다.이 제약은 특정 전자 에너지만 자동으로 허용했습니다.원자의 Bohr 모델은 (이보다 낮은 상태가 없다고 선언함으로써) 지면 상태의 방사선에 의한 에너지 손실 문제를 해결했으며, 스펙트럼 라인의 기원을 더 중요하게 설명했다.
원자 속의 에너지 수준을 방출된 빛의 파장과 연관시키기 위해 광전 효과에 대한 아인슈타인의 설명을 사용한 후, 원자 내의 전자 구조와 원자 방출 및 흡수 스펙트럼 사이의 연결은 원자 내의 전자를 이해하는 데 점점 더 유용한 도구가 되었다.(19세기 중반 이후 실험적으로 알려진) 방출 및 흡수 스펙트럼의 가장 두드러진 특징은 이러한 원자 스펙트럼이 이산 라인을 포함하고 있다는 것이다.Bohr 모델의 중요성은 방출과 흡수 스펙트럼의 선을 전자가 원자 주위를 돌 수 있는 궤도 사이의 에너지 차이에 연관시켰다는 것이다.그러나, 전자가 물질 파동처럼 행동할 수 있다는 생각은 11년이 지나서야 제안되었기 때문에, 이것은 전자에게 일종의 파동 같은 특성을 줌으로써 보어에 의해 달성되지 않았다.그럼에도 불구하고, Bohr 모델의 양자화된 각도 모멘타와 그에 따라 양자화된 에너지 레벨의 사용은 원자의 전자에 대한 이해를 향한 중요한 단계였고, 양자화된 제약이 원자의 모든 불연속적인 에너지 레벨과 스펙트럼을 설명해야 한다는 것을 암시하는 양자 역학의 발전을 향한 중요한 단계였다.
전자 물질파의 1924년 존재의 드브로이의 제안, 수소 유사 원자의 완전한 1926년 슈뢰딩거 방정식을 내보내기 전에 짧은 시간 동안 가지고, 보어 전자"파장"가 모멘텀의 함수가 보어 궤도를 돌고 있는 전자 원의 half-wavelength의 배수로에서 궤도를 도는 것을 봤다 볼 수 있었다.[를]짧은 시간 동안 Bohr 모델은 '파장' 인수에 의해 제공되는 추가적인 제약을 가진 고전적인 모델로 볼 수 있다.그러나 이 시기는 1926년의 완전한 3차원 파동역학에 의해 즉시 대체되었다.현재 물리학에 대한 우리의 이해에서, Bohr 모델은 각운동량의 양자화 때문에 반고전적 모델이라고 불리는데, 이는 Bohr 모델이 제안되고 12년 후에야 나타난 전자파장과의 관계 때문이 아니다.
Bohr 모델은 수소의 방출과 흡수 스펙트럼을 설명할 수 있었다.Bohr 모델에서 n = 1, 2, 3 등의 상태에 있는 전자의 에너지는 현재 물리학의 에너지와 일치한다.그러나 헬륨(2전자), 네온(10전자), 아르곤(18전자)이 유사한 화학적 불활성성을 보인다는 사실 등 주기율표로 표현되는 서로 다른 원자 간의 유사성은 설명되지 않았다.현대의 양자역학은 파울리 배타원리에 의해 결정되는 많은 전자를 각각 보유할 수 있는 전자껍질과 서브껍질의 관점에서 이것을 설명한다.따라서 n = 1 상태는 하나 또는 두 개의 전자를 보유할 수 있는 반면, n = 2 상태는 2s 및 2p 하위 껍질에서 최대 8개의 전자를 보유할 수 있습니다.헬륨의 경우 모든 n = 1 상태가 완전히 점유되며, 네온의 경우 n = 1 및 n = 2에 대해서도 마찬가지입니다.아르곤에서 3s 및 3p 서브셸은 마찬가지로 8개의 전자에 의해 완전히 점유됩니다. 양자역학도 3d 서브셸을 허용하지만 이는 아르곤의 3s 및 3p보다 높은 에너지이며 비어 있습니다(수소의 상황과는 반대됨).
하이젠베르크 불확도 원리에 대한 현대 개념 및 연관성
Heisenberg가 [18]불확실성 원리를 발견한 직후, [19]Bohr는 패킷 자체를 생성하기 위해 주파수의 확산이 필요하기 때문에 어떤 종류의 파형 패킷의 존재는 파형 주파수와 파장의 불확실성을 의미한다고 언급했다.모든 입자 모멘타가 파동과 관련된 양자역학에서, 우주에서 파동을 국소화하는 것은 그러한 파동 패킷의 형성이다.양자역학적 입자가 결합되어 있는 상태에서는 파동 패킷으로 국소화되어야 하며, 패킷의 존재와 최소 사이즈는 입자 파장의 확산과 최소치를 의미하며, 이에 따라 운동량과 에너지도 포함된다.양자역학에서, 입자가 공간의 작은 영역에 국소화됨에 따라, 관련된 압축파 패킷은 점점 더 큰 범위의 모멘타, 따라서 더 큰 운동 에너지를 필요로 한다.따라서 작은 공간 영역에 입자를 포함하거나 가두는 결합 에너지는 공간 영역이 작아질수록 제한 없이 증가합니다.입자는 무한한 입자 운동량을 필요로 하기 때문에 공간의 기하학적 점으로 제한될 수 없습니다.
화학에서, 슈뢰딩거, 폴링, 물리켄과 다른 사람들은 하이젠베르크의 관계의 결과가 파동 패킷으로서 전자가 궤도에서 정확한 위치를 갖는 것으로 간주될 수 없다는 것에 주목했다.Max Born은 전자의 위치가 관련된 파동 패킷을 설명하는 파동 함수의 어떤 지점에서 전자를 찾는 것과 연결된 확률 분포에 의해 설명되어야 한다고 제안했다.새로운 양자역학은 정확한 결과를 제시하지 않고 다양한 가능한 결과가 발생할 확률만 제시했습니다.하이젠버그는 움직이는 입자의 경로는 원자 내의 전자로는 관찰할 수 없는 것처럼 우리가 그것을 관찰할 수 없다면 의미가 없다고 주장했다.
하이젠베르크, 슈뢰딩거 등의 양자 그림에서 각 궤도별 Bohr 원자수 n은 3차원 원자의 n-구로[citation needed] 알려져 원자를 둘러싼 전자파 패킷의 확률 구름의 가장 가능성이 높은 에너지로 그려졌다.
궤도명
궤도 표기법 및 서브셸
궤도에는 보통 다음과 같은 형태로 이름이 지정됩니다.
여기서 X는 주요 양자 번호 n에 해당하는 에너지 수준이며, type은 각 운동량 양자 번호 θ에 해당하는 궤도의 모양 또는 부껍질을 나타내는 소문자입니다.
예를 들어, 궤도 1s("one" 'ess'로 발음됨)는 가장 낮은 에너지 수준이며(n = 1) θ = 0의 각 양자 수를 가지며, s로 표시된다.θ = 1, 2, 3인 궤도는 각각 p, d, f로 표기한다.
주어진 n과 θ에 대한 궤도 집합을 서브셸이라고 하며, 이는 다음과 같다.
- t y \ X , \ { { } \}。
지수 y는 하위 껍질에 있는 전자 수를 나타냅니다.예를 들어 표기법4 2p는 원자의 2p 서브셸에 4개의 전자가 포함되어 있음을 나타낸다.이 서브셸은 각각 n = 2 및 θ = 1인 3개의 오비탈을 가진다.
X선 표기법
또한 X선 과학에서 아직 덜 일반적으로 사용되는 또 다른 X선 표기법인 X선 표기법이 있는데, 이것은 궤도 이론이 잘 이해되기 전에 사용된 표기법의 연속이다.본 시스템에서는 주요 양자수에 관련된 문자가 부여된다.n = 1, 2, 3, 4, 5, ...의 경우, 이러한 숫자와 관련된 문자는 각각 K, L, M, N, O, ...이다.
수소 궤도
가장 단순한 원자 궤도는 수소 원자와 같이 단일 전자를 가진 시스템을 위해 계산된 것입니다.단일 전자로 이온화된 다른 원소의 원자는 수소와 매우 유사하며, 궤도는 같은 형태를 취합니다.하나의 음의 입자와 하나의 양의 입자로 이루어진 이 시스템에 대한 슈뢰딩거 방정식에서, 원자 궤도는 에너지에 대한 해밀턴 연산자의 고유 상태입니다.분석적으로 얻을 수 있으며, 이는 결과 궤도가 다항식 급수와 삼각함수의 산물임을 의미합니다.(수소 원자 참조).
두 개 이상의 전자를 가진 원자의 경우, 지배 방정식은 반복 근사 방법을 사용해야만 풀 수 있다.다중 전자 원자의 궤도는 수소와 질적으로 비슷하며, 가장 단순한 모델에서는 같은 형태를 취한다.보다 엄격하고 정확한 분석을 위해서는 수치 근사치를 사용해야 한다.
주어진 (수소 유사) 원자 궤도는 n, θ 및ℓ m의 3개의 양자수의 고유값으로 식별된다.양자수와 그 에너지(아래 참조)의 값을 제한하는 규칙은 원자의 전자 구성과 주기표를 설명한다.
수소 유사 원자의 정지 상태(양자 상태)는 원자 [clarification needed]궤도이다.하지만, 일반적으로 전자의 행동은 단일 궤도로는 완전히 묘사되지 않는다.전자 상태는 다중 궤도의 시간에 의존하는 "혼합"(선형 조합)으로 가장 잘 표현된다.원자 궤도 분자 궤도법의 선형 결합을 참조하십시오.
양자 번호 n은 각 원형 전자 궤도의 반지름을 결정하는 Bohr 모델에서 처음 나타났다.그러나 현대 양자역학에서 n은 핵에서 전자의 평균 거리를 결정합니다. n의 값이 같은 모든 전자는 같은 평균 거리에 있습니다.이 때문에, 같은 값 n의 궤도는 「셸」을 구성하고 있다고 한다.값이 n이고 값이 θ인 궤도는 더욱 밀접하게 관련되어 있으며 "하위 껍질"을 구성한다고 한다.
양자수
원자핵 주변 전자의 양자역학적 특성 때문에 원자 궤도는 양자수라고 알려진 정수 집합에 의해 고유하게 정의될 수 있다.이러한 양자수는 특정 값의 조합에서만 발생하며, 실제 또는 복잡한 버전의 원자 궤도 사용 여부에 따라 물리적 해석이 달라집니다.
복소 궤도
물리학에서 가장 일반적인 궤도 설명은 수소 원자에 대한 해법에 기초하며, 여기서 궤도는 방사 함수와 순수한 구면 고조파 사이의 곱에 의해 주어진다.양자수는 가능한 값을 지배하는 규칙과 함께 다음과 같습니다.
주 양자수 n은 전자의 에너지를 나타내며 항상 양의 정수이다.실제로는 어떤 양의 정수라도 상관없습니다만, 아래에서 설명하는 이유로 큰 숫자는 거의 볼 수 없습니다.각 원자는 일반적으로 n의 각 값과 관련된 많은 궤도들을 가지고 있다; 이러한 궤도들을 함께 전자 껍질이라고 부르기도 한다.
방위 양자수 θ는 각 전자의 궤도 각운동량을 나타내며 음이 아닌 정수이다.n이 정수0 n인 셸 내에서는 0 n0 -1({0}- 를 만족하는 모든 (표준) 값에 걸쳐 의 궤도만을 가지며, n = 1의 셸은 01의 궤도만을 . 1 ( \ \ell ) 。특정 값 θ와 관련된 궤도 집합을 집합적으로 서브셸이라고 부르기도 한다.
자기 m { m _ { \ } 는 임의의 방향의 전자의 자기모멘트를 나타내며 항상 정수이다.서 {은 정수 의 범위입니다 0 0 m 0 0、 \ 0
위의 결과는 다음 표에 요약되어 있습니다.각 셀은 서브셸을 나타내며 해당 서브셸에서 사용 가능한m {\( \ m { \ ell} )의 값을 합니다.빈 셀은 존재하지 않는 하위 쉘을 나타냅니다.
| ℓ = 0 ( s ) | ℓ = 1 (p) | ℓ = 2 (d) | ℓ = 3 (f) | θ = 4 (g) | ... | |
|---|---|---|---|---|---|---|
| n = 1 | ... | |||||
| n = 2 | 0 | −1, 0, 1 | ... | |||
| n = 3 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | ... | ||
| n = 4 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | −3, −2, −1, 0, 1, 2, 3 | ... | |
| n = 5 | 0 | −1, 0, 1 | −2, −1, 0, 1, 2 | −3, −2, −1, 0, 1, 2, 3 | −4, −3, −2, −1, 0, 1, 2, 3, 4 | ... |
| ... | ... | ... | ... | ... | ... | ... |
서브셸은 보통 n 및{\(\ 으로 식별됩니다. n은 수치로 나타내지만{\(\은 0은 's', 1은 'p', 2는 'd', 3은 'f', 4는 'g'로 나타냅니다.예를 들어, 서브셸은 n =2 { n=2} 및 = { 0으로 ' '이라고 할 수 있습니다.
각 전자는 또한 각 전자의 스핀을 설명하는 스핀 양자수 s를 가지고 있습니다.숫자 s는 +로 할 수 있습니다.1/2 또는 -1/2.
파울리 배타 원리는 원자의 어떤 두 전자도 네 개의 양자수 모두의 동일한 값을 가질 수 없다고 말한다.만약 궤도 내에 세 개의 양자수(n, θ, m)에 대해 주어진 값을 가진 두 개의 전자가 있다면, 이 두 전자는 스핀이 달라야 한다.
위의 규칙은 선호 축(예: 데카르트 좌표의 z 방향)을 의미하며, 이 선호 축을 따라 선호되는 방향을 의미하기도 합니다.그렇지 않으면 m = +1과 m = -1을 구별하는 것이 의미가 없습니다.따라서 이 모델은 이러한 대칭을 공유하는 물리적 시스템에 적용할 때 가장 유용합니다.원자가 자기장에 노출되는 Stern-Gerlach 실험은 그러한 [20]한 가지 예를 제공한다.
실궤도
위에서 설명한 복잡한 궤도 외에, 특히 화학 문헌에서는 실제 원자 궤도를 이용하는 것이 일반적입니다.이러한 실제 궤도는 복잡한 궤도의 단순한 선형 조합에서 발생합니다.Condon 사용-쇼트리 위상 규칙, 실제 궤도는 실제 구면 고조파가 복잡한 구면 고조파와 관련이 있는 것과 같은 방식으로 복잡한 궤도와 관련이 있습니다.n , , { \ \_ , \ , m} numbers 、 n , \ l ( \ m n 、 {\ {\ 、 { m} be be be[21] be be be be be n n n be be be be be n n n n n nbe n n n n n n be n n 、 { displaystyle be n n n n n n n n n
, 、 ,) n ( ) m (、、 )、 , \ \ \ ) \ \ _) =theta 과 이 정의는 , real θ ) , r 과 같다 m 서 Y m {\ m 은 복소 구면 m {\Y_{\ 의 실수 부분과 관련된 구면 고조파이다.
실제 구면 고조파는 원자가 결정성 고체에 내장되어 있을 때 물리적으로 관련성이 있으며, 이 경우 복수의 우선 대칭 축이 존재하지만 단일 우선[citation needed] 방향이 존재하지 않는다.실제 원자 궤도는 또한 화학 입문 교재에서 더 자주 발견되고 일반적인 궤도 시각화에서 [22]보여진다.실제 수소 유사 궤도에서 n(\ n과(\은 복잡한 양자수 n(\displaystyle m)과 동일한 해석과 의미를 m m은 더 이상 좋은 양자수가 아니다(그러나 절대값은 그렇다).
일부 실제 궤도에는 단순한 " ""," _ 명칭 이상의 구체적인 이름이 붙는다.양자번호 \ell가 ,,, 4, 5, 0,1, 2, 3, 5,인 궤도는 s, {\ s라고 .이를 통해 2 ± 2, ,± _1)과 복잡한 궤도에 이름을 할당할 수 있습니다. 첫 번째 기호는 n{\ n 번호이고 두 번째 숫자는 특정 양자 번호에 대한 기호이고 첨자는 첨자입니다. 번호
궤도에 대해 전체 궤도 이름이 생성되는 방법의 예로서, 구면 고조파 표에서 n ± 1 ± = , 1 ± ± 、 1 、 1 、1 、 1 、 1 1 N 、 、 3 / ⋅ ⋅ 。1}1}^{\ 1}=\pir + y+ z 2 { r {x^+ } ^ ^2 ) 그럼
로 1, n, / z { _ = z 보다 복잡한 예로서 다음과 같습니다.
이러한 경우 모두 분자에 나타나는 x x y y z(\ z의 다항식을 검사하고 생략하여 오비탈에 대한 데카르트 라벨을 생성합니다.z r z z에서 높은 지수를 가진 를 하고 z 다항식의 모든 용어는 무시합니다. 그런 다음 n n 을 나타내기 위해 위와 동일한 명명법을 사용하여 원자 상태의 첨자 라벨로 단축 다항식을 사용합니다양자수
위의 표현은 모두 Condon-을 사용합니다.양자 [23][24]물리학자들이 선호하는 쇼트리 위상 규칙.구면 고조파의 위상에 대한 다른 규칙이 존재합니다.[25][26]이러한 다른 표기법에서는 x(\ p y 오비탈은 에 표시된 것과p + 1(\p_과p - 1(\1})의 과 로 표시될 수 있습니다.
아래는 원자 [27][28]궤도에 대한 데카르트 다항식 이름 목록입니다.문헌에는 > 3 {\에 대해 긴 데카르트 구면 조화 다항식을 축약하는 방법에 대한 참조가 없는 것 같다. 따라서 이 명명법에 따라 g{\ g 이상의 오비탈을 하는 데 합의된 것으로 보이지 않는다.
| m = -3 | m = -2 | m = - 1 | m = 0 | m = +1 | m = +2 | m = +3 | |
|---|---|---|---|---|---|---|---|
궤도의 모양
간단한 사진 궤도 모양을 보여 주고 지역의 전자가 궤도를 차지하고 발견될 가능성이 있은 공간 안에 각 형태 묘사하기 위한 것이다.그 도표는 전자 찾을 수 있다. 양자 역학에 따라 이후 우주 어느 곳에서나 전자(거의)를 찾는 것에 대한 영이 아닌 확률은 전체적인 지역, 보여 주지 못한다.는 확률 밀도 ψ(r, θ, φ)2경계나 윤곽 표면 대신 그림은 대략적인 표현을 하는 상수 값이 윤곽 내에서 전자를 찾는 것에 대한 특정 확률(예를 들어 90%)은 선택했다.비록 2는 절대 값의 제곱으로ψ 어디에나non-negative은, 파동 함수가 ψ(r, θ, φ)의 부호는 종종 궤도 사진의 각 아구로 표시되어 있다
때때로ψ 기능은 단계를 보여 줄 ψ(r, θ, φ)2이 없는 단계( 때 절대 값을 먹은 이후로 ψ(r, θ, φ는 길을 잃은 것)는 복잡한 번호)이 확률 밀도를 보여 주기보다는 그래프로 그려진다.ψ(r, θ, φ)2궤도 그래프 ψ(r, θ, φ)그래프보다 덜 구형 더 얇은 로브. 하지만, 그것이 없었다면, 알아볼 수 있는 로우브를 가지고 있는 같은 장소에 숫자가 동일하는 경향이 있다.이 기사는 위해 파동 함수 위상 보여 주어야 할, 대부분 ψ(r, θ, φ)그래프를 보여 준다.
이 엽들 기립파 간섭 패턴 두 사람이 카운터에서 나타난다 회전, 링 공진 트레블링 웨이브 m이고 −m 모드, 돌출부의 궤도에 xy 비행기를 갖고 있는 공진 m파장 주변의 원주.Alhough 거의 표시한 트레블링 웨이브 솔루션 회전 밴디드 tori으로 하고, 밴드들 위상 정보를 나타내는 볼 수 있다.각 m에서는 두개의 기립 웨이브 솔루션과− ⟨−m⟩ ⟨m⟩+⟨−m⟩ ⟨m⟩ 있다.만약 m=0은 궤도, 카운터 회전하는 정보를 알 수 없고 궤도z-axis 대칭은 수직이다.만약 ℓ 0게 국가 주의적 관점에서 서술이 없 역회전하는 방법이 있다.단지 방사 모드와 모양은 구형으로 대칭이다.어떤 주어진 n의 경우, 작은 ℓ 있을수록 레이디얼 노드에 있다.어떤 주어진 ℓ의 경우, 작은 n은 더 적어지레이디얼 노드가(0중 엔은 처음에는ℓ 궤돘다) 있다.ℓ 기행과 유사하다 대략적으로 말하면, n은 에너지, m은 방향.고전적인 경우, 예를 들어 원형전송로 내의 링공진주행파는 능동적으로 강제하지 않는 한 링공진정파로서 자연히 붕괴한다.이는 가장 작은 불완전성 또는 불연속성에서도 시간이 지남에 따라 반사가 축적되기 때문이다.
일반적으로 n은 주어진 핵에 대한 궤도의 크기와 에너지를 결정합니다. n이 증가할수록 궤도의 크기는 증가합니다.무거운 원소의 핵 전하 Z가 높으면 가벼운 원소에 비해 궤도가 수축하기 때문에 전자의 수가 증가하더라도 원자의 크기는 거의 일정하게 유지됩니다.

또한 일반적으로 θ는 궤도의 형상을 결정하여ℓ 그 방향을 m으로 한다.그러나 일부 궤도는 복소수 방정식으로 설명되기 때문에 모양도 m에 따라ℓ 달라질 수 있습니다.동시에, 주어진 θ와 n에 대한 전체 궤도 집합은 점점 더 복잡해지는 엽과 노드 집합으로 가능한 한 대칭적으로 공간을 채운다.
단일 s-표면( 0 \ \0 )은 구형입니다.n = 1의 경우 대략 고체 볼(중앙에서 밀도가 높고 지수적으로 바깥쪽으로 희미함)이지만, n µ 2의 경우, 각 단일 s-입자는 중첩된 셸인 구체 대칭 표면으로 구성된다(즉, "파장"은 사인파 방사형 구성 요소를 따라 방사형이다).오른쪽의 중첩된 셸의 단면도를 참조하십시오.모든 n개의 숫자에 대한 s-오비탈은 핵의 중심에 반노드(높은 파동 함수 밀도의 영역)가 있는 유일한 궤도이다.다른 모든 궤도(p, d, f 등)는 각운동량을 가지므로 핵(핵에 파동 노드가 있음)을 피한다.최근에는 에너지 분산형 X선 분광법을 [29]이용한 주사 투과 전자 현미경을 이용해 SrTiO3 결정의 1s 및 2p 궤도 영상을 실험적으로 촬영하려는 노력이 있었다.이미징은 전자빔을 사용하여 수행되었기 때문에 종종 충격 파라미터 효과라고 불리는 쿨롱 빔-궤도 상호작용이 최종 결과에 포함됩니다(오른쪽 그림 참조).
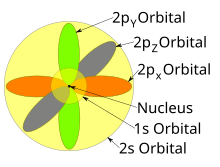
p, d 및 f-오비탈의 모양은 여기서 구두로 설명되며 아래 Orbitals 표에 그래픽으로 표시됩니다.n = 2에 대한 세 개의 p-표면체는 핵에서 접점이 있는 두 개의 타원체의 형태를 가지고 있다. (두 개의 잎 모양은 때때로 "두 개의 잎 모양"이라고 불리며, 서로 반대 방향을 가리키는 두 개의 잎이 있다.)각 셸의 세 개의 p-오비탈은 각각 m 값의ℓ 선형 조합에 의해 결정되는 대로 서로 직각으로 방향을 잡습니다.전체 결과는 기본 축의 각 방향을 따라 가리키는 로브입니다.
n = 3에 대한 5개의 d-표면 중 4개는 각각 4개의 배 모양의 엽을 가지고 있고, 각 엽은 다른 2개의 엽과 직각으로 접하며, 4개의 중심은 모두 한 평면에 놓여 있다.이들 평면 중 3개는 xy, xz 및 yz 평면(로브는 기본 축 쌍 사이에 있음)이며, 4번째 평면은 x축과 y축 자체를 따라 중심이 있습니다.다섯 번째이자 마지막 d-궤도는 높은 확률 밀도의 세 개의 영역으로 구성되어 있습니다. 즉, z축에 대칭으로 배치된 두 배 모양의 영역 사이에 있는 토러스입니다.총 18개의 방향성 로브가 모든 기본 축 방향과 모든 쌍 사이를 가리킵니다.
7개의 f-오비탈이 있으며, 각각은 d-오비탈보다 더 복잡한 모양을 가지고 있습니다.
또한 s궤도의 경우와 마찬가지로 n개의 값이 가능한 최소값보다 높은 개별 p, d, f, g궤도는 파동의 최저(또는 기본) 모드에 비해 동종의 고조파를 연상시키는 추가 방사 노드 구조를 나타낸다.s 오비탈과 마찬가지로 이 현상은 각 로브에서 추가 노드인 n의 다음으로 높은 값(예를 들어 3p 오비탈 대 기본 2p)에서 p, d, f 및 g 오비탈을 제공한다.n의 값이 클수록 각 궤도 유형에 대해 방사형 노드의 수가 더욱 증가합니다.
1전자 원자의 원자 궤도 모양은 3차원 구면 고조파와 관련이 있다.이러한 모양은 고유하지 않으며 입방체 고조파로의 변환과 같이 선형 조합이 유효합니다.실제로 p, py [30][31]및 p가xz 동일한 모양인 것처럼 모든 d가 동일한 모양인 집합을 생성할 수 있습니다.
개별 궤도가 서로 독립적으로 나타나는 경우가 가장 많지만, 궤도는 동시에 핵 주위에 공존합니다.또한 1927년 Albrecht Unsöld는 각 궤도가 전자에 의해 점유되거나 각각 전자 쌍에 의해 점유되는 동일한 셸 n(예를 들어 3개의 2p 궤도 또는 5개의 3D 궤도)의 특정 방위 양자 번호 δ의 모든 궤도의 전자 밀도를 합하면 모든 각의존성이 th라는 것을 증명했다.e 결과 하위 껍질(동일한 θ를 가진 것)에 있는 모든 원자 궤도의 총 밀도는 구형이다.이것은 Unsöld의 정리라고 알려져 있다.
궤도표
이 표는 최대 7s의 모든 원자 궤도에 대한 실제 수소 유사 파동 함수를 보여주며, 따라서 라듐과 그 이상의 주기율표에 있는 모든 원소의 지상 상태에서 점유된 궤도에 대해 다룬다."파형" 그래프는 - 및 +파형 함수 위상과 함께 두 가지 다른 색상(임의로 빨간색과 파란색)으로 표시됩니다.p 오비탈은 pz0 오비탈과 동일하지만 px 오비탈과 p+1−1 오비탈의 선형 조합을 취함으로써 p와y p가 형성된다(이 때문에 m = ±1 라벨 아래에 나열된다).또+1 p와−1 p는 순수 구형 고조파이기 때문에 p와0 같은 형상이 아니다.
* 6f, 7d, 7f 전자를 가진 원소는 아직 발견되지 않았습니다.
③ 7p 전자를 가진 원소가 발견됐지만, 그 전자 구성은 예측된 것일 뿐이다.
∙ 점유궤도가 가장 높은 원소는 6d 궤도인 원소의 경우 일부 전자구성만 확인되었다(Ds, Rg, Cn은 아직 누락).
이것들은 화학에서 일반적으로 사용되는 실제 값 궤도입니다. {\ m 궤도만 이며, 여기서 는 궤도 L^z {\의 고유 상태입니다.m ±,± , { m=\,\2,\의 은 두 고유 상태의 조합을 포함합니다.다음 그림의 비교를 참조하십시오.
도형의 질적 이해
원자 궤도의 모양은 원형 [32]드럼 위에 있는 정재파의 유사한 경우를 고려함으로써 질적으로 이해할 수 있다.유추하기 위해서는 평형점으로부터의 여러 사이클에 걸친 드럼막의 각 비트의 평균 진동 변위(그 지점의 평균 드럼막 속도와 운동량의 측정치)를 드럼헤드 중심으로부터의 거리에 대해 고려해야 합니다.만약 이 변위가 핵으로부터 주어진 거리에서 전자를 찾을 확률과 유사한 것으로 받아들여진다면, 진동 원반의 많은 모드는 다양한 형태의 원자 궤도를 추적하는 패턴을 형성한다는 것을 알 수 있을 것이다.이러한 대응에 대한 기본적인 이유는 물질파에서 운동 에너지와 운동량의 분포가 파동과 관련된 입자가 어디에 있을지를 예측하기 때문이다.즉, 주어진 위치에서 전자를 찾을 확률은 또한 그 지점에서 전자의 평균 운동량의 함수이다. 왜냐하면 주어진 위치에서 높은 전자 운동량은 전자파 패킷의 특성을 통해 그 위치에 있는 전자를 "국재화"하는 경향이 있기 때문이다(메커니즘의 자세한 내용은 하이젠베르크 불확도 원리 참조)..
이 관계는 드럼막 모드와 원자 궤도 모두에서 특정 주요 특징을 관찰할 수 있음을 의미합니다.예를 들어, s 오비탈과 유사한 모든 모드(아래 애니메이션 그림의 맨 위 행)에서 드럼막의 가장 중심이 원자 내의 모든 s 오비탈의 안티노드에 대응하여 가장 강하게 진동하는 것을 볼 수 있습니다.이 안티노드는 전자가 핵의 물리적 위치(산란이나 타격 없이 직진)에 있을 가능성이 가장 높다는 것을 의미합니다. 왜냐하면 전자는 그 지점에서 가장 빠르게 (평균적으로) 움직이며 최대의 운동량을 제공하기 때문입니다.
각운동량이 없는 s궤도에서 전자의 거동에 가장 가까운 정신적 "행성 궤도" 그림은 아마도 궤도 이심률이 1인 케플러 궤도의 것일 수 있지만 물리적으로 가능하지 않지만(입자가 충돌했기 때문에), 동일한 큰 축을 가진 궤도의 한계로 상상할 수 있다.하지만 점점 더 괴팍해지고 있습니다.
아래는 수소 원자의 드럼막 진동 모드와 각각의 파동 기능을 나타낸다.진동드럼헤드의 파동함수가 2좌표계 θ(r, θ)용이고 진동구체의 파동함수가 3좌표 θ(r, θ, θ)인 경우의 대응관계를 생각할 수 있다.
- s타입 드럼 모드 및 웨이브 기능
드럼막의 다른 모드 세트에는 중앙 안티노드가 없고 드럼의 중심이 움직이지 않습니다.이것들은 원자 내의 모든 비s 궤도에 대한 핵의 노드에 해당합니다.이들 궤도는 모두 어느 정도 각운동량을 가지고 있으며 행성 모형에서는 편심률이 1.0 미만인 궤도의 입자에 해당하기 때문에 주체의 중심을 똑바로 통과하지 않고 다소 떨어져 있습니다.
또한 원자 중의 p, d모드와 유사한 드럼모드는 드럼의 중심에서 다른 반경방향에 따른 공간적 불규칙성을 나타내며, s모드와 유사한 모든 모드는 반경방향에서 완벽하게 대칭이다.비궤도의 비대칭적 특성은 중심 흡인력 지점에서 국소화된 입자가 각운동량을 가질 수 없기 때문에 중심 흡인력으로부터 멀리 떨어져 있어야 하는 궤도에서 각운동량과 파동성을 가진 입자를 국소화하기 위해 필요하다.이러한 모드의 경우 드럼 헤드의 파형은 중앙점을 피하는 경향이 있습니다.이러한 특징들은 원자 궤도의 모양이 전자의 파동 성질의 직접적인 결과라는 것을 다시 강조한다.
- p형 드럼 모드 및 웨이브 기능
- d타입 드럼모드
궤도 에너지
하나의 전자(수소 유사 원자)를 가진 원자에서 궤도(그리고 결과적으로 궤도 내의 모든 전자)의 에너지는 주로 nn에 결정된다.n n 오비탈은 내에서 가능한 가장 낮은 에너지를 가집니다.n n의 이 연속적으로 클수록 에너지가 커지지만 n{ n의 값이 할수록 차이가 감소합니다. n n의 경우 에너지가 너무 높아져 전자가 쉽게 원자를 빠져나갈 수 있습니다.단일 전자 원자에서는 주어진 n 내에서 서로 다른(\를 가진 모든 레벨이 슈뢰딩거 근사치로 퇴화하며 동일한 에너지를 갖는다.이 근사치는 디락 방정식(여기서 에너지가 n과 다른 양자 번호 j에 의존함)의 해와 핵의 자기장과 양자 전기역학 효과의 영향으로 약간 깨진다.후자는 특히 원자핵에 가까이 가는 s 전자의 경우 작은 결합 에너지 차이를 유발합니다. 왜냐하면 이들은 심지어 하나의 전자 원자에서도 매우 약간 다른 핵 전하를 느끼기 때문입니다. 램 시프트를 참조하십시오.
여러 개의 전자를 가진 원자에서, 전자의 에너지는 궤도뿐만 아니라 다른 전자와의 상호작용에 의해서도 좌우된다.이러한 상호작용은 공간 확률 분포의 세부 사항에 따라 달라지므로 궤도의 에너지 수준은 n n뿐만 아니라(\에 달라집니다.(\ 값이 높을수록 에너지 값이 더 높습니다. 예를 들어 2p 상태가 더 높습니다.2s 상태 일 때 궤도의 에너지 증가는 오비탈의 에너지를 다음 상위 셸의 s-display의 에너지 위로 밀어올릴 정도로 커집니다. 3)일 때 에너지는 셸 안으로 두 단계 더 높게 밀어 넣습니다.3d 오비탈은 4s 오비탈이 채워질 때까지 채워지지 않습니다.
더 큰 원자의 각운동량이 증가하는 서브셸에 대한 에너지의 증가는 전자-전자 상호작용 효과 때문이며, 특히 낮은 각운동량 전자가 핵을 향해 더 효과적으로 침투하는 능력과 관련이 있다. 여기서 저각운동량 전자는 간섭하는 전자의 전하로부터 더 적은 스크리닝의 대상이 된다.따라서 원자번호가 높은 원자에서는 전자의 \ell가 에너지의 결정인자가 되고 전자의 주요 n(\ n은 에너지 배치에서 점점 중요도가 낮아진다.
처음 35개의 서브셸(예: 1s, 2p, 3d 등)의 에너지 시퀀스는 다음 표에 나와 있습니다.각 셀은 행 인덱스와 열 인덱스에 의해 각각n개(\ n와{\(\displaystyle 로 서브셸을 나타냅니다.셀의 번호는 시퀀스 내의 서브셸 위치입니다.다전자 원자의 에너지 증가에 관한 서브셸의 선형 목록은 아래 절을 참조하십시오.
l n | s | p | d | f | g | h |
|---|---|---|---|---|---|---|
| 1 | 1 | |||||
| 2 | 2 | 3 | ||||
| 3 | 4 | 5 | 7 | |||
| 4 | 6 | 8 | 10 | 13 | ||
| 5 | 9 | 11 | 14 | 17 | 21 | |
| 6 | 12 | 15 | 18 | 22 | 26 | 31 |
| 7 | 16 | 19 | 23 | 27 | 32 | 37 |
| 8 | 20 | 24 | 28 | 33 | 38 | 44 |
| 9 | 25 | 29 | 34 | 39 | 45 | 51 |
| 10 | 30 | 35 | 40 | 46 | 52 | 59 |
주의: 빈 셀은 존재하지 않는 서브레벨을 나타내며, 이탤릭체로 표시된 숫자는 존재할 수 있지만 현재 알려진 어떤 요소에도 전자를 포함하지 않는 서브레벨을 나타냅니다.
전자 배치 및 주기율표

몇 가지 규칙이 궤도에서의 전자 배치를 제어합니다(전자 구성).첫 번째는 원자 내의 어떤 두 전자도 양자 수의 동일한 집합을 가질 수 없다는 것을 지시합니다(이것은 파울리 배타 원리입니다).이 양자수에는 s 또는 스핀 양자수뿐만 아니라 궤도를 정의하는 세 가지가 포함됩니다.따라서, 두 전자는 서로 다른 s 값을 갖는 한 하나의 궤도를 차지할 수 있다.하지만, 그들의 스핀 때문에, 오직 두 개의 전자만이 각각의 궤도에 연관될 수 있다.
게다가 전자는 항상 가능한 한 가장 낮은 에너지 상태로 떨어지는 경향이 있습니다.파울리 배제 원칙을 위반하지 않는 한 어떤 궤도도 점유할 수 있지만, 낮은 에너지 궤도를 이용할 수 있다면 이 조건은 불안정하다.전자는 결국 (광자를 방출함으로써) 에너지를 잃고 낮은 궤도로 떨어질 것이다.따라서, 전자는 위에 주어진 에너지 시퀀스에 의해 지정된 순서로 궤도를 채웁니다.
이 동작은 주기율표 구조의 원인이 됩니다.표는 여러 행('주기'라고 함)으로 나눌 수 있으며, 맨 위에 1부터 번호가 매겨집니다.현재 알려진 원소는 7주기를 차지한다.만약 어떤 주기가 숫자 i를 가지고 있다면, 그것은 가장 바깥쪽 전자가 ih 껍질에 떨어지는 원소로 구성됩니다.닐스 보어는 원소의 성질에 있어서 주기성이 전자 에너지 수준의 주기적인 충전에 의해 설명되어 [33]원자의 전자 구조를 야기할 수 있다고 제안한 최초의 사람이다.
주기율표는 여러 개의 번호가 매겨진 직사각형 '블록'으로 나눌 수도 있습니다.주어진 블록에 속하는 원소들은 공통적인 특징을 가지고 있다. 즉, 가장 높은 에너지 전자는 모두 동일한 γ-상태이다(그러나 그 γ-상태와 관련된 n은 주기에 따라 다르다).예를 들어, 맨 왼쪽에 있는 두 열은 's-블록'을 구성합니다.Li와 Be의 가장 바깥쪽 전자는 각각 2s 서브셸에 속하고, Na와 Mg는 3s 서브셸에 속합니다.
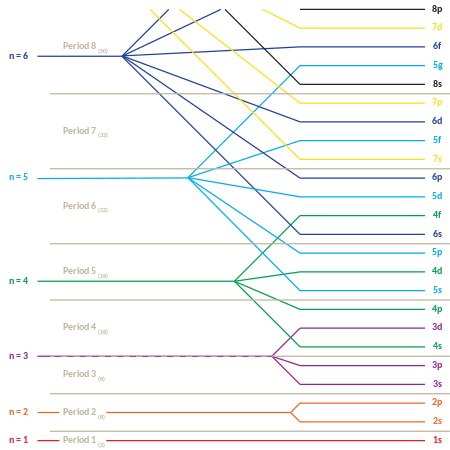
다음은 주기율표의 "블록" 순서도 제공하는 "하위 껍질" 궤도 채우기 순서입니다.
- 1, 2, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 4f, 5d, 6p, 7s, 5f, 6d, 7p
s, p, d 및 f "블록"의 출현뿐만 아니라 궤도 채우기의 "주기적" 특성은 행렬의 새로운 행("주기")을 시작하는 증가하는 주요 양자 수와 함께 행렬 형태로 주어진다면 더 명백하다.그런 다음, 각 하위 껍질(처음 두 개의 양자 번호로 구성됨)은 포함할 수 있는 각 전자 쌍에 대해 필요한 횟수만큼 반복됩니다.그 결과 각 엔트리는 다음 2개의 연속된 요소를 나타내는 압축된 정기 테이블이 됩니다.
| 1s | |||||||||||||||
| 2초 | 2p | 2p | 2p | ||||||||||||
| 3초 | 3p | 3p | 3p | ||||||||||||
| 4초 | 3D | 3D | 3D | 3D | 3D | 4p | 4p | 4p | |||||||
| 5초 | 4D | 4D | 4D | 4D | 4D | 5p | 5p | 5p | |||||||
| 6s | 4층 | 4층 | 4층 | 4층 | 4층 | 4층 | 4층 | 5d | 5d | 5d | 5d | 5d | 6p | 6p | 6p |
| 7s | 5f | 5f | 5f | 5f | 5f | 5f | 5f | 6d | 6d | 6d | 6d | 6d | 7p | 7p | 7p |
이는 마델룽 규칙에 따른 일반적인 궤도 충진 순서이지만 예외도 있으며, 각 원소의 실제 전자 에너지도 원자의 추가 세부 사항에 따라 달라집니다(전자 구성 » 원자: Aufbau 원칙과 Madelung 규칙).
전기적으로 중성인 원자의 전자 수는 원자 번호에 따라 증가한다.가장 바깥쪽 껍질에 있는 전자, 즉 원자가 전자는 원소의 화학적 거동에 책임이 있는 경향이 있습니다.같은 수의 원자가 전자를 포함하는 원소는 함께 그룹화되어 유사한 화학적 특성을 나타낼 수 있습니다.
상대론적 효과
높은 원자 번호 Z를 가진 원소의 경우, 상대성 이론의 효과는 더욱 뚜렷해지고, 특히 높은 Z 원자의 핵 근처에 있는 선별 전자를 통과할 때 상대성 이론적인 속도로 이동하는 s 전자의 경우 더욱 뚜렷해집니다.고속전자의 상대론적 운동량 증가는 (주기표의 같은 열에 있는 더 가벼운 원소의 대응하는 s 및 d 전자와 비교하여) 5d 궤도에 대한 파장과 6s 궤도의 수축에 상응하는 감소를 야기합니다; 이것은 6s의 원자가 전자의 에너지를 감소시킵니다.
이 효과의 중요한 물리적 결과의 예로는 수은의 낮은 용해 온도(6s 전자가 금속 결합에 사용할 수 없기 때문에 발생)와 금과 [34]세슘의 황금색이 있습니다.
Bohr 모델에서 n = 1 전자는 v c { vc에서 속도를 가진다. 여기서 Z는 원자 이고 α{\는 미세 입자 상수이며 c는 빛의 속도이다.따라서 비상대론적 양자역학에서는 원자 번호가 137보다 큰 원자는 1s 전자가 빛의 속도보다 더 빨리 이동해야 합니다.상대론적 효과를 설명하는 디락 에서도 Z에 대한 전자의 파동 함수는 진동하고 무한하다.비분석이라고도 알려진 137원소의 중요성은 물리학자 리처드 파인만에 의해 처음 지적되었다.원소 137을 비공식적으로 파인마늄(기호 [35]Fy)이라고 부르기도 합니다.그러나 파인만의 근사치는 핵의 비점전하 특성과 내부 전자의 궤도 반경이 매우 작기 때문에 Z의 정확한 임계값을 예측하지 못하고, 결과적으로 Z보다 작은 내부 전자에 의해 보이는 전위를 발생시킨다.진공의 고전계 파괴와 전자-양전자 쌍 생성에 관해 원자를 불안정하게 만드는 임계 Z 값은 Z가 약 173이 될 때까지 발생하지 않는다.이러한 조건은 가속기의 납이나 우라늄과 같은 매우 무거운 핵의 충돌에서 일시적으로 나타나는 경우를 제외하고는 나타나지 않으며, 이러한 효과로부터 전자-양전자 생산이 관찰되었다고 주장되어 왔다.
상대론적 궤도 밀도에는 노드가 없지만 파동 함수의 개별 구성요소는 [36]노드를 가집니다.
pp 하이브리드화(구조화)
8주기 후반에는 8p와3/2 9p의1/2 교배체가 [37]존재할 것으로 예상된다. 여기서 "3/2"와 "1/2"는 총 각운동량 양자수를 의미한다.이 "pp" 하이브리드는 일반적인 원자가 쉘의 p 서브셸과 유사한 특성으로 인해 해당 기간의 p 블록을 담당할 수 있습니다.8p와3/2 9p의1/2 에너지 수준은 상대론적 스핀-오빗 효과로 인해 근접합니다. 9s 하위 껍질도 참여해야 합니다. 이러한 원소는 제논을 통해 각각의 5p 원소 인듐과 유사할 것으로 예상되기 때문입니다.
궤도간의 천이
결합 양자 상태는 이산 에너지 수준을 가집니다.원자 궤도에 적용되었을 때, 이것은 상태 간의 에너지 차이 또한 이산적이라는 것을 의미한다.따라서 이들 상태(즉, 광자를 흡수하거나 방출하는 전자) 간의 전환은 광자가 상기 상태 간의 정확한 에너지 차이에 대응하는 에너지를 가질 경우에만 발생할 수 있다.
수소 원자의 두 가지 상태를 고려합니다.
- 상태 n = 1, θ = 0, mℓ = 0 및s m = +1/2
- 상태 n = 2, θ = 0, mℓ = 0 및 ms = -1/2
양자이론에 따르면 상태 1은 E의1 고정에너지를 가지며 상태 2는 E의2 고정에너지를 가진다.상태 1의 전자가 상태 2로 이동하면 어떻게 될까요?이를 위해 전자는 정확히2 E - E의1 에너지를 얻어야 합니다. 만약 전자가 이 값보다 작거나 큰 에너지를 받으면, 상태 1에서 상태 2로 점프할 수 없습니다.이제 원자에 광스펙트럼을 조사한다고 가정해봅시다.정확히2 E - E의1 에너지를 가진 원자에 도달한 광자는 상태 1의 전자에 의해 흡수되고, 그 전자는 상태 2로 점프합니다.그러나 에너지가 크거나 낮은 광자는 전자에 의해 흡수될 수 없다. 왜냐하면 전자는 궤도 중 하나로 점프할 수 있기 때문이다.그 결과 특정 주파수의 광자만 원자에 흡수됩니다.이로 인해 스펙트럼에 흡수선으로 알려진 선이 생성되며, 이는 상태 1과 상태 2 사이의 에너지 차이에 해당합니다.
따라서 원자 궤도 모델은 실험적으로 관측된 라인 스펙트럼을 예측한다.이것은 원자 궤도 모델의 주요 검증 중 하나이다.
그럼에도 불구하고 원자 궤도 모델은 많은 전자 상태만을 인식하는 완전한 양자 이론에 대한 근사치이다.라인 스펙트럼의 예측은 질적으로 유용하지만 하나의 전자만을 포함하는 원자 및 이온에 대해서는 정량적으로 정확하지 않다.
「 」를 참조해 주세요.
메모들
- ^ 이 신체적으로 잘못된 보어 모델은 여전히 초보 [citation needed]학생들에게 종종 가르쳐진다.
레퍼런스
- ^ Orchin, Milton; Macomber, Roger S.; Pinhas, Allan; Wilson, R. Marshall (2005). Atomic Orbital Theory (PDF).
- ^ Daintith, J. (2004). Oxford Dictionary of Chemistry. New York: Oxford University Press. ISBN 978-0-19-860918-6.
- ^ Griffiths, David (1995). Introduction to Quantum Mechanics. Prentice Hall. pp. 190–191. ISBN 978-0-13-124405-4.
- ^ Levine, Ira (2000). Quantum Chemistry (5 ed.). Prentice Hall. pp. 144–145. ISBN 978-0-13-685512-5.
- ^ Laidler, Keith J.; Meiser, John H. (1982). Physical Chemistry. Benjamin/Cummings. p. 488. ISBN 978-0-8053-5682-3.
- ^ Atkins, Peter; de Paula, Julio; Friedman, Ronald (2009). Quanta, Matter, and Change: A Molecular Approach to Physical Chemistry. Oxford University Press. p. 106. ISBN 978-0-19-920606-3.
- ^ Feynman, Richard; Leighton, Robert B.; Sands, Matthew (2006). The Feynman Lectures on Physics – The Definitive Edition, Vol 1 lect 6. Pearson PLC, Addison Wesley. p. 11. ISBN 978-0-8053-9046-9.
- ^ 로저 펜로즈, 현실로의 길
- ^ Levine, Ira N. (1991). Quantum Chemistry (4th ed.). Prentice-Hall. p. 262. ISBN 0-205-12770-3.
Therefore, the wave function of a system of identical interacting particles must not distinguish among the particles.
- ^ Mulliken, Robert S. (July 1932). "Electronic Structures of Polyatomic Molecules and Valence. II. General Considerations". Physical Review. 41 (1): 49–71. Bibcode:1932PhRv...41...49M. doi:10.1103/PhysRev.41.49.
- ^ a b Bohr, Niels (1913). "On the Constitution of Atoms and Molecules". Philosophical Magazine. 26 (1): 476. Bibcode:1914Natur..93..268N. doi:10.1038/093268a0. S2CID 3977652.
- ^ a b Nagaoka, Hantaro (May 1904). "Kinetics of a System of Particles illustrating the Line and the Band Spectrum and the Phenomena of Radioactivity". Philosophical Magazine. 7 (41): 445–455. doi:10.1080/14786440409463141. Archived from the original on 2017-11-27. Retrieved 2009-05-30.
- ^ Bryson, Bill (2003). A Short History of Nearly Everything. Broadway Books. pp. 141–143. ISBN 978-0-7679-0818-4.
- ^ Thomson, J. J. (1897). "Cathode rays". Philosophical Magazine. 44 (269): 293. doi:10.1080/14786449708621070.
- ^ Thomson, J. J. (1904). "On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure" (extract of paper). Philosophical Magazine. Series 6. 7 (39): 237–265. doi:10.1080/14786440409463107.
- ^ Rhodes, Richard (1995). The Making of the Atomic Bomb. Simon & Schuster. pp. 50–51. ISBN 978-0-684-81378-3.
- ^ Nagaoka, Hantaro (May 1904). "Kinetics of a System of Particles illustrating the Line and the Band Spectrum and the Phenomena of Radioactivity". Philosophical Magazine. 7 (41): 446. doi:10.1080/14786440409463141. Archived from the original on 2017-11-27. Retrieved 2009-05-30.
- ^ Heisenberg, W. (March 1927). "Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik". Zeitschrift für Physik A. 43 (3–4): 172–198. Bibcode:1927ZPhy...43..172H. doi:10.1007/BF01397280. S2CID 122763326.
- ^ Bohr, Niels (April 1928). "The Quantum Postulate and the Recent Development of Atomic Theory". Nature. 121 (3050): 580–590. Bibcode:1928Natur.121..580B. doi:10.1038/121580a0.
- ^ Gerlach, W.; Stern, O. (1922). "Das magnetische Moment des Silberatoms". Zeitschrift für Physik. 9 (1): 353–355. Bibcode:1922ZPhy....9..353G. doi:10.1007/BF01326984. S2CID 126109346.
- ^ Thaller, Bernd (2004). Advanced visual quantum mechanics. New York: Springer/TELOS. ISBN 978-0387207773.
- ^ General chemistry: principles and modern applications. [Place of publication not identified]: Prentice Hall. 2016. ISBN 978-0133897319.
- ^ Messiah, Albert (1999). Quantum mechanics : two volumes bound as one (Two vol. bound as one, unabridged reprint ed.). Mineola, NY: Dover. ISBN 978-0-486-40924-5.
- ^ Claude Cohen-Tannoudji; Bernard Diu; Franck Laloë; et al. (1996). Quantum mechanics. Translated by from the French by Susan Reid Hemley. Wiley-Interscience. ISBN 978-0-471-56952-7.
- ^ Levine, Ira (2014). Quantum Chemistry (7th ed.). Pearson Education. pp. 141–2. ISBN 978-0-321-80345-0.
- ^ Blanco, Miguel A.; Flórez, M.; Bermejo, M. (December 1997). "Evaluation of the rotation matrices in the basis of real spherical harmonics". Journal of Molecular Structure: THEOCHEM. 419 (1–3): 19–27. doi:10.1016/S0166-1280(97)00185-1.
- ^ General chemistry : principles and modern applications. [Place of publication not identified]: Prentice Hall. 2016. ISBN 978-0133897319.
- ^ Friedman (1964). "The shapes of the f orbitals". J. Chem. Educ. 41 (7): 354. doi:10.1021/ed041p354.
- ^ a b Jeong, Jong Seok; Odlyzko, Michael L.; Xu, Peng; Jalan, Bharat; Mkhoyan, K. Andre (2016-04-26). "Probing core-electron orbitals by scanning transmission electron microscopy and measuring the delocalization of core-level excitations". Physical Review B. 93 (16): 165140. Bibcode:2016PhRvB..93p5140J. doi:10.1103/PhysRevB.93.165140.
- ^ Powell, Richard E. (1968). "The five equivalent d orbitals". Journal of Chemical Education. 45 (1): 45. Bibcode:1968JChEd..45...45P. doi:10.1021/ed045p45.
- ^ Kimball, George E. (1940). "Directed Valence". The Journal of Chemical Physics. 8 (2): 188. Bibcode:1940JChPh...8..188K. doi:10.1063/1.1750628.
- ^ Cazenave, Lions, T., P.; Lions, P. L. (1982). "Orbital stability of standing waves for some nonlinear Schrödinger equations". Communications in Mathematical Physics. 85 (4): 549–561. Bibcode:1982CMaPh..85..549C. doi:10.1007/BF01403504. S2CID 120472894.
- ^ Bohr, Niels (1923). "Über die Anwendung der Quantumtheorie auf den Atombau. I". Zeitschrift für Physik. 13 (1): 117. Bibcode:1923ZPhy...13..117B. doi:10.1007/BF01328209. S2CID 123582460.
- ^ Lower, Stephen. "Primer on Quantum Theory of the Atom".
- ^ Poliakoff, Martyn; Tang, Samantha (9 February 2015). "The periodic table: icon and inspiration". Philosophical Transactions of the Royal Society A. 373 (2037): 20140211. Bibcode:2015RSPTA.37340211P. doi:10.1098/rsta.2014.0211. PMID 25666072.
- ^ Szabo, Attila (1969). "Contour diagrams for relativistic orbitals". Journal of Chemical Education. 46 (10): 678. Bibcode:1969JChEd..46..678S. doi:10.1021/ed046p678.
- ^ Fricke, Burkhard (1975). Superheavy elements: a prediction of their chemical and physical properties. Recent Impact of Physics on Inorganic Chemistry. Structure and Bonding. Vol. 21. pp. 89–144. doi:10.1007/BFb0116498. ISBN 978-3-540-07109-9. Retrieved 4 October 2013.
- McCaw, Charles S. (2015). Orbitals: With Applications in Atomic Spectra. Singapore: World Scientific Publishing Company. ISBN 9781783264162.
- Tipler, Paul; Llewellyn, Ralph (2003). Modern Physics (4 ed.). New York: W. H. Freeman and Company. ISBN 978-0-7167-4345-3.
- Scerri, Eric (2007). The Periodic Table, Its Story and Its Significance. New York: Oxford University Press. ISBN 978-0-19-530573-9.
- Levine, Ira (2014). Quantum Chemistry (7th ed.). Pearson Education. ISBN 978-0-321-80345-0.
- Griffiths, David (2000). Introduction to Quantum Mechanics (2 ed.). Benjamin Cummings. ISBN 978-0-13-111892-8.
- Cohen, Irwin; Bustard, Thomas (1966). "Atomic Orbitals: Limitations and Variations". J. Chem. Educ. 43 (4): 187. Bibcode:1966JChEd..43..187C. doi:10.1021/ed043p187.
외부 링크
- Wikimedia Commons의 3D 수소 궤도
- 원자 궤도 안내서
- 공유 결합 및 분자 구조
- 수소 궤도 시간 진화 애니메이션
- 수소 궤도 3차원 표현
- Orbitron은 1s에서 7g까지의 모든 일반적이고 희귀한 원자 궤도의 시각화이다.
- 웅장한 테이블 많은 궤도의 스틸 이미지











 정수
정수 




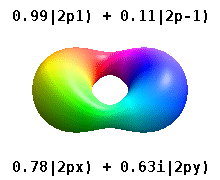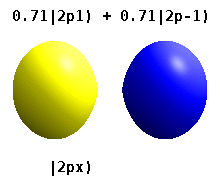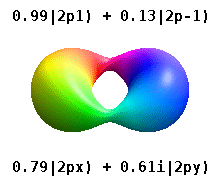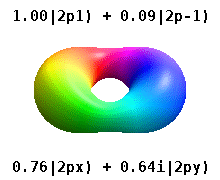









 Y
Y 












 다항식을 검사하고 생략하여 오비탈에 대한 데카르트 라벨을 생성합니다.z
다항식을 검사하고 생략하여 오비탈에 대한 데카르트 라벨을 생성합니다.z




 대해 긴 데카르트 구면 조화 다항식을 축약하는 방법에 대한 참조가 없는 것 같다. 따라서 이 명명법에 따라 g
대해 긴 데카르트 구면 조화 다항식을 축약하는 방법에 대한 참조가 없는 것 같다. 따라서 이 명명법에 따라 g






















































































 미세
미세 


