보어 모형
Bohr model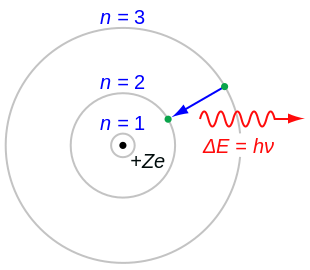
원자물리학에서 1913년 닐스 보어와 어니스트 러더퍼드가 제시한 원자의 보어 모형 또는 러더퍼드-보어 모형은 궤도를 도는 전자로 둘러싸인 작고 밀도가 높은 핵으로 이루어져 있습니다. 이것은 태양계의 구조와 비슷하지만 중력이 아닌 정전기력에 의해 제공되는 인력과 양자화된 전자 에너지(불연속적인 값만 가정)에 의해 제공됩니다.
원자물리학의 역사에서 조셉 라모르의 태양계 모델(1897), 장 페린의 모델(1901),[2] 입방체 모델(1902), 나가오카 한타로의 토성 모델(1904), 자두 푸딩 모델(1904), 아서 하스의 양자 모델(1910), 러더퍼드 모델(1911), 그리고 존 윌리엄 니콜슨의 핵 양자 모델(1912). 1911년 러더퍼드 모델에 대한 개선은 주로 하스와 니콜슨이 도입한 새로운 양자역학적 해석에 관한 것이었지만, 고전물리학에 따른 방사선을 설명하려는 시도는 포기했습니다.
이 모델의 핵심 성공은 수소의 스펙트럼 방출선에 대한 Rydberg 공식을 설명하는 데 있습니다. 뤼드베르크 공식은 실험적으로 알려져 있었지만, 보어 모델이 도입되기 전까지는 이론적 기반을 얻지 못했습니다. 보어 모델은 뤼드베르크 공식의 구조에 대한 이유를 설명했을 뿐만 아니라 공식의 경험적 결과를 구성하는 기본적인 물리 상수에 대한 정당성을 제공했습니다.
보어 모델은 원자가 쉘 모델에 비해 수소 원자의 비교적 원시적인 모델입니다. 이론으로서, 그것은 더 광범위하고 훨씬 더 정확한 양자역학을 사용하여 수소 원자의 1차 근사치로 도출될 수 있고, 따라서 더 이상 쓸모없는 과학 이론으로 간주될 수 있습니다. 그러나 단순성과 선택된 시스템에 대한 올바른 결과(응용 방법은 아래 참조) 때문에 Bohr 모델은 여전히 더 정확하지만 더 복잡한 원자가 껍질 원자로 이동하기 전에 학생들에게 양자역학 또는 에너지 수준 다이어그램을 소개하도록 일반적으로 교육됩니다. 관련 양자 모델은 1910년 아서 에리히 하스에 의해 제안되었지만, 1911년 솔베이 대회에서 철저히 논의될 때까지 거부되었습니다.[3] 흔히 플랑크의 양자 발견(1900년)과 성숙한 양자역학의 출현(1925년) 사이의 기간의 양자 이론을 옛 양자 이론이라고 합니다.
기원.

20세기 초, 어니스트 러더퍼드의 실험은 원자들이 작고 밀도가 높으며 양전하를 띤 핵을 둘러싸고 있는 음전하를 띤 전자들의 확산 구름으로 구성되어 있다는 것을 밝혀냈습니다.[5] 이러한 실험 데이터를 감안할 때 러더퍼드는 자연스럽게 원자의 행성 모델인 1911년의 러더퍼드 모델을 생각하게 되었습니다. 이것은 태양핵 주위를 도는 전자를 가지고 있었지만 기술적인 문제를 수반했습니다: 고전역학의 법칙(즉, 라모르 공식)은 전자가 핵 주위를 도는 동안 전자기 복사를 방출할 것이라고 예측합니다. 전자는 에너지를 잃기 때문에 안쪽으로 빠르게 나선을 그리며 약 16피코초의 시간 척도로 핵으로 붕괴됩니다.[6] 러더퍼드의 원자 모델은 모든 원자가 불안정하다고 예측하기 때문에 재앙입니다.[7] 또한 전자가 안쪽으로 나선을 그리면서 궤도 주기가 짧아져서 방출되는 주파수가 급격히 증가하여 연속 스펙트럼을 갖는 전자기 복사가 발생합니다. 그러나 19세기 후반의 전기 방전 실험은 원자가 특정한 이산 주파수에서만 빛을 방출한다는 것을 보여주었습니다. 20세기 초에는 원자가 스펙트럼 라인을 설명할 것으로 예상되었습니다. 1897년, 레일리 경은 이 문제를 분석했습니다. 1906년에 레일리는 "스펙트럼에서 관측되는 주파수는 일반적인 의미에서 교란이나 진동의 주파수가 아니라 안정성 조건에 의해 결정되는 원자의 원래 구성의 필수적인 부분을 형성할 수 있다"고 말했습니다.[8][9]
보어의 원자에 대한 윤곽은 보어의 멘토인 러더퍼드가 참석한 가운데 1911년 방사선과 양자를 주제로 한 제1차 솔베이 회의가 진행되는 동안 나왔습니다. 막스 플랑크의 강연은 "...분자결합의 대상이 되는 원자나 전자는 양자론의 법칙을 따를 것입니다."[10][11]라는 발언으로 끝이 났습니다. 헨드릭 로렌츠는 플랑크의 강의에서 아서 에리히 하스가 개발한 원자모형을 중심으로 한 논의의 상당 부분을 톰슨의 모형에 기초한 원자의 구성에 대한 문제를 제기했습니다. 로렌츠는 플랑크 상수가 원자의 크기를 결정하는 것으로 받아들여질 수도 있고, 원자의 크기가 플랑크 상수를 결정하는 것으로 받아들여질 수도 있다고 설명했습니다.[12] 로렌츠는 방사선의 방출과 흡수에 관한 언급을 포함시켜 "전자의 수가 그들의 영역으로 들어오는 사람들의 수와 같은 정지 상태가 확립될 것"이라고 결론지었습니다.[3] 원자들 사이의 에너지 차이를 조절할 수 있는 것에 대한 논의에서 막스 플랑크는 "매개체는 전자일 수 있다"[13]고 간단히 말했습니다. 토론에서는 양자 이론이 원자에 포함되어야 할 필요성과 원자 이론의 어려움을 설명했습니다. 플랑크는 강연에서 다음과 같이 명시적으로 말했습니다: "진동자[분자 또는 원자]가 방정식에 따라 방사선을 제공할 수 있으려면, 이 보고서의 첫머리에서 이미 말했듯이, 특정한 물리적 가설, 즉 근본적인 지점에서, 명시적이든 암묵적이든 고전역학과 모순됩니다."[14] 보어의 원자모형에 관한 첫 논문은 플랑크를 인용하여 다음과 같이 말하고 있습니다: "전자의 운동 법칙의 변화가 무엇이든 간에, 문제의 법칙에서 고전적인 전기역학에 반대되는 양, 즉 플랑크 상수 또는 종종 그것이 작용의 기본 양자라고 불리는 양을 도입하는 것이 필요한 것 같습니다." 페이지 하단에 있는 보어의 각주는 1911년 솔베이 대회의 프랑스어 번역본으로 플랑크, 로렌츠, 양자화된 아서 하스 모델이 17번 언급한 절차와 기본 원리에 직접 패턴을 나타냈다는 것을 증명했습니다.[5] 로런츠는 다음과 같이 하면서 의 강연을 끝냈습니다. "이 에너지가 hν의 배수여야 한다는 가정 h\n은(는) 공식으로 이어집니다 서 n {\displaystyle n은(는) 정수입니다. 2 h {\displaystyle qv^{} nh\n”[15]러더퍼드는[15] 보어에게 이 점들의 개요를 설명하거나 그가 그들로부터 인용하고 그것들을 참고로 사용했기 때문에 그에게 절차의 사본을 줄 수 있었을 것입니다.[16] 이후 인터뷰에서 보어는 솔베이 대회에 대한 러더퍼드의 발언을 듣는 것은 매우 흥미로운 일이라고 말했습니다.[17] 그러나 보어는 솔베이 의회의 "실제 보고서를 보았습니다."라고 말했습니다.[18]
그러던 중 1912년 보어는 각운동량을 hπh2\pi}로 양자화한 원자모형의 존 윌리엄 니콜슨 이론을 접하게 되었습니다. 네이처지에 실린 보어 원자 100주년 기념행사에 따르면, 전자가 핵 쪽으로 내려오면서 스펙트럼선을 방사한다는 사실을 발견한 사람은 니콜슨이었고, 그의 이론은 핵과 양자론이었습니다.[11][19][20] 닐스 보어는 1913년 보어 원자 모형 논문에서 그의 말을 인용했습니다.[5] 보어의 모형에 대한 니콜슨의 핵 양자 원자 모형 작업의 중요성은 많은 역사학자들에 의해 강조되어 왔습니다.[21][22][20][23]
다음으로, 보어는 친구인 한스 한센으로부터 발머 급수는 1885년 요한 발머가 발견한 수소의 일부 스펙트럼선의 파장을 기술하는 경험적 방정식인 발머 공식을 사용하여 계산된다는 말을 들었습니다.[17][24] 이는 1888년 요하네스 뤼드베르크에 의해 더욱 일반화되었고, 그 결과 현재 뤼드베르크 공식으로 알려져 있습니다. 이후 보어는 "모든 것이 명확해졌다"고 선언했습니다.[24]
러더퍼드 원자의 문제를 극복하기 위해 1913년 닐스 보어는 그의 모델의 대부분을 다음과 같이 정리하는 세 가지 가정을 제시했습니다.
- 전자는 고전 전자기학이 시사하는 것과는 달리 어떤 에너지도 복사하지 않고 핵 주위의 특정한 안정된 궤도를 회전할 수 있습니다. 이러한 안정된 궤도를 정지 궤도라고 하며, 핵으로부터 일정한 이격된 거리에서 달성됩니다. 전자는 분리된 궤도 사이에 다른 궤도를 가질 수 없습니다.
- 정지 궤도는 회전하는 전자의 각운동량이 감소된 플랑크 상수의 정수배인 거리에서 달성됩니다. = ℏ{\ m_{\mathrm {e} }= n\hbar } 여기서 n = 1, 2, 3, ... {\displaystyle n = 1, 2, 3, ...이를 주양자수라고 하며, h / 2 {\displaystyle \hbar h/2\pi}라고 합니다. n {\displaystyle n}의 가장 낮은 값은 1이며, 이는 수소의 경우 0.0529nm로 알려진 가장 작은 궤도 반지름을 제공합니다. 일단 전자가 이 가장 낮은 궤도에 오르면, 전자는 핵에 더 이상 접근할 수 없습니다. 보어가 1912년 논문에서 니콜슨이 이전에 제시한 각운동량 양자 규칙에서 출발하여 [17][11][19][20]보어는[5] 수소 원자와 다른 수소 유사 원자와 이온의 허용 궤도의 에너지를 계산할 수 있었습니다. 이 궤도들은 일정한 에너지와 관련이 있으며 에너지 껍질 또는 에너지 준위라고도 합니다. 이러한 궤도에서 전자의 가속은 복사와 에너지 손실을 초래하지 않습니다. 원자의 보어 모형은 플랑크의 복사 양자론에 기초를 두고 있었습니다.
- 전자는 하나의 된 궤도에서 다른 궤도로 점프하거나 주파수ν로 전자기 복사를 흡수하거나 방출함으로써 에너지를 얻고 잃을 수 있습니다. {\displaystyle \nu 플랑크 관계에 따른 레벨의 에너지 차이에 의해 결정됩니다. E E 2 - E h {\E E_{{1} h\n 서 h h는 플랑크 상수입니다.
다른 점은 다음과 같습니다.
- 아인슈타인의 광전효과 이론처럼 보어의 공식은 양자 점프 중에 이산적인 양의 에너지가 복사된다고 가정합니다. 하지만 아인슈타인과 달리 보어는 전자기장의 고전적인 맥스웰 이론을 고수했습니다. 전자기장의 양자화는 원자 에너지 준위의 불연속성으로 설명되었습니다; 보어는 광자의 존재를 믿지 않았습니다.[25][26]
- 맥스웰 이론에 의하면 주파수νdisplaystyle \n고전적 방사선의 은(는) 회전 주파수 \n과 같습니다.궤도에 있는 전자의rot 는 이 주파수의 정수배의 고조파를 가지고 있습니다. 결과는 k 가 보다 훨씬 작을 때 와 - k n-k 사이의 점프에 대해 Bohr 모델에서 얻은 것입니다 이 점프는 n 의 k k번째 고조파의 주파수를 재현합니다 충분히 n{\ n 값(소위 Rydberg 상태)의 경우 방출 과정에 포함된 두 궤도는 거의 동일한 회전 주파수를 갖습니다. 고전적인 궤도 주파수가 모호하지 않도록. 그러나 작은 n또는 큰 의 경우 복사 주파수는 명확한 고전적 해석이 없습니다. 이는 양자론이 큰 양자수의 한계에서만 고전 이론과 일치하도록 요구하는 대응 원리의 탄생을 의미합니다.
- 보어-크레이머스-슬레이터 이론(BKS 이론)은 보어 모델을 확장하려는 시도가 실패한 것으로, 양자 점프에서 에너지와 운동량의 보존을 위반하며, 보존 법칙은 평균적으로만 유지됩니다.
각운동량이ℏ {\displaystyle\hbar}의 정수배라는 보어의 조건은 이후 1924년 드브로이에 의해 정상파 조건으로 재해석되었습니다: 전자는 파동으로 기술되고 모든 수의 파장이 전자 궤도의 둘레를 따라 맞아야 합니다.
드브로이의 가설에 따르면 전자와 같은 물질 입자는 파동처럼 행동합니다. 전자의 드브로이 파장은
그 말은 다음과 같습니다.
아니면
서 은 궤도를 도는 전자의 각운동량입니다. 이 각운동량에 대해ℓ {\displaystyle ell}을(를) 쓰면 이전 방정식은
보어의 두 번째 공준입니다
보어는 전자 궤도의 각운동량을 로 설명한 반면, 드브로이의 λ =hp \ lambda =h/p} 파장은 h {\displaystyle h}를 전자 운동량으로 나눈 값으로 설명했습니다. 그러나 1913년 보어는 어떠한 종류의 파동 해석도 제공하지 않고 대응 원리에 호소함으로써 그의 통치를 정당화했습니다. 1913년에는 전자와 같은 물질 입자의 파동 행동을 의심하지 않았습니다.
1925년에는 양자화된 궤도를 이동하는 보어의 전자 모델을 보다 정확한 전자 운동 모델로 확장한 새로운 종류의 양자역학이 제안되었습니다. 이 새로운 이론은 베르너 하이젠베르크에 의해 제안되었습니다. 같은 이론의 또 다른 형태인 파동역학은 오스트리아의 물리학자 에르빈 슈뢰딩거에 의해 독립적으로, 그리고 다른 추론에 의해 발견되었습니다. 슈뢰딩거는 드브로이의 물질파를 이용했지만, 양의 핵전하의 퍼텐셜에 갇힘으로써 수소와 같은 원자의 핵 주위를 이동하도록 제한된 전자를 기술하는 3차원 파동 방정식의 파동해를 구했습니다.
전자 에너지 준위
보어 모델은 두 개의 충전된 점이 빛보다 훨씬 적은 속도로 서로를 도는 시스템에 대해서만 거의 정확한 결과를 제공합니다. 여기에는 수소 원자, 단일 이온화된 헬륨, 이중 이온화된 리튬과 같은 일전자계뿐만 아니라 전자 하나가 다른 모든 것으로부터 멀리 떨어져 있는 모든 원자의 양전자 상태와 리드버그 상태가 포함됩니다. 다른 가정이 추가될 경우 K선 X선 전환 계산에 사용할 수 있습니다(아래 모즐리 법칙 참조). 고에너지 물리학에서는 무거운 쿼크 중간자의 질량을 계산하는 데 사용할 수 있습니다.
궤도 계산에는 두 가지 가정이 필요합니다.
- 고전역학
- 전자는 정전기적 인력에 의해 원형 궤도에 고정됩니다. 구심력은 쿨롱력과 같습니다.
- 여기서 m은e 전자의 질량, e는 기본 전하, k는e 쿨롱 상수, Z는 원자의 원자 번호입니다. 여기서는 핵의 질량이 전자의 질량보다 훨씬 크다고 가정합니다. 이 방정식은 임의의 반경에서 전자의 속도를 결정합니다.
- 또한 모든 반경에서 전자의 총 에너지를 결정합니다.
- 총 에너지는 음이고 r에 반비례합니다. 이것은 궤도를 도는 전자를 양성자로부터 떼어내는 데 에너지가 필요하다는 것을 의미합니다. r의 무한대 값의 경우 에너지는 0이며, 양성자에서 무한히 멀리 떨어진 운동하지 않는 전자에 해당합니다. 총 에너지는 퍼텐셜 에너지의 절반이며, 그 차이는 전자의 운동 에너지입니다. 이는 비리알 정리에 의한 비원형 궤도에도 해당됩니다.
- 양자법칙
- 각운동량 L = mvr은 ħ의 정수배입니다.
파생
만약 원자 내의 전자가 주기 T의 궤도 위를 이동하고 있다면, 고전적으로 전자기 복사는 매 주기마다 반복될 것입니다. 만약 전자기장에 대한 결합이 약해서 궤도가 한 주기에 많이 붕괴되지 않는다면, 복사는 매 주기마다 반복되는 패턴으로 방출될 것이고, 그래서 푸리에 변환은 단지 1/T의 배수의 주파수를 갖게 될 것입니다. 그러나 양자 영역에서 각운동량의 양자화는 이산 에너지 수준으로 이어지고 방출된 주파수는 이러한 수준 간의 에너지 차이에 따라 양자화됩니다. 에너지 수준의 이러한 이산적인 특성은 고전적인 방사선 법칙에서 근본적인 이탈을 초래하여 방출된 방사선에서 뚜렷한 스펙트럼 라인을 생성합니다.
양자역학에서 이 방출은 빛의 양자, 즉 1/T의 정수배로 구성된 주파수여야 하므로 고전역학은 큰 양자수에서 대략적인 설명이 됩니다. 즉, 1/T 주기의 고전적 궤도에 해당하는 에너지 준위는 h/T 단위의 에너지 준위가 다른 근처의 에너지 준위를 가져야 하며, 그 준위에 동일한 간격을 두어야 합니다.
보어는 에너지 간격 1/T를 에너지 상태 또는 + 1 의 주기로 가장 잘 계산해야 하는지, 아니면 En + 1 {\displaystyle E_{n+1 또는 어느 정도의 평균으로 계산해야 하는지에 대해 걱정했습니다. 나중에 생각해보면, 이 모델은 선도적인 반고전적 근사치일 뿐입니다.
보어는 원형 궤도를 고려했습니다. 고전적으로 광자가 방출되면 이 궤도들은 더 작은 원으로 붕괴해야 합니다. 원형 궤도 사이의 수평 간격은 대응 공식으로 계산할 수 있습니다. 수소 원자의 경우, 고전 궤도는 r로3/2 확장하기 위해 케플러의 제3법칙에 의해 결정되는 주기 T를 가집니다. 에너지는 1/r로 확장되므로 수평 간격 공식은 다음과 같습니다.
궤도로 궤도를 재귀적으로 내려감으로써 에너지 수준을 파악할 수 있지만 지름길이 있습니다.
원형 궤도의 각운동량 L은 로 확장됩니다 각운동량에 대한 에너지는 다음과 같습니다.
보어의 양자화된 L 값이 동일한 간격이라고 가정하면, 이웃하는 에너지 사이의 간격은 다음과 같습니다.
이는 동일한 간격의 각운동량에 대해 원하는 대로입니다. 상수를 계속 추적하면 간격은 ħ이므로 각운동량은 ħ의 정수배여야 합니다.
보어는 이렇게 그의 모델에 도착했습니다.
- 식을 속도에 대입하면 r에 대한 방정식을 n의 항으로 구할 수 있습니다.
- 임의의 n에서 허용되는 궤도 반경이
- 수소 원자에서 가능한 가장 작은 r 값(Z = 1)을 보어 반지름이라고 하며 다음과 같습니다.
- 모든 원자에 대한 n차 레벨의 에너지는 반지름과 양자수에 의해 결정됩니다.
따라서 수소의 가장 낮은 에너지 준위에 있는 전자(n = 1)는 핵에서 무한히 멀리 떨어진 운동하지 않는 전자보다 약 13.6 eV 적은 에너지를 가지고 있습니다. 다음 에너지 레벨(n = 2)은 -3.4 eV입니다. 세 번째(n = 3)는 -1.51 eV 등입니다. n의 값이 더 큰 경우, 이것들은 원자의 나머지 부분 주위의 큰 원형 궤도에 한 개의 전자가 있는 고도로 들뜬 원자의 결합 에너지이기도 합니다. 또한 수소 공식은 월리스 제품과 일치합니다.[27]
에너지 공식에 있는 자연 상수의 조합을 RydbergE 에너지라고 합니다.
이 표현식은 더 자연스러운 단위를 형성하는 조합으로 해석함으로써 명확해집니다.
- 는 전자(511keV)의 정지 질량 에너지이며,
- c 1 137 {\frac {k_{\mathrm {e}}e^{2}}{\bar c}}= \approx {\frac {1}{137}}}는 미세 구조 상수입니다.
- = ( 2 α 2 {\displaystyle R_{\mathrm E}} = {\frac {1}{2}}(m_{\mathrm {e} }c^{2})\alpha ^{2}}.
이 유도는 핵이 한 개의 전자에 의해 궤도를 돌고 있다는 가정과 함께 있기 때문에, 핵에 전하 q = Ze를 갖게 함으로써 이 결과를 일반화할 수 있습니다. 여기서 Z는 원자 번호입니다. 이것은 이제 실제 에너지 수준의 대략적인 크기의 근사치로 작용할 수 있는 수소 원자에 대한 에너지 수준을 제공할 것입니다. 따라서 Z 양성자를 가진 핵의 에너지 준위는 대략적으로 다음과 같습니다.
실제 에너지 수준은 두 개 이상의 전자(n-body 문제 참조)에 대해 분석적으로 해결할 수 없습니다. 전자는 핵의 영향을 받을 뿐만 아니라 쿨롱 힘을 통해 상호 작용하기 때문입니다.
Z = 1/α (Z ≈ 137)일 때, 운동은 매우 상대론적이 되고, Z는 R의 α를 상쇄합니다. 궤도 에너지는 정지 에너지와 비슷해지기 시작합니다. 충분히 큰 핵은 안정적이라면 진공에서 전자가 결합하여 양전자를 무한대로 방출함으로써 전하를 감소시킬 것입니다. 이것은 최대 핵 전하를 예측하는 전자기 전하 스크리닝의 이론적 현상입니다. 이러한 양전자의 방출은 무거운 이온의 충돌에서 관찰되어 일시적인 슈퍼헤비핵을 생성했습니다.[28]
보어 공식은 모든 상황에서 전자의 질량 대신 전자와 양성자의 감소된 질량을 적절하게 사용합니다.
그러나 양성자의 질량이 전자의 질량의 약 1836.1배로 훨씬 크기 때문에 이 숫자들은 거의 비슷하므로, 계에서 줄어든 질량은 전자의 질량에 상수 1836.1/(1+ 1836.1) = 0.99946을 곱한 것입니다. 이 사실은 러더퍼드에게 보어 모델의 중요성을 설득하는 데 역사적으로 중요했는데, 이는 단일 이온화 헬륨에 대한 스펙트럼에서 선의 주파수가 수소의 주파수와 정확히 4배 차이가 나는 것이 아니라 수소 대 수소에 대한 감소된 질량의 비율의 4배라는 사실을 설명했기 때문입니다. 정확히 4보다 실험 비율에 훨씬 가까운 헬륨 시스템.
양전자의 경우, 공식에서도 감소된 질량을 사용하지만, 이 경우 정확히 전자의 질량을 2로 나눈 값입니다. 반지름의 어떤 값에 대해서도, 전자와 양전자는 각각 그들의 공통된 질량 중심을 중심으로 반 정도의 속도로 움직이고 있으며, 각각의 운동 에너지는 4분의 1에 불과합니다. 총 운동 에너지는 무거운 핵 주위를 움직이는 전자 한 개의 양의 절반입니다.
- = 2 n 2 {\displaystyle E{n} = {\frac {R_{\mathrm {E}}} {2n^{2}}}(양전자).
뤼드베르크 공식
보어의 공식 이전에 경험적으로 알려진 뤼드베르크 공식은 보어의 이론에서 궤도 에너지 수준 사이의 전이나 양자 점프의 에너지를 설명하는 것으로 보여집니다. 보어의 공식은 이미 알려져 있고 측정된 뤼드베르크 상수의 수치 값을 제공하지만, 전자의 전하와 플랑크 상수를 포함한 보다 근본적인 자연 상수의 관점에서 볼 때 그렇습니다.
전자가 원래의 에너지 준위에서 더 높은 에너지 준위로 이동하면 원래 위치로 올 때까지 각 준위를 뒤로 뛰어올라 광자가 방출됩니다. 수소의 다른 에너지 수준에 대해 유도된 공식을 사용하면 수소 원자가 방출할 수 있는 빛의 파장을 결정할 수 있습니다.
수소 원자가 방출하는 광자의 에너지는 두 수소 에너지 준위의 차이로 주어집니다.
여기서 n은f 최종 에너지 준위, n은i 초기 에너지 준위입니다.
광자의 에너지는
방출되는 광자의 파장은 다음에 의해 주어집니다.
이것은 Rydberg 공식으로 알려져 있으며, Rydberg 상수 R은 R/hc, 또는 R/2 π를 자연 단위로 합니다. 이 공식은 19세기에 분광학을 연구하는 과학자들에게 알려졌지만, 보어까지 이 형태에 대한 이론적 설명이나 R의 값에 대한 이론적 예측은 없었습니다. 사실, 보어의 뤼드베르크 상수의 유도뿐만 아니라 보어 공식과 라이만(n = 1), 발머(n = 2), 파셴(n = 3) 시리즈의 스펙트럼 라인이 실험적으로 관찰된 것과 일치하고 아직 관찰되지 않은 다른 라인의 성공적인 이론적 예측이 그의 모델이 즉시 받아들여진 한 가지 이유였습니다.
두 개 이상의 전자를 가진 원자에 적용하기 위해, Rydberg 공식은 Z를 Z - b 또는 n을 n - b로 대체함으로써 수정될 수 있습니다. 여기서 b는 일정하게 내부 쉘 및 기타 전자에 의한 스크리닝 효과를 나타냅니다(전자 쉘 및 아래 "원자의 쉘 모델"에 대한 나중의 논의 참조). 이것은 보어가 그의 모델을 제시하기 전에 경험적으로 확립되었습니다.
쉘 모델(더 무거운 원자)
1913년 보어의 최초의 세 논문은 주로 가벼운 원소에서의 전자 배치를 기술했습니다. 1913년 보어는 자신의 전자껍질을 "반지"라고 불렀습니다. 그의 행성 모델 당시에는 포탄 안의 원자 궤도가 존재하지 않았습니다. 보어는 1913년 그의 유명한 논문의 제3부에서 껍질의 최대 전자는 8이라고 설명하면서, "더 나아가 n개의 전자로 이루어진 고리는 n < 8이 아니면 n개의e 전하를 띤 핵 주위를 한 고리로 회전할 수 없다는 것을 알게 되었습니다."라고 썼습니다. 더 작은 원자의 경우, 전자 껍질은 다음과 같이 채워집니다: "전자 고리는 전자가 같은 수의 전자를 포함할 경우에만 결합되며, 따라서 내부 고리에 있는 전자의 수는 2, 4, 8개뿐입니다." 그러나 더 큰 원자에서 가장 안쪽 껍질은 8개의 전자를 포함할 것입니다. "반면, 원소들의 주기적인 체계는 이미 네온 N = 10에서 8개의 전자로 구성된 내부 고리가 발생할 것임을 강력하게 시사합니다." 보어는 "위에서 우리는 가벼운 원자에서 전자의 배열을 위한 다음과 같은 가능한 계획으로 이끌려집니다."[29][30][4][16]라고 썼습니다.
| 원소 | 포탄당 전자 | 원소 | 포탄당 전자 | 원소 | 포탄당 전자 |
|---|---|---|---|---|---|
| 1 | 1 | 9 | 4, 4, 1 | 17 | 8, 4, 4, 1 |
| 2 | 2 | 10 | 8, 2 | 18 | 8, 8, 2 |
| 3 | 2, 1 | 11 | 8, 2, 1 | 19 | 8, 8, 2, 1 |
| 4 | 2, 2 | 12 | 8, 2, 2 | 20 | 8, 8, 2, 2 |
| 5 | 2, 3 | 13 | 8, 2, 3 | 21 | 8, 8, 2, 3 |
| 6 | 2, 4 | 14 | 8, 2, 4 | 22 | 8, 8, 2, 4 |
| 7 | 4, 3 | 15 | 8, 4, 3 | 23 | 8, 8, 4, 3 |
| 8 | 4, 2, 2 | 16 | 8, 4, 2, 2 | 24 | 8, 8, 4, 2, 2 |
1913년 보어의 세 번째 논문 제3부 "몇 개의 핵을 포함하는 시스템"에서 그는 두 개의 원자가 대칭면에서 분자를 형성하고 수소를 기술하는 것으로 돌아선다고 말합니다.[31] 1913년의 보어 모델은 더 높은 원소에 대해서는 자세히 논의하지 않았고 존 윌리엄 니콜슨은 1914년에 리튬에 대해서는 작동할 수 없다는 것을 최초로 증명했지만 수소와 이온화된 헬륨에 대해서는 매력적인 이론이었습니다.[16][32]
1921년, 주기율표 작업에 참여한 화학자들과 다른 사람들의 작업에 이어, 보어는 더 무거운 원자에 대한 대략적인 모델을 제공하기 위해 수소 모델을 확장했습니다. 이러한 성질들은 화학자 찰스 루글리 베리의[4][33] 동일한 연구와 동시에 제안되었지만, 이것은 알려진 많은 원자적 성질을 처음으로 재현하는 물리적 그림을 제공했습니다.
1914년부터 1916년까지 보어의 연구 파트너였던 발터 코셀은 보어의 연구를 수정하여 전자가 외부 고리를 통해 상호작용한다는 것을 보여주었고, 코셀은 고리를 다음과 같이 불렀습니다. “shells.”[34][35] 어빙 랭무어(Irving Langmuir)는 1916년에 이미 포탄당 최대 8개의 전자를 예측했지만 1904년 옥텟 규칙에 따라 첫 번째 포탄에 2개만 있고 다음 포탄에 8개까지 전자를 배치할 수 있는 최초의 실행 가능한 포탄 배열을 한 것으로 알려져 있습니다.[36] 무거운 원자는 원자핵에 양성자가 더 많고, 전하를 상쇄할 전자가 더 많습니다. 보어는 이러한 화학자들로부터 각각의 이산 궤도가 특정 수의 전자만을 보유할 수 있다는 아이디어를 얻었습니다. 코셀에 의하면, 궤도가 꽉 찬 후에는 다음 단계를 사용해야 합니다.[4] 이것은 원자에 Kosel, Langmuir, Bury에 의해 설계된 껍질 구조를 제공하며, 각각의 껍질은 보어 궤도에 해당합니다.
이 모델은 각 껍질의 전자를 상호작용이 없는 것으로 취급하기 때문에 수소 모델보다 훨씬 더 근사합니다. 그러나 전자의 반발은 선별 현상에 의해 어느 정도 고려됩니다. 외부 궤도의 전자는 핵의 궤도를 돌 뿐만 아니라 내부 전자의 주위를 돌기 때문에 내부 궤도의 전자의 수만큼 이들이 느끼는 유효 전하 Z가 감소하게 됩니다.
예를 들어, 리튬 원자는 가장 낮은 1s 궤도에 두 개의 전자를 가지고 있고, 이들은 Z = 2의 궤도를 가지고 있습니다. 각자 Z = 3의 핵 전하량에서 다른 하나의 선별 효과를 뺀 값으로 핵 전하량이 1단위 감소한다고 봅니다. 이것은 가장 안쪽의 전자가 보어 반지름의 약 1/2로 궤도를 돈다는 것을 의미합니다. 리튬에서 가장 바깥쪽에 있는 전자는 대략 보어 반지름에서 공전하는데, 그 이유는 두 내부 전자가 핵전하를 2만큼 감소시키기 때문입니다. 이 외부 전자는 핵에서 거의 한 보어 반경에 있어야 합니다. 전자들이 서로 강하게 반발하기 때문에 유효전하 설명은 매우 근사합니다. 유효전하 Z는 보통 정수가 되지 않습니다. 그러나 모즐리의 법칙은 가장 안쪽에 있는 전자 쌍을 실험적으로 조사하고, 가장 바깥쪽 껍질에 전자가 하나만 있는 원자나 이온의 가장 바깥쪽 전자는 유효 전하 Z - k를 가진 핵 주위를 돈다는 것을 보여줍니다. 여기서 k는 내부 껍질에 있는 전자의 총 개수입니다.
껍질 모형은 원소의 주기율표에서 19세기 후반에 성문화된 원자의 많은 신비한 성질을 정성적으로 설명할 수 있었습니다. 한 가지 성질은 기체의 점도와 순수한 결정성 고체의 밀도를 측정하면 대략적으로 알 수 있는 원자의 크기였습니다. 원자는 주기율표에서 오른쪽으로 갈수록 작아지는 경향이 있고, 표의 다음 줄에서 훨씬 커집니다. 표의 오른쪽에 있는 원자는 전자를 얻는 경향이 있는 반면 왼쪽에 있는 원자는 전자를 잃는 경향이 있습니다. 표의 마지막 열에 있는 모든 원소는 화학적으로 불활성(귀기체)입니다.
쉘 모델에서 이러한 현상은 쉘 충전으로 설명됩니다. 연속적인 원자들은 궤도가 꽉 찰 때까지 같은 크기의 궤도를 채우고 있기 때문에 더 작아지는데, 이때 표의 다음 원자는 느슨하게 결합된 외부 전자를 가지고 있어서 팽창하게 됩니다. 첫 번째 보어 궤도는 전자가 두 개일 때 채워지는데, 이것이 헬륨이 비활성인 이유입니다. 두 번째 궤도는 8개의 전자를 허용하고, 그것이 가득 차면 원자는 다시 비활성인 네온이 됩니다. 세 번째 오비탈은 더 정확한 소머펠트 처리(현대 양자역학에서 재현된)에서 여분의 "d" 전자가 있다는 것을 제외하고는 다시 8개를 포함합니다. 세 번째 궤도에는 추가적인 10 d 전자가 있을 수 있지만, 다음 레벨에서 몇 개의 궤도가 더 채워질 때까지 이러한 위치는 채워지지 않습니다( filling, n=3 d 궤도는 10개의 전이 요소를 생성합니다). 불규칙한 충전 패턴은 보어나 소머펠트 모델 중 어느 모델에서도 고려되지 않고 현대적인 처리에서도 계산이 어려운 전자 간 상호작용의 영향입니다.
모즐리의 법칙과 계산(K-alpha X-ray 방출선)
닐스 보어(Niels Bohr)는 1962년에 다음과 같이 말했습니다: "사실 러더퍼드 작업은 심각하게 받아들여지지 않았습니다. 오늘은 이해할 수 없지만, 전혀 심각하게 생각하지 않았습니다. 어디에서도 그것에 대한 언급이 없었습니다. 큰 변화는 모즐리에게서 왔습니다."[37]
1913년, 헨리 모즐리는 전자 폭격을 받는 원자들에 의해 방출되는 가장 강한 X선과 그들의 원자 번호 Z 사이의 경험적인 관계를 발견했습니다. 모즐리의 경험적 공식은 Rydberg의 공식과 나중에 보어의 공식에서 파생될 수 있는 것으로 밝혀졌습니다(모즐리는 모즐리의 연구 이전에 발표되었고 모즐리의 1913년 논문은 최초의 보어 모델 논문과 같은 달에 발표되었기 때문에 모델 측면에서 어니스트 러더퍼드와 안토니우스 반 덴 브록만을 실제로 언급합니다).[38] [1] 이 X선 라인이 양자수 1과 2를 가진 에너지 수준 사이의 전환에서 비롯되었다는 두 가지 추가 가정과 [2], 수소보다 무거운 원자에 대한 공식에 사용될 때 원자수 Z를 1에서 (Z - 1)로 줄여야 한다는 가정이 있습니다.2
모즐리는 자신의 결과에 어리둥절해하며 보어에게 편지를 보냈지만 보어는 도와줄 수 없었습니다. 당시 그는 전자의 가장 안쪽에 있는 가정된 "K" 전자껍질이 결과를 깔끔하게 설명할 수 있는 2개가 아니라 적어도 4개의 전자를 가져야 한다고 생각했습니다. 그래서 모즐리는 이론적인 설명 없이 그의 결과를 발표했습니다.
주기율표에서 전자가 외각에 추가되면서 새로운 원소가 생성될 것이라고 설명한 사람은 1914년과 1916년의 발터 코셀이었습니다. 코셀의 논문에서, 그는 이렇게 썼습니다: "이것은 더 추가된 전자들이 각각의 동심원 고리나 껍질에 넣어져야 한다는 결론으로 이어집니다. namely, 우리의 경우에는 8개의 전자, 특정한 수의 전자만이 배열되어야 합니다. 고리나 껍질 하나가 완성되면 바로 다음 원소를 위해 새로운 것을 시작해야 하는데, 가장 쉽게 접근할 수 있고 가장 바깥쪽 주변에 위치한 전자의 수가 원소마다 다시 증가하기 때문에 새로운 껍질이 형성될 때마다 화학적 주기성이 반복됩니다."[34][35] 나중에 화학자 Langmuir는 그 효과가 전하 스크리닝에 의해 발생한다는 것을 깨달았고, 내부 껍질은 2개의 전자만을 포함하고 있었습니다. 1919년 논문에서 어빙 랭무어는 각각 2개의 전자만을 포함할 수 있는 "세포"의 존재를 가정했고, 이들은 "등거리 층"으로 배열되었습니다.
모즐리 실험에서는 원자에서 가장 안쪽에 있는 전자 중 하나가 떨어져 나가면서 남아 있는 전자 하나가 포함된 가장 낮은 보어 궤도에 빈자리를 남깁니다. 그리고 나서 이 빈자리는 n=2인 다음 궤도에서 나오는 전자에 의해 채워집니다. 그러나 n=2개의 전자는 핵 전하 +Z를 선별하기 위해 단일 전자가 가장 낮은 보어 궤도에 남아 있을 때 핵 전하에 적합한 값인 Z -1의 유효 전하를 보고, (전자의 음전하가 핵 양전하를 선별하기 때문에) -1만큼 낮춥니다. 전자가 두 번째 껍질에서 첫 번째 껍질로 떨어지는 에너지는 K-알파 라인에 대한 모즐리의 법칙을 제공합니다.
아니면
여기서 R = R/h는 3.28 x 10 Hz와 동일한 주파수 측면에서 Rydberg 상수입니다. 11과 31 사이의 Z 값의 경우, 이 후자의 관계는 원자 번호에 대한 X선 주파수의 제곱근의 단순(선형) 도표에서 Mosley에 의해 경험적으로 도출되었습니다(단, 은, Z = 47의 경우 실험적으로 얻은 스크리닝 항이 0.4로 대체되어야 합니다). 제한된 유효성에도 불구하고,[39] 모즐리의 법칙은 원자번호의 객관적 의미를 확립하였을 뿐만 아니라, 보어가 지적한 바와 같이 원자의 러더퍼드/반덴브룩/보어 핵모형의 유효성을 확립하기 위하여 뤼드베르크 유도 이상의 일을 하였을 뿐만 아니라, 원자 번호(주기율표상의 위치)는 핵 전하의 전체 단위를 나타내는 것입니다. 밴덴브룩은 1913년 1월에 그의 모델을 발표했는데, 보어의 원자 모델은 1913년 7월까지 발표되지 않은 반면 주기율표는 전하에 따라 배열되어 있다는 것을 보여주었습니다.[40]
모즐리 시대의 K-알파 선은 현재 지그반 표기법으로 (Kα와1 Kα2)로 표기된 한 쌍의 가까운 선으로 알려져 있습니다.
단점
Bohr 모델은 접지 상태 궤도 각운동량에 대해 잘못된 값 L= ħ을 제공합니다. 실제 바닥 상태에서의 각운동량은 실험 결과 0으로 알려져 있습니다. 비록 정신적인 그림들은 이 정도 수준에서 다소 실패하지만, 궤도 운동량이 없는 가장 낮은 현대의 "궤도"에 있는 전자는 핵을 전혀 "회전"하지 않고, 단지 0의 영역이 있는 타원에서 그 주위를 단단히 도는 것으로 생각될 수 있습니다. 부딪히거나 핵과 상호작용하지 않고). 이것은 소머펠트의 것처럼 좀 더 정교한 반고전적인 대우로 재현될 뿐입니다. 그럼에도 불구하고 가장 정교한 반고전학적 모델조차도 가장 낮은 에너지 상태가 구형 대칭이라는 사실을 설명하지 못합니다. 이는 특정 방향을 가리키는 것이 아닙니다.
그럼에도 불구하고 위상 공간에서 현대의 완전 양자 처리에서는 반고전적 결과의 적절한 변형(세심한 완전 확장)이 각운동량 값을 정확한 유효 값으로 조정합니다.[41] 결과적으로 물리적 기저 상태 표현은 소실되는 양자 각운동량 표현의 이동을 통해 얻어지는데, 이는 구면 대칭에 해당합니다.
현대 양자역학에서 수소의 전자는 핵 근처에서 밀도가 더 커지는 확률의 구형 구름입니다. 수소에서 확률-붕괴의 속도 상수는 보어 반지름의 역수와 같지만, 보어가 0영역 타원이 아닌 원형 궤도를 연구했기 때문에 이 두 숫자가 정확히 일치한다는 사실은 '우연'으로 여겨집니다. (그러나 이러한 우연적인 합의는 반고전적인 원자 대 완전한 양자역학적 처리 사이에서 많이 발견됩니다; 여기에는 수소 원자의 동일한 에너지 수준과 미세 구조 상수의 유도가 포함됩니다. 상대론적 보어-소머펠트 모델(아래 참조)에서 발생하며, 완전히 현대 양자역학에서 완전히 다른 개념과 동일하게 발생합니다.
Bohr 모형은 또한 다음과 같이 설명하는 데 어려움이 있습니다.
- 더 큰 원자의 스펙트럼의 대부분. 기껏해야 두 가지 추가적인 임시 가정이 이루어지면 더 큰 원자에 대한 K-알파 및 일부 L-알파 X-선 방출 스펙트럼에 대한 예측을 할 수 있습니다. 단일 외각 전자(리튬 그룹의 원자)를 갖는 원자에 대한 방출 스펙트럼도 대략적으로 예측할 수 있습니다. 또한 많은 원자에 대한 경험적 전자-핵 선별 인자가 알려진 경우, 리츠-리드버그 조합 원리를 통해 다른 원소의 유사한 원자에 있는 정보에서 다른 많은 스펙트럼 라인을 추론할 수 있습니다(리드버그 공식 참조). 이 모든 기술은 본질적으로 원자에 대한 보어의 뉴턴식 에너지-잠재력 그림을 이용합니다.
- 스펙트럼선의 상대적인 강도, 비록 몇몇 단순한 경우에 보어의 공식이나 그 수정은 합리적인 추정치(예를 들어 스타크 효과에 대한 크라머의 계산)를 제공할 수 있었습니다.
- 스펙트럼 라인에 미세 구조와 초미세 구조가 존재하는 것은 상대론적이고 미묘한 다양한 효과와 전자 스핀에 의한 합병증 때문으로 알려져 있습니다.
- 제만 효과 – 외부 자기장으로 인한 스펙트럼 선의 변화; 또한 전자 스핀 및 궤도 자기장과 상호 작용하는 더 복잡한 양자 원리 때문이기도 합니다.
- 이 모델은 동시에 측정할 수 없는 두 가지, 전자가 알려진 궤도와 위치를 가지고 있다고 간주한다는 점에서 불확정성 원칙에도 위배됩니다.
- 이중선과 삼중선은 일부 원자의 스펙트럼에서 매우 가까운 선의 쌍으로 나타납니다. 보어의 모델은 왜 일부 에너지 수준이 서로 매우 가까워야 하는지 말할 수 없습니다.
- 다중 전자 원자는 모델에서 예측한 에너지 수준을 가지고 있지 않습니다. 이것은 (중성) 헬륨에는 작동하지 않습니다.
정교화
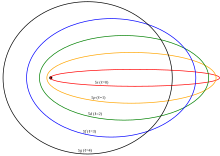
보어 모델에 대한 몇 가지 개선 사항이 제안되었는데, 특히 소머펠트 또는 보어-소머펠트 모델이 가장 유명합니다. 이 모델은 전자가 보어 모델의 원형 궤도 대신 핵 주위를 타원 궤도로 이동한다고 제안했습니다.[1] 이 모델은 추가적인 방사상 양자화 조건인 윌슨-소머펠트 양자화 조건으로[42][43] 보어 모델의 양자화 각운동량 조건을 보완했습니다.
여기서 p는r 반지름 위치인 좌표 q에r 캐논 결합된 반지름 운동량이고, T는 1개의 완전한 궤도 주기입니다. 적분은 작용각 좌표의 작용입니다. 양자수는 단열 불변량이기 때문에 대응 원리에 의해 제시된 이 조건이 유일하게 가능합니다.
보어-소머펠트 모델은 근본적으로 일관성이 없었고 많은 역설을 초래했습니다. 자기양자수는 xy평면에 대한 궤도면의 기울기를 측정했고, 몇 개의 이산값만 취할 수 있었습니다. 이것은 원자를 이 방향으로 돌릴 수 있다는 명백한 사실과 좌표에 대한 제한 없이 상대적인 사실을 모순시켰습니다. Sommerfeld 양자화는 다른 표준 좌표에서 수행될 수 있으며 때때로 다른 답을 제공합니다. 방사선 보정의 통합은 방사선이 빠져나가는 것이 어려운 복합 방사선/원자 시스템에 대한 작용각 좌표를 찾아야 했기 때문에 어려움이 있었습니다. 전체 이론은 비적분 운동으로 확장되지 않았으며, 이는 많은 시스템이 원칙적으로도 취급될 수 없다는 것을 의미했습니다. 결국 이 모델은 1925년 볼프강 파울리가 하이젠베르크의 행렬역학을 이용해 처음으로 준 수소 원자의 현대적인 양자역학적 처리로 대체되었습니다. 수소 원자의 현재 그림은 에르빈 슈뢰딩거가 1926년에 개발한 파동역학의 원자 궤도를 기반으로 합니다.
그러나, 이것은 보어-소머펠트 모델이 성공하지 못했다는 것을 말하는 것은 아닙니다. 보어-소머펠트 모델을 기반으로 한 계산은 몇 가지 더 복잡한 원자 스펙트럼 효과를 정확하게 설명할 수 있었습니다. 예를 들어, 1차 섭동까지 보어 모델과 양자 역학은 스타크 효과에서 스펙트럼 선 분할에 대해 동일한 예측을 수행합니다. 그러나 고차 섭동에서는 보어 모델과 양자 역학이 다르며 높은 필드 강도에서 스타크 효과를 측정한 결과 보어 모델보다 양자 역학의 정확성을 확인하는 데 도움이 되었습니다. 이 차이 뒤에 있는 지배적인 이론은 전자의 에너지 상태에 따라 달라지는 전자의 궤도 모양에 있습니다.
보어-소머펠트 양자화 조건은 현대 수학의 질문으로 이어집니다. 일관된 반고전적 양자화 조건은 위상 공간에서 특정 유형의 구조를 필요로 하며, 이는 양자화될 수 있는 심플렉틱 다양체의 유형에 위상적 제한을 가합니다. 특히 심플렉틱 형태는 에르미트 선다발 연결의 곡률 형태여야 하는데, 이를 사전 양자화라고 합니다.
보어는 또한 1922년에 특정 수의 전자(예를 들어, 2, 8, 18)가 안정적인 "닫힌 껍질"에 해당한다고 가정하고 자신의 모델을 업데이트했습니다.[44]
화학결합의 모형
닐스 보어는 원자 모형과 화학 결합 모형을 제안했습니다. 이원자 분자에 대한 그의 모델에 따르면, 분자 원자의 전자는 평면이 분자의 축과 수직이고 원자핵과 등거리인 회전 고리를 형성합니다. 분자계의 동적 평형은 전자 고리의 평면에 대한 핵의 인력과 핵의 상호 반발력 사이의 힘의 균형을 통해 달성됩니다. 화학 결합의 보어 모형은 고리의 전자들이 서로 최대 거리에 있는 쿨롱 반발력을 고려했습니다.[45][46]
참고 항목
- 1913년 과학으로
- 발머 상수
- 보어-소머펠트 모형
- 프랑크-헤르츠 실험은 보어 모델을 초기에 지원했습니다.
- 비활성 쌍 효과는 보어 모델을 통해 적절하게 설명됩니다.
- 양자역학개론
- 슈뢰딩거 방정식의 이론적, 실험적 정당성
참고문헌
각주
- ^ a b Lakhtakia, Akhlesh; Salpeter, Edwin E. (1996). "Models and Modelers of Hydrogen". American Journal of Physics. 65 (9): 933. Bibcode:1997AmJPh..65..933L. doi:10.1119/1.18691.
- ^ Perrin, Jean (1901). "Les Hypothèses moléculaires". La Revue scientifique: 463.
- ^ a b 드브로이 외 1912, 페이지 122–123.
- ^ a b c d Kragh, Helge (1 January 1979). "Niels Bohr's Second Atomic Theory". Historical Studies in the Physical Sciences. 10: 123–186. doi:10.2307/27757389. JSTOR 27757389.
- ^ a b c d Bohr, N. (July 1913). "I. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (151): 1–25. Bibcode:1913PMag...26....1B. doi:10.1080/14786441308634955.
- ^ Olsen, James D.; McDonald, Kirk T. (2005). "Classical lifetime of a bohr atom" (PDF). Archived (PDF) from the original on 2022-10-09.[셀프 published 소스?]
- ^ "CK12 – Chemistry Flexbook Second Edition – The Bohr Model of the Atom". Retrieved 30 September 2014.
- ^ Kragh, Helge (2012). Niels Bohr and the Quantum Atom: The Bohr Model of Atomic Structure 1913–1925. Oxford University Press. p. 18. ISBN 978-0-19-163046-0.
- ^ Rayleigh, Lord (January 1906). "VII. On electrical vibrations and the constitution of the atom". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 11 (61): 117–123. doi:10.1080/14786440609463428.
- ^ 드브로이 외 1912, 페이지 114.
- ^ a b c Heilbron, John L. (June 2013). "The path to the quantum atom". Nature. 498 (7452): 27–30. doi:10.1038/498027a. PMID 23739408. S2CID 4355108.
- ^ 드브로이 외 1912, 페이지 124.
- ^ 드브로이 외 1912, 페이지 127.
- ^ 드브로이 외 1912, 페이지 109.
- ^ 드브로이 외 1912, 페이지 447.
- ^ a b c Heilbron, John L.; Kuhn, Thomas S. (1969). "The Genesis of the Bohr Atom". Historical Studies in the Physical Sciences. 1: vi–290. doi:10.2307/27757291. JSTOR 27757291.
- ^ a b c Bohr, Niels (7 November 1962). "Niels Bohr – Session III" (Interview). Interviewed by Thomas S. Kuhn; Leon Rosenfeld; Aage Petersen; Erik Rudinger. American Institute of Physics.
- ^ Bohr, Niels (1 November 1962). "Niels Bohr – Session II" (Interview). Interviewed by Thomas S. Kuhn; Leon Rosenfeld; Aage Petersen; Erik Rudinger. American Institute of Physics.
- ^ a b Nicholson, J. W. (14 June 1912). "The Constitution of the Solar Corona. IL". Monthly Notices of the Royal Astronomical Society. Oxford University Press. 72 (8): 677–693. doi:10.1093/mnras/72.8.677. ISSN 0035-8711.
- ^ a b c McCormmach, Russell (1 January 1966). "The atomic theory of John William Nicholson". Archive for History of Exact Sciences. 3 (2): 160–184. doi:10.1007/BF00357268. JSTOR 41133258. S2CID 120797894.
- ^ Hirosige, Tetu; Nisio, Sigeko (1964). "Formation of Bohr's theory of atomic constitution". Japanese Studies in the History of Science (3): 6–28. OCLC 1026682346.
- ^ Heilbron, J. L. (1964). A History of Atomic Models from the Discovery of the Electron to the Beginnings of Quantum Mechanics (Thesis).
- ^ Wilson, William (November 1956). "John William Nicholson, 1881–1955". Biographical Memoirs of Fellows of the Royal Society. 2: 209–214. doi:10.1098/rsbm.1956.0014.
- ^ a b Bohr, Niels; Rosenfeld, Léon Jacques Henri Constant (1963). On the Constitution of Atoms and Molecules ... Papers of 1913 reprinted from the Philosophical Magazine, with an introduction by L. Rosenfeld. Copenhagen; W.A. Benjamin: New York. OCLC 557599205.[페이지 필요]
- ^ Stachel, John (2009). "Bohr and the Photon". Quantum Reality, Relativistic Causality, and Closing the Epistemic Circle. Dordrecht: Springer. p. 79.
- ^ Gilder, Louisa (2009). "The Arguments 1909—1935". The Age of Entanglement. p. 55.
Well, yes," says Bohr. "But I can hardly imagine it will involve light quanta. Look, even if Einstein had found an unassailable proof of their existence and would want to inform me by telegram, this telegram would only reach me because of the existence and reality of radio waves.
- ^ "Revealing the hidden connection between pi and Bohr's hydrogen model". Physics World. November 17, 2015.
- ^ Müller, U.; de Reus, T.; Reinhardt, J.; Müller, B.; Greiner, W. (1988-03-01). "Positron production in crossed beams of bare uranium nuclei". Physical Review A. 37 (5): 1449–1455. Bibcode:1988PhRvA..37.1449M. doi:10.1103/PhysRevA.37.1449. PMID 9899816. S2CID 35364965.
- ^ Bohr, N. (1913). "On the Constitution of Atoms and Molecules, Part II. Systems containing only a Single Nucleus". Philosophical Magazine. 26: 476–502.
- ^ Kragh, Helge (1 January 1979). "Niels Bohr's Second Atomic Theory". Historical Studies in the Physical Sciences. University of California Press. 10: 123–186. doi:10.2307/27757389. ISSN 0073-2672. JSTOR 27757389.
- ^ Bohr, N. (1 November 1913). "LXXIII. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (155): 857–875. Bibcode:1913PMag...26..857B. doi:10.1080/14786441308635031.
- ^ Nicholson, J. W. (May 1914). "The Constitution of Atoms and Molecules". Nature. 93 (2324): 268–269. Bibcode:1914Natur..93..268N. doi:10.1038/093268a0. S2CID 3977652.
- ^ Bury, Charles R. (July 1921). "Langmuir's Theory of the Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 43 (7): 1602–1609. doi:10.1021/ja01440a023.
- ^ a b Kossel, W. (1916). "Über Molekülbildung als Frage des Atombaus" [On molecular formation as a question of atomic structure]. Annalen der Physik (in German). 354 (3): 229–362. Bibcode:1916AnP...354..229K. doi:10.1002/andp.19163540302.
- ^ a b Kragh, Helge (2012). "Lars Vegard, atomic structure, and the periodic system" (PDF). Bulletin for the History of Chemistry. 37 (1): 42–49. OCLC 797965772. S2CID 53520045. Archived (PDF) from the original on 2022-10-09.
- ^ Langmuir, Irving (June 1919). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002.
- ^ Bohr, Niels (31 October 1962). "Niels Bohr – Session I" (Interview). Interviewed by Thomas S. Kuhn; Leon Rosenfeld; Aage Petersen; Erik Rudinger. American Institute of Physics.
- ^ Moseley, H.G.J. (1913). "The high-frequency spectra of the elements". Philosophical Magazine. 6th series. 26: 1024–1034.
- ^ M.A.B. Whitaker (1999). "The Bohr–Moseley synthesis and a simple model for atomic x-ray energies". European Journal of Physics. 20 (3): 213–220. Bibcode:1999EJPh...20..213W. doi:10.1088/0143-0807/20/3/312. S2CID 250901403.
- ^ van den Broek, Antonius (January 1913). "Die Radioelemente, das periodische System und die Konstitution der. Atome". Physikalische Zeitschrift (in German). 14: 32–41.
- ^ Dahl, Jens Peder; Springborg, Michael (10 December 1982). "Wigner's phase space function and atomic structure: I. The hydrogen atom ground state". Molecular Physics. 47 (5): 1001–1019. doi:10.1080/00268978200100752. S2CID 9628509.
- ^ A. Sommerfeld (1916). "Zur Quantentheorie der Spektrallinien". Annalen der Physik (in German). 51 (17): 1–94. Bibcode:1916AnP...356....1S. doi:10.1002/andp.19163561702.
- ^ W. Wilson (1915). "The quantum theory of radiation and line spectra". Philosophical Magazine. 29 (174): 795–802. doi:10.1080/14786440608635362.
- ^ Shaviv, Glora (2010). The Life of Stars: The Controversial Inception and Emergence of the Theory of Stellar Structure. Springer. p. 203. ISBN 978-3642020872.
- ^ Бор Н. (1970). Избранные научные труды (статьи 1909–1925). Vol. 1. М.: «Наука». p. 133.
- ^ Svidzinsky, Anatoly A.; Scully, Marlan O.; Herschbach, Dudley R. (23 August 2005). "Bohr's 1913 molecular model revisited". Proceedings of the National Academy of Sciences of the United States of America. 102 (34): 11985–11988. arXiv:physics/0508161. Bibcode:2005PNAS..10211985S. doi:10.1073/pnas.0505778102. PMC 1186029. PMID 16103360.
주출처
- Bohr, N. (July 1913). "I. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (151): 1–25. Bibcode:1913PMag...26....1B. doi:10.1080/14786441308634955.
- Bohr, N. (September 1913). "XXXVII. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (153): 476–502. Bibcode:1913PMag...26..476B. doi:10.1080/14786441308634993.
- Bohr, N. (1 November 1913). "LXXIII. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (155): 857–875. Bibcode:1913PMag...26..857B. doi:10.1080/14786441308635031.
- Bohr, N. (October 1913). "The Spectra of Helium and Hydrogen". Nature. 92 (2295): 231–232. Bibcode:1913Natur..92..231B. doi:10.1038/092231d0. S2CID 11988018.
- Bohr, N. (March 1921). "Atomic Structure". Nature. 107 (2682): 104–107. Bibcode:1921Natur.107..104B. doi:10.1038/107104a0. S2CID 4035652.
- A. Einstein (1917). "Zum Quantensatz von Sommerfeld und Epstein". Verhandlungen der Deutschen Physikalischen Gesellschaft. 19: 82–92. Albert Einstein, A. Engel 번역가, (1997) Princeton University Press, Princeton 6p. 434. (보어-소머펠트 양자화 조건의 우아한 재구성과 비적분(혼란적인) 동적 시스템의 양자화에 대한 중요한 통찰력을 제공합니다.)
- de Broglie, Maurice; Langevin, Paul; Solvay, Ernest; Einstein, Albert (1912). La théorie du rayonnement et les quanta : rapports et discussions de la réunion tenue à Bruxelles, du 30 octobre au 3 novembre 1911, sous les auspices de M.E. Solvay (in French). Gauthier-Villars. OCLC 1048217622.
더보기
- Linus Carl Pauling (1970). "Chapter 5-1". General Chemistry (3rd ed.). San Francisco: W.H. Freeman & Co.
- 재인쇄:
- George Gamow (1985). "Chapter 2". Thirty Years That Shook Physics. Dover Publications.
- Walter J. Lehmann (1972). "Chapter 18". Atomic and Molecular Structure: the development of our concepts. John Wiley and Sons. ISBN 0-471-52440-9.
- Paul Tipler and Ralph Llewellyn (2002). Modern Physics (4th ed.). W. H. Freeman. ISBN 0-7167-4345-0.
- 클라우스 헨첼: 엘렉트로넨바넨, 콴텐스프린게운스펙트렌, 인: 샬롯 빅 & 요헨 헤니그 (에드) 아톰빌더. 이코노그라피엔 데 아톰스 비센샤프트와 외펜트리히케이트 데 20. Jahrhunders, 괴팅겐: Wallstein-Verlag 2009, 페이지 51–61
- Steven and Susan Zumdahl (2010). "Chapter 7.4". Chemistry (8th ed.). Brooks/Cole. ISBN 978-0-495-82992-8.
- Kragh, Helge (November 2011). "Conceptual objections to the Bohr atomic theory — do electrons have a 'free will'?". The European Physical Journal H. 36 (3): 327–352. Bibcode:2011EPJH...36..327K. doi:10.1140/epjh/e2011-20031-x. S2CID 120859582.
외부 링크
- 보어의 원자모형에서 정상파-보어의 원자모드에서 정상파의 양자화 조건을 직관적으로 설명하기 위한 상호작용 시뮬레이션


 플랑크 상수입니다.
플랑크 상수입니다.








 궤도를 도는 전자의 각운동량입니다. 이 각운동량에 대해
궤도를 도는 전자의 각운동량입니다. 이 각운동량에 대해
















 전자(511keV)의 정지
전자(511keV)의 정지 









