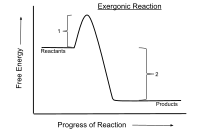
외기반응
Exergonic reaction화학적 열역학에서 외기 반응은 자유 에너지의 변화가 음(자유 에너지의 순 방출이 있음)인 화학 반응이다.[1] 이는 시스템이 폐쇄되고 초기 및 최종 온도가 동일할 경우 자발적인 반응을 나타낸다. 일정한 압력과 온도에서 닫힌 시스템에서 발생하는 공정의 경우, Gibbs 자유 에너지가 사용되는 반면, Helmholtz 에너지는 일정한 부피와 온도에서 발생하는 공정과 관련이 있다. 열역학 제2법칙에 따르면 전기 또는 광자 에너지의 입력 없이 일정한 온도에서 발생하는 모든 반응은 외기성이다. 그 예가 세포호흡이다.
상징적으로 외기 반응(일정한 압력 및 온도에서)에서 자유 에너지 G의 방출은 다음과 같이 표시된다.
외기 반응은 자연적으로 발생한다고는 하지만, 이것이 그 반응이 관측 가능한 속도로 일어날 것이라는 것을 의미하지는 않는다. 예를 들어 과산화수소의 불균형은 자유 에너지를 방출하지만 적절한 촉매가 없을 때는 매우 느리다. 이런 맥락에서 간절함이 보다 직관적인 용어가 될 것이라는 의견이 제기되었다.[2]
보다 일반적으로, 외기(exergonic)와 내기(endergonic)라는 용어는 화학적 반응뿐만 아니라 어떤 과정에서든 자유로운 에너지 변화와 관련이 있다. 이와는 대조적으로, 발열과 내열이라는 용어는 프로세스 중 닫힌 시스템의 엔탈피 변화와 관련이 있으며, 일반적으로 열 교환과 관련이 있다.
참고 항목
참조
- ^ IUPAC 골드 북 정의: 외기 반응(외기 반응)
- ^ Hamori, Eugene; James E. Muldrey (1984). "Use of the word "eager" instead of "spontaneous" for the description of exergonic reactions". Journal of Chemical Education. 61 (8): 710. Bibcode:1984JChEd..61..710H. doi:10.1021/ed061p710.