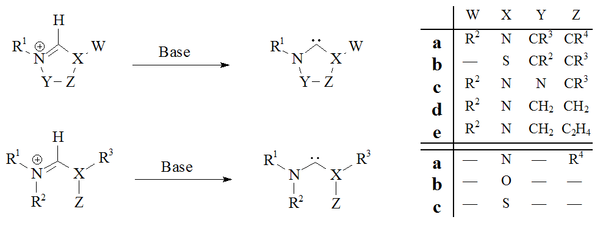
지속적 카베네
Persistent carbene지속적인 카베네(안정적인 카베네라고도 한다)는 특정한 안정성을 보여주는 카베네다.가장 잘 알려진 예와 훨씬 큰 부분군으로는 N-히터로시카베네(NHC)[1] (일명 아두엔고 카르베네)가 있으며, 예를 들어 일반 공식(RN2)2C가 있는 직경(dimmonocarbenes)이 있으며, 여기서 네 개의 R 모이에티는 일반적으로 알킬과 아릴 그룹이다.이 그룹들은 이미다졸레, 이미다졸린, 티아졸레 또는 트라이아졸레에서 파생된 것과 같은 이질성 카베네를 주기 위해 연결될 수 있다.
전통적으로 카르벤은 반응을 가두어 간접적으로만 연구된 반응성으로 간주된다.끈질긴 카르베네들의 등장으로 이 상황은 극적으로 달라졌다.비록 그것들이 상당히 반응하는 물질이지만, 조광화 과정을 거치면서, 많은 것들이 순수 물질로서 격리될 수 있다.
집요한 카베네는 싱글렛에 존재하는 경향이 있다.그들의 안정은 부분적으로 부피가 큰 그룹에 의한 강한 방해에 기인한다.어떤 싱클레트 카베네는 열역학적으로 안정적이며 격리되어 무기한 보관할 수 있다.다른 것들은 며칠에 걸쳐 서서히 희미해진다.트리플트 주 카베네는 반감기가 초 단위로 측정되므로 관찰은 가능하나 보관하지는 않는다.
역사
초기증거
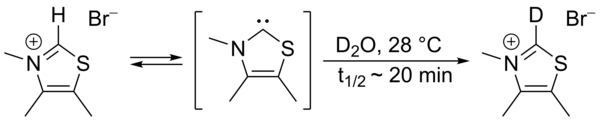
1957년 로날드 브레슬로는 비교적 안정된 핵탄두 카베네, 티아졸-2-ylidene 파생상품이 후르푸아민으로부터 퓨로인을 산출하는 비타민 B1(thiamine)의 촉매 순환에 관여한다고 제안했다.[2][3] 이 사이클에서 비타민 티아졸륨 링은 수소 원자(링의 탄소 2에 부착된 것)를 후르푸랄 잔여물과 교환한다.중수에서 C2-proton은 통계적 평형상태에서 중수소와 빠르게 교환되는 것으로 밝혀졌다.[4]
이 교환은 티아졸-2-ylidene의 매개체를 통해 진행되도록 제안되었다.2012년에 소위 브레슬로우 중간 기종의 격리가 보고되었다.[5][6]
1960년, 한스-워너 완즐릭과 동료들은 디히드로이미다졸-2-ylidene에서 파생된 카르베네가 클로로포름의 손실과 함께 상응하는 2-트리클로로메틸 디히드로이미다졸 화합물의 진공 열분해에 의해 생성되었다고 추측했다.[7][8][9] 그들은 카베인이 그것의 조광기, 테트라아미노에틸렌 유도체, 이른바 완즐릭 평형과의 평형 속에 존재한다고 추측했다.1964년 르말과 동료들이 이 추측에 도전했는데, 르말과 동료들은 조광기가 분리되지 않았다는 증거를 제시했고,[10] 1965년에는 윈버그가 이 추측에 도전했다.[11]그러나 덴크, 헤르만 등의 후속 실험에서는 비록 구체적인 상황이지만 이러한 평형을 확인했다.[12][13]
영구 카베네 분리
1970년, Wanzlick의 그룹은 이미다졸리움 소금의 감화를 통해 이미다졸-2-ylidene 카르베네스를 생성했다.[14]Roald Hoffmann뿐만 아니라 Wanzlick은 이러한 이미다졸 기반의 카르베네들은 Hukel형 방향성 때문에 4,5다이수드로 아날로그보다 더 안정적이어야 한다고 제안했다.[9][15]그러나 Wanzlick은 이미다졸-2-ylidenes를 분리하지 않고 대신 수은과 이소티오시아네이트와의 조정 화합물을 분리했다.
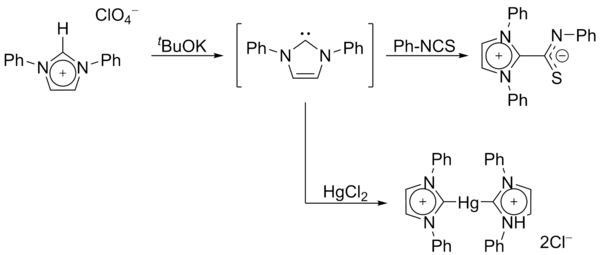
1988년 가이 베르트랑 등이 인광효소를 분리했다.이러한 종은 λ-인산인산소카르베네3 또는 λ-인산인산소세틸렌으로5 나타낼 수 있다.[16][17]
이 화합물들은 인과 실리콘 원자의 대조적인 전자 친화성을 언급하여 "푸시풀 카르베네"라고 불렸다.그들은 카르베닉과 알키닉 반응성을 모두 보여준다.이 분자의 X선 구조는 얻어지지 않았으며, 출판 당시에는 그들의 정확한 카르베닉 성질에 대해 약간의 의심이 남아 있었다.
1991년, 아두엔고와 동료들은 이미다졸륨 양이온의 감소를 통해 직격탄을 맞았다.[18]
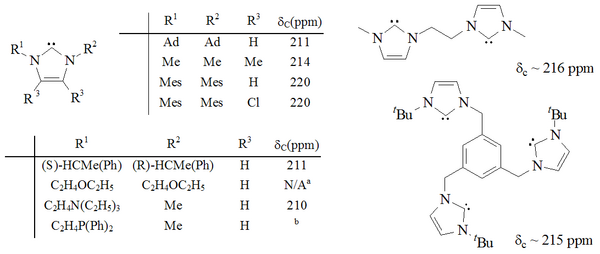
이미다졸-2-ylidene 코어를 가진 많은 카베네의 선구자인 이 카베네는 산소와 수분이 없는 상태에서 상온에서 무한정 안정되어 있다.분해 없이 240–241 °C에서 녹는다.C NMR 스펙트럼에는 카르베닉 원자의 경우 211ppm의 신호가 나타난다.[19]X선 구조는 카베인의 링에서 모체 이미다졸륨 화합물보다 더 긴 N-C 결합 길이를 나타냈으며, 이러한 결합에는 거의 이중 결합 특성이 없음을 보여준다.[20]
아이미다졸-2-이리덴 계열의 염소 처리된 구성원인 공기안정성 이리딕 카베네는 1997년에 처음 획득되었다.[21]
베르트랑은 2000년에 (인산염)(트리플루오로메틸)카르베네를 추가로 취득하였으며, -30[22]℃에서 용액이 안정적이며 카르베닉 원자와 인접한 이형 원자가 하나만 있는 적당히 안정된(아미노)(아릴)카르베네를 얻었다.[23][24]
이형 원자탄 안정화 카베네의 안정성에 영향을 미치는 요인
강직 장애물
아두엥고 카르베네스의 안정성은 처음에는 N-아다만틸 대체재가 부피가 커서 견고한 장애로 인해 카베네가 희미해지는 것을 방지했기 때문이다.N-아다만틸 그룹을 메틸 그룹으로 대체하는 것도 안정적인 NHC를 제공한다.[25]따라서 이미다졸-2-ylidene은 열역학적으로 안정적이다.
방향족 참여
또한 그 시스템에 방향성을 부여한 이미다졸륨 고리 등뼈의 4번과 5번 탄소의 이중 결합이 카베인의 안정성을 위해 중요하다고 추측되어 왔었다.이러한 추측은 1995년 디하이드로이미다졸-2-ylidene의 파생상품을 취득한 아두엔고 그룹이 이중결합이 결여된 것에 의해 반증되었다.[26]이 화합물의 열역학적 안정성과 조광 방지에서 강체 보호의 역할은 일부 논쟁의 대상이 되어 왔다.[27][28]
링 참여
최초의 반복적인 영구적인 카베인은 1996년에 보고되었고,[29] 따라서 주기적인 등뼈가 그들의 안정성을 위해 필요하지 않다는 것을 보여주었다.주기적인 파생 모델과는 달리, 주기적인 카베네는 카베닉 원자에 대한 결합 회전과 관련하여 유연하다.이러한 채권의 회전에 대한 장벽을 측정함으로써 이중 결합 성격의 범위를 측정할 수 있었고, 이 카베인의 ylidic 성질을 결정할 수 있었다.순환직경직경처럼, 방해받지 않는 변형은 약해지는 경향이 있다.[28][30][31]
질소참가
대부분의 집요한 카베네는 2개의 측면 질소 센터에 의해 안정화된다.아미노티오카르베네와 아미노옥시카르베네는 특출한 것이다.[32][33]이러한 안정적인 화합물에서 카르베닉 원자는 질소 원자와 황 또는 산소 원자 사이에 위치한다.
NHC와 달리 이러한 카르벤은 열역학적으로 안정적이지는 않지만 약해지는 경향이 있다.
상온에서 안정된 bis(diisopropylamino)사이클로프로페닐리덴에서 카베네 원자는 두 개의 탄소 원자와 연결되어 시클로프로페닐리덴 고리의 방향성과 기하학적 구조를 유지한다.이 사례는 카베네 옆에 있는 이단계의 존재도 안정성을 위해 필요하지 않음을 증명하였다.[34]
분자 궤도 및 영구 카베네
마지막 예는 이러한 화합물들이 결국 왜 (메타)안정성이 있는지에 대한 질문에 대한 대답을 엿볼 수 있다.그것은 또한 유기화학에서 루이스 구조물의 사용의 한계에 약간의 시력을 제공한다.
탄소배출량
이 경우 카베네 탄소의 빈 p-오르비탈은 전혀 비어 있지 않다.그것은 두 개의 전자가 차지하는 분자 궤도 안에 포함된다.이 궤도 내 카베네 중심에서 전자 밀도는 추정 값이 1(1/3)이다.따라서 탄소 발란스 궤도에서의 전자의 총 카운트는 다른 링 카본에 대한 2 ³의 4개, 단독 쌍의 2개, 방향족 분자 궤도 내 1(1/3)로, 필요한 8개보다 약간 적은 7개(1/3)까지만 추가된다.따라서 카베네 탄소가 적어도 6개의 전자만을 운반한다고 말하는 것은 정확하지 않다.
이미다졸 기반 카르베네스
이미다졸에서 파생된 카르벤의 경우에도 마찬가지다.카베네 중심부의 "사용되지 않은" p-오르비탈은 6개의 전자, 각 참여 질소 p-오르비탈에서 2개, 각 탄소에서 1개로 구성된 방향족 구조의 일부로서 5개의 막으로 된 링에서 분해된다.여기서도 카베네 센터 p-오르비탈의 전자 밀도는 1보다 다소 클 것이다.다시 말하지만, 적어도 카베네 센터에 6개의 전자만을 주장하는 것은 정확하지 않다.
디아미노 카르베네스

이미다졸 링의 4번과 5번 탄소에 포화상태 또는 링 구조의 부족은 모두 두 개의 인접한 질소 원자를 카베네 중심부에 남겨둔다.루이스 구조로 분자를 그려 국부적 결합만 허용하면 카베네 중심에는 6개의 전자만 남게 된다.그러나 분자 구조는 세 개의 원자를 연속적으로 포함하고 있는데, 그 중 두 개의 원자인 니트로겐은 한 쌍의 전자쌍을 가지고 있고 세 번째 원자에는 빈 p-오르비탈이 있다.이것은 전자의 국소화 해제와 같은 동맹국으로 가는 길을 열어준다.오른쪽 그림에서, 비록 진정한 동맹 분자로부터 빌린 것이지만, 그러한 시스템의 MO는 보여진다.다시 말해 카베네 센터가 이 궤도 안에서 전자 밀도를 운반한다는 것이 분명하고, 카베네 센터에 적어도 6개의 전자가 있다고 주장하는 것은 정확하지 않다.
결론
이제 최종적인 질문에 대한 논거는 왜 이런 카베인이 적어도 구조 (메타)와 같이 안정적일까이다.
이 화합물들은 그들의 루이스 구조물이 카베네 중심에서 6개의 전자만을 보여주기 때문에 카르베네라고 불린다.현실은, 이러한 화합물의 탄소 원자와 같은 카베네는 단순한 루이스 구조물이 예측하는 것보다 더 큰 전자 밀도를 가지고 있다.카베네 센터의 전자 격차를 최소한 부분적으로 채울 수 있는 전자 기부 환경과 결합하면 화합물을 안정화시킬 수 있는 충분한 에너지가 발견된다.
안정화 카베네 등급
다음은 현재까지 격리된 안정화 카베네 등급의 예들이다.
이미다졸-2-이리데네스
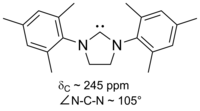
격리된 최초의 안정된 카베네는 이미다졸 고리에 바탕을 두고 있었는데, 고리의 탄소 2(두 질소 원자 사이)에 있는 수소가 제거되었고, 다른 하이드로겐은 다양한 집단으로 대체되었다.이 이미다졸-2-ylidenes는 여전히 가장 안정적이고 가장 잘 연구되고 이해되는 집단의 집요한 카르베네 가족이다.
1,3-positions가 알킬, 아릴,[25] 알킬록시, 알킬라미노, 알킬포시노[35] 그리고 심지어 치랄 대체물로 기능화된 것을 포함하여 상당한 범위의 이미다졸-2-ylidene이 합성되었다.[35]
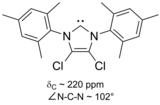
특히 링 위치 4와 5에서 두 개의 수력발전소에 대한 두 개의 염소 원자를 대체한 결과 최초의 공기안정성 카베인이 나왔다.[21]그것의 추가적인 안정성은 시그마 백본을 통한 유도를 통해 한 쌍이 있는 탄소 원자의 전자 밀도를 감소시키는 염소 대체물의 전자 인출 효과에서 비롯될 것이다.
두 개의 이미다졸-2-ylidene 그룹 그리고 심지어 세 개의 이미다졸-2-ylidene 그룹을 포함하는 분자도 합성되었다.[36][37]
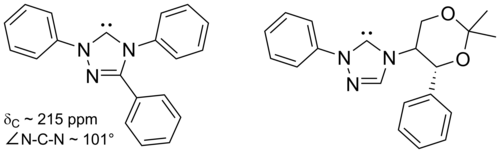
이미다졸 기반의 카르베네는 열역학적으로 안정적이며 일반적으로 카르베닉 카본에 대한 진단 C NMR 화학 이동 값이 210 - 230ppm이다.일반적으로 이러한 분자의 X선 구조는 101–102°의 N–C–N 결합 각도를 나타낸다.
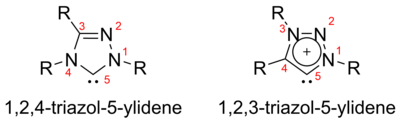
트라이아졸-5일리데네스
3개 질소 원자의 triazol-5-ylidene의 배열에 따라 두 개의 가능한 이소머 즉, 1,2,3-triazol-5-ylidene과 1,2,4-triazol-5-ylidene이 있다.
아래에는 1,2,4-트리아졸 링을 기반으로 한 트라이아졸-5-ylidenes가 그려져 있으며, 2-메톡시트리올의 메탄올 분실을 통해 엔더스와[38] 동료들이 진공 열분해 방식으로 처음 준비했다.트리페닐 대체 분자가 상업적으로 사용 가능한 가운데 이러한 분자의 제한된 범위만이 보고되었다.
트라이아졸 기반의 카베네는 열역학적으로 안정적이며 카베닉 카본의 경우 진단 C NMR 화학 이동 값이 210~220ppm이다.위의 트리페닐 대체 카베네의 X선 구조는 약 101°의 N–C–N 결합 각도를 보여준다.이 카베네의 5메톡시트리올 전구체는 메톡시드나트륨을 이용한 트라이아졸륨 염을 치료하여 만든 것으로 핵성분으로서 공격한다.[38]이는 이미다졸-2-ylidenes보다 이 카르베네가 덜 향기롭다는 것을 나타낼 수 있는데, 이는 이미다졸륨 전구체가 결과적으로 방향성이 상실되어 핵포체와 반응하지 않기 때문이다.
기타다이아미노카베네
위의 두 집단은 두 개의 질소 원자를 연결하는 카르베닉 원자를 가진 보다 광범위한 화합물의 특별한 경우로 볼 수 있다.그러한 일련의 직경들은 주로 Roger Alder의 연구 그룹에 의해 준비되었다.이러한 화합물들 중 일부에서 N-C-N 장치는 자전거 예시를 포함하여 [26][27][39]5-6membed의 비자동 링의 회원이다.다른 예에서, 인접한 니트로겐은 카르베닉 원자를 통해서만 연결되며, 별도의 링의 일부가 될 수도 있고 아닐 수도 있다.[29][30][31]
방향족 이미다졸-2-ylidenes 또는 triazol-5-ylidenes와는 달리, 이러한 카르베네들은 열역학적으로 안정적이지 않은 것으로 보인다. 이는 일부 비혼합성 주기 및 순환 사례의 조광화에서 알 수 있다.[27][30]연구[28] 결과에 따르면 이러한 카르벤은 산성 강직성 조광화를 통해 조광화된다(완즐릭 평형에서와 같이).
Diaminocarbenes에는 카르베닉 원자에 대한 진단 C NMR 화학 시프트 값이 230 - 270ppm이다.디히드로이미다졸-2-ylidene의 X선 구조는 N–C–N 본드 각도가 약 106°인 반면, Acyclic carbene의 각도는 모두 121°로 이미다졸-2-ylidene에서 볼 수 있는 각도보다 크다.
헤테로아미노 카르베네스
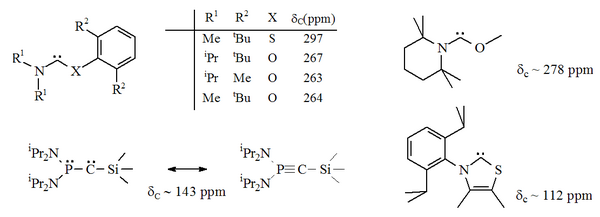
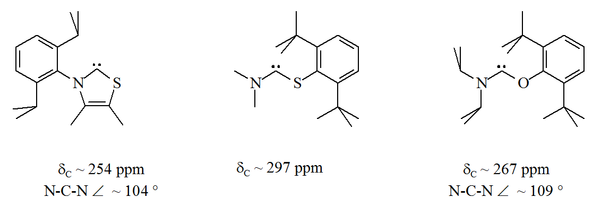
카베네 센터에 인접한 질소 원자(α 니트로겐) 중 하나가 산소, 황 또는 인과 같은 대체 이질 원자로 대체된 곳에는 위쪽의 여러 가지 안정적인 카베네 변종이 존재한다.[16][17][32][33]
특히 이미다졸에 있는 니트로겐 중 하나에 대한 유황의 공식 대체는 방향성 헤테로사이클릭 화합물 티아졸을 산출할 것이다.티아졸을 기반으로 한 카르베네(Breslow가 가정하는 카르베네와 유사함)[40]가 X선 결정학에 의해 준비되고 특성화되었다.[32]O, S 및 P 원자가 카베네 중심과 인접한 다른 비-아미노카베네(즉, 알파)는 준비되었다. 예를 들어, 티오 및 옥시미늄 기반 카베네는 X선 결정학에 의해 특징지어졌다.[33]
산소와 유황은 불량이므로 특히 N-C-X 장치가 링의 일부인 경우 카르베닉 중심부의 장력 보호가 제한된다.이러한 순환 카베네에는 카베닉 카본에 대한 진단 C NMR 화학 이동 값이 250~300ppm으로, 다른 어떤 종류의 안정 카베네보다 훨씬 아래쪽에 있다.X선 구조물은 각각 약 104°와 109°의 N–C–X 결합 각도를 보였다.
두 α-니트로겐에 대해 유황, 산소 또는 다른 찰코겐을 대체하여 아이미다졸-2-ylidene에서 공식적으로 유래하는 카르베네는 알키네(RCR12)와 탄소 이칼코겐화(X1=C=X2)로 분리될 가능성이 있기 때문에 불안정할 것으로 예상된다.[41][42]
논아미노 카르베네스
전자 결핍 아세틸렌 유도체를 가진 이황화탄소(CS2)의 반응은 과도 1,3-디티올륨 카르베네(즉1, X2 = S)를 준 다음 테트라시아풀베네(Tetrathiafulvene)의 유도체를 희석시키기 위해 제안된다.따라서 이 과정의 역행은 유사한 카르베네에서 발생할 수 있다.[41][42]
베르트랑 카베네스
베르트랑의 집요한 카베네에서 불포화탄소는 인과 실리콘에 결합된다.[43]그러나, 이러한 화합물들은 약간의 알키닉 성질을 보이는 것 같다. 그리고 출판되었을 때, 이 붉은 기름의 정확한 카베닉 성질이 논쟁 중에 있었다.[17]
기타 핵탄두 카베네
하나의 안정적인 N-헤로사이클릭 카베네는[44] 하나의 붕소 원자를 메틸렌 그룹으로 대체한 채 보라진과 유사한 구조를 가지고 있다.이것은 평면 6 전자 화합물을 만든다.
사이클로프로페닐리덴
또 다른 카르베네 계열은 사이클로프로페닐리덴 코어(cyclopropenylidene core)에 바탕을 두고 있는데, 카베닉과 인접한 두 원자 사이에 이중 결합이 있는 3탄소 고리(cyclopropenylidene core)이다.이 가문은 bis(diisopropylamino)사이클로프로페닐리딘으로 대표된다.[34]
트리플트 주 카베네스
2001년, 토미오카 히데오와 그의 동료들은 전자 소산화를 이용하여 비교적 안정된 트리플트 카르베네(bis(9안트릴) 카르베네, 반감기가 19분)를 생산할 수 있었다.[45][46]
아래 그림은 하나의 평면에 있는 분자의 ~ 부분을 나타내지만, 분자 기하학은 두 방향의 부분을 서로에 대한 직교 위치에 놓는다.
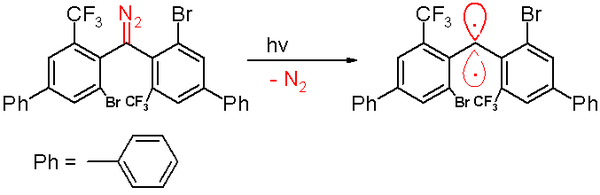
2006년에는 같은 그룹에 의해 40분의 반감기를 가진 트리플 카베인이 보고되었다.[47]이 카베네는 질소 가스의 배출과 함께 벤젠에서 디아조메탄 전구체를 300nm 빛으로 광화학적으로 분해하여 제조한다.
다시 말하지만 아래 그림은 실제 분자 구조를 적절하게 표현하지 못한다. 두 페닐 링은 서로에 대해 직교하는 위치에 있다.카베네 탄소는 sp-하이브리지를 가지며, 남은 두 개의 직교 p-orbital은 각각 방향족 고리 중 하나와 결합한다.
산소에 노출되면 이 카베네가 상응하는 벤조페논으로 바뀐다.디페닐메탄 화합물은 사이클로헥사-1,4-다이엔에 의해 갇힐 때 형성된다.다른 카르베네와 마찬가지로, 이 종은 카베네를 보호하고 1,1,2,2-테트라(페닐)알켄으로 조광되는 과정을 방지하거나 속도를 늦추는 큰 부피가 큰 대체 물질인 브롬과 페닐 링에 있는 트리플루오로메틸을 함유하고 있다.컴퓨터 시뮬레이션을 바탕으로 이웃에 대한 분리 탄소 원자의 거리는 138 피코미터로, 결합 각도는 158.8°라고 한다.페닐 그룹의 평면은 서로 거의 직각이다(이면각은 85.7°).
메소이온 카르베네스
MIC(Mesoionic Carbenes)는 표시된 카베네가 있는 표준 공명 구조는 추가 전하를 추가하지 않고는 그릴 수 없다는 점을 제외하면 NHC(N-heterocyclic Carbenes(Mesoionic Carbenes, MICs)는 NHCs와 유사하다.중이온성 카르벤은 비정상 N-히터사이클 카벤(aNHC) 또는 원격 N-히터사이클 카벤(rNHC)이라고도 한다.다양한 무료 카베네를 분리할 수 있으며 상온에서도 안정적이다.다른 무료 카르벤은 안정적이지 않고 분자간 분해 경로에 취약하다.
화학적 특성
기본성과 핵소독성
이미다졸-2-ylidene은 강력한 베이스로, DMSO(Dimethyl sulfoxiden, Dimethyl sulfoxiden, DMSO)의 결합산 pKa ≈ 24를 가지고 있다.[48]
그러나, 추가 연구 결과, 디아미노카베네스는 DMSO 용제를 감압할 것이며, 그 결과 음이온이 그 결과 아미듐소금과 반응할 것이라는 것을 보여주었다.
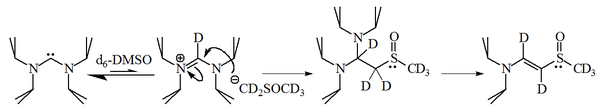
이미다졸-2-ylidenes와 1-브로모헥산느의 반응으로 2-대신 인덕트의 90%가 주어졌고, 그에 상응하는 알켄의 10%만이 주어졌으며, 이 분자들 역시 합리적으로 핵성인 것을 알 수 있었다.
몇몇 NHC 계열의 결합산에 대한 pKa 값은 수용액에서 검사되었다. pKa 값은 관련 이미다졸륨 이온보다 약 3 pKa 단위 산도가 높은 16.5~17.8 범위에 있다.[49][50]
조광화
한때, 안정된 카르베네는 소위 완즐릭 평형을 통해 역적으로 희미해진다고 생각되었다.그러나 이미다졸-2-ylidenes와 트라이아졸-5-ylidenes는 열역학적으로 안정되어 희미해지지 않으며, 수년간 물과 공기가 없는 상태에서 용액에 저장되어 왔다.이것은 아마도 이러한 카르베네들의 방향성 때문이며, 그것은 조광화 시 상실된다.사실 imidazol-2-ylidene은 열역학적으로 매우 안정적이어서 매우 제약이 심한 조건에서만 이러한 카르베네들은 빛을 약하게 할 수 밖에 없다.
첸과 타톤은[51] 각각의 다이미다졸륨 소금을 감압하여 이중 테더로 된 디미다졸-2-ylidene을 만들었다.짧은 메틸렌 브리지(–CH2–)와 이중 테더로 연결된 디이미다졸륨 소금의 감화만이 디카베네어 디카베네 디머 다이머를 낳았다.
만약 이 조광기가 디카르베네로 존재한다면, 카베닉 카본의 전자 단독 쌍은 가까운 곳에 있을 수밖에 없을 것이다.아마도 그 결과로 유발되는 정전기적 상호작용은 상당한 불안정한 영향을 미칠 것이다.이러한 전자적 상호작용을 피하기 위해 카베네 유닛은 디메인한다.
반면, 헤테로아미노 카르베네(RN-C2–OR 또는2 RN-C–SR 등)와 직경 카베네(RN2–C–NR 등)와 같은 비-자율 카베네(RN–C–NR2)는 상당히 느리지만 [52]희미해지는 것으로 나타났다.이는 싱글릿 상태 조광화에 대한 높은 장벽 때문이라고 추정되었다.
디아미노카르베네스는 진정 희미하게 만드는 것이 아니라 양성자 전구종인 포마미디늄 염을 통한 반응에 의해 조광기를 형성한다.[28]따라서, 이 반응은 산성 촉매제가 될 수 있다.이 반응은 이미다졸륨 기반의 카르베네와 달리 카베네 양성에서 방향성의 손실이 없기 때문에 발생한다.
트리플릿 주 카베네의 조광화와 달리, 이러한 싱글릿 주 카베네는 정면으로 접근하지 않고("최소 운동") 카베니 주 카베네 한 쌍이 빈 탄소 p-오르비탈("최소 운동")을 공격한다.카베네 조광화는 산과 금속 둘 다에 의해 촉매될 수 있다.
반응도
안정적인 카베네들의 화학성분은 아직 충분히 탐구되지 않았다.그러나 Enders 외.[38][53][54]삼아졸-5-ylidene과 관련된 다양한 유기농 반응을 수행했다.이러한 반응은 아래에 간략히 설명되어 있으며 다른 카르베네에 대한 모델로 간주될 수 있다.

| a | 3,6-162-헤닐-1,2,4,5-헤라진, 톨루엔 | 92% | e | 2 equiv, PhNCO, 톨루엔, 환류 | 92% | |
|---|---|---|---|---|---|---|
| b | RXH, RT | 95–97% | f | CS2, 톨루엔 또는 PhNCS, THF, RT | 71–90% | |
| c | O28, S, 또는 Se, 톨루엔, 환류 | 54–68% | g | 말레미드, THF, RT | 47–84% | |
| d | R1CH=CHR2, THF, RT | 25–68% | h | 디메틸아세틸렌디카르복실산, THF, 환류 | 21% |
이러한 카르베네들은 단순한 탈색뿐만 아니라 삽입 반응 (b), 첨가 반응 (c), [2+1] 사이클로아데이션 (d, g, h), [4+1] 사이클로아데이션 (a)을 수행하면서 핵포틸론적인 방식으로 행동하는 경향이 있다.삽입 반응 (b)은 아마도 감응을 통해 진행되며, 생성된 소금을 공격할 수 있는 핵소금(−XR)이 생성되어 H-X 삽입의 인상을 준다.
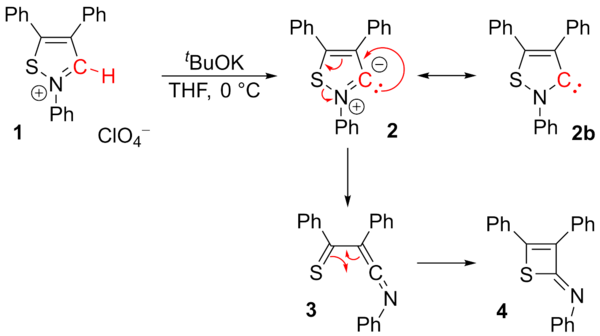
보고된 안정적인 이소티아졸레 카르베네(2b)는 과염소산 이소티아졸륨(1)에서 [55]추출한 것으로 조사되었다.[56]연구진은 2-이미노-2H-thiete(4)만 분리할 수 있었다.중간 3은 재배열 반응을 통해 제안되었다.카베네 2b는 더 이상 안정적이라고 여겨지지 않는다.[57]
카베네이션 콤플렉스
이미다졸-2-ylidenes, triazol-5-ylidenes (그리고 그 이하, diaminocarbenes)는 알칼리 금속, 주요 그룹 원소, 전이 금속, 심지어 란타니드 및 작용제로부터 다수의 원소들과 조정되는 것으로 나타났다.주기적인 원소 표는 준비된 콤플렉스에 대한 아이디어를 제공하며, 많은 경우 이것들은 단일 결정 X선 결정학에 의해 확인되었다.[39][58][59]안정적인 카베네는 금속과의 조정 특성에서 유기인산염과 유사한 방식으로 작용한다고 여겨진다.이들 리간드는 카베닉 단독쌍을 통해 σ-기증자가 좋다고 하지만 카베네 중심과 인접한 질소 원자의 내부 리간드 백-기증 때문에 빈약한 accept-수용체여서 상대적으로 전자 결핍 금속에도 조응할 수 있다.엔더스와 헤르만은[61][62] 이러한 카르베네가 여러 촉매 사이클에서 인산 리간드에 적합한 대체물이라는 것을 보여주었다.그들은 이러한 리간드가 인산 리간드만큼 금속 촉매를 활성화하지 않는다는 것을 발견했지만, 종종 더 강력한 촉매를 초래한다.헤르만과 엔더스는 이미다졸과 트라이아졸 카르베네 리간드를 함유한 촉매제를 사용하여 여러 촉매 시스템을 조사했으며, 중간 정도의 성공을 거두었다.[58][60][61][62]Grubbs는 올레핀 전이 촉매 RuCl2(PCy3)2C에서 인광 리간드(PCy3)를 이미다졸-2-ylidene으로 대체했다고 보고하였다.HPh는 링 클로징 메타텍스 증가와 더불어 "놀라운 공기와 물의 안정성"을 보여 주었다.카베네 모이티 2개와 3개의 카베네 모이티(carbene moieties)를 함유한 분자가 잠재적 바이덴테이트(bidentate)[36][37]와 트리덴테이트(tri
| 그룹 → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ 기간 | ||||||||||||||||||||
| 1 | 1 H | 2 그 | ||||||||||||||||||
| 2 | 3 리 | 4 있다 | 5 B | 6 C | 7 N | 8 O | 9 F | 10 네 | ||||||||||||
| 3 | 11 나 | 12 MG | 13 알 | 14 SI | 15 P | 16 S | 17 CL | 18 아르 | ||||||||||||
| 4 | 19 K | 20 CA. | 21 sc | 22 티 | 23 V | 24 CR | 25 Mn | 26 Fe | 27 Co. | 28 니 | 29 CU | 30 Zn | 31 가 | 32 Ge | 33 로서 | 34 SE | 35 BR | 36 크르 | ||
| 5 | 37 Rb | 38 SR | 39 Y | 40 Zr | 41 Nb | 42 모 | 43 TC | 44 루 | 45 RH | 46 피디 | 47 AG | 48 cd | 49 인 | 50 Sn | 51 SB | 52 Te | 53 I | 54 세 | ||
| 6 | 55 Cs | 56 BA | 71 루 | 72 Hf | 73 타 | 74 W | 75 레 | 76 Os | 77 Ir | 78 PT | 79 Au | 80 Hg | 81 Tl | 82 PB | 83 비 | 84 포 | 85 에서 | 86 Rn | ||
| 7 | 87 FR | 88 라 | 103 Lr | 104 RF | 105 db | 106 sg | 107 BH | 108 HS | 109 MT | 110 Ds | 111 RG | 112 씨엔 | 113 NH | 114 플 | 115 맥 | 116 LV | 117 TS | 118 Og | ||
| 57 라 | 58 CE | 59 PR | 60 ND | 61 PM | 62 sm | 63 Eu | 64 Gd | 65 TB | 66 DY | 67 호 | 68 음.정말 | 69 TM | 70 Yb | |||||||
| 89 Ac | 90 TH | 91 파 | 92 U | 93 Np | 94 PU | 95 암 | 96 CM | 97 Bk | 98 cf | 99 에스 | 100 FM | 101 md | 102 아니요. | |||||||
- 레전설
- 요소가 알려진 카베네 콤플렉스
- 요소가 알려진 카베네 콤플렉스는 없음
유기물 화학 및 촉매 내 카르베네
카베네는 유기농법으로 안정될 수 있다.이러한 전환 금속 카베네 단지는 다음 두 가지 범주로 분류된다.
- 카베네가 금속과 전자 인출 그룹(일반적으로 카보닐)에 매여 있는 피셔 카베네,
- 슈록 카베네: 카베네들이 금속과 전자 기부 그룹에 묶여 있다.그런 카르벤이 참여하는 반응은 유기 카르벤이 참여하는 것과 매우 다르다.
트리플트 주 카베네 화학
영구적인 트리플트 주 카베네는 다른 비영구적인 트리플트 주 카베네와 매우 유사한 반응성을 가질 가능성이 있다.
물리적 성질
현재까지 격리된 카베네는 녹는점이 낮은 무색의 고체인 경향이 있다.이 카베네들은 높은 진공 상태에서 낮은 온도에서 숭상하는 경향이 있다.
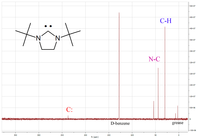
보다 유용한 물리적 특성 중 하나는 C-NMR 스펙트럼에서 카르베닉 탄소 원자의 진단 화학적 이동이다.일반적으로 이 피크는 C-NMR 스펙트럼에 다른 피크가 거의 나타나지 않는 200~300ppm 범위에 있다.카베닉 피크가 238ppm인 순환 직경 편익에 대한 예가 왼쪽에 나타난다.
금속중심으로의 조정에 의해 C 카르베네 공명은 복잡한 파편의 루이스 산성에 따라 보통 하이필드(high field)를 이동한다.Huynh 외 연구진은 이러한 관찰을 바탕으로 트랜스 팔라듐(trans-palladium)의 C NMR 분석에 의해 리간드 기증자 강도를 결정하는 새로운 방법론을 개발하였다.II)-카르베인 복합체C 라벨이 부착된 N-heterocyclick carbene ligand를 사용하면 트랜스퍼 효과로 시스 이소머화를 겪는 혼합 카베네-인산 복합체에 대한 연구도 가능하다.[64]
적용들
NHC는 유기농 화학에서 보조 리간드로 널리 사용된다.한 가지 실용적인 적용은 루테늄 기반의 그럽스의 촉매와 교차 결합 반응을 위한 NHC-팔라듐 콤플렉스다.[65][66][67]NHC 금속 복합체, 특히 Ag(I)-NHC 복합체는 생물학적 적용에 대해 광범위하게 시험되어 왔다.[68]
준비 방법
NHC는 종종 매우 기초적이며(이미다졸-2-ylidene의 결합산의 pKa 값은 ca. 24에서 측정되었다)[48] 산소와 반응한다.분명히 이러한 반응은 공기 없는 기법을 사용하여, 심지어 중간 산도의 화합물도 피한다.이미다졸륨염은 핵포함염에 대해 안정적이지만, 다른 비자율염은 그렇지 않다(즉, 포름아미디늄염).[69]
이 경우 강력한 비파괴 핵물질은 현장에서 생성되거나 다른 시약(BuLi의 LiOH 등)에서 불순물로 존재하는지를 피한다.
안정적인 카베네를 준비하기 위해 몇 가지 접근법이 개발되었는데, 이 접근법은 아래에 요약되어 있다.
디프로토네이션
기초가 튼튼한 카르베네 전구 염의 감응은 거의 모든 안정적인 카르베네로 가는 믿을 수 있는 경로임이 입증되었다.
이미다졸-2-ylidenes와 디히드로이미다졸-2-ylidenes는 각각의 이미다졸륨과 디히드로이미다졸륨염의 디프로토닝에 의해 준비되었다.순환식 카르베네와[29][30] 테트라히드롭리미디닐[39] 기반 카르베네들은 강한 균질 베이스를 이용한 디프로토닝에 의해 준비되었다.
여러 베이스와 반응 조건이 다양한 성공으로 채택되었다.성공의 정도는 주로 타락한 전구체의 성격에 의존해 왔다.이 준비 방법의 주요 단점은 준비 시 사용되는 금속 이온으로부터 자유 카베네를 분리하는 문제다.
금속 하이드라이드 베이스
어떤 사람들은 나트륨이나 수산화칼륨이[26][32] 이러한 전구 염분을 고갈시키는 이상적인 기반이 될 것이라고 믿을 수 있다.하이드라이드는 원하는 카베인을 얻기 위해 수소의 손실과 함께 불가역적으로 반응해야 하며, 무기 부산물과 과잉 하이드라이드는 여과로 제거되어야 한다.실제로 이 반응은 DMSO 또는 t-BuOH를 추가해야 하는 너무 느린 경우가 많다.[18][25]이 시약들은 수용성 촉매를 생성하는데, 이는 테르트-부타산화물 또는 딤실 음이온의 생성을 통해 이 이질적인 시스템의 반응 속도를 증가시킨다.그러나 이러한 촉매들은 전구 염에 대해 핵소재로 작용하는 경향이 있고 그렇게 함으로써 파괴되기 때문에 비이미다졸륨 유도체의 준비에 비효과적인 것으로 판명되었다.수산화 이온이 금속 하이드라이드에 불순물로 존재하면 비-자율 염류도 파괴할 수 있다.
-40 °C에서 액체 암모니아/THF 혼합물에 나트륨 또는 수화물 칼륨을 사용한 디프로토닝이 이미다졸 기반 카르벤에 대해 보고되었다[35].아두엔고와 동료들은[32] 간신히 NaH를 이용해 디하이드로히미다졸-2-ylidene을 준비했다.단, 이 방법은 직경(diaminocarbenes)의 준비에는 적용하지 않았다.테르트-부토산화칼륨을 금속 하이드라이드를 첨가하지 않고 사용할 수 있는 경우도 있다.[25]
알킬리튬
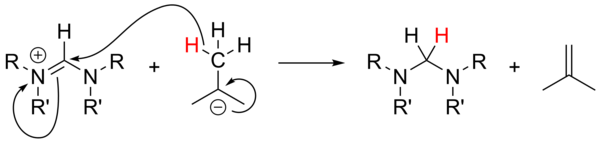
알킬리튬을 튼튼한 베이스로[18] 사용하는 것은 광범위하게 연구되지 않았으며, 전구 염의 감응에 대해 신뢰할 수 없었다.n-BuLi와 PhLi는 비-자율염으로 핵물질 역할을 할 수 있고, t-BuLi는 때때로 하이드라이드의 원천 역할을 할 수 있어 이소부틴 생성과 함께 소금을 줄일 수 있다.
아미데스 베이스
디이소프로필아미드(LDA) 및 테트라메틸피페리디드(LiTMP)[29][30]와 같은 리튬 아미드는 리튬 아미드를 만드는 데 사용되는 n-butyllithium에 LiOH가 너무 많이 존재하지 않는다면 일반적으로 모든 종류의 염의 디프로톤화에 효과가 좋다.리튬 아미드의 적정화는 용액 내 수산화물의 양을 결정하는 데 사용될 수 있다.금속 헥사메틸디실라지드를[39] 사용한 전구 염의 디프로토닝은 이 베이스가 트라이아미노메탄 인덕트를 주는 핵소재의 역할을 할 수 있는 무힌드 포마미디늄 염을 제외한 모든 종류의 염의 디프로토닝에 매우 깨끗하게 작용한다.
무금속 카베네 제제

금속 양이온에서 자유로운 안정적인 카베네의 준비는 이러한 금속으로부터 격리된 카베네 종에 대한 추가 연구를 가능하게 하기 위해 절실히 요구되어 왔다.카베네-금속단지에서 카베네를 분리하는 것은 단지 안정성 때문에 문제가 될 수 있다.따라서, 애초에 카베인을 이러한 금속으로부터 자유롭게 하는 것이 바람직하다.실제로 일부 금속 이온은 카베네를 안정화시키기 보다는 숨김이 없는 예들의 촉매적 조광화에 관련되어 있다.
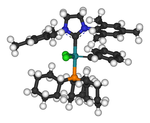
오른쪽은 직경 HMDS와 칼륨 HMDS 사이의 콤플렉스를 보여주는 X선 구조로, 과잉 KHMDS가 포마미디늄 소금의 감응을 위한 강력한 베이스로 사용되면서 형성된 복합체다.특히 리튬 이소프로필아미드(LDA)와 같은 시약으로 디프로토네이션을 일으키는 리튬 이온을 제거하는 것은 문제가 될 수 있다.칼륨과 나트륨 염 부산물은 용액에서 침전되기 쉬우며 제거할 수 있다.리튬 이온은 암호나 크라운 에테르와 같은 종에 결합하여 화학적으로 제거할 수 있다.
금속 프리 카베네는 다음과 같이 여러 가지 방법으로 준비되었다.
디찰코제네이션
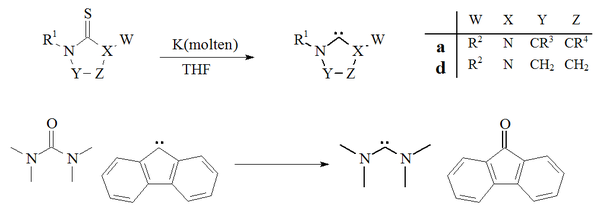
카르베네를 준비하는 또 다른 접근방식은 THF에서 칼륨으로 티우레아를 탈황시키는 것에 의존해왔다.[27][70]이 반응의 성공에 기여하는 요인은 부산물인 황화칼륨이 용매에서 용해되지 않는다는 것이다.온도가 상승하면 이 방법은 불안정한 조광 카베네 준비에는 적합하지 않다는 것을 알 수 있다.테트라메틸디아미노카르베네와 플루오렌네를 주기 위해 플루오렌에서 파생된 카베네를 가진 요소에서 탈산소가 발생한 단 하나의 사례도 보고되었다.[71]
이미다졸-2-ylidenes나 diaminocarbenes를 주기 위해 녹인 칼륨으로 티우레아의 탈황은 널리 사용되지 않았다.이 방법은 디히드로이미다졸 카르베네를 준비하는 데 사용되었다.[27]
진공 열분해
중성 휘발성 부산물(예: 메탄올 또는 클로로포름)의 제거와 함께 진공 열분해효소는 디하이드로이미다졸과 트라이아졸 기반의 카르베네를 준비하는데 사용되었다.역사적으로 아첨물 A의 진공 열분해에 의한 클로로포름 제거는 Wanzlick이[8] 디하이드로이미다졸-2-ylidenes를 준비하기 위한 초기 시도에서 사용되었지만 이 방법은 널리 사용되지 않는다.Enders 실험실은[38] 3AZol-5-ylidene을 생성하기 위해 유도 B의 진공 열분해를 사용해 왔다.
비스(트리메틸실릴)머큐리
비스(트리메틸실릴)머큐리(CH3)3시-히그시(CH3)3는 클로로이미늄과 클로로아미디늄염과 반응하여 금속이 없는 카베네와 원소 수은을 제공한다.[72]예를 들면 다음과 같다.
- (CH3)3Si−Hg−Si(CH3)3 + R2N=C(Cl)−NR+
2Cl− → R2N−C−NR2 + Hg(l) + 2(CH3)3SiCl
광화학 분해
지속적인 트리플트 주 카베네는 벤젠 내 300nm 파장에서 질소 가스의 배출을 통해 디아조메탄 제품을 광화학적으로 분해하여 준비되었다.
정화
안정적인 카베네는 반응성이 매우 높기 때문에 무공해 기법을 이용한 최소한의 취급이 바람직하다.그러나, 엄격하게 건조하고, 상대적으로 비산소성 및 공기 없는 재료가 사용된다면, 안정적인 카베네는 취급 시 상당히 견고하다.예를 들어, 하이드라이드 칼륨으로부터 준비된 안정적인 카베네는 마른 셀라이트 패드를 통해 여과되어 반응으로부터 과다한 KH(및 결과염)를 제거할 수 있다.비교적 작은 규모로 용액에 안정적 카베네가 들어 있는 서스펜션이 정착할 수 있고, 건조된 막 주사기 필터를 통해 상등액 용액이 밀릴 수 있다.안정적인 카베네는 헥산 등 비극성 용매에 쉽게 용해되기 때문에 일반적으로 적절한 비산성 극성 용매의 사용 불가능으로 인해 안정적인 카베네의 재분산이 어려울 수 있다.공기 없는 승화는 정화의 효과적인 방법이 될 수 있지만, 높은 진공 상태에서 60 °C 미만의 온도가 선호되는 것은 이러한 카베네는 상대적으로 휘발성이 강하며 또한 이러한 높은 온도에서 분해되기 시작할 수 있기 때문이다.실제로 어떤 경우 승화는 X선 분석에 적합한 단일 결정체를 제공할 수 있다.그러나 리튬과 같은 금속 이온에 대한 강한 콤플렉스는 대부분의 경우 승화를 막을 것이다.
참조
- ^ Hopkinson, M. N.; Richter, C.; Schedler, M.; Glorius, F. (2014). "An Overview of N-Heterocyclic Carbenes". Nature. 510 (7506): 485–496. Bibcode:2014Natur.510..485H. doi:10.1038/nature13384. PMID 24965649. S2CID 672379.
- ^ Ronald Breslow (1957). "Mechanism of Thiamine Action: Participation of a Thiazolium Zwitterion". Chem. Ind. 26: 893.
- ^ Ronald Breslow (1958). "On the Mechanism of Thiamine Action. IV.1 Evidence from Studies on Model Systems". J. Am. Chem. Soc. 80 (14): 3719–3726. doi:10.1021/ja01547a064.
- ^ R. Breslow (1957). "Rapid Deuterium Exchange in Thiazolium Salts". J. Am. Chem. Soc. 79 (7): 1762–1763. doi:10.1021/ja01564a064.
- ^ Berkessel A.; Elfert S.; Yatham V. R.; Neudörfl J.-M.; Schlörer N. E.; Teles J. H. (2012). "Umpolung by N-Heterocyclic Carbenes: Generation and Reactivity of the Elusive 2,2-Diamino Enols (Breslow Intermediates)". Angew. Chem. Int. Ed. 51 (49): 12370–12374. doi:10.1002/anie.201205878. PMID 23081675.
- ^ 화학자들이 접근하기 어려운 브레슬로우 중간 카르멘 드라엘
- ^ Hans-Werner Wanzlick; E. Schikora (1960). "Ein neuer Zugang zur Carben-Chemie" [A new way into carbene chemistry]. Angew. Chem. 72 (14): 494. Bibcode:1960AngCh..72..494W. doi:10.1002/ange.19600721409.
- ^ a b H. W. Wanzlick; E. Schikora (1960). "Ein nucleophiles Carben" [A nucleophilic carbene]. Chem. Ber. 94 (9): 2389–2393. doi:10.1002/cber.19610940905.
- ^ a b H. W. Wanzlick (1962). "Aspects of Nucleophilic Carbene Chemistry". Angew. Chem. Int. Ed. 1 (2): 75–80. doi:10.1002/anie.196200751.
- ^ D. M. Lemal; R. A. Lovald; K. I. Kawano (1964). "Tetraaminoethylenes. The Question of Dissociation". J. Am. Chem. Soc. 86 (12): 2518–2519. doi:10.1021/ja01066a044.
- ^ H. E. Winberg; J. E. Carnahan; D. D. Coffman; M. Brown (1965). "Tetraaminoethylenes". J. Am. Chem. Soc. 87 (9): 2055–2056. doi:10.1021/ja01087a040.
- ^ Denk M. K.; Hatano K.; Ma M. (1999). "Nucleophilic Carbenes and the Wanzlick Equilibrium A Reinvestigation". Tetrahedron Lett. 40 (11): 2057–2060. doi:10.1016/S0040-4039(99)00164-1.
- ^ Böhm Volker P. W.; Herrmann Wolfgang A. (2000). "The Wanzlick Equilibrium". Angew. Chem. Int. Ed. 39 (22): 4036–4038. doi:10.1002/1521-3773(20001117)39:22<4036::AID-ANIE4036>3.0.CO;2-L.
- ^ a b H. W. Wanzlick; H. J. Schonherr (1970). "Chemie nucleophiler Carbene, XVIII, 1) 1.3.4.5-Tetraphenyl-imidazoliumperchlorat" [Cemistry of nucleophilic carbenes, XVIII. 1) 1,3,4,5-Tetraphenylimidazolium perchlorate]. Liebigs Ann. Chem. 731: 176–179. doi:10.1002/jlac.19707310121.
- ^ R. Gleiter; R. Hoffmann (1968). "Stabilizing a singlet methylene". J. Am. Chem. Soc. 90 (20): 5457–5460. doi:10.1021/ja01022a023.
- ^ a b A. Igau; H. Grutzmacher; A. Baceiredo; G. Bertrand (1988). "Analogous α,α′-bis-carbenoid, triply bonded species: synthesis of a stable λ3-phosphino carbene-λ3-phosphaacetylene". J. Am. Chem. Soc. 110 (19): 6463–6466. doi:10.1021/ja00227a028.
- ^ a b c G. Bertrand; R. Reed (1994). "λ3-Phosphinocarbenes λ5-phosphaacetylenes". Coord. Chem. Rev. 137: 323–355. doi:10.1016/0010-8545(94)03005-B.
- ^ a b c Arduengo, A.J.; Harlow, R.L.; Kline, M. (1991). "A stable crystalline carbene". J. Am. Chem. Soc. 113 (1): 361–363. doi:10.1021/ja00001a054.
- ^ Tapu, Daniela; Dixon, David A.; Roe, Christopher (12 August 2009). "13C NMR Spectroscopy of "Arduengo-type" Carbenes and Their Derivatives". Chem. Rev. 109 (8): 3385–3407. doi:10.1021/cr800521g. PMID 19281270.
- ^ Arduengo, Anthony J.; Harlow, Richard L.; Kline, Michael (January 1991). "A stable crystalline carbene". J. Am. Chem. Soc. 113 (1): 361–363. doi:10.1021/ja00001a054.
- ^ a b A. J. Arduengo; F. Davidson; H. V. R. Dias; J. R. Goerlich; D. Khasnis; W. J. Marshall; T. K. Prakasha (1997). "An Air Stable Carbene and Mixed Carbene "Dimers"". J. Am. Chem. Soc. 119 (52): 12742–12749. doi:10.1021/ja973241o.
- ^ Christophe Buron; Heinz Gornitzka; Vadim Romanenko; Guy Bertrand (2000). "Stable Versions of Transient Push-Pull Carbenes: Extending Lifetimes from Nanoseconds to Weeks". Science. 288 (5467): 834–836. Bibcode:2000Sci...288..834B. doi:10.1126/science.288.5467.834. PMID 10796999.
- ^ Solé, Stéphane; Gornitzka, Heinz; Schoeller, Wolfgang W.; Bourissou, Didier; Bertrand, Guy (2001). "(Amino)(Aryl)Carbenes: Stable Singlet Carbenes Featuring a Spectator Substituent". Science. 292 (5523): 1901–1903. Bibcode:2001Sci...292.1901S. doi:10.1126/science.292.5523.1901. PMID 11397943.
- ^ Lai Chun-Liang; Guo Wen-Hsin; Lee Ming-Tsung; Hu Ching-Han (2005). "Ligand properties of N-heterocyclic and Bertrand carbenes: A density functional study". J. Organomet. Chem. 690 (24–25): 5867–5875. doi:10.1016/j.jorganchem.2005.07.058.
- ^ a b c d A. J. Arduengo; H. V. R. Dias; R. L. Harlow; M. Kline (1992). "Electronic stabilization of nucleophilic carbenes". J. Am. Chem. Soc. 114 (14): 5530–5534. doi:10.1021/ja00040a007.
- ^ a b c J. Arduengo; J. R. Goerlich; W. J. Marshall (1995). "A stable diaminocarbene". J. Am. Chem. Soc. 117 (44): 11027–11028. doi:10.1021/ja00149a034.
- ^ a b c d e M. K. Denk; A. Thadani; K. Hatano; A. J. Lough (1997). "Steric Stabilization of Nucleophilic Carbenes". Angew. Chem. Int. Ed. 36 (23): 2607–2609. doi:10.1002/anie.199726071.
- ^ a b c d Alder, RW; Chaker, L; Paolini, FP (2004). "Bis(diethylamino)carbene and the mechanism of dimerisation for simple diaminocarbenes". Chemical Communications (Cambridge, England) (19): 2172–2173. doi:10.1039/b409112d. PMID 15467857.
- ^ a b c d R. W. Alder; P. R. Allen; M. Murray; A. G. Orpen (1996). "Bis(diisopropylamino)carbene". Angew. Chem. Int. Ed. 35 (10): 1121–1123. doi:10.1002/anie.199611211.
- ^ a b c d e R. W. Alder; M. E. Blake (1997). "Bis(N-piperidyl)carbene and its slow dimerisation to tetrakis(N-piperidyl)ethene". Chem. Commun. (16): 1513–1514. doi:10.1039/a703610h.
- ^ a b R. W. Alder; M. E. Blake; J. M. Oliva (1999). "Diaminocarbenes; Calculation of Barriers to Rotation about Ccarbene–N Bonds, Barriers to Dimerization, Proton Affinities, and 13C NMR Shifts". J. Phys. Chem. A. 103 (50): 11200–11211. Bibcode:1999JPCA..10311200A. doi:10.1021/jp9934228.
- ^ a b c d e A. J. Arduengo, J. R. Goerlich and W. J. Marshall (1997). "A Stable Thiazol-2-ylidene and Its Dimer". Liebigs Ann. Chem. 1997 (2): 365–374. doi:10.1002/jlac.199719970213.
- ^ a b c R. W. Alder; C. P. Butts; A. G. Orpen (1998). "Stable Aminooxy- and Aminothiocarbenes". J. Am. Chem. Soc. 120 (44): 11526–11527. doi:10.1021/ja9819312.
- ^ a b Lavallo, Vincent; Canac, Yves; Donnadieu, Bruno; Schoeller, Wolfgang W.; Bertrand, Guy (2006). "Cyclopropenylidenes: From Interstellar Space to an Isolated Derivative in the Laboratory". Science. 312 (5774): 722–724. Bibcode:2006Sci...312..722L. doi:10.1126/science.1126675. PMC 2427275. PMID 16614171.
- ^ a b c W. A. Herrmann; C. Kocher; L. J. Goossen; G. R. J. Artus (1996). "Heterocyclic Carbenes: A High-Yielding Synthesis of Novel, Functionalized N-Heterocyclic Carbenes in Liquid Ammonia". Chem. Eur. J. 2 (12): 1627–1636. doi:10.1002/chem.19960021222.
- ^ a b W. A. Herrmann; M. Elison; J. Fischer; C. Kocher; G. R. J. Artus (1996). "N-Heterocyclic Carbenes: Generation under Mild Conditions and Formation of Group 8–10 Transition Metal Complexes Relevant to Catalysis". Chem. Eur. J. 2 (7): 772–780. doi:10.1002/chem.19960020708.
- ^ a b H. V. R. Dias; W. C. Jin (1994). "A stable tridentate carbene ligand". Tetrahedron Lett. 35 (9): 1365–1366. doi:10.1016/S0040-4039(00)76219-8.
- ^ a b c d D. Enders; K. Breuer; G. Raabe; J. Runsink; J. H. Teles; J. P. Melder; K. Ebel; S. Brode (1995). "Preparation, Structure, and Reactivity of 1,3,4-Triphenyl-4,5-dihydro-1H-1,2,4-triazol-5-ylidene, a New Stable Carbene". Angew. Chem. Int. Ed. 34 (9): 1021–1023. doi:10.1002/anie.199510211.
- ^ a b c d R. W. Alder; M. E. Blake; C. Bortolotti; S. Buffali; C. P. Butts; E. Lineham; J. M. Oliva; A. G. Orpen; M. J. Quayle (1999). "Complexation of stable carbenes with alkali metals". Chem. Commun. (3): 241–242. doi:10.1039/a808951e.
- ^ R. Breslow (1957). "Rapid Deuterium Exchange in Thiazolium Salts". J. Am. Chem. Soc. 79 (7): 1762–1763. doi:10.1021/ja01564a064.
- ^ a b H. D. Haztzler (1970). "Nucleophilic 1,3-dithiolium carbenes". J. Am. Chem. Soc. 92 (5): 1412–1413. doi:10.1021/ja00708a058.
- ^ a b H. D. Hartzler (1972). "1,3-Dithiolium carbenes from acetylenes and carbon disulfide". J. Am. Chem. Soc. 95 (13): 4379–4387. doi:10.1021/ja00794a039.
- ^ G. Bertrand; A. Igau; A. Baceiredo; G. Trinquier (1989). "[Bis(diisopropylamino)phosphino]trimethylsilylcarbene: A Stable Nucleophilic Carbene". Angew. Chem. Int. Ed. 28 (5): 621–622. doi:10.1002/anie.198906211.
- ^ a b Präsang, C; Donnadieu, B; Bertrand, G (2005). "Stable Planar Six-π-Electron Six-Membered N-Heterocyclic Carbenes with Tunable Electronic Properties". J. Am. Chem. Soc. 127 (29): 10182–10183. doi:10.1021/ja052987g. PMC 2440681. PMID 16028925.
- ^ Tomioka, H; Iwamoto, E; Itakura, H; Hirai, K (2001). "Generation and characterization of a fairly stable triplet carbene". Nature. 412 (6847): 626–628. Bibcode:2001Natur.412..626T. doi:10.1038/35088038. PMID 11493917. S2CID 4373216.
- ^ Michael Freemantle (2001-08-13). "Triplet Carbene has Long Life". Chemical & Engineering News. 79 (33): 11. doi:10.1021/cen-v079n033.p011a.
- ^ Itoh, T; Nakata, Y; Hirai, K; Tomioka, H (2006). "Triplet Diphenylcarbenes Protected by Trifluoromethyl and Bromine Groups. A Triplet Carbene Surviving a Day in Solution at Room Temperature". J. Am. Chem. Soc. 128 (3): 957–967. doi:10.1021/ja056575j. PMID 16417387.
- ^ a b R. W. Alder; P. R. Allen; S. J. Williams (1995). "Stable carbenes as strong bases". Chem. Commun. (12): 1267. doi:10.1039/c39950001267.
- ^ Massey Richard S (2012). "Proton Transfer Reactions of Triazol-3-ylidenes: Kinetic Acidities and Carbon Acid pKaValues for Twenty Triazolium Salts in Aqueous Solution" (PDF). J. Am. Chem. Soc. 134 (50): 20421–20432. doi:10.1021/ja308420c. PMID 23173841.
- ^ Higgins, Eleanor M.; Sherwood, Jennifer A.; Lindsay, Anita G.; Armstrong, James; Massey, Richard S.; Alder, Roger W.; O'Donoghue, Annmarie C. (2011). "pKas of the conjugate acids of N-heterocyclic carbenes in water". Chem. Commun. 47 (5): 1559–1561. doi:10.1039/C0CC03367G. PMID 21116519. S2CID 205757477.
- ^ T. A. Taton; P. Chen (1996). "A Stable Tetraazafulvalene". Angew. Chem. Int. Ed. 35 (9): 1011–1013. doi:10.1002/anie.199610111.
- ^ Alder, Roger W.; Blake, Michael E.; Chaker, Leila; Harvey, Jeremy N.; Paolini, François; Schütz, Jan (2004). "When and How Do Diaminocarbenes Dimerize?". Angew. Chem. Int. Ed. 43 (44): 5896–5911. doi:10.1002/anie.200400654. PMID 15457494.
- ^ Enders, D.; Breuer, K.; Runsink, J.; Teles, J.H. (1996). "Chemical Reactions of the Stable Carbene 1,3,4-Triphenyl-4,5-dihydro-1H-1,2,4-triazol-5-ylidene". Liebigs Ann. Chem. 1996 (12): 2019–2028. doi:10.1002/jlac.199619961212.
- ^ a b Enders, D.; Breuer, K.; Teles, J.H.; Ebel, K. (1997). "1,3,4-Triphenyl-4,5-dihydro-1H-1,2,4-triazol-5-ylidene – applications of a stable carbene in synthesis and catalysis". J. Prakt. Chem. 339: 397–399. doi:10.1002/prac.19973390170.
- ^ Wolf, J; Böhlmann, W; Findeisen, M; Gelbrich, T; Hofmann, HJ; Schulze, B (2007). "Synthesis of stable isothiazole carbenes". Angew. Chem. Int. Ed. 46 (17): 3118–3121. doi:10.1002/anie.200604305. PMID 17372997.
- ^ a b DeHope, A; Lavallo, V; Donnadieu, B; Schoeller, WW; Bertrand, G (2007). "Recently reported crystalline isothiazole carbenes: Myth or reality". Angew. Chem. Int. Ed. 46 (36): 6922–6925. doi:10.1002/anie.200702272. PMID 17661300.
- ^ Wolf Janine; Böhlmann Winfried; Findeisen Matthias; Gelbrich Thomas; Hofmann Hans-Jorg; Schulze Borbel (2007). "Reply to "Recently Reported Crystalline Isothiazole Carbenes: Myth or Reality"". Angew. Chem. Int. Ed. 46 (36): 6926. doi:10.1002/anie.200702746.
- ^ a b Wolfgang A. Herrmann; Christian Köcher (1997). "N-Heterocyclic Carbenes". Angew. Chem. Int. Ed. 36 (20): 2162–2187. doi:10.1002/anie.199721621.
- ^ Gernot Boche; Christof Hilf; Klaus Harms; Michael Marsch; John C. W. Lohrenz (1995). "Crystal Structure of the Dimeric (4-tert-Butylthiazolato)(glyme)lithium: Carbene Character of a Formyl Anion Equivalent". Angew. Chem. Int. Ed. 34 (4): 487–489. doi:10.1002/anie.199504871.
- ^ a b D. Enders; H. Gielen; G. Raabe; J. Runsink; J. H. Teles (1996). "Synthesis and Stereochemistry of the First Chiral (Imidazolinylidene)- and (Triazolinylidene)palladium(II) Complexes". Chem. Ber. 129 (12): 1483–1488. doi:10.1002/cber.19961291213.
- ^ a b Wolfgang A. Herrmann; Martina Elison; Jakob Fischer; Christian Köcher; Georg R. J. Artus (1995). "Metal Complexes of N-Heterocyclic Carbenes – A New Structural Principle for Catalysts in Homogeneous Catalysis". Angew. Chem. Int. Ed. 34 (21): 2371–2374. doi:10.1002/anie.199523711.
- ^ a b Wolfgang A. Herrmann; Lukas J. Goossen; Christian Köcher; Georg R. J. Artus (1996). "Chiral Heterocylic Carbenes in Asymmetric Homogeneous Catalysis". Angew. Chem. Int. Ed. 35 (23–24): 2805–2807. doi:10.1002/anie.199628051.
- ^ M. Scholl; T. M. Trnka; J. P. Morgan; R. H. Grubbs (1999). "Increased ring closing metathesis activity of ruthenium-based olefin metathesis catalysts coordinated with imidazolin-2-ylidene ligands". Tetrahedron Lett. 40 (12): 2247–2250. doi:10.1016/S0040-4039(99)00217-8.
- ^ Han Vinh Huynh; et al. (2009). "13C NMR Spectroscopic Determination of Ligand Donor Strengths Using N-Heterocyclic Carbene Complexes of Palladium(II)". Organometallics. 28 (18): 5395–5404. doi:10.1021/om900667d.
- ^ S. P. 놀란 [편집자](2006).N-Herocyclic carbenes in consolation, Wiley-VCH ISBN 3-527-31400-8
- ^ F. Migius [편집자] (2007) 전환 금속 강직 시 N-헤로사이클릭 카베네, Springer ISBN 3-540-36929-5
- ^ Díez-González, Silvia; Marion, Nicolas; Nolan, Steven P. (2009-08-12). "N-Heterocyclic Carbenes in Late Transition Metal Catalysis". Chem. Rev. 109 (8): 3612–3676. doi:10.1021/cr900074m. ISSN 0009-2665. PMID 19588961. S2CID 206902952.
- ^ Garrison Jered C.; Youngs Wiley J. (2005). "Ag(I) N-Heterocyclic Carbene Complexes: Synthesis, Structure, and Application". Chem. Rev. 105 (11): 3978–4008. doi:10.1021/cr050004s. PMID 16277368. S2CID 43090499.
- ^ Roger W. Alder; Michael E. Blake; Simone Bufali; Craig P. Butts; A. Guy Orpen; Jan Schütz; Stuart J. Williams (2001). "Preparation of tetraalkylformamidinium salts and related species as precursors to stable carbenes". J. Chem. Soc., Perkin Trans. 1 (14): 1586–1593. doi:10.1039/b104110j.
- ^ N. Kuhn; T. Kratz (1993). "Synthesis of Imidazol-2-ylidenes by Reduction of Imidazole-2(3H)-thiones". Synthesis. 1993 (6): 561–562. doi:10.1055/s-1993-25902.
- ^ D. Kovacs; M. S. Lee; D. Olson; J. E. Jackson (1996). "Carbene-to-Carbene Oxygen Atom Transfer". J. Am. Chem. Soc. 118 (34): 8144–8145. doi:10.1021/ja961324j.
- ^ Michael Otto; Salvador Conejero; Yves Canac; Vadim D. Romanenko; Valentyn Rudzevitch; Guy Bertrand (2004). "Mono- and Diaminocarbenes from Chloroiminium and -amidinium Salts: Synthesis of Metal-Free Bis(dimethylamino)carbene". J. Am. Chem. Soc. 126 (4): 1016–1017. doi:10.1021/ja0393325. PMID 14746458.
추가 읽기
영구 카베네에 대한 리뷰:
- Hopkinson, M. N.; Richter, C.; Schedler, M.; Glorius, F. (2014). "An Overview of N-Heterocyclic Carbenes". Nature. 510 (7506): 485–496. Bibcode:2014Natur.510..485H. doi:10.1038/nature13384. PMID 24965649. S2CID 672379..
- 카르베네 화학: 덧없는 매개체에서 강력한 시약까지 (4장, 토미오카 히데오(트리플렛 주);제5장 (싱글렛 상태), 로저 W. 알더) - 에드.가이 버트랜드
- 로버트 A에 의한 반응성 중간 화학모스, 매튜 플래츠, 메이틀랜드 존스 (8장, 스테이블 싱글렛 카베네스, 가이 버트랜드)
- R. W. 알더, '다이아미노카르베네스: 구조와 반응성을 탐구한다'에서, 2002년 뉴욕 주, G. 버트랜드 주,
- M. Regitz (1996). "Stable Carbenes—Illusion or Reality?". Angew. Chem. Int. Ed. 30 (6): 674–676. doi:10.1002/anie.199106741.
N-헬로사이클릭 카베네의 물리적 화학적 특성(전자, 스테릭스 등...)에 대한 검토:
- T. Dröge; F. Glorius (2010). "The Measure of All Rings - N-Heterocyclic Carbenes". Angew. Chem. Int. Ed. 49 (39): 6940–6952. doi:10.1002/anie.201001865. PMID 20715233.