무공해 기법
Air-free technique무공해 기법은 화학 실험실에서 공기에 민감한 화합물을 취급하기 위한 다양한 조작을 말한다. 이러한 기법들은 화합물이 공기, 보통 물과 산소, 덜 흔한 이산화탄소와 질소와 반응하는 것을 막는다. 이러한 기법의 공통 주제는 공기를 제거하기 위해 미세(100–10−3 Torr) 또는 높은(10−3–10−6 Torr) 진공 사용과 불활성 기체 사용(가능한 경우 아르곤을 선호하지만 질소)이다.
가장 일반적인 두 가지 유형의 무공기 기술에는 글로브 박스와 슐렌크 라인의 사용이 포함되지만, 일부 엄격한 적용은 고진공 라인을 사용한다. 두 방법 모두 유리제품(흔히 Schlenk tube)은 사용하기 전에 오븐에서 미리 건조한다. 흡착수를 제거하기 위해 불꽃을 건조할 수 있다. 비활성 대기에 도달하기 전에, 혈관은 퍼지 앤 리필(purge-and-refill)에 의해 더 건조된다. 즉, 혈관은 가스와 물을 제거하기 위해 진공 상태를 거친 다음 불활성 가스로 재충전된다. 이 사이클은 보통 세 번 반복되거나 장기간 진공을 가한다. 글로브 박스와 슐렌크 라인 사용의 차이점 중 하나는 퍼지-리필 사이클이 적용되는 부분이다. 글로브 박스를 사용할 때 퍼지 앤 리필은 일반적으로 "포트" 또는 "안테 챔버"라고 불리는 글로브 박스에 부착된 에어록에 적용된다. 이와는 대조적으로 Schlenk 라인을 사용하는 경우 Purge-and-refill은 다지관에 연결된 호스 또는 접지 유리 조인트를 통해 반응 용기에 직접 적용된다.[1]
글러브 박스
가장 직설적인 형태의 에어프리 기법은 글로브 박스의 사용이다. 글러브 백은 같은 생각을 사용하지만, 대개는 숙청이 더 어렵고 밀봉이 덜 되기 때문에 더 가난한 대체품이다. 장갑의 손이 닿지 않는 품목에 접근하는 창의적인 방법은 집게와 줄을 사용하는 것과 같다. 글로브 박스를 사용할 때의 주된 단점은 글로브 박스의 비용이며, 장갑을 착용하는 동안 손재주가 제한된다는 것이다.
글로브 박스에서는 장갑을 사용하여 장비를 취급해야 함에도 불구하고 기존의 실험실 장비를 설치하고 조작할 수 있는 경우가 많다. 밀봉되었지만 재순환되는 불활성 가스의 대기를 제공함으로써 글로브 박스는 다른 주의사항이 거의 필요하지 않다. 특히 다른 시약, 특히 휘발성 시약을 사용하는 작업자 간에 글러브 박스를 공유하는 경우 기술 불량으로 인한 시료의 교차 오염도 문제가 된다.
합성 화학에 글러브 박스를 사용하는 데 있어서 두 가지 스타일이 진화했다. 보다 보수적인 모드에서는 공기에 민감한 시약을 저장, 무게 측정 및 이송하는 데만 사용한다. 이후 Schlenk 기법을 사용하여 반응을 수행한다. 따라서 글로브 박스는 실험에서 가장 공기에 민감한 단계에만 사용된다. 글러브 박스는 용매의 반응, 작업, 분광기 검체 준비 등 전체 합성 작업에 보다 자유롭게 사용된다.
서로 다른 실험실이 서로 다른 배양액을 채택하고 있지만 모든 시약과 용제가 글로브 박스에 사용 가능한 것은 아니다. "상자 대기"는 보통 구리 촉매에 걸쳐 지속적으로 산소를 제거한다. 할로겐화 화합물과 같은 특정 휘발성 화학물질과 특히 인광과 티올과 같은 강하게 조화된 종은 불가역적으로 구리 촉매를 오염시키기 때문에 문제가 될 수 있다. 이 때문에 많은 실험학자들은 그러한 화합물을 슐렌크 기법을 사용하여 처리하기로 선택한다. 글로브 박스의 보다 자유로운 사용에서 구리 촉매는 보다 빈번한 교체가 필요하지만 이 비용은 보호 환경 내에서 전체 합성을 수행하는 효율성에 대한 허용 가능한 절충으로 간주된다.
슐렌크 선
공기에 민감한 화합물의 준비 및 취급에 대한 다른 주요 기술은 Schlenk 라인의 사용과 관련이 있다. 주요 기법은 다음과 같다.
- 역류 첨가물, 즉 공기 주입 시약이 불활성 기체의 흐름에 대항하여 반응 용기에 첨가된다.
- 액체 및 용액을[2] 옮기기 위한 주사기 및 고무 증분(구멍 뚫린 후 다시 봉합하는 스톱퍼) 사용
- 캐뉼라 이동(canula transfer), 캐뉼라라고 알려진 길고 얇은 튜브를 사용하여 셉타로 정지된 여러 용기 간에 공기 민감 시약의 액체 또는 용액이 전달되는 경우. 액체 흐름은 진공 또는 불활성 가스 압력을 통해 달성된다.[3]
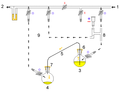
 캐뉼라는 오른쪽 플라스크에서 왼쪽 플라스크로 THF를 옮기는 데 사용된다.
캐뉼라는 오른쪽 플라스크에서 왼쪽 플라스크로 THF를 옮기는 데 사용된다.
유리그릇은 일반적으로 단단히 고정되고 기름칠된 접지 유리 관절을 통해 연결된다. 다양한 용기의 방향을 조정하기 위해 접지 유리 관절이 있는 유리 튜브의 둥근 굴곡을 사용할 수 있다. 전용 장비로 오일을 처리할 수 있다.
관련 준비
상업적으로 이용 가능한 정제 불활성 가스(아르곤 또는 질소)는 대부분의 목적에 적합하다. 그러나 특정 용도의 경우 물과 산소를 추가로 제거해야 한다. 이러한 추가적인 정화는 가열된 구리 촉매 기둥을 통해 불활성 가스 라인을 배관하여 산소를 구리 산화물로 변환시킴으로써 이루어질 수 있다. 물은 오산화 인이나 분자체 같은 방습제 기둥을 통해 가스를 제거한다.
공기 및 무수 용매도 필요하다. 질소 정화 윈체스터에 고순도 용제가 있으면 글로브 박스에 직접 반입할 수 있다. 슐렌크 기법과 함께 사용하기 위해 분자 체를 충전한 슐렌크 플라스크에 빠르게 붓고 탈가스를 제거할 수 있다. 더 일반적으로 용제는 정전기 또는 용제 정화기둥에서 직접 분사된다.
디가싱
탈가스를 위한 두 가지 절차는 흔하다. 첫 번째는 동결펌프-토우(freeze-pump-thaw)라고 알려져 있다. 용제는 액체 질소 아래에 얼리고, 진공이 가해진다. 이후 스톱콕을 닫고 따뜻한 물에 용제를 녹여 갇힌 기포가 빠져나오게 한다.[4]
두 번째 절차는 용매에 진공 상태를 가하는 것이다. 초음파기를 이용한 교반 또는 기계적 교반이 유용하다. 용해된 가스는 먼저 진화한다. 일단 용제가 증발하기 시작하면 플라스크 벽 밖의 응축에 의해 확인되며, 플라스크는 불활성 가스로 재충전된다. 두 절차 모두 세 번 반복된다.
건조
용제는 화학 반응의 주요 오염원이다. 전통적인 건조 기술은 공격적인 건조제로부터의 증류를 포함하지만, 분자 체는 훨씬 우수하다.[5]
| 건조제 | 건조 기간 | 수분 함유량 |
|---|---|---|
| 미처리된 | 0시간 | 225ppm |
| 나트륨/벤조페논 | 48시간 | 31ppm |
| 3 å 분자체 | 24시간 | 0.9ppm |
비효율적일 뿐 아니라 방습제로서의 나트륨(융점 이하)은 미량의 물과 천천히 반응한다. 그러나 방습제가 용해되면 분자체보다는 아직 열세지만 건조 속도가 빨라진다. 벤조페논은 그러한 수용성 건조제를 생성하는 데 종종 사용된다. 이 어플리케이션의 장점은 케틸 래디컬 음이온의 강렬한 파란색이다. 따라서 나트륨/벤조페논은 증류에 의한 용매 정화에 있어서 무공기와 무수 상태를 나타내는 지표로 사용할 수 있다.[6][7]
증류 스틸은 화재 위험성이며, 대체 용매 건조 시스템으로 점점 대체되고 있다. 활성 알루미나로 채워진 기둥을 통해 탈산성 용제를 여과하는 시스템이 인기다.[8]
고체의 건조는 오산화 인(PO
2
5)이나 실리카겔 등 건조제 위에 고체를 보관하거나 건조 오븐/진공 건조 오븐에 보관하거나 고진공이나 건조권총에 가열하거나 미량의 물을 제거해 건조 대기가 있는 글로브 박스에 고체를 보관하기만 하면 된다.
대안
이 두 가지 기술 모두 다소 비싼 장비가 필요하며 시간이 많이 걸릴 수 있다. 무공기 요건이 엄격하지 않은 경우 다른 기법을 사용할 수 있다. 예를 들어, 물/산소와 반응하는 시약의 희생적 초과분을 사용할 수 있다. 희생적 과잉은 사실상 물과 반응하여 반응을 "배합"한다(예: 용매). 그러나 이 방법은 이 반응에서 생성된 불순물이 차례로 반응의 원하는 생산물에 해가 되지 않거나 쉽게 제거할 수 있는 경우에만 적합하다. 일반적으로 이러한 희생적 과잉을 이용한 반응은 이러한 부작용은 원하는 제품 반응에 비해 무시할 수 있을 정도로 상당히 큰 규모로 반응을 할 때만 효과적이다. 예를 들어, Grignard 시약을 준비할 때 마그네슘(가장 저렴한 시약)이 과다하게 사용되는 경우가 많은데, 이는 수산화 마그네슘을 주기 위해 물과 직접 반응하거나 물과 차례로 반응하는 Grignard 시약(예: R-Mg-X + HO2 → HO-Mg-X + R-H)을 통해 미량수를 제거하기 위해 반응한다. 결과적인 "건조" 환경을 유지하기 위해서는 일반적으로 염화칼슘이 채워진 가드 튜브를 환류 응축기에 연결하여 시간이 지남에 따라 반응하는 습기를 느리게 하거나 불활성 가스 라인을 연결하는 것으로 충분하다.
건조는 분자 체와 같은 상황 건조제 또는 딘-스타크 기기와 같은 저온성 증류 기법의 사용으로도 달성할 수 있다.
참고 항목
참조
- ^ 듀워드 F. 슈라이버와 M. A. 드레즈존 "대기감응 화합물의 조작" 1986, J. 와일리 앤 선즈: 뉴욕 ISBN0-471-86773-X.
- ^ Johansen, Martin B.; Kondrup, Jens C.; Hinge, Mogens; Lindhardt, Anders T. (13 June 2018). "Improved Safety during Transfer of Pyrophoric tert-Butyllithium from Flasks with Protective Seals". Organic Process Research & Development. 22 (7): 903–905. doi:10.1021/acs.oprd.8b00151.
- ^ 브라운, H. C. "보라네스를 통한 유기물 합성" 존 와일리 & 선스 주식회사. 뉴욕: 1975. ISBN 0-471-11280-1.
- ^ "Freeze-Pump-Thaw Degassing of Liquids" (PDF). University of Washington.
- ^ 윌리엄스, D. B. G, 로튼, M, "유기 용매의 건조: 여러 건조제의 효율성의 정량적 평가", 유기 화학 2010 저널, 75, 8351. 도이: 10.1021/jo101589h
- ^ Nathan L. Bauld (2001). "Unit 6: Anion Radicals". University of Texas.
- ^ W. L. F. Armarego; C. Chai (2003). Purification of laboratory chemicals. Oxford: Butterworth-Heinemann. ISBN 0-7506-7571-3.
- ^ Pangborn, A. B.; Giardello, M. A.; Grubbs, R. H.; Rosen, R. K.; Timmers, F. J. (1996). "Safe and Convenient Procedure for Solvent Purification". Organometallics. 15 (5): 1518–20. doi:10.1021/om9503712.
외부 링크
- Rob Toreki (2004-05-24). "Glove Boxes". The Glassware Gallery. Interactive Learning Paradigms Incorporated.
- Rob Toreki (2004-05-25). "Schlenk Lines and Vacuum Lines". The Glassware Gallery. Interactive Learning Paradigms Incorporated.
- Jürgen Heck. "The Integrated Synthesis Course: Schlenk Technique" (PDF). University of Hamburg. Archived from the original (reprint at Norwegian University of Science and Technology) on 2008-03-09.
- "AL-134: Handling and Storage of Air-Sensitive Reagents" (PDF). Technical Bulletin. Sigma-Aldrich.[영구적 데드링크]
- R. John Errington (3 July 1997). Advanced practical inorganic and metalorganic chemistry. ISBN 9780751402254.
- John Leonard; B. Lygo; Garry Procter (2 June 1994). Advanced practical organic chemistry. ISBN 9780748740710.
갤러리
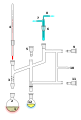
퍼킨 삼각형: 공기 민감 증류