루이스 구조
Lewis structure루이스 도트 공식, 루이스 도트 구조, 전자 도트 구조 또는 루이스 도트 구조(LEDs)라고도 알려진 루이스 구조물은 분자의 원자들 사이의 결합을 보여주는 도표일 뿐 아니라 분자에 존재할 수 있는 유일한 전자 쌍을 보여준다.[1][2][3] 루이스 구조는 조정 화합물뿐만 아니라 모든 공동 결합 분자에 대해 그려질 수 있다. 루이스 구조물은 길버트 N의 이름을 따서 지어졌다. 루이스는 1916년 자신의 글 "원자"와 "분자"에서 그것을 소개했다.[4] 루이스 구조는 화학 결합에서 공유 쌍을 나타내기 위해 원자 사이에 선을 추가하여 전자 도트 다이어그램의 개념을 확장한다.
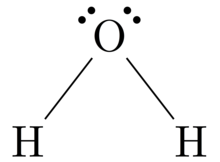
루이스 구조는 화학적 기호를 사용하여 분자의 구조에서 각각의 원자와 그 위치를 보여준다. 서로 결합되는 원자 사이에 선이 그려진다(선 대신 점의 입자를 사용할 수 있다). 외로운 쌍을 이루는 과잉 전자는 점의 쌍으로 표현되며, 원자 옆에 위치한다.
제2기와 그 이상의 주요 그룹 원소들은 대개 (8)전자의 완전한 옥텟으로 발란스 쉘 전자 구성을 이룰 때까지 전자를 얻거나 잃거나 공유함으로써 반응하지만, 수소(H)는 단지 두 개의 전자를 공유하는 결합만을 형성할 수 있다.
시공 및 전자계산
루이스 구조로 대표되는 총 전자 수는 각 개별 원자의 발란스 전자 수의 합과 같다. 비밸런스 전자는 루이스 구조에서 표현되지 않는다.
사용 가능한 전자의 총 수가 결정되면 다음 단계에 따라 전자를 구조물에 넣어야 한다.
- 원자들은 먼저 하나의 결합으로 연결되어 있다.
- t가 전자의 총 수이고 n 단일 결합의 수인 경우 t-2n 전자가 배치되어야 한다. 이것들은 단독 쌍으로 배치되어야 한다: 사용 가능한 각 전자 쌍에 대해 하나의 점 쌍이다. 외측 원자가 결합 쌍과 외측 쌍에 8개의 전자를 가질 때까지 외측 원자들(수소 이외의 것)에 초기에 외측 쌍을 배치해야 한다. 그런 다음 추가 외측 쌍은 중앙 원자에 배치될 수 있다. 의심스러울 때는 먼저 한 쌍을 더 많은 전기 원자에 놓아야 한다.
- 일단 모든 외로운 쌍을 배치하면 원자(특히 중심 원자)는 전자의 8진수를 갖지 못할 수도 있다. 이 경우 원자는 이중 결합을 형성해야 한다, 한 쌍의 전자가 이동해서 두 원자 사이에 두 번째 결합을 형성한다. 결합 쌍이 두 원자들 사이에 공유되기 때문에, 원래 한 쌍을 가지고 있던 원자는 여전히 옥텟을 가지고 있고, 다른 원자는 이제 그것의 발랑 껍질에 두 개의 전자를 더 가지고 있다.
다원자 이온을 위한 루이스 구조물은 동일한 방법으로 그려질 수 있다. 전자를 계산할 때, 음이온은 루이스 구조물에 배치된 여분의 전자를 가져야 한다; 양이온은 충전되지 않은 분자보다 적은 전자를 가져야 한다. 이온의 루이스 구조물이 작성되면 전체 구조물이 브래킷에 배치되고, 전하가 브래킷 바깥쪽의 오른쪽 상단에 위첨자로 기록된다.
루이스 구조를 만들기 위해 전자 계산의 필요성을 없애기 위해 더 간단한 방법이 제안되었다: 원자는 발란스 전자를 보여주고, 결합을 만드는 과정에 관여하는 원자의 발란스 전자를 결합하여 결합을 형성하며, 음이온과 양이온을 앱에 추가하거나 앱에서 제거하여 형성된다.원자를 [5]회전시키다
비결은 발란스 전자를 세고 나서 옥텟 규칙(또는 수소 단 2개)을 완성하는 데 필요한 전자 수를 세고 나서 이 두 숫자의 차이를 취하는 것이다. 정답은 결합을 구성하는 전자의 수입니다. 나머지 전자는 다른 원자의 옥텟을 채우기 위해 간다.
루이스 구조물과 공명 양식을 작성하는 또 다른 간단하고 일반적인 절차가 제안되었다.[6]
정식 충전
루이스 구조물의 경우, 배타적 공밸런스 또는 비극성 본딩을 가정하여 전자점 구조에 기초하여 각 원자의 겉보기 전자전하를 결정함으로써 가능한 위상학적 및 공명 구조의[7] 설명, 비교 및 평가에 공식 전하를 사용한다. 그것은 반응 메커니즘을 언급할 때 가능한 전자 재구성을 결정하는 데 사용되며, 종종 예외를 제외하고 원자의 부분 전하와 같은 부호를 초래한다. 일반적으로 원자의 공식 전하량은 사용된 마크업에 대한 비표준 정의를 가정하여 다음과 같은 공식을 사용하여 계산할 수 있다.
여기서:
- 가 정식 충전이다.
- 는 원소의 자유 원자에 있는 발란스 전자 수를 나타낸다.
- 는 원자의 비공유 전자 수를 나타낸다.
- 는 원자가 다른 원자와 결합하는 총 전자 수를 나타낸다.
원자의 공식 전하량은 중성 원자가 가질 수 있는 발란스 전자의 수와 루이스 구조에서 그것에 속하는 전자의 수의 차이로 계산된다. 공밸런트 결합의 전자는 결합에 관여하는 원자 사이에 균등하게 분할된다. 이온에 대한 공식 전하의 합계는 이온에 대한 전하와 같아야 하며, 중성 분자의 공식 전하의 합계는 0과 같아야 한다.
공명
일부 분자와 이온의 경우, 이중 또는 삼중 결합을 형성하기 위해 어느 한 쌍을 이동시켜야 하는지를 결정하기 어렵고, 동일한 분자나 이온에 대해 둘 이상의 다른 공명 구조를 작성할 수 있다. 이러한 경우 모두 양방향 화살표로 작성하는 것이 일반적이다(아래 예 참조). 이는 같은 유형의 여러 원자가 중심 원자를 둘러싸고 있을 때 나타나는 경우가 있으며, 특히 다원자 이온에 흔히 나타난다.
이 상황이 발생하면 분자의 루이스 구조는 공명 구조라고 하며, 분자는 공명 잡종으로서 존재한다. 각각의 다른 가능성은 다른 가능성들에 중첩되며, 분자는 이러한 상태의 어떤 조합에 상당하는 루이스 구조를 가지고 있는 것으로 간주된다.
예를 들어 질산염 이온(NO3−)은 질소에 대한 옥텟 규칙을 만족시키기 위해 질소와 옥시겐 중 하나 사이에 이중 결합을 형성해야 한다. 그러나 분자는 대칭적이기 때문에 어느 옥시겐이 이중 결합을 형성하는지는 중요하지 않다. 이 경우 공진 구조는 세 가지 가능성이 있다. 루이스 구조물을 그릴 때 공명을 표현하는 것은 가능한 공진 형태를 각각 그리고 그 사이에 이중으로 된 화살을 놓거나 부분적인 결합을 나타내기 위해 점선을 사용함으로써 이루어질 수 있다(그러나 후자는 공식적으로 말해서 루이스 구조물이 아닌 공명 혼합물을 잘 표현한다).
동일한 분자에 대한 공명 구조를 비교할 때, 일반적으로 형식 전하가 가장 적은 공진 구조는 전체 공진 하이브리드에 더 많은 기여를 한다. 정식 전하가 필요한 경우, 보다 전기적 요소에 음전하를, 덜 전기적 요소에 양전하를 갖는 공명 구조가 선호된다.
단일 결합도 같은 방법으로 이동시켜 유황 육플루오라이드와 같은 고밸런스 분자에 대한 공명 구조를 만들 수 있는데, 이는 공통적으로 확장된 옥텟 모델 대신 양자 화학 계산에 따른 정확한 설명이다.
공진 구조는 분자가 형태를 전환한다는 것을 나타내는 것이 아니라, 분자가 복수의 형태의 평균으로 작용한다는 것을 나타내는 것으로 해석해야 한다.
예
아질산 이온의 공식은 NO−2.
- 질소는 둘 중 가장 적은 전기 원자로 복수의 기준에 의한 중심 원자가 된다.
- 발란스 전자를 세어라. 질소는 5개의 발란스 전자를 가지고 있다; 각각의 산소는 총 (6 × 2) + 5 = 17의 6을 가지고 있다. 이온은 여분의 전자를 나타내는 -1의 전하를 가지고 있어, 전자의 총수는 18이다.
- 원자를 하나의 결합으로 연결한다. 각각의 산소는 반드시 질소에 결합되어야 하며, 질소는 각 결합에 2개의 전자를 사용한다.
- 한 쌍을 혼자 두어라. 나머지 14개의 전자는 처음에 7개의 단독 쌍으로 배치되어야 한다. 각 산소는 최대 3개의 단독 쌍을 취할 수 있으며, 각 산소는 결합 쌍을 포함하여 8개의 전자를 제공한다. 일곱 번째 단독 쌍은 질소 원자 위에 놓아야 한다.
- 옥텟 규칙을 만족하십시오. 두 산소 원자는 현재 8개의 전자가 할당되어 있다. 질소 원자에는 6개의 전자만 할당되어 있다. 산소 원자 위에 있는 외로운 쌍들 중 하나는 이중 결합을 형성해야 하지만, 두 원자는 똑같이 잘 작동할 것이다. 그러므로 공명구조가 있다.
- 느슨한 끝을 묶어라. 다음 두 개의 Lewis 구조물을 그려야 한다. 각 구조물은 질소 원자에 이중 결합한 두 개의 산소 원자 중 하나를 가지고 있다. 각 구조물의 두 번째 산소 원자는 질소 원자에 단결합될 것이다. 각 구조물에 브래킷을 두르고 충전물(-)을 브래킷 바깥쪽 오른쪽 상단에 추가하십시오. 두 공명의 양식 사이에 양면 화살을 그린다.
대체형식

화학적 구조는 특히 유기 분자를 보여줄 때 더 작은 형태로 쓰여질 수 있다. 응축된 구조 공식에서, 많은 또는 심지어 모든 공동 가치 결합은 제외될 수 있으며, 특정 원자에 부착된 동일한 그룹의 수를 나타내는 첨자가 있을 수 있다. 또 다른 속기 구조도는 골격 공식(본드 라인 공식 또는 탄소 골격 다이어그램이라고도 한다)이다. 골격 공식에서 탄소 원자는 기호 C가 아니라 선들의 정점으로 표시된다. 탄소에 결합한 수소 원자는 표시되지 않는다. 특정 탄소 원자에 대한 결합의 수를 세어 유추할 수 있다. 각 탄소에는 총 4개의 결합이 있다고 가정하므로, 표시하지 않은 결합은 수소 원자에 대한 함축적 의미에 의해 나타난다.
다른 도표는 루이스 구조보다 더 복잡할 수 있는데, 공간 채우기 도표와 같은 다양한 형태를 사용하여 3D로 결합을 보여준다.
사용 및 제한
화학적 결합에 대한 이해가 여전히 초보적이었던 20세기 초의 단순함과 발전에도 불구하고, 루이스 구조는 화학 반응성과 관련된 것을 포함하여 다양한 분자 시스템의 전자적 구조의 주요 특징들 중 많은 부분을 포착한다. 따라서, 그들은 화학자와 화학 교육자들에 의해 널리 사용되는 것을 계속 즐기고 있다. 이것은 특히 전통적인 용맹-본드 결합 모델이 여전히 지배하고 있는 유기 화학 분야에서는 더욱 그러하며, 메커니즘은 종종 루이스 구조의 속기판인 골격 공식에 중첩된 곡선-화살표기법으로 이해된다. 무기질과 유기물 화학에서 만나는 더 다양한 결합 체계 때문에, 마주치는 많은 분자들은 그들의 결합을 적절히 설명하기 위해 완전 소산화된 분자 궤도 사용을 요구하기 때문에 루이스 구조물은 상대적으로 덜 중요해진다(아직은 흔하지만).
적어도 수정되지 않은 형태로 루이스의 묘사가 오해의 소지가 있거나 부정확한 단순하고 원형적인 분자체계가 있다는 점에 유의해야 한다. 특히, 실험적으로 손상된 전자(예2: O, NO, ClO2)를 포함하는 것으로 알려진 분자에 대한 루이스 구조물의 순진한 도면은 결합 순서, 결합 길이 및/또는 자기 성질에 대한 부정확한 추론을 초래한다. 단순한 루이스 모델도 방향성 현상을 설명하지 않는다. 예를 들어 루이스 구조물은 왜 사이클릭 CH66(벤젠)가 정상적인 탈초점화 효과를 넘어 특별한 안정화를 경험하는지, 반면 CH44(사이클로부타디엔)는 실제로 특별한 불안정화를 경험하는지에 대한 설명을 제공하지 않는다. 분자 궤도 이론은 이러한 현상에 대한 가장 직접적인 설명을 제공한다.
참고 항목
참조
- ^ 루이스 공식의 IUPAC 정의
- ^ 줌달, S. (2005) 화학원리 호우톤-미플린 (1905) ISBN0-618-37206-7)
- ^ G.L. Miessler; D.A. Tarr (2003), Inorganic Chemistry (2nd ed.), Pearson Prentice–Hall, ISBN 0-13-035471-6
- ^ Lewis, G. N. (1916), "The Atom and the Molecule", J. Am. Chem. Soc., 38 (4): 762–85, doi:10.1021/ja02261a002
- ^ Miburo, Barnabe B. (1993), "Simplified Lewis Structure Drawing for Non-science Majors", J. Chem. Educ., 75 (3): 317, Bibcode:1998JChEd..75..317M, doi:10.1021/ed075p317
- ^ Lever, A. B. P. (1972), "Lewis Structures and the Octet Rule", J. Chem. Educ., 49 (12): 819, Bibcode:1972JChEd..49..819L, doi:10.1021/ed049p819
- ^ Miessler, G. L. 및 Tarr, D. A., 무기 화학 (제2편, 프렌티스 홀 1998) ISBN 0-13-841891-8, 페이지 49–53 – 공식 충전 사용 설명.

 정식 충전이다.
정식 충전이다. 원소의 자유 원자에 있는 발란스 전자 수를 나타낸다.
원소의 자유 원자에 있는 발란스 전자 수를 나타낸다.





