입체 이성질
Conformational isomerism
화학에서, 입체 이성질체는 이성질체가 공식적으로 단일 결합에 대한 회전에 의해서만 상호 변환될 수 있는 입체 이성질체의 한 형태이다(단일 결합 회전 그림 참조).단일 결합에 대해 회전으로 다른 분자 내 원자의 어떤 두 배열도 다른 형태라고 할 수 있는 반면, 잠재적 에너지 표면의 국소 최소치에 해당하는 배치는 특히 배향 이성질체 또는 [1]배향체라고 불립니다.에너지 표면의 국소 최대치에 해당하는 배치는 국소 최소 배향 이성질체 사이의 전이 상태입니다.단일 결합에 대한 회전은 하나의 컨포머를 다른 컨포머로 상호 변환하기 위해 회전 에너지 장벽을 극복하는 것을 포함합니다.만약 에너지 장벽이 낮은지, 무료 rotation[2]과 화합물 샘플 여러 conformers의 급속하게 equilibrating 혼합물로서 존재하면 에너지 장벽 충분히 그 다음에는 제한된 회전은 높다, 분자가 안정된 회전 이성질체나 rotamer(이성체 hindere에서 발생하는 비교적 오랜 기간에 대해 존재할 수도 있다.d단일 결합 회전).상호변환을 위한 시간 척도가 개별 로타머를 분리하기에 충분히 긴 경우(통상 임의로 정의됨), 이 이성질체를 아트로피소머라고 한다(참조:[1][3][4] 아트로피소머를 아트로피소머라고 한다.치환된 시클로헥산의 고리 플립은 구조 이성질체의 또 다른 일반적인 형태를 구성합니다.
따라서 입체 이성질체(즉, 입체 이성질체)는 상호 변환이 반드시 화학적 [5]결합의 파괴와 개질을 수반하는 다른 종류의 입체 이성질체(즉, 입체 이성질체)와는 구별된다.예를 들어 유기분자의 L/D- 및 R/S-배치는 서로 다른 핸드니스 및 광학활성을 가지며 키랄 원자에 연결된 하나 이상의 결합을 끊고 다른 방향 또는 공간방향으로 유사한 결합을 재형성함으로써만 상호변환될 수 있다.그들은 또한 상호 변환을 위해 이중 결합의 δ 성분을 파괴하는 것을 필요로 하는 또 다른 종류의 입체 이성질체인 기하학적 (cis/trans) 이성질체와는 다르다. (비록 그 구별은 공식적으로 단일 결합인 특정 결합이 실제로 2차 공명이 있을 때만 명백해지는 이중 결합 특성을 가지고 있기 때문에 항상 명확한 것은 아니다.)e 기여자는 예를 들어 아미드의 C-N 결합과 같이 고려된다.)빠른 상호 변환으로 인해 컨포머는 보통 상온에서 분리할 수 없습니다.
상이한 배치 사이의 에너지학 연구는 배치 [6]분석이라고 불린다.예를 들어 치환기의 공간 방향 및 공간 간 상호작용을 고려함으로써 다양한 이성질체의 안정성을 이해하는 데 유용하다.또한 구성 분석을 사용하여 제품 선택성, 메커니즘 [7]및 반응 속도를 예측하고 설명할 수 있습니다.구조 분석은 또한 합리적인 구조 기반 의약품 설계에서 중요한 역할을 한다.
종류들
탄소-탄소 결합을 회전시키면 에탄과 프로판은 세 가지 국소 에너지 최소값을 가집니다.이들은 구조적으로나 에너지적으로 동등하며, 시차적 컨포머라고 불립니다.각 분자에 대해 각 탄소-탄소 결합에서 방출되는 세 가지 치환기는 각각 H-C-C-H 이면각(프로판의 경우 H-C-C-CH3 이면각)이 60°(또는 프로판의 경우 약 60°)와 같다.이면각이 0인 세 개의 일식 배치는 두 개의 등가 에너지 최소값인 엇갈린 배향체를 연결하는 전이 상태(에너지 최대값)이다.
부탄 분자는 단일 결합 회전이 안티 컨피머와 고슈 컨피머로 알려진 두 가지 유형의 비원가 구조를 생성하는 가장 단순한 분자입니다(그림 참조).
예를 들어 부탄은 2개의 메틸기(CH)에3 관한 컨포머를 가진다.즉, 2개의 고슈 컨포머(메틸기 ±60°의 간격을 가지며, 에난티오머)와 1개의 반 컨포머(반 컨포머)가 있으며, 4개의 탄소 중심은 코프라너이며 치환기는 180°의 간격을 가진다(부탄의 자유 에너지도 참조).고슈와 안티의 에너지 차이는 고슈 컨포머의 변형 에너지와 관련된 0.9 kcal/mol입니다.따라서 안티 컨포머가 가장 안정적이다( 0 0kcal/mol).0°, 120° 및 240°의 이면각을 갖는 세 가지 일식 구성은 컨포머 [6]간의 전이 상태이다.두 가지 일식 구조는 서로 다른 에너지를 갖는다. 즉, 0°에서 두 개의 메틸기가 일식되어 120°에서보다 높은 에너지(≈ 5kcal/mol)가 생성되며, 여기서 메틸기는 수소로 일식된다( 3 3.5kcal/mol).[9]
단순한 분자는 이러한 형태의 배좌에 의해 설명될 수 있지만, 더 복잡한 분자는 다른 [6]배좌체를 설명하기 위해 클라인-프렐로그 시스템을 사용해야 한다.
입체구조 이성질체의 보다 구체적인 예는 다른 곳에 자세히 설명되어 있습니다.
- 링 구성
- 알릴 균주 – SP2 카본과 SP3 카본 사이의 단일 결합에 대한 회전에 관련된 에너지학.
- 아트로피 이성질 – 결합에 대한 회전 제한으로 인한 것입니다.
- 생체 고분자(핵산 및 단백질)[10]의 2차 및 3차 구조를 포함하는 접힘.
- Akamptisomerism – 결합 각도의 제한된 반전 때문에 발생합니다.
입체 이성질체의 자유 에너지 및 평형
컨포머의 평형
입체구조 이성질체는 동적 평형에 존재하며, 여기서 이성질체의 상대적 자유 에너지는 각 이성질체의 모집단을 결정하고 회전 에너지 장벽은 [11]이성질체 간의 상호 변환 속도를 결정한다.
여기서 K는 평형상수, δG°는 kcal/mol 단위의 두 컨포머 사이의 표준 자유 에너지 차이, R은 범용 가스 상수(1.987×10−3 kcal/mol K), T는 켈빈 단위의 시스템 온도이다.298 K에서 kcal/mol 단위로,
따라서, 1.36 kcal/mol마다 상온 주변 온도에서 평형 상수로 환산하면 약 10의 인수에 해당한다.("1.36 규칙"은 일반적으로 자유 에너지 차이에서 상온에서 평형 상수를 추정하는 데 유용하다.낮은 온도에서 주어진 평형 상수를 얻으려면 더 작은 에너지 차이가 필요합니다.)
서로 다른 온도에서 두 컨포머의 평형 분포를 나타내는 다이어그램에는 세 개의 등온도가 제시되어 있다.0kcal/mol의 자유 에너지 차이에서 이것은 평형 상수 1을 제공합니다. 즉, 2개의 컨포머가 1:1 비율로 존재함을 의미합니다.그 둘은 동등한 자유 에너지를 가지고 있다; 어느 쪽도 더 안정적이지 않기 때문에, 어느 쪽도 다른 쪽보다 우세하지 않다.자유 에너지의 음의 차이는 컨포머가 열역학적으로 보다 안정적인 구성으로 상호 변환된다는 것을 의미하며, 따라서 평형 상수는 항상 1보다 클 것입니다.예를 들어 고슈 컨포머에서 안티 컨포머로의 부탄 변환의 δG°는 298K에서 [12]-0.47kcal/mol이다.이것은 평형 상수가 반 컨포머에 유리한 약 2.2 또는 평형 상태에서 고슈: 반 컨포머의 31:69 혼합이라는 것을 나타낸다.반대로 자유 에너지의 양의 차이는 컨포머가 이미 더 안정적이라는 것을 의미하므로 상호 변환은 불리한 평형이다(K < 1).매우 불리한 변화(큰 양의 δG°)라도 온도를 높임으로써 두 컨포머 간의 평형정수를 증가시킬 수 있으므로 평형상태에서 존재하는 안정성이 낮은 컨포머의 양이 증가할 수 있다(항상 마이너 컨포머로 유지됨).
컨포머 인구 분포
다른 컨포머의 부분 모집단 분포는 볼츠만 [13]분포를 따릅니다.
왼쪽은 열역학 평형상태에서 M개의 컨포머의 평형혼합물에서 컨포머 i의 비율이다.오른쪽에서k E(k = 1, 2, ..., M)는 컨포머 k의 에너지, R은 몰 이상 기체 상수(약 8.314J/(mol·K) 또는 1.987cal/(mol·K)와 동일), T는 절대 온도이다.오른쪽 분모는 파티션 함수입니다.
컨포머의 자유 에너지에 기여하는 요인
치환기의 정전 및 입체 상호작용의 영향뿐만 아니라 과접합과 같은 궤도 상호작용은 컨포머의 상대적 안정성과 그 전이 상태에 영향을 미친다.이러한 요인의 기여도는 대체물의 특성에 따라 다르며 에너지 장벽에 긍정적이거나 부정적으로 기여할 수 있다.에탄과 같은 작은 분자에 대한 컴퓨터 연구는 정전 효과가 에너지 장벽에 가장 큰 기여를 한다는 것을 시사한다; 하지만, 장벽은 전통적으로 주로 입체 [14][15]상호작용에 기인한다.
순환계의 경우 자유에너지에 대한 입체효과와 기여는 A값으로 근사할 수 있으며, A값은 적도위치에 비해 축방향의 사이클로헥산에 치환기가 있을 때의 에너지 차이를 측정한다.큰(>14 원자) 고리에는 무변형 다이아몬드 [16]격자에 대응하는 많은 접근 가능한 저에너지 구조가 있다.
입체구조 이성질체 분리 또는 관찰
상호 변환의 짧은 시간 척도로 인해 대부분의 경우 입체 이성질체의 분리가 방지됩니다.아트로피소머는 제한된 [17]회전으로 인해 분리될 수 있는 입체구조 이성질체이다.입체구조 이성질체 사이의 균형은 다양한 스펙트럼 분석 기법을 사용하여 관찰할 수 있다.
단백질 접힘은 또한 관찰할 수 있는 안정된 입체구조 이성질체를 생성한다.Karplus 방정식은 NMR에 의해 측정된 바이시얼 양성자의 이면각과 J 결합 상수를 관련짓는다.이 방정식은 단백질 접힘의 해명과 다른 단단한 지방족 [18]분자의 구조를 설명하는 데 도움이 됩니다.단백질 측쇄는 로타머를 나타내며, 그 분포는 [19]골격의 다른 형태와의 입체적 상호작용에 의해 결정된다.이것은 Backbone-dependent Rotamer 라이브러리에서 단백질 측쇄의 구조에 대한 통계적 분석에서 명백하다.
시클로헥산 유도체에서 두 개의 의자 컨포머는 상온에서 빠르게 상호 변환되며, 시클로헥산 자체는 약 105 링 플립/초의 속도로 링 플립을 수행하며, 전체 에너지 장벽은 10 kcal/mol(42 kJ/mol)이며, 이는 주변 [20]온도에서 분리를 방지한다.단, 결합점 이하의 저온에서는 NMR 스펙트럼법과 동적 온도 의존 NMR 스펙트럼법으로 장벽 상호변환을 [21]직접 모니터링할 수 있다.
배향 이성질(및 다른 종류의)의 역학은 다양한 온도에서 NMR 분광법에 의해 감시될 수 있다.이 기술은 8-14 kcal/mol의 장벽에 적용되며, 그러한 역학을 보이는 종들은 종종 "플루시온"이라고 불린다.
컨포머 비율을 측정하기 위해 NMR 분광법 외에 IR 분광법을 사용한다.브로모시클로헥산의 축방향 컨포머와 적도 컨포머는 θ가CBr 약 50cm−1 [20]차이가 난다.
배좌의존반응
반응속도는 반응물질의 형태에 따라 크게 달라진다.대부분의 경우 지배적인 산물은 커틴-해밋 원리에 의해 덜 일반적인 컨포머의 반응에서 발생한다.이것은 제품을 형성하기 위한 반응보다 구조 평형이 훨씬 빠른 상황에서 전형적입니다.따라서 입체화학적 방향에 대한 반응의 의존성은 일반적으로 치환기에 의해 특정 배치가 잠기는 구성 이성질체에서만 볼 수 있다.모든 컨포머와 그 균주에 의해 지배되는 상대적 안정성을 [22]고려할 경우 케톤 환원, 알코올 산화 또는 친핵성 치환과 같은 sp2와 sp3 상태 사이의 전이를 포함하는 많은 반응 속도의 예측이 가능하다.
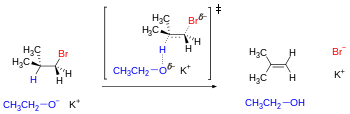
염기의 영향을 받아 근위 또는 반평면 위치에서 양성자와 이탈기를 동시에 제거하는 제거 반응에 의해 구성 이성체를 갖는 예가 제공된다.
이 메커니즘은 출발하는 원자 또는 그룹이 반평행 궤적을 따를 것을 요구한다.오픈체인 기판의 경우 이 기하학적 전제조건은 3개의 컨포머 중 적어도 1개로 충족된다.그러나 시클로헥산 등의 일부 순환기판에서는 배향 잠금을 [23]설정할 수 있는 치환기에 따라 역평행 배치가 달성되지 않을 수 있다.사이클로헥산 링 상의 인접 치환기는 횡단 반축 위치(즉, 둘 다 축 위치에 있고 하나는 위로, 하나는 아래로)에 있을 때만 반평면성을 달성할 수 있습니다.
이 분석의 결과 중 하나는 트랜스-4-tert-부틸시클로헥실 염화물이 쉽게 제거되지 않고 대신 치환(아래 그림 참조)을 받는 것이다. 왜냐하면 가장 안정적인 배치는 부피가 큰 t-Bu기를 적도 위치에 가지고 있기 때문이다. 따라서 염화물기는 어떤 근위수소와도 반평면적이지 않다(4개 모두에 대하여 고크).) 열역학적으로 미가공배치는 축방향 위치에 t-Bu기가 있어 에너지가 5 kcal/mol 이상 높다(A값 [24]참조).그 결과, t-Bu군은 고리가 적도 위치에 있는 배색으로 「잠금」되어 치환 반응이 관찰된다.한편 cis-4-tert-부틸시클로헥실염화물은 t-Bu기가 적도에 있을 때 Cl과 H의 반평면성을 얻을 수 있기 때문에 제거된다.
1,3-diaxial 위치에서 축방향 t-부틸기와 수소 원자 사이의 반발력이 너무 강하여 사이클로헥산 고리가 비틀린 보트 형태로 되돌아간다.순환 구조의 변형은 일반적으로 이상적인 결합 각도(배이어 변형), 이상적인 비틀림 각도(피처 변형) 또는 환상(프렐로그) 상호 작용으로부터의 편차로 특징지어집니다.
알칸 입체 화학
알칸 컨포머는 sp 하이브리드화된 탄소-탄소 시그마 결합 주변에서3 회전하여 발생합니다.이러한 화학적 결합을 가진 가장 작은 알칸인 에탄은 C-C 결합 주위의 회전에 관해 무한히 많은 형태로 존재한다.이 중 두 가지는 에너지 최소(정지된 구성) 및 에너지 최대(이클립된 구성) 형태로 인식된다.비록 경쟁 이론에 의해 초결합의 역할이 제안되기는 하지만, 특정 구성의 존재는 시그마 결합 주위의 회전이 방해되기 때문이다.
에너지 최소값과 에너지 최대값의 중요성은 이러한 개념을 최소 에너지 형태로 안정적인 구성이 예측될 수 있는 보다 복잡한 분자로 확장함으로써 확인할 수 있다.안정된 배형의 결정은 또한 비대칭 유도의 개념과 입체 효과에 의해 제어되는 반응의 입체 화학을 예측하는 능력의 확립에 큰 역할을 했다.
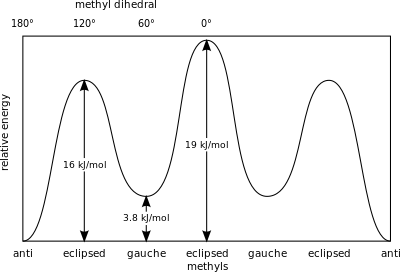
뉴먼 투영에서의 엇갈린 에탄 예에서 한 탄소원자상의 수소원자는 다른 탄소원자상의 가장 가까운 수소원자에 대해 60°의 비틀림각 또는 비틀림각을 가지므로 입체장애가 최소화된다.에탄에 대한 에너지 최대값인 일식 구성보다 비틀어진 구성이 12.5 kJ/mol 더 안정적이다.일식 구성에서는 비틀림 각도가 최소화됩니다.


부탄에서는 두 개의 엇갈린 구성이 더 이상 동일하지 않으며 두 개의 뚜렷한 컨포머, 즉 안티 컨포메이션(왼쪽 끝, 아래)과 고슈 컨포메이션(오른쪽 끝, 아래)을 나타냅니다.



두 형태 모두 비틀림 변형률이 없지만, 고슈 형태에서 두 메틸기는 반데르발스 반지름의 합보다 더 가깝다.두 메틸기 사이의 상호작용은 거부감(반데르발스 균주)이며 에너지 장벽이 발생한다.
부탄 컨포머에 저장된 위치 에너지의 측정값은 [26]'안티' 컨포머의 지면 상태보다 더 큰 입체적 장애를 가진다.
- Gauche, 컨포머– 3.8 kJ/mol
- 일식 H 및 CH3 – 16 kJ/mol
- 일식3 CH 및 CH3 – 19 kJ/mol.
일식화된 메틸기는 단일 수소 원자에 비해 전자 밀도가 높기 때문에 더 큰 입체 변형을 보인다.
에탄에서 일식화된 형태에 대한 에너지 최대치의 존재에 대한 교과서적인 설명은 입체 장애물이지만, C-C 결합 길이가 154pm이고 수소가 120pm인 반데르발스 반경이므로 에탄에 있는 수소 원자는 결코 서로 방해가 되지 않는다.에너지 최대량의 저하가 입체 장애의 원인인지에 대한 질문은 오늘날까지 논쟁의 주제이다.입체 장애 설명의 한 가지 대안은 Natural Bond Orbit [27][28][29]Framework 내에서 분석되는 초접합에 기초한다.이 엇갈린 형태에서 한쪽 C-H 시그마 결합 오비탈은 다른 쪽 C-H 결합의 반결합 오비탈에 전자밀도를 기부한다.이 효과의 에너지 안정화는 두 궤도가 최대 중첩을 가질 때, 엇갈린 형태에서 발생할 때 극대화된다.일식 구조에는 겹치는 부분이 없으며, 이로 인해 바람직하지 않은 에너지 극대치가 초래됩니다.한편, 정량적 분자 궤도 이론 내에서의 분석은 2-궤도-4-전자([30]스테릭) 반발이 초접합보다 우세하다는 것을 보여준다.원자가 결합 이론 연구는 또한 입체 [31]효과의 중요성을 강조한다.
명명법
IUPAC Gold Book에 열거된 표준별 알칸 명명 작업은 단일 [32]결합 주위의 치환기 사이의 각도( 비틀림 또는 이면각이라고 함)를 지정하기 위한 Klyne-Prelog 시스템에 따라 수행됩니다.
- 0°와 ± 90° 사이의 비틀림 각도를 syn(s)이라고 한다
- ± 90°에서 180° 사이의 비틀림 각도를 안티(a)라고 한다
- 30°와 150° 사이 또는 -30°와 -150° 사이의 비틀림 각도를 클리날(c)이라고 한다.
- 0°와 ±30° 사이 또는 ±150°와 180° 사이의 비틀림 각도를 근평면(p)이라고 한다.
- 0°와 ± 30° 사이의 비틀림 각도는 합성 또는 시스 컨피그레이션이라고도 한다.
- 30°에서 90°, -30°에서 -90° 사이의 비틀림 각도는 싱클리니얼(sc)이라고 불리며, 고슈[33] 또는 스큐라고도 불린다.
- 90°와 150° 사이 또는 -90°와 -150° 사이의 비틀림 각도를 반사각(ac)이라고 한다.
- ±150°에서 180° 사이의 비틀림 각도는 반평면(ap)이라고 불리며, 반구성 또는 트랜스컨피규레이션이라고도 불린다.
비틀림 변형률 또는 "피처 변형률"은 접합부의 비틀림에 대한 저항을 말합니다.
특수한 경우
n-펜탄에서 말단 메틸기는 추가적인 펜탄 간섭을 경험한다.
폴리테트라플루오로에틸렌 중 수소를 불소로 치환하면 1,3위치의 불소 원자의 정전적 반발에 의해 입체화학이 지그재그 형상에서 나선의 형상으로 변화한다.결정 상태의 나선구조에 대한 증거는 X선 결정학, [34]용액 중의 NMR 분광법 및 원형 이색성에서 도출된다.
「 」를 참조해 주세요.
- 아노머 효과
- 백본 의존형 로타머 라이브러리
- 사이클로알칸
- 사이클로헥산
- 고슈 효과
- 이성질체
- 클린 프롤로그 시스템
- 매크로사이클식 스테레오 컨트롤
- 분자 구조
- 분자 모델링
- 분자대칭 molecular 분자비강성
- 입체 효과
- 변형률(화학)
레퍼런스
- ^ a b c Moss, GP (1996-01-01). "Basic terminology of stereochemistry (IUPAC Recommendations 1996)". Pure and Applied Chemistry. 68 (12): 2193–2222. doi:10.1351/pac199668122193. ISSN 1365-3075. S2CID 98272391.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (1996) "자유회전(감겨진 회전, 제한된 회전)" doi:10.1351/goldbook.F02520
- ^ 오키, 미치노리(1983) 입체화학의 토픽, 제14권(N. L. Allinger, E. L. Elliel 및 S. H. Wilen, Eds), NJ 호보켄: John Wiley & sons, 1페이지, 82)의 아트로피소머리즘의 최근 발전.
- ^ Alkorta, Ibon; Jose Elguero; Christian Roussel; Nicolas Vanthuyne; Patrick Piras (2012). Atropisomerism and Axial Chirality in Heteroaromatic Compounds. Advances in Heterocyclic Chemistry. Vol. 105. pp. 1–188. doi:10.1016/B978-0-12-396530-1.00001-2. hdl:10261/62060. ISBN 9780123965301.
- ^ Hunt, Ian. "Stereochemistry". University of Calgary. Retrieved 28 October 2013.
- ^ a b c Anslyn, Eric; Dennis Dougherty (2006). Modern Physical Organic Chemistry. University Science. p. 95. ISBN 978-1891389313.
- ^ Barton, Derek (1970). "The Principles of Conformational Analysis". Nobel Media AB 2013. Elsevier Publishing Co. 169 (3945): 539–44. Bibcode:1970Sci...169..539B. doi:10.1126/science.169.3945.539. PMID 17746022. Retrieved 10 November 2013.
- ^ J, McMurry (2012). Organic chemistry (8 ed.). Belmont, CA: Brooks/Cole. p. 98. ISBN 9780840054449.
- ^ Bauld, Nathan. "Butane Conformational Analysis". University of Texas. Retrieved 28 October 2013.
- ^ Dunbrack, R. (2002). "Rotamer Libraries in the 21st Century". Current Opinion in Structural Biology. 12 (4): 431–440. doi:10.1016/S0959-440X(02)00344-5. PMID 12163064.
- ^ Bruzik, Karol. "Chapter 6: Conformation". University of Illinois at Chicago. Archived from the original on 11 November 2013. Retrieved 10 November 2013.
- ^ 표준 엔탈피 변화 δH°는 고슈에서 안티로 -0.88 kcal/mol입니다.그러나 두 가지 가능한 가우슈 형식이 있기 때문에 엔트로픽 용어로 고려해야 하는 통계적 요인이 있습니다.따라서 298K에서 δG° = δH° – TδS° = δH° + RT ln 2 = -0.88 kcal/ln + 0.41 kcal/ln = -0.47 kcal/lnm이다.
- ^ Rzepa, Henry. "Conformational Analysis". Imperial College London. Retrieved 11 November 2013.
- ^ Liu, Shubin (7 February 2013). "Origin and Nature of Bond Rotation Barriers: A Unified View". The Journal of Physical Chemistry A. 117 (5): 962–965. Bibcode:2013JPCA..117..962L. doi:10.1021/jp312521z. PMID 23327680.
- ^ Carey, Francis A. (2011). Organic chemistry (8th ed.). New York: McGraw-Hill. p. 105. ISBN 978-0-07-340261-1.
- ^ Dragojlovic, Veljko (2015). "Conformational analysis of cycloalkanes" (PDF). Chemtexts. 1 (3). doi:10.1007/s40828-015-0014-0. S2CID 94348487.
- ^ McNaught (1997). "Atropisomers". IUPAC Compendium of Chemical Terminology. Oxford: Blackwell Scientific Publications. doi:10.1351/goldbook.A00511. ISBN 978-0967855097.
- ^ Dalton, Louisa. "Karplus Equation". Chemical and Engineering News. American Chemical Society. Retrieved 2013-10-27.
- ^ Dunbrack, R. L.; Cohen, F. E. (1997). "Bayesian statistical analysis of protein side-chain rotamer preferences". Protein Science. 6 (8): 1661–1681. doi:10.1002/pro.5560060807. ISSN 0961-8368. PMC 2143774. PMID 9260279.
- ^ a b Eliel, E. L.; Wilen, S. H.; Mander, L. N. (1994). Stereochemistry Of Organic Compounds. J. Wiley and Sons. ISBN 978-0-471-01670-0.
- ^ Jensen, Frederick R.; Bushweller, C. Hackett (1969-06-01). "Separation of conformers. II. Axial and equatorial isomers of chlorocyclohexane and trideuteriomethoxycyclohexane". Journal of the American Chemical Society. 91 (12): 3223–3225. doi:10.1021/ja01040a022. ISSN 0002-7863.
- ^ 슈나이더, H.-J.; 슈미트, G.;토마스 F. J. 암화학, 사회학, 1983년, 105년, 3556년https://pubs.acs.org/doi/pdf/10.1021/ja00349a031
- ^ "Cycloalkanes". Imperial College London. Retrieved 28 October 2013.
- ^ Dougherty, Eric V. Anslyn; Dennis, A. (2006). Modern Physical Organic Chemistry (Dodr. ed.). Sausalito, CA: University Science Books. p. 104. ISBN 978-1-891389-31-3.
- ^ 골드북 링크
- ^ 유기화학 6e, McMurray, J.E., Brooks Cole(2003)
- ^ 초접합 비 입체적 반발은 에탄 구조의 비틀림을 초래한다.Pophristic, V. & Goodman, L. Nature 411, 565-568 (2001) 추상
- ^ 화학: 분자 형상의 새로운 반전 Frank Weinhold Nature 411, 539-541 (2001년 5월 31일)
- ^ 에탄의 엇갈린 배열을 야기하는 입체 반발에 대한 Bickelhaupt-Barends 사례에 대한 반박.Weinhold, F.앵귀, 화학.내부 번호 42, 4188–4194(2003)
- ^ 스테릭 반발의 경우 에탄 배열을 엇갈리게 합니다.빅켈하우트, 에프엠앤배런즈, E.J.앵거화학 회사Ed. 42, 4183-4188 (2003)
- ^ 에탄에서의 과잉 결합의 크기: 초기 결합 이론의 관점.모, Y.R. 등앵귀, 화학.1986~1990년 제43호(2004)
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "토션 각도".doi:10.1351/goldbook.T06406
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "gauche" . doi : 10.1351 / goldbook . G02593
- ^ VCD Kenji Monde, Nobuaki Mi Hashimoto, Tohru Taniguchi, Tamotsu Inabe J. Am에 의한 키랄 헬리컬 퍼플루오로알킬 체인의 구조 분석 Chem. Soc.; 2006; 128(18) 페이지 6000–6001, 그래픽 추상