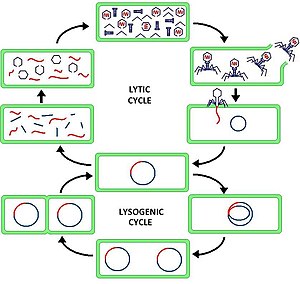
라이틱 사이클
Lytic cycle리틱 사이클(/ˈlɪtɪk/LIT-ik)은 바이러스 번식의 두 사이클 중 하나(세균 바이러스 또는 박테리오파지를 참조), 다른 사이클은 리소겐 사이클이다. 라이틱 사이클은 감염된 세포와 세포막의 파괴를 초래한다. 리틱 사이클만 사용하는 박테리오파지는 (온대성 페이징과는 대조적으로) 맹독성 페이징이라고 불린다.
라이틱 사이클에서는 바이러스 DNA가 박테리아 세포 내에 별도의 자유 부유 분자로 존재하며 숙주 박테리아 DNA와 별도로 복제되는 반면, 리소겐 사이클에서는 바이러스 DNA가 숙주 DNA 내에 위치한다. 이것이 리틱과 리소게닉(박테리오) 페이징 사이클의 주요 차이점이다. 그러나 두 경우 모두 바이러스/피지는 호스트 DNA 기계를 사용하여 복제한다.
설명
박테리오파지의 "생산적인 순환"이라고도 불리는 리틱 사이클은 6단계 사이클이다. 6단계는 부착, 침투, 전사, 생합성, 성숙, 투석이다.
- 부착 – 페이지는 세포에 DNA를 주입하기 위해 숙주 세포 표면에 스스로 부착된다.
- 침투 – 페이지는 세포막을 통해 침투하여 숙주 세포에 DNA를 주입한다.
- 전사 – 숙주 세포의 DNA가 저하되고 세포의 신진대사가 유도되어 페이징 생합성을 시작한다.
- 생합성 – 페이지는 세포 안에서 복제되며 새로운 페이지는 DNA와 단백질을 합성한다.
- 성숙 – 복제된 물질은 완전히 형성된 바이러스 페이징으로 조립된다(각각 머리, 꼬리 및 꼬리 섬유로 구성됨).
- 용해 – 새로 형성된 페이지는 감염된 세포에서 방출되며(이 과정에서 그 자체가 파괴됨) 감염될 새로운 숙주 세포를 찾기 위한 것이다.
부착 및 삽입
숙주세포를 감염시키려면 바이러스는 먼저 혈장막을 통해 자신의 핵산을 세포에 주입하고 (있는 경우) 세포벽에 주입해야 한다. 이 바이러스는 세포 표면의 수용체에 부착하거나 단순한 기계적 힘에 의해 그렇게 한다. 결합은 정전기 상호작용에 기인하며 pH와 이온의 존재에 의해 영향을 받는다. 그러면 바이러스는 자신의 유전 물질(단일 또는 이중 가닥의 RNA 또는 DNA)을 세포로 방출한다. 몇몇 바이러스에서 이 유전 물질은 원형이고 박테리아 플라스미드를 흉내낸다. 이 단계에서 세포가 감염되고 면역체계의 표적이 될 수도 있다. 그것은 대부분 세포 표면의 수용체에 의해 보조된다.
전사 및 생합성
전사와 생합성 단계에서 바이러스는 세포의 복제와 변환 메커니즘을 가로채 더 많은 바이러스를 만들기 위해 사용한다. 이 바이러스의 핵산은 숙주 세포의 대사 기계를 사용하여 많은 양의 바이러스 성분을 만든다.
DNA 바이러스의 경우, DNA 트랜스퍼는 그 자체를 전령 RNA(mRNA) 분자로 만들어 세포의 리보솜을 지시하는 데 사용된다. 번역된 최초의 폴리펩타이드 중 하나가 숙주의 DNA를 파괴한다. (RNA 가닥을 주입하는) 역분해효소라는 독특한 효소는 바이러스성 RNA를 DNA로 옮겨 다시 RNA로 옮겨진다. 일단 바이러스 DNA가 통제되면 숙주 세포의 기계가 바이러스 DNA와 단백질을 합성하도록 유도하고 곱하기 시작한다.
생합성은 mRNA 생산의 3단계에 이어 단백질 생산의 1단계로 조절된다(예:[1] T4).
- 초기 단계
- 효소는 숙주의 전사 과정을 RNA 중합효소에 의해 수정한다. 그 중에서도 바이러스 T4는 항시그마 인자를 생성하여 숙주의 시그마 인자를 변화시켜 숙주 프로모터가 더 이상 인식되지 않고 현재 T4 중간 단백질을 인식하도록 한다. 단백질 합성을 위해 샤인-달가르노의 반복 GAGGG는 초기 유전자 번역을 지배한다.[2]
- 중간상
- 바이러스 핵산(바이러스 유형에 따라 DNA 또는 RNA).
- 후기상
- 머리와 꼬리를 포함한 구조 단백질.
성숙 및 용해
초기 감염 후 약 25분 후에 약 200개의 새로운 바이러스(바이러스체)가 형성된다. 일단 충분한 병리체가 성숙하고 축적되면, 세포벽을 녹이는 데 특화된 바이러스 단백질이 사용된다. 세포벽에 의해 더 이상 제약될 수 없는 높은 내부 삼투압(수압)으로 인해 세포가 파열(즉, 용해)된다. 이것은 다른 세포들을 감염시킬 수 있고 또 다른 라이틱 사이클이 시작되는 주변 환경으로 생식 바이러스를 방출한다. 숙주의 용해( lage)를 일으키는 페이지를 리틱(lytic) 또는 맹독성 페이즈(viral phage)라고 한다.[3]
유전자조절생화학
페이지 게놈에는 리틱이나 리소겐 사이클이 나타날지 여부를 조절하는 세 종류의 유전자가 있다. 첫 번째 부류는 즉시 초기 유전자, 두 번째 부류는 지연 초기 유전자, 세 번째 부류는 후기 유전자다. 다음은 대장균의 잘 연구된 온대성 파이지 람다에 관한 것이다.
- 즉시 초기 유전자: 이들 유전자는 숙주 RNA 중합효소(RNA polyerase)에 의해 인식된 촉진제로부터 발현되며, Cro, cII는 주 리소겐 억제제 유전자인 cI의 발현을 자극하는 전사 인자인 반면, Cro는 cI 발현에 대한 억제제다. 용해성 결정은 주로 Cro와 CII의 경쟁에 의해 영향을 받아 충분한 CI 억제기가 만들어졌는지 아닌지를 결정하는 결과를 초래한다. 만약 그렇다면, CI는 초기 촉진자들을 억압하고 감염은 리소겐 경로로 옮겨진다. N은 지연된 초기 유전자의 전사에 필요한 반종말 인자다.
- 지연된 초기 유전자: 여기에는 복제 유전자 O와 P와 모든 후기 유전자의 전사를 담당하는 항단말기(anti-terminator)를 암호화하는 Q도 포함된다.
- 후기 유전자:
Lytic 경로를 선택하면 감염 후 약 6~8분 후에 후기 전사의 Q 매개 켜기가 시작된다. 단일 후기 촉진자로부터 25개 이상의 유전자가 발현되어 4개의 평행 생합성 경로가 생긴다. 그 경로 중 세 가지는 처녀막의 세 가지 구성 요소인 DNA가 채워진 머리, 꼬리, 그리고 옆 꼬리 섬유의 생산을 위한 것이다. 바이러스들은 감염 후 약 20분 후에 첫 번째 바이러스들이 나타나면서 이들 구성 요소들로부터 자체 조립된다. 네 번째 방법은 용해용이다. 람다에서는 5개의 단백질들이 용해에 관여한다: 유전자 S의 홀린과 안티홀린, 유전자 R의 엔돌리신, 그리고 유전자 Rz와 Rz1의 스패닌 단백질. 야생형 람다에서는 약 50분에서 용석이 일어나 약 100개의 완성된 처녀막을 방출한다. 용해 시기는 홀린과 안티홀린 단백질에 의해 결정되며, 후자는 전자를 억제한다. 개괄적으로 보면 홀린 단백질이 세포질 막에 축적되어 갑자기 미크론 크기의 구멍이 생기게 되고, 이것이 용해작용을 유발한다. 내성신 R은 펩티도글리칸을 공격하는 경막으로 방출된다. 스패닌 단백질 Rz와 Rz1은 각각 세포막과 외부막에 축적되어 펩티도글리칸의 메쉬워크를 통해 페리플라즘에 걸쳐 있는 복합체를 형성한다. 엔돌리신이 펩티도글리칸을 분해하면 스패닌 복합체가 해방되어 외막의 붕괴를 일으킨다. 펩티도글리칸을 엔돌리신에 의한 파괴와 스패닌 콤플렉스에 의한 외막파괴는 모두 람다 감염의 투석을 위해 필요하다.
용해 억제: T4와 같은 페이지는 감염된 세포가 다른 T4(또는 밀접하게 연관되어 있는) 처녀성에 의해 초감염을 겪는 경우 T4 홀린을 억제하는 두 개의 유전자를 가지고 있다. 초감염이 반복되면 T4 감염이 몇 시간 동안 투석 없이 계속돼 바이러스 축적이 정상보다 10배 이상 높아질 수 있다.[4]
참조
- ^ Madigan M, Martinko J (editors) (2006). Brock Biology of Microorganisms (11th ed.). Prentice Hall. ISBN 978-0-13-144329-7.
{{cite book}}:author=일반 이름 포함(도움말) - ^ Malys N (2012). "Shine-Dalgarno sequence of bacteriophage T4: GAGG prevails in early genes". Molecular Biology Reports. 39 (1): 33–9. doi:10.1007/s11033-011-0707-4. PMID 21533668. S2CID 17854788.
- ^ 생물학 계열
- ^ "The Lytic Cycle of the T-Even Bacteriophage". nemetoadreviews.com. Retrieved January 9, 2018.