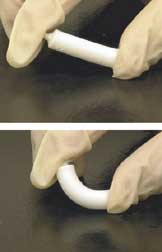
인공뼈
Artificial bone인공골이란 뼈 이식에 사용할 수 있는 실험실에서 만들어진 뼈와 같은 물질을 말하며, 골절이나 질병 등이 심해 유실된 사람의 뼈를 대신한다.[1]
뼈의 완전 또는 부분적인 골절인 골절은 연간 300만 명 이상의 미국 환자가 발생하는 매우 흔한 질환이다.[2] 인간의 뼈는 뼈 재흡수와 뼈 형성의 순환에 의해 스스로 재생되는 능력을 가지고 있다. 뼈 재흡수를 담당하는 세포는 골성형이고, 뼈 형성을 담당하는 세포는 골성형이다. 말하자면, 인체는 골절된 뼈를 재생시킬 수 있다. 그러나 질병이나 중상으로 뼈에 손상이 생기면 몸이 스스로 회복되기 어려워진다. 인체가 잃어버린 뼈 조직을 재생할 수 없게 되면 외과의들이 들어와 자동기프트, 알로그라프트, 합성 이식물(인공 뼈) 등을 이용해 없어진 뼈를 교체한다. 인공뼈를 자동조종 및 알로그라프트와 비교할 때 알려지지 않은 바이러스 감염의 위험을 피하기 때문에 침습성이 낮고 생체적합성이 높다.[3]
이식된 생체물질을 설계할 때 주요 기준은 생체적합성, 골수축성, 다공성, 생체역학 호환성이다. 인공 뼈는 처음에는 금속이나 고체 세라믹과 같은 물질로 만들어졌는데, 이것은 뼈의 하중을 지탱할 수 있을 만큼 튼튼하다. 그러나 이러한 물질의 경직성은 환자에게 엄청난 부담을 안겨주었으며 생체 물질을 이식하는 기준과 일관되지 않았다. 금속과 세라믹으로 만들어진 인공뼈는 뼈 조직과 혼합되기 어렵기 때문에 생체적합성 측면에서 좋지 않은 성과를 내는 경향이 있다.[4] 그러므로, 더 편안한 삶을 살 필요가 있는 사람들을 더 잘 돕기 위해, 기술자들은 더 나은 인공 뼈 구조와 물질을 생산하고 디자인하는 새로운 기술을 개발하고 있다.
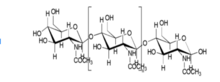
뼈의 두 주요 성분은 히드록사파타이트[Ca10(PO4)6(OH)2)]와 콜라겐 섬유다. 인산칼슘의 가장 안정된 형태 중 하나인 히드록사파타이트는 뼈의 약 60~65%를 차지한다.[5] 뼈의 나머지 부분은 연드로이틴 황산염, 케라탄 황산염, 지질 등의 물질로 구성되어 있다.[5] 콜라겐과 히드록사파타이트의 조직, 성질의 구조에 관한 연구와 지식이 증가하면서 뼈 조직 공학에서 콜라겐 기반의 비계가 많이 개발되었다. 히드록사파타이트의 구조는 원래 뼈와 매우 유사하며, 콜라겐은 분자 케이블의 역할을 할 수 있어 임플란트의 생체적합성을 더욱 향상시킬 수 있다.[6]
개요
골손상 인구통계
미국에서는 매년 650만 건 이상의 뼈 결함과 300만 건 이상의 안면 손상 사례가 보고되고 있다. 전 세계적으로 매년 220만 건 이상의 뼈 이식 수술이 행해지고 있다. 뼈 이식의 일반적인 원인은 종양 절제술, 선천성 기형, 외상, 골절, 수술, 골다공증, 관절염이다.[7] 2010년 전국이동진료조사(NAMCS)에 따르면 미국 내 정형외과 진료실 방문 건수는 약 6300만 건, 응급실 내 골절 방문 건수는 약 350만 건으로, 골절 또는 결함 환자 650만 건 중 약 88만7679명이 입원했다.[8]
현재 골 이식 부위(골격 유형, 복합체)
뼈접착의 재료 유형에 대한 연구는 전통적으로 유기 다당류(치틴, 키토산, 알긴산)와 미네랄(히드록사파타이트)의 합성물을 생산하는 데 집중되어 왔다. 교차연계 칼슘 이온으로 구성된 알긴산염은 피부, 간, 뼈의 재생에 활발하게 탐사되고 있다.[9] 알긴산염의 비계를 만들어 새로운 다당류로 만드는 능력. 많은 미네랄을 뼈의 조성에 적용할 수 있지만, 히드록사파타이트는 그 강도와 알려진 인간 뼈의 자거-프래틀 모델이 간격과 제작에 대한 기존의 틀을 제공하기 때문에 지배적인 물질로 남아 있다.
재료 종류
인공 뼈에 사용하기에 적합한 물질은 생체 적합성, 골수축성, 기계적으로 강해야 한다.[5] 왜냐하면 이것은 생체 적합성과 osteoconductivity는 효과적이고, 오래 지속되는 뼈 이식을 요구해 왔다 Hydroxyapatite 자주 인공 뼈 연구에서 깨고 추가적인 전시회 매년 약 10wt%의 크게 새롭게 형성된 뼈의 성장률보다, meas이 필요한 느리다는 용해 속도, brittle,[5]된다.네es 그것의 해체율을 높이기 위해.[10] 내구성이 우수한 소재를 필요로 하는 어플리케이션의 경우 인장강도 및 영의 계량성이 높아 나노구조 인조 나크를 사용할 수 있다.[11] 한 종류의 재료를 사용하면 인공뼈 이식술의 기능이 제한되는 경우가 많아 복합재료를 활용한다. 치토산과 히드록사파타이트로 구성된 임플란트는 치토산의 생체적합성과 복합 다공성 형상으로 성형되는 능력, 히드록사파타이트의 골축성 등을 활용해 세 가지 특징을 모두 살린 복합체를 만든다.[5] 인공뼈에 사용하기에 적합한 다른 합성물로는 비계 형성 특성으로 알려진 생물 고분자인 알긴산을 사용하는 것이 있다. 합성물에서 알긴산염의 용도는 골조직 수리를 위한 키토산 합성물, 결함이 있거나 병든 뼈를 수리하거나 교체하는 바이오글라스 합성물, 골재생을 위한 세라믹 콜라겐 합성물이 있다.[9] 인공 뼈 이식물에 사용되는 물질은 궁극적으로 생성되는 임플란트의 종류와 그 사용에 달려 있다.
인공뼈 3D 프린팅
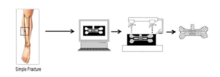
3D 프린팅은 인공 뼈를 만드는 효율적인 방법이 되고 있다. 첫째, 골격 모델은 환자로부터 얻은 CAT 스캔 영상의 재구성을 통해 생성된다. 그 후 인공 뼈 재료는 3D 프린팅의 "필라멘트"로 사용된다. 분해능 이식편에 따르면, 3D 골격 모델은 몇 개의 층으로 나뉘게 된다. 프린터는 한 겹을 인쇄하고, 그 다음에 한 겹을 인쇄하고, 마침내 인공 뼈를 만들 것이다. 대부분의 최근 연구는 히드록시파타이트(HA) 나노크리스탈이 3D 프린팅된 인공뼈에 이상적인 물질이라는 것을 보여준다. HA 나노크리스탈은 각각 인과 칼슘 전구체로서 직경모늄 인산염과 염화칼슘을 이용한 습합성에 의해 합성된다.[12] 또한 일부 연구 보고서에서는 폴리카프로락톤(PCL)을 인공뼈의 3D 인쇄에 사용할 수도 있다. 손상된 뼈를 수리하는 것에 비해 3D 프린팅 기술은 개인화된 수리 필요를 충족시키는 임플란트를 생산할 수 있다. 반면 3D 프린팅 기술은 환자에게 거의 악영향을 주지 않는 임플란트를 만들어낸다. 림프구와 적혈구 등 다양한 분류의 숙주세포는 인공이식에 대한 면역학적 반응을 최소화하고 있다.[13]
이점
재료 특성
효과적인 골격 대체 재료는 적절한 생체 활동과 함께 우수한 기계적 강도를 보여야 한다. 종종 용해율과 임플란트 표면의 인비보에 광물층 형성을 기준으로 측정되는 생체활동은 도핑에 의해 성분과 구조를 수정함으로써 특히 히드록사파타이트에서 강화될 수 있다.[10] 히드록시렙타이트 시스템의 대안으로 치토산 합성물은 인공뼈에 사용할 수 있는 하나의 재료로 철저히 연구되어 왔다.[5] 치토산은 그 자체로도 다공성 구조를 포함하는 복잡한 모양으로 쉽게 변형될 수 있어 세포 성장과 골전도에도 적합하다.[5] 또 키토산 비계는 생체적합성이 있고 생분해성이 있으나 강성이 낮고, 소재 자체가 골수축성이 없다.[5] 반면 히드록사파타이트는 생체적합성은 뛰어나지만 부서지기 쉬운 성질에 방해를 받는다.[14] 합성물로 히드록사파타이트를 구현하면 강도와 골수축성이 모두 현저히 향상되어 합성물이 인공뼈 재료에 대한 실행 가능한 옵션이 된다.[5] 키토산은 또한 높은 영의 계량(1.0–1.8 TPA), 인장 강도(30–200 GPA), 장단 연신(10–30%), 가로 세로 비율(>1,000)을 가진 탄소 나노튜브와 함께 사용할 수 있다.[5] 탄소 나노튜브는 크기가 매우 작고, 화학적으로나 구조적으로 안정적이며, 생체 활성이다.[5] 탄소나노튜브와 키토산이 형성한 복합체는 키토산의 견고함을 크게 향상시킨다.[5] 나노 구조 인조 자크레는 인공 뼈를 만드는 또 다른 선택사항이다.[11] 천연 자크레는 벽돌과 박격포와 유사한 유기층과 무기층이 배열되어 있다.[9] 이것은 단단하게 접힌 분자의 이온적인 교차 링크와 함께 자크레가 높은 힘과 강인함을 가질 수 있게 한다.[9] 이온 결합의 구조와 효과를 모두 모방한 인공 자크레는 자연 자크레와 비슷한 인장 강도는 물론, 항성 뼈와 비슷한 궁극의 영의 계수를 가지고 있었다.[11] 기계적인 관점에서 보면, 이 물질은 인공 뼈를 위한 실행 가능한 선택이 될 것이다.
설계 고려사항
임상 결과
환자에게 설계를 시행하기 전에 인공 뼈 설계의 몇 가지 측면을 고려해야 한다. 받는 사람의 뼈가 붙지 않은 상태로 방치되는 등의 이벤트로 인해 환자 내부에 맞지 않는 인공뼈 임플란트는 받는 부위에 홍조와 붓기를 유발할 수 있다.[3] 잘못 맞는 임플란트도 소결로 인해 발생할 수 있으며, 이는 임플란트의 치수 수축을 최대 27%[15]까지 유발할 수 있다. 골수축성은 인공 뼈 디자인에 있어 또 다른 중요한 고려사항이다. 소결된 물질은 특정 인공 뼈에 있는 인산칼슘의 결정성을 증가시켜 골성형에 의한 재흡수 불량과 생분해성 저하로 이어진다.[15] 한 연구는 수산화물(Hydroxyapatite)으로 전환해 소결 없이 임플란트를 굳히는 재료인 α-트리칼슘 인산염(TCP)을 활용한 잉크젯 프린팅 맞춤형 인공뼈를 만들어 이를 피했다.[15] 또 α-TCP는 생체적합성이 있고 새로운 뼈를 형성하는데 도움을 주므로 장기적으로는 환자에게 좋다.[3] 인공뼈 설계는 자가 및 동종 골격 임플란트와 비교하여 실행 가능한 해결책이 되려면 생체 적합성이 있어야 하며, 골수축성이 있어야 하며, 환자 내부에서 장기간 지속되어야 한다.
과제들
지표면 특성
인공 이식술은 유사한 압축 강도를 유지하지만, 때때로 횡력이나 마찰력에 반응하여 인간의 뼈와 유사성이 결여된다.[16] 특히 인공뼈의 지형은 자연에 비해 부정확하다. 그랜트 외 연구진에서는 융합 증착에 의해 생성된 인공 뼈 이식물이 실제 뼈에 비해 마찰 계수가 평균 20% 낮았다.[16] CT 스캔과 후속 골격 모델은 내부 조성을 위해 실제 뼈를 잘 나타내지만 최종 제품은 프린터의 해상도에 의존한다. 프린터에 결함이 발생한 경우, 의도하지 않은 공극으로 인한 압축강도의 하락이 가장 큰 이슈다.[15] 이식 후 나이가 들수록 환자가 증가함에 따라 세포 증식과 분화의 감소는 뚜렷하다. 이것은 이식물의 통합을 연장시키고 뼈 조직의 형성을 방해한다. 동물 모델에서, 알로그래프트의 결합은 기형종을 형성하게 한다. 이 사건의 확률을 크게 높일지는 두고 봐야 한다.[2] 따라서 신체의 골격을 모방하기 위해서는 다른 생물학적 작용제와의 비계가 필요하다. 뼈의 유기질량 중 상당 부분을 구성하는 제1형 콜라겐은 비계제가 자주 사용된다. 또는 폴리머 키토산은 유사한 생물학적 반응, 즉 체내에서 골생식을 촉진한다.[2]
제작 제한 사항
보다 현대적인 제작 기술로는 잉크젯 프린팅이 있다.[17] 한 연구에서 3D 잉크젯 프린터가 10명의 환자의 아래턱을 위한 자동 이식 임플란트를 만들었다. 히드록사파타이트 임플란트는 트리칼슘 인산염 분말로 만들어졌으며, 이 분말은 수화 후 굳어졌다.[17] 수술 절차는 심미성과 기능 모두를 위해 실시되었다. 모든 환자들은 뼈 제품에 대한 만족감을 나타냈다. 복제 염소 대퇴골을 조사한 또 다른 연구에서는 수산화나노크리스탈이 생산되어 현장에서 혼합된 후 3D 프린터를 장착했다. 이 연구는 대퇴골의 압축강도가 약간 감소하는 것을 주목했는데, 이는 불완전한 인쇄와 취소골의 비율 증가에 기인할 수 있다. 일반적으로 3D 프린팅 기술은 환자에게 부작용이 거의 없는 임플란트를 생산한다. 림프구와 적혈구 등 다양한 분류의 숙주세포는 인공이식에 대한 면역학적 반응을 최소로 보였다.[2] 불임이나 이전에 감염되기 쉬운 성질의 경우에만 심각한 합병증이 발생했다. 인쇄 속도는 인공 뼈 생산의 일차적인 속도 제한 단계다. 뼈 이식 수술의 종류에 따라 인쇄 시간은 1시간에서 몇 시간까지 다양할 수 있다.[15] 프린터가 고해상도 접목물을 만들면서 인쇄 지속시간이 비례적으로 늘어난다.
생물학적 반응
인공뼈 물질에 대한 연구 결과 생체 활성 및 재흡수가 가능한 규산염 안경(바이오글라스), 유리세라믹스, 칼슘 인산염 등이 사람 뼈와 유사한 기계적 성질을 보인다는 사실이 밝혀졌다.[18] 유사한 기계적 특성이 생체적합성을 보장하지 않는다. 그러한 물질에 대한 신체의 생물학적 반응은 화학적 구성, 지형, 다공성, 곡물 크기를 포함한 많은 매개변수에 따라 결정된다.[18] 소재가 금속일 경우 부식과 감염의 위험이 있다. 소재가 세라믹이라면 원하는 모양을 만들기 어렵고, 뼈는 결정성이 높아 재흡수나 교체가 불가능하다.[3] 반면 히드록사파타이트는 열역학적으로 안정적이고 생체활성적이기 때문에 골생세포의 접착과 분화, 증식을 지원하는 데 탁월한 성질을 보였다.[18] 히드록사파타이트를 사용한 인공뼈는 콜라겐 조직과 결합해 모공에서 새로운 뼈를 형성하는데 도움을 주고, 인접한 골조직과 균일성을 유지하면서 생물조직에 대한 친화력이 강하다.[3] 히드록사파타이트는 골조직과 상호작용하는 성능이 뛰어나지만 결정성이 높아 재흡수 시 세라믹과 같은 문제가 있다. 히드록사파타이트는 고온에서 가공되기 때문에 안정적인 상태로 유지될 가능성은 낮다.[3]
참조
- ^ "ARTIFICIAL BONE GRAFTS: PRO OSTEON". Arthroscopy.com. Archived from the original on 2013-04-04. Retrieved 2013-11-16.
- ^ a b c d Kashte, Shivaji; Jaiswal, Amit Kumar; Kadam, Sachin (2017). "Shivaji Kashte, Amit Kumar Jaiswal, Sachin Kadam. (2017). Artificial Bone via Bone Tissue Engineering: Current Scenario and Challenges". Tissue Engineering and Regenerative Medicine. 14 (1): 1–14. doi:10.1007/s13770-016-0001-6. PMC 6171575. PMID 30603457.
- ^ a b c d e f Saijo, Hideto; Fujihara, Yuko; Kanno, Yuki; Hoshi, Kazuto; Hikita, Atsuhiko; Chung, Ung-il; Takato, Tsuyoshi (2016). "Saijo, H., Fujihara Y., Kanno Y., Hoshi K., Hikita A., Chung U., Takato T. (2016). Clinical Experience of full custom-made artificial bones for the maxillofacial region". Regenerative Therapy. 5: 72–78. doi:10.1016/j.reth.2016.08.004. PMC 6581837. PMID 31245504.
- ^ "Creating Artificial Bones for Faster Bone Regeneration". Tokyo Institute of Technology. Retrieved 2018-04-20.
- ^ a b c d e f g h i j k l Venkatesan, Jayachandran; Kim, Se-Kwon (2010). "Venkatesan, J., & Kim, S.-K. (2010). Chitosan Composites for Bone Tissue Engineering—An Overview". Marine Drugs. 8 (8): 2252–2266. doi:10.3390/md8082252. PMC 2953403. PMID 20948907.
- ^ Ferreira, Ana Marina; Gentile, Piergiorgio; Chiono, Valeria; Ciardelli, Gianluca (2012). "Ferreira, A. M., Gentile, P., Chiono, V., & Ciardelli, G. (2012). Collagen for bone tissue regeneration". Acta Biomaterialia. 8 (9): 3191–3200. doi:10.1016/j.actbio.2012.06.014. PMID 22705634.
- ^ Kashte, Shivaji; Jaiswal, Amit Kumar; Kadam, Sachin (2017). "Shivaji Kashte, Amit Kumar Jaiswal, Sachin Kadam. (2017). Artificial Bone via Bone Tissue Engineering: Current Scenario and Challenges". Tissue Engineering and Regenerative Medicine. 14 (1): 1–14. doi:10.1007/s13770-016-0001-6. PMC 6171575. PMID 30603457.
- ^ "NAMCS: Factsheet-ORTHOPEDIC SURGERY". Centers for disease control and prevention. Retrieved 2018-04-20.
- ^ a b c d Venkatesan, Jayachandran; Bhatnagar, Ira; Manivasagan, Panchanathan; Kang, Kyong-Hwa; Kim, Se-Kwon (2015). "Venkatesan, J., Bhatnagar, I., Manivasagan, P., Kang, K., & Kim, S. (2015). Alginate composites for bone tissue engineering: A review". International Journal of Biological Macromolecules. 72: 269–281. doi:10.1016/j.ijbiomac.2014.07.008. PMID 25020082.
- ^ a b Zhu, H.; et al. (2018). "Nanostructural insights into the dissolution behavior of Sr-doped hydroxyapatite". Journal of the European Ceramic Society. 38 (16): 5554–5562. arXiv:1910.10610. doi:10.1016/j.jeurceramsoc.2018.07.056. S2CID 105932012.
- ^ a b c Tang, Zhiyong; Kotov, Nicholas A.; Magonov, Sergei; Ozturk, Birol (2003). "Tang, Z., Kotov, N. A., Magonov, S., & Ozturk, B. (2003). Nanostructured artificial nacre". Nature Materials. 2 (6): 413–418. doi:10.1038/nmat906. PMID 12764359. S2CID 6192932.
- ^ Fan, Chunquan; Li, Jiashun; Xu, Guohua; He, Hailong; Ye, Xiaojian; Chen, Yuyun; Sheng, Xiaohai; Fu, Jianwei; He, Dannong (2010). "Fan, C., Li, J., Xu, G., He, H., Ye, X., Chen, Y., Sheng, X., Fu, J., He, D. (2010). Facile fabrication of nano-hydroxyapatite/silk fibroin composite via a simplified coprecipitation route". Journal of Materials Science. 45 (21): 5814–5819. doi:10.1007/s10853-010-4656-4. S2CID 136591597.
- ^ Kashte, Shivaji; Jaiswal, Amit Kumar; Kadam, Sachin (2017). "Shivaji Kashte, Amit Kumar Jaiswal, Sachin Kadam. (2017). Artificial Bone via Bone Tissue Engineering: Current Scenario and Challenges". Tissue Engineering and Regenerative Medicine. 14 (1): 1–14. doi:10.1007/s13770-016-0001-6. PMC 6171575. PMID 30603457.
- ^ Zhou, Hongjian; Lee, Jaebeom (2011). "Zhou, H., & Lee, J. (2011). Nanoscale hydroxyapatite particles for bone tissue engineering". Acta Biomaterialia. 7 (7): 2769–2781. doi:10.1016/j.actbio.2011.03.019. PMID 21440094.
- ^ a b c d e Saijo, Hideto; Igawa, Kazuyo; Kanno, Yuki; Mori, Yoshiyuki; Kondo, Kayoko; Shimizu, Koutaro; Suzuki, Shigeki; Chikazu, Daichi; Iino, Mitsuki; Anzai, Masahiro; Sasaki, Nobuo; Chung, Ung-il; Takato, Tsuyoshi (2009). "Saijo H, Igawa K, Kanno Y, Mori Y, Kondo K, Shimizu K, Suzuki S, Chikazu D, Iino M, Anzai M, Sasaki N, Chung UI, Takato T. (2009). Maxillofacial reconstruction using custom-made artificial bones fabricated by inkjet printing technology". Journal of Artificial Organs. 12 (3): 200–205. doi:10.1007/s10047-009-0462-7. PMID 19894095. S2CID 35626675.
- ^ a b Grant, J.A.; Bishop, N.E.; Götzen, N.; Sprecher, C.; Honl, M.; Morlock, M.M. (2007). "Grant, J., Bishop, N., Götzen, N., Sprecher, C., Honl, M., & Morlock, M. (2007). Artificial composite bone as a model of human trabecular bone: The implant-bone interface". Journal of Biomechanics. 40 (5): 1158–1164. doi:10.1016/j.jbiomech.2006.04.007. PMID 16806236.
- ^ a b Xu, Ning; Ye, Xiaojian; Wei, Daixu; Zhong, Jian; Chen, Yuyun; Xu, Guohua; He, Dannong (2014). "Xu, N., Ye, X., Wei, D., Zhong, J., Chen, Y., Xu, G., & He, D. (2014). 3D Artificial Bones for Bone Repair Prepared by Computed Tomography-Guided Fused Deposition Modeling for Bone Repair". ACS Applied Materials & Interfaces. 6 (17): 14952–14963. doi:10.1021/am502716t. PMID 25133309.
- ^ a b c Hoppe, Alexander; Güldal, Nusret S.; Boccaccini, Aldo R. (2011). "Hoppe, A., Güldal, N. S., & Boccaccini, A. R. (2011).A review of the biological response to ionic dissolution products from bioactive glasses and glass-ceramics". Biomaterials. 32 (11): 2757–2774. doi:10.1016/j.biomaterials.2011.01.004. PMID 21292319.