SCN8A
SCN8A| SCN8A | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 별칭 | SCN8A, CERIII, CIO, EIE13, MED, NaCh6, Nav1.6, PN4, 나트륨 전압 게이트 채널 알파 서브 유닛 8, BFIS5, MYOCL2, DE13 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 600702 MGI: 103169 호몰로진: 7927 GeneCard: SCN8A | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 직교체 | |||||||||||||||||||||||||
| 종 | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레스 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 위치(UCSC) | Cr 12: 51.59 – 51.81Mb | Cr 15: 100.77 – 100.94Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키다타 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
나트륨 채널, 전압 게이트, 타입 VIII, 알파 서브유닛(SCN8A 또는 Na1v.6이라고도 함)은 SCN8A 유전자에 의해 인코딩된 막 단백질이다.[5]Na1v.6은 하나의 나트륨 채널 이소 형태로 란비에르 노드의 1차 전압 게이트 나트륨 채널이다.이 채널은 말초신경계의 감각 및 운동축에 고도로 집중되어 있고 중추신경계의 노드에 있는 군집이다.[6][7][8]
구조
Na1v.6은 27 exon을 포함하고 170 kb인 SCN8A 유전자에 의해 암호화된다.전압 게이트 나트륨 채널은 1980년 잔류물로 구성된다.다른 나트륨 채널과 마찬가지로 Na1v.6은 4개의 동질 영역(I-IV)과 25개의 투과체 세그먼트로 구성된 모노머다.SCN8A는 세포 내 루프를 형성하는 S3-S4 트랜섬브레인 세그먼트를 암호화한다.[9]
함수
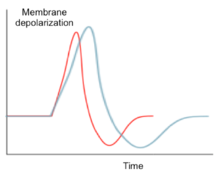
다른 나트륨 이온 채널과 마찬가지로 Na1v.6은 Na+ 이온의 유입에 의해 막 전위가 탈극화되었을 때 작용 전위 전위를 촉진한다.그러나 Na1v.6은 반복적인 흥분과 사격을 지속할 수 있다.Na1v.6의 고주파 발사 특성은 지속적이고 부활하는 나트륨 전류에 의해 발생한다.이 특성은 초기 작용 전위 전파 후 정상 상태 나트륨 전류를 허용하는 [10]재분극화에 따른 나트륨 채널의 느린 활성화에 의해 발생한다.정상 상태의 나트륨 전류는 다음과 같은 작용 전위의 탈극화에 기여한다.또한 Na1v.6의 활성화 임계값은 Na1v.2와 같은 다른 일반적인 나트륨 채널에 비해 낮다.이 기능을 통해 Na1v.6 채널은 비활성화 상태에서 신속하게 복구하고 높은 활동률을 유지할 수 있다.[11]
Na1v.6은 주로 골수축에서 란비에르 노드에 표현되지만 또한 골수축, 소뇌과립세포 및 푸르킨제 뉴런의 원위부 끝에서 고도로 집중되며 비골수축과 덴드리이트에서도 낮은 수준으로 집중된다.[11]Na1v.6의 위치를 고려할 때, 채널은 액손 힐록에서 다양한 입력에서 발생하는 전기적 자극을 합산하여 액손 아래로 전파하기 전에 발화 임계값에 도달하기 때문에 주어진 뉴런의 발화 임계값에 기여한다.다른 나트륨 채널 이소폼은 Na1v.1과 Na1v.2를 포함하여 축선 힐록의 원위부 끝에서 표현된다.[7]

Na1V.6 채널은 단백질 인산화 조절에 대한 저항을 입증한다.나트륨 채널은 단백질 키나아제 A와 단백질 키나아제 C(PKC) 인산화 작용으로 변조돼 피크 나트륨 전류가 감소한다.도파민과 아세틸콜린은 해마 피라미드 뉴런의 나트륨 전류를 인산화 작용을 통해 감소시킨다.마찬가지로 전전뇌피질 내 세로토닌 수용체는 나트륨 전류를 줄이기 위해 PKC에 의해 조절된다.[10]나트륨 채널의 인산화 규제는 불활성화를 늦추는 데 도움이 된다.그러나 Na1V.6 채널에는 적절한 단백질 키나제 부위가 없다.아미노산 잔류물 Ser573 및 Ser687의 인산화 부위는 다른 나트륨 채널에서 발견되지만 Na1V.6에서는 잘 보존되지 않는다.세린 잔류물이 부족하면 채널이 불활성화에 따라 일관되고 신속하게 발포할 수 있다.[13]
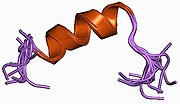
Na1V.6은 Cammodulin (CaM)에 의해 반대로 조절된다. CaM은 채널 불활성화를 위해 Na1V.6의 IQ(Isoleucine-glutamine) 모티브와 상호작용한다.CaM과 상호작용할 때 IQ 모티브가 나선형으로 접히고 CaM은 칼슘 농도에 따라 Na1V.6을 비활성화한다.Na1V.6 IQ는 Na1V.6과 같은 다른 나트륨 채널 이소 형태와 비교하여 CaM에 대한 중간 친화력을 나타낸다.CaM 친화력의 차이는 Na1V.6의 불활성화에 대한 저항성에 기여한다.[14]
임상적 유의성
인간에게 최초로 알려진 돌연변이는 2012년 크리슈나 베라마와 마이클 해머에 의해 발견되었다.[15]간질성 뇌병증을 보이는 아이의 게놈의 염기서열 분석 결과 노보 미스 돌연변이가 밝혀졌다.Asn1768Ap.Na1v.6의 오감 돌연변이는 지속적인 나트륨 전류의 지속시간을 증가시켜 채널 기능을 증가시켰고, 초극화에 따른 완전한 불활성화를 막았다.초기 전류의 20%는 초극화 후 뉴런의 과민성을 초래하고 조기 또는 의도하지 않은 발화 가능성을 증가시키는 100ms를 지속했다.간질성 뇌병증 외에도 발달지연, 자폐증, 지적장애, 아탁시아 등이 나타났다.
나트륨 채널 변환은 액손과 관련된 다발성 경화증(MS)의 용해 감소에 관련되어 있다. 용해 초기 단계에서는 미성숙 Na1v.2 채널이 액손에서 Na1v.6보다 많다.그러나 성숙한 Na1v.6 채널은 감광 상태가 지속됨에 따라 점차 다른 채널을 대체하여 Na1v.6의 낮은 임계값을 고려할 때 전도 속도를 증가시킬 수 있다.[7]단, MS 모델에서는 성숙한 Na1v.6에서 Na1v.2로의 나트륨 채널 변환이 관찰된다.[16]
참고 항목
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000196876 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000023033 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Entrez Gene: SCN8A sodium channel, voltage gated, type VIII, alpha subunit".
- ^ Caldwell JH, Schaller KL, Lasher RS, Peles E, Levinson SR (May 2000). "Sodium channel Na(v)1.6 is localized at nodes of ranvier, dendrites, and synapses". Proceedings of the National Academy of Sciences of the United States of America. 97 (10): 5616–20. Bibcode:2000PNAS...97.5616C. doi:10.1073/pnas.090034797. PMC 25877. PMID 10779552.
- ^ a b c Boiko T, Rasband MN, Levinson SR, Caldwell JH, Mandel G, Trimmer JS, Matthews G (April 2001). "Compact myelin dictates the differential targeting of two sodium channel isoforms in the same axon". Neuron. 30 (1): 91–104. doi:10.1016/s0896-6273(01)00265-3. PMID 11343647. S2CID 7168889.
- ^ Tzoumaka E, Tischler AC, Sangameswaran L, Eglen RM, Hunter JC, Novakovic SD (April 2000). "Differential distribution of the tetrodotoxin-sensitive rPN4/NaCh6/Scn8a sodium channel in the nervous system". Journal of Neuroscience Research. 60 (1): 37–44. doi:10.1002/(SICI)1097-4547(20000401)60:1<37::AID-JNR4>3.0.CO;2-W. PMID 10723066.
- ^ O'Brien JE, Meisler MH (October 2013). "Sodium channel SCN8A (Nav1.6): properties and de novo mutations in epileptic encephalopathy and intellectual disability". Frontiers in Genetics. 4: 213. doi:10.3389/fgene.2013.00213. PMC 3809569. PMID 24194747.
- ^ a b Chen Y, Yu FH, Sharp EM, Beacham D, Scheuer T, Catterall WA (August 2008). "Functional properties and differential neuromodulation of Na(v)1.6 channels". Molecular and Cellular Neurosciences. 38 (4): 607–15. doi:10.1016/j.mcn.2008.05.009. PMC 3433175. PMID 18599309.
- ^ a b Freeman SA, Desmazières A, Fricker D, Lubetzki C, Sol-Foulon N (February 2016). "Mechanisms of sodium channel clustering and its influence on axonal impulse conduction". Cellular and Molecular Life Sciences. 73 (4): 723–35. doi:10.1007/s00018-015-2081-1. PMC 4735253. PMID 26514731.
- ^ Reddy Chichili VP, Xiao Y, Seetharaman J, Cummins TR, Sivaraman J (2013). "Structural basis for the modulation of the neuronal voltage-gated sodium channel NaV1.6 by calmodulin". Scientific Reports. 3: 2435. Bibcode:2013NatSR...3E2435C. doi:10.1038/srep02435. PMC 3743062. PMID 23942337.
- ^ Chen Y, Yu FH, Sharp EM, Beacham D, Scheuer T, Catterall WA (August 2008). "Functional properties and differential neuromodulation of Na(v)1.6 channels". Molecular and Cellular Neurosciences. 38 (4): 607–15. doi:10.1016/j.mcn.2008.05.009. PMC 3433175. PMID 18599309.
- ^ Reddy Chichili VP, Xiao Y, Seetharaman J, Cummins TR, Sivaraman J (2013-08-14). "Structural basis for the modulation of the neuronal voltage-gated sodium channel NaV1.6 by calmodulin". Scientific Reports. 3: 2435. Bibcode:2013NatSR...3E2435C. doi:10.1038/srep02435. PMC 3743062. PMID 23942337.
- ^ Veeramah KR, O'Brien JE, Meisler MH, Cheng X, Dib-Hajj SD, Waxman SG, Talwar D, Girirajan S, Eichler EE, Restifo LL, Erickson RP, Hammer MF (March 2012). "De novo pathogenic SCN8A mutation identified by whole-genome sequencing of a family quartet affected by infantile epileptic encephalopathy and SUDEP". American Journal of Human Genetics. 90 (3): 502–10. doi:10.1016/j.ajhg.2012.01.006. PMC 3309181. PMID 22365152.
- ^ Craner MJ, Newcombe J, Black JA, Hartle C, Cuzner ML, Waxman SG (May 2004). "Molecular changes in neurons in multiple sclerosis: altered axonal expression of Nav1.2 and Nav1.6 sodium channels and Na+/Ca2+ exchanger". Proceedings of the National Academy of Sciences of the United States of America. 101 (21): 8168–73. Bibcode:2004PNAS..101.8168C. doi:10.1073/pnas.0402765101. PMC 419575. PMID 15148385.
추가 읽기
- Catterall WA, Goldin AL, Waxman SG (December 2005). "International Union of Pharmacology. XLVII. Nomenclature and structure-function relationships of voltage-gated sodium channels". Pharmacological Reviews. 57 (4): 397–409. doi:10.1124/pr.57.4.4. PMID 16382098. S2CID 7332624.
- Burgess DL, Kohrman DC, Galt J, Plummer NW, Jones JM, Spear B, Meisler MH (August 1995). "Mutation of a new sodium channel gene, Scn8a, in the mouse mutant 'motor endplate disease'". Nature Genetics. 10 (4): 461–5. doi:10.1038/ng0895-461. PMID 7670495. S2CID 28941670.
- Plummer NW, McBurney MW, Meisler MH (September 1997). "Alternative splicing of the sodium channel SCN8A predicts a truncated two-domain protein in fetal brain and non-neuronal cells". The Journal of Biological Chemistry. 272 (38): 24008–15. doi:10.1074/jbc.272.38.24008. PMID 9295353.
- Plummer NW, Galt J, Jones JM, Burgess DL, Sprunger LK, Kohrman DC, Meisler MH (December 1998). "Exon organization, coding sequence, physical mapping, and polymorphic intragenic markers for the human neuronal sodium channel gene SCN8A". Genomics. 54 (2): 287–96. doi:10.1006/geno.1998.5550. PMID 9828131.
- Anis Y, Nürnberg B, Visochek L, Reiss N, Naor Z, Cohen-Armon M (March 1999). "Activation of Go-proteins by membrane depolarization traced by in situ photoaffinity labeling of galphao-proteins with [alpha32P]GTP-azidoanilide". The Journal of Biological Chemistry. 274 (11): 7431–40. doi:10.1074/jbc.274.11.7431. PMID 10066808.
- Caldwell JH, Schaller KL, Lasher RS, Peles E, Levinson SR (May 2000). "Sodium channel Na(v)1.6 is localized at nodes of ranvier, dendrites, and synapses". Proceedings of the National Academy of Sciences of the United States of America. 97 (10): 5616–20. Bibcode:2000PNAS...97.5616C. doi:10.1073/pnas.090034797. PMC 25877. PMID 10779552.
- Wittmack EK, Rush AM, Craner MJ, Goldfarb M, Waxman SG, Dib-Hajj SD (July 2004). "Fibroblast growth factor homologous factor 2B: association with Nav1.6 and selective colocalization at nodes of Ranvier of dorsal root axons". The Journal of Neuroscience. 24 (30): 6765–75. doi:10.1523/JNEUROSCI.1628-04.2004. PMC 6729706. PMID 15282281.
- Raymond CK, Castle J, Garrett-Engele P, Armour CD, Kan Z, Tsinoremas N, Johnson JM (October 2004). "Expression of alternatively spliced sodium channel alpha-subunit genes. Unique splicing patterns are observed in dorsal root ganglia". The Journal of Biological Chemistry. 279 (44): 46234–41. doi:10.1074/jbc.M406387200. PMID 15302875.
- Drews VL, Lieberman AP, Meisler MH (February 2005). "Multiple transcripts of sodium channel SCN8A (Na(V)1.6) with alternative 5'- and 3'-untranslated regions and initial characterization of the SCN8A promoter". Genomics. 85 (2): 245–57. doi:10.1016/j.ygeno.2004.09.002. PMID 15676283.
- Wittmack EK, Rush AM, Hudmon A, Waxman SG, Dib-Hajj SD (July 2005). "Voltage-gated sodium channel Nav1.6 is modulated by p38 mitogen-activated protein kinase". The Journal of Neuroscience. 25 (28): 6621–30. doi:10.1523/JNEUROSCI.0541-05.2005. PMC 6725417. PMID 16014723.
- Schiavon E, Sacco T, Cassulini RR, Gurrola G, Tempia F, Possani LD, Wanke E (July 2006). "Resurgent current and voltage sensor trapping enhanced activation by a beta-scorpion toxin solely in Nav1.6 channel. Significance in mice Purkinje neurons". The Journal of Biological Chemistry. 281 (29): 20326–37. doi:10.1074/jbc.M600565200. PMID 16702217.
- Shirahata E, Iwasaki H, Takagi M, Lin C, Bennett V, Okamura Y, Hayasaka K (September 2006). "Ankyrin-G regulates inactivation gating of the neuronal sodium channel, Nav1.6". Journal of Neurophysiology. 96 (3): 1347–57. doi:10.1152/jn.01264.2005. PMID 16775201.
- Black JA, Newcombe J, Trapp BD, Waxman SG (September 2007). "Sodium channel expression within chronic multiple sclerosis plaques". Journal of Neuropathology and Experimental Neurology. 66 (9): 828–37. doi:10.1097/nen.0b013e3181462841. PMID 17805013.
외부 링크
- "SCN8A Website and Registry". University of Arizona.
이 기사는 공공영역에 있는 미국 국립 의학 도서관의 텍스트를 통합하고 있다.