메탈
Metal
| 의 시리즈의 일부 |
| 주기율표 |
|---|
금속(그리스어 μμμμαδομμμαδομμμμαδομμμμα δοομμα δα δmetallon, "광산, 채석장, 금속")은 새로 준비, 연마 또는 골절되었을 때 광택이 나는 외관을 나타내며 전기와 열을 비교적 잘 전도하는 물질이다.금속은 일반적으로 가단성(얇은 시트로 망치질할 수 있음) 또는 연성(와이어로 끌 수 있음)입니다.금속은 철과 같은 화학 원소, 스테인리스강과 같은 합금 또는 고분자 [1]질화황과 같은 분자 화합물일 수 있다.
물리학에서 금속은 일반적으로 절대 [2]0도의 온도에서 전기를 전도할 수 있는 물질로 간주됩니다.일반적으로 금속으로 분류되지 않는 많은 원소 및 화합물은 고압에서 금속이 됩니다.예를 들어 비금속 요오드는 대기압 4~17만배의 압력으로 점차 금속이 된다.마찬가지로 금속으로 간주되는 물질도 비금속이 될 수 있습니다.예를 들어 나트륨은 대기압의 2백만 배 미만의 압력에서 비금속 성분이 됩니다.
화학에서는 (물리학에서) 깨지기 쉬운 금속으로 인정될 두 가지 원소인 아르세닉과 안티몬이 대신 금속으로 인식된다(비소의 경우 주로 비금속, 안티몬의 경우 금속성과 비금속성 사이의 균형).주기율표에 있는 118개의 원소 중 약 95개가 금속이다(또는 금속일 가능성이 높다).관련된 범주의 정의가 보편적으로 받아들여지지 않기 때문에 금속, 비금속 및 금속 사이의 경계가 약간 변동하기 때문에 이 수치는 정확하지 않다.
천체 물리학에서 "금속"이라는 용어는 전통적인 금속뿐만 아니라 헬륨보다 무거운 별의 모든 화학 원소를 지칭하기 위해 더 널리 주조됩니다.이런 의미에서 핵합성을 통해 항성 코어에 모이는 최초의 네 가지 "금속"은 탄소, 질소, 산소, 네온이며, 이들 모두는 화학에서 완전히 비금속입니다.별은 수소와 헬륨인 가벼운 원자를 평생 동안 더 무거운 원자로 융합한다.그런 의미에서, 천문학 물체의 금속성은 무거운 화학 [3][4]원소로 이루어진 물질의 비율이다.
금속은 화학 원소로서 지각의 25%를 차지하며 현대 생활의 많은 측면에 존재한다.일부 금속의 강도와 탄성 때문에 고층 건물과 교량 건설뿐만 아니라 대부분의 차량, 많은 가전제품, 공구, 파이프 및 철도 선로에 자주 사용되었습니다.귀금속은 역사적으로 주화로 사용되었지만, 현대에는 주화 금속이 적어도 23개의 화학 [5]원소로 확장되었다.
정제 금속의 역사는 약 11,000년 전 구리의 사용으로 시작된 것으로 생각된다.금, 은, 철(운석 철), 납, 놋쇠도 기원전 5천년에 청동이 처음 등장하기 전에 사용되었습니다.그 후의 발전에는 초기 형태의 강철 생산, 1809년 최초의 경금속인 나트륨의 발견, 현대 합금강의 부상, 그리고 제2차 세계대전 이후 보다 정교한 합금의 개발이 포함됩니다.
특성.
형태 및 구조

금속은 적어도 새로 준비, 연마 또는 골절되었을 때 광택이 나고 광택이 납니다.몇 마이크로미터보다 두꺼운 금속판은 불투명해 보이지만 금박은 녹색 빛을 전달한다.
금속의 고체 또는 액체 상태는 주로 외부 껍데기 전자를 쉽게 잃을 수 있는 금속 원자의 용량에서 비롯됩니다.대체로, 개별 원자의 외부 껍질 전자를 제자리에 고정시키는 힘은 고체 또는 액체 금속의 원자 사이의 상호작용에서 발생하는 동일한 전자에 대한 유인력보다 약합니다.관련된 전자는 비국재화되고 금속의 원자 구조는 상대적으로 이동성 전자 구름에 내장된 원자의 집합으로 효과적으로 시각화할 수 있다.이러한 상호작용을 금속 결합이라고 [6]합니다.서로 다른 원소 금속에 대한 금속 결합의 강도는 전이 금속 계열의 중심 부근에서 최대치에 달합니다. 이러한 원소에는 많은 수의 비국재화 [n 1]전자가 있기 때문입니다.
대부분의 원소 금속이 대부분의 [6]비금속보다 더 높은 밀도를 가지고 있지만, 그 밀도에는 큰 차이가 있습니다. 리튬이 가장 밀도가 낮은(0.534 g/cm3), 오스뮴(22.59 g/cm3)입니다.마그네슘, 알루미늄, 티타늄은 상업적으로 중요한 경금속입니다.각각 1.7, 2.7 및 4.5g3/cm의 밀도는 철(7.9), 구리(8.9g/cm3)와 같은 오래된 구조 금속과 비교할 수 있다.따라서 철공은 같은 부피의 알루미늄 공 3개 정도의 무게가 나간다.

금속은 전형적으로 가단성이 있고 연성이 있으며,[6] 응력을 받으면 쪼개지지 않고 변형됩니다.금속 결합의 비방향성은 대부분의 금속 고형물의 연성에 크게 기여하는 것으로 생각된다.반면 식탁용 소금과 같은 이온 화합물에서는 이온 결합면이 서로 미끄러지면 위치변화에 의해 동일 전하의 이온이 근접하게 이동해 결정의 균열이 발생한다.이러한 변화는 다이아몬드와 같이 파단 및 결정 파편이 [7]발생하는 공유 결합 결정에서는 관찰되지 않습니다.금속의 가역 탄성 변형은 응력이 변형률에 선형 비례하는 힘 회복에 대한 후크의 법칙으로 설명할 수 있다.
열이나 힘이 금속의 탄성 한계보다 크면 소성 변형 또는 소성이라고 하는 영구(불가역적) 변형이 발생할 수 있습니다.가해지는 힘은 인장력(당기는 힘), 압축력(밀리는 힘), 전단력, 구부림 또는 비틀림(비틀림)이 될 수 있다.온도 변화는 결정 및 비결정 금속 모두의 입자 경계, 점 공극, 라인 및 나사 전위, 적층 결함 및 트윈과 같은 금속의 구조적 결함의 이동 또는 이동에 영향을 미칠 수 있습니다.내부 미끄러짐, 크리프 및 금속 피로가 발생할 수 있습니다.
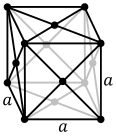
금속 물질의 원자는 일반적으로 세 가지 일반적인 결정 구조, 즉 신체 중심 입방체(BCC), 면 중심 입방체(FCC), 육각형 밀착형(hcp) 중 하나로 배열됩니다.BCC에서 각 원자는 다른 8개의 입방체의 중심에 위치한다.FCC 및 hcp에서는 각 원자가 12개의 다른 원자에 둘러싸여 있지만 레이어의 스태킹은 다릅니다.어떤 금속들은 [8]온도에 따라 다른 구조를 채택한다.
각 결정 구조의 단위 셀은 결정의 전체적인 대칭을 가지고 있고, 3차원의 반복에 의해 전체 결정 격자가 형성될 수 있는 가장 작은 원자 그룹입니다.상기의 체심 입방정 결정 구조의 경우, 단위 셀은 중심 원자 + 8개의 각 원자의 8분의 1로 구성되어 있다.
전기 및 열

금속의 전자 구조는 금속이 비교적 양호한 전도체라는 것을 의미합니다.물질의 전자는 가변 에너지 수준이 아닌 고정된 에너지 수준만을 가질 수 있으며, 금속에서 전자 구름에 있는 전자의 에너지 수준은 적어도 어느 정도는 전기 전도가 발생할 수 있는 에너지 수준에 해당합니다.실리콘이나 황과 같은 비금속 반도체에서는 물질 내의 전자와 전기 전도가 발생할 수 있는 에너지 수준 사이에 에너지 격차가 있습니다.따라서 반도체와 비금속은 상대적으로 도체가 불량하다.
원소 금속은 망간의 경우 6.9 × 103 S/cm, 은의 경우 6.3 × 105 S/cm의 전기 전도도 값을 가진다.반면 붕소 등의 반도체 금속은 1.5×10S−6/cm의 도전성을 가진다.한 가지 예외를 제외하고 금속 요소는 가열될 때 전기 전도성을 감소시킵니다.플루토늄은 약 -175~+125°C의 온도 범위에서 가열될 때 전기 전도율이 높아집니다.
금속은 비교적 열 전도성이 좋다.금속의 전자 구름에 있는 전자는 매우 이동성이 높고 열에 의해 유발되는 진동 에너지를 쉽게 전달할 수 있습니다.
금속의 전자가 열용량과 열전도율에 미치는 영향 및 금속 자체의 전기 전도율은 자유 전자 모델을 통해 계산할 수 있습니다.그러나 이것은 금속 이온 격자의 상세한 구조를 고려하지 않는다.이온코어 배치에 의해 발생하는 정전위를 고려함으로써 금속의 전자밴드 구조 및 결합에너지를 고려할 수 있다.다양한 수학적 모델이 적용 가능하며, 가장 간단한 것은 거의 자유로운 전자 모델입니다.
화학의
금속은 보통 전자 [6]손실을 통해 양이온을 형성하는 경향이 있다.대부분은 공기 중의 산소와 반응하여 다양한 시간 척도에 걸쳐 산화물을 형성합니다(칼륨은 몇 초 안에 연소하고 철은 녹슬습니다).팔라듐, 백금, 금과 같은 다른 것들은 대기와 전혀 반응하지 않는다.금속의 산화물은 산성 또는 중성인 비금속과 달리 일반적으로 염기성입니다.산화도가 매우 높은 산화물3(예27: CrO, MnO, OsO4)은 대부분 산성이 강한 반응을 보입니다.
금속의 부식을 방지하는 좋은 방법은 도장, 양극화 또는 도금입니다.그러나 전기화학 시리즈의 보다 반응성이 높은 금속을 코팅에 사용해야 하며, 특히 코팅이 깨질 것으로 예상되는 경우에는 더욱 그러합니다.물과 두 금속은 전기화학 셀을 형성하며 코팅이 기초 금속보다 반응성이 낮으면 실제로 부식을 촉진합니다.
주기율표분포
화학에서 통상적인 조건에서 금속으로 간주되는 원소는 아래 주기율표에서 노란색으로 표시되어 있다.나머지 원소는 금속(B, Si, Ge, As, Sb, Te) 또는 비금속입니다.아스타틴(At)은 보통 비금속 또는 금속으로 분류되지만, 일부 예측에서는 금속일 것으로 예상합니다. 따라서 실험 지식에 대한 결정적 상태가 아니기 때문에 공백으로 남아 있습니다.알려지지 않은 성질을 가진 것으로 보이는 다른 원소들은 금속일 가능성이 높지만, 코페르니슘과 오가네손(Og)에 대해서는 약간의 의심이 있다.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 그룹 → | ||||||||||||||||||||||||||||||||
| ↓ 기간 | ||||||||||||||||||||||||||||||||
| 1 | H | 그 | ||||||||||||||||||||||||||||||
| 2 | 리 | 있다 | B | C | N | O | F | 로마 | ||||||||||||||||||||||||
| 3 | 나 | Mg | 알 | Si | P | S | 당분이나 지방 말고도 | 아르곤 | ||||||||||||||||||||||||
| 4 | K | 칼슘 | Sc | 티 | V | Cr | Mn | Fe | 회사 | 니 | CU | Zn | 가 | 그 | ~하듯이 | Se | Br | Kr | ||||||||||||||
| 5 | Rb | 보 | Y | Zr | Nb | 모 | Tc | Ru | Rh | PD | Ag | Cd | 인 | Sn | Sb | 테 | I | Xe | ||||||||||||||
| 6 | Cs | 바 | 라 | Ce | Pr | Nd | 그럼 | Sm | 으로 | 냉동기 | Tb | Dy | 호 | 음.정말 | Tm | YB | 루 | HF | 강타 | W | 리 | OS | 이르 | Pt | Au | Hg | tael양. | PB | 비 | 포 | 에서 | Rn |
| 7 | 버섯 | 라 | Ac | Th(Th) | Pa | U | Np | 푸 | 암 | Cm | Bk | Cf | 에스 | Fm에서는 | Md | 아니요. | 로렌슘 | Rf | 데이터베이스 | Sg | Bh | Hs | 산 | Ds | Rg | Consols정리 공채. | Nh | 플 | Mc | Lv | Ts | 오그 |
합금
합금은 금속성을 가진 물질로 적어도 1개가 금속인 2개 이상의 원소로 구성되어 있다.합금은 가변 또는 고정 조성을 가질 수 있다.예를 들어 금과 은의 비율을 자유롭게 조절할 수 있는 합금을 형성하고 티타늄과 실리콘은 두 성분의 비율이 고정된 합금2 TiSi(금속 간 화합물이라고도 함)를 형성합니다.

대부분의 순수 금속은 실용적으로 사용하기에는 너무 부드럽고, 부서지기 쉬우며, 화학적으로 반응합니다.금속의 다양한 비율을 합금으로 결합하면 순금속의 특성이 변경되어 바람직한 특성을 얻을 수 있습니다.합금을 만드는 목적은 일반적으로 합금이 덜 부서지고 단단하며 부식에 강하거나 더 바람직한 색상과 광택을 내는 것입니다.오늘날 사용되는 모든 금속 합금 중 철 합금(강철, 스테인리스강, 주철, 공구강, 합금강)이 양과 상업적 가치 모두에서 가장 큰 비중을 차지하고 있습니다.다양한 비율의 탄소와 합금된 철은 저탄소, 중탄소 및 고탄소강을 제공하며 탄소 수준이 증가하면 연성과 인성이 감소합니다.실리콘을 첨가하면 주철이 생성되고, 탄소강에 크롬, 니켈 및 몰리브덴을 첨가하면 스테인리스강이 생성됩니다(10% 이상).
다른 중요한 금속 합금으로는 알루미늄, 티타늄, 구리 및 마그네슘이 있습니다.구리 합금은 선사시대부터 알려져 왔으며, 청동기 시대에는 청동기라는 이름이 붙여졌습니다. 그리고 오늘날에는 전기 배선에 가장 중요한 용도로 많이 사용되고 있습니다.다른 세 가지 금속의 합금은 비교적 최근에 개발되었습니다. 화학 반응성 때문에 전해 추출 과정이 필요합니다.알루미늄, 티타늄 및 마그네슘 합금은 중량 대비 강도가 높으며 마그네슘은 전자파 [citation needed]차폐 기능도 제공합니다.이러한 재료는 항공우주 및 일부 자동차 분야와 같이 재료 비용보다 고강도 대 중량비가 더 중요한 상황에 이상적입니다.
제트 엔진과 같이 까다로운 용도에 맞게 특별히 설계된 합금은 10개 이상의 원소를 포함할 수 있습니다.
분류
| 금속 원소 |
|---|
| 알칼리 금속 |
| 알칼리 토류 금속 |
| 전이 금속 |
| 전이 후 금속 |
| 란타니데스 |
| 악티니데스 |
| 금속일 가능성이 있는 원소 |
| 때때로 금속으로 간주되는 원소 |
금속은 물리적 또는 화학적 특성에 따라 분류할 수 있다.아래 항에서 설명하는 범주에는 철 및 비철금속, 부서지기 쉬운 금속 및 내화금속, 백색금속, 중금속 및 경금속, 염기, 귀금속 등이 있습니다.이 절의 금속 원소 표는 화학적 특성에 따라 원소 금속을 알칼리 및 알칼리 토류 금속, 전이 및 전이 후 금속, 란탄화물 및 악티니드로 분류한다.포함 기준에 따라 다른 범주가 가능합니다.예를 들어, 강자성 금속(실온에서 자성을 띠는 금속)은 철, 코발트 및 니켈입니다.
철금속 및 비철금속
"철"이라는 용어는 "철을 함유하고 있다"는 뜻의 라틴어에서 유래했습니다.여기에는 연철과 같은 순철이나 강철과 같은 합금이 포함될 수 있습니다.철금속은 종종 자성을 띠지만 전유물은 아니다.비철금속과 합금에는 상당한 양의 철이 부족하다.
부서지기 쉬운 금속
거의 모든 금속이 가단성 또는 연성이지만, 베릴륨, 크롬, 망간, 갈륨, 비스무트 등 일부 금속은 [9]부서지기 쉽습니다.비소와 안티몬은 금속으로 인정되면 부서지기 쉽다.벌크 탄성 계수 대 전단 계수 비율의 낮은 값(Pugh 기준)은 내인성 취약성을 나타낸다.
내화 금속
재료 과학, 야금 및 공학에서 내화 금속은 열과 마모에 매우 강한 금속입니다.이 범주에 속하는 금속은 다양하며, 가장 일반적인 정의는 니오브, 몰리브덴, 탄탈, 텅스텐 및 레늄입니다.모두 녹는점이 2000°C 이상이고 상온에서 높은 경도를 가집니다.
- 니오브 결정 및 비교용3 1cm 양극산화 니오브 큐브
화이트 메탈
흰색 금속은 녹는점이 상대적으로 낮은 흰색 금속(또는 그 합금)의 총칭입니다.이러한 금속에는 아연, 카드뮴, 주석, 안티몬(여기서는 금속으로 간주), 납 및 비스무트가 포함되며, 이들 중 일부는 상당히 독성이 있습니다.영국에서 미술품 거래는 경매 카탈로그에서 "화이트 메탈"이라는 용어를 사용하여 영국 검사국 마크가 붙어 있지 않지만 은으로 이해되고 그에 따라 가격이 책정되는 외국 은 품목을 묘사한다.
중금속 및 경금속
헤비메탈은 비교적 밀도가 높은 금속 또는 [10]금속을 말한다.좀 더 구체적인 정의가 제안되었지만, 널리 받아들여진 정의는 없었다.어떤 중금속은 틈새로 쓰이거나 유독성이 있으며, 어떤 중금속은 미량에서 필수적입니다.다른 모든 금속은 경금속이다.
,
화학에서 베이스메탈이란 용어는 금속염화물 및 수소를 형성하기 위해 희석염산(HCl)과 쉽게 반응하는 등 쉽게 산화되거나 부식되는 금속을 지칭하기 위해 비공식적으로 사용된다.예로는 철, 니켈, 납, 아연이 있습니다.구리는 HCl과 반응하지 않지만 비교적 쉽게 산화되기 때문에 모재로 간주됩니다.

귀금속이라는 용어는 일반적으로 비금속과 반대되는 의미로 사용된다.귀금속은 대부분의 비금속과 달리 부식이나 [11]산화에 강하다.귀금속인 경우가 많은데, 이는 종종 희귀성이 인식되기 때문입니다.예를 들어 금, 백금, 은, 로듐, 이리듐, 팔라듐 등이 있습니다.
연금술과 화폐학에서 비금속이라는 용어는 귀금속, 즉 경제적 [12]가치가 높은 것과 대조된다.연금술사들의 오랜 목표는 값싼 금속을 은이나 금과 같은 주화 금속을 포함한 귀금속으로 바꾸는 것이었다.오늘날 대부분의 동전은 낮은 내재가치를 가진 비금속들로 만들어져 있다.과거 동전은 주로 귀금속 함량에서 가치를 도출하는 경우가 많았다.
화학적으로 귀금속(귀금속과 같은)은 대부분의 원소보다 반응성이 낮고 광택이 높고 전기 전도성이 높습니다.역사적으로 귀금속은 화폐로서 중요했지만, 지금은 주로 투자와 산업용 상품으로 여겨진다.금, 은, 백금 및 팔라듐은 각각 ISO 4217 통화 코드를 가지고 있습니다.가장 잘 알려진 귀금속은 금과 은이다.둘 다 산업적인 용도를 가지고 있지만, 그것들은 예술, 보석, 그리고 주화에서의 사용으로 더 잘 알려져 있다.다른 귀금속에는 백금족 금속인 루테늄, 로듐, 팔라듐, 오스뮴, 이리듐, 백금이 포함되며, 백금은 가장 널리 거래된다.
귀금속에 대한 수요는 실용성뿐만 아니라 투자와 [13]가치의 저장고로서의 역할에 의해서도 좌우된다.팔라듐과 플래티넘은 2018년 가을 기준으로 금값의 약 4분의 3 수준으로 평가되고 있다.은은 이들 금속보다 상당히 저렴하지만, 주화와 보석에서의 역할을 고려하면 종종 귀금속으로 여겨집니다.
전기화학에서 밸브 금속은 전류를 한 방향으로만 전달하는 금속입니다.
사이클
★★★
| 무게에 의한[n 2] 풍부함과 주요 발생원 또는 근원 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | H | ||||||||||||||||||
| 2 | B | C | N | O | F | ||||||||||||||
| 3 | na | Mg | Si | P | S | Cl분이 cl cl cl cl cl cl cl cl cl | Ar아르곤 | ||||||||||||
| 4 | K | Ca칼슘 | ScSc | Ti티 | V | CrCr | MnMn | FeFe | Co회사 | Ni니 | CuCU | ZnZn | Ga가 | Ge그 | As~하듯이 | SeSe | BrBr | Kr | |
| 5 | Rb | ★ | Y | Zr | Nb | Rh | CD | ★ | Sn | ★ | I | Xe | |||||||
| 6 | Cs | lu | W | ★ | Pt | Hg | tael양. | 비 | |||||||||||
| 7 | |||||||||||||||||||
| Ce | Nd | Gd ★★★ | Tb | Dy | . | Tm | |||||||||||||
| Th(Th) | U | ||||||||||||||||||
가장 풍부한 (최대 82000ppm) | |||||||||||||||||||
풍부(100~999ppm) | |||||||||||||||||||
일반(1~99ppm) | |||||||||||||||||||
희귀(0.01~0.99ppm) | |||||||||||||||||||
매우 드문 경우(0.0001~0.0099ppm) | |||||||||||||||||||
| 구분선 왼쪽의 금속은 주로 석연화 물질로 발생하거나, 오른쪽에 있는 금속은 금(사이더필)과 주석(석연화 물질)을 제외하고 석연화 물질로 발생한다. | |||||||||||||||||||
- 이 하위 섹션에서는 주기율표 원소 금속이 본 문서에서 정의한 바와 같이 금속 재료의 기초를 형성하기 때문에 이러한 원소 금속의 형성에 대해 설명합니다.
(주기율표에서) 철 근처까지의 금속은 주로 별의 핵합성을 통해 만들어진다.이 과정에서 수소에서 실리콘에 이르는 가벼운 원소들은 별 안에서 연속적으로 핵융합 반응을 일으켜 빛과 열을 방출하고 더 높은 [14]원자번호를 가진 무거운 원소들을 형성한다.
중금속은 보통 이런 식으로 형성되지 않는데, 그러한 핵과 관련된 핵융합 반응이 에너지를 [15]방출하기 보다는 소비하기 때문이다.오히려 중성자 포획에 의해 (원자 번호가 낮은 원소로부터) 크게 합성되며, 이 반복 포획의 두 가지 주요 모드는 s-과정과 r-과정이다.s-프로세스("s"는 "느린"을 의미)에서, 단수 포획은 년 또는 수십 년 단위로 분리되며, 덜 안정적인 핵은 베타 [16]붕괴할 수 있는 반면, r-프로세스("급속")에서는 포획이 핵이 붕괴할 수 있는 것보다 더 빨리 일어난다.따라서, s-과정은 어느 정도 명확한 경로를 거칩니다: 예를 들어, 안정적인 카드뮴-110 핵은 불안정하고 붕괴하여 인듐-115를 형성할 때까지 별 안에서 자유 중성자의 연속적인 폭격을 받습니다(우주 나이가 30000배인 거의 안정적입니다).이 원자핵들은 중성자를 포획하여 불안정한 인듐-116을 형성하고, 붕괴하여 주석-116을 형성합니다.[14][17][n 3]이와는 대조적으로 r-프로세스에는 이러한 경로가 없습니다.다음 두 원소인 폴로늄과 아스타틴의 반감기가 짧기 때문에 비스무트에서 s-공정이 멈춥니다. 폴로늄과 아스타틴은 비스무트 또는 납으로 분해됩니다.r-과정은 매우 빨라서 이 불안정 영역을 건너뛰고 토륨이나 [19]우라늄과 같은 무거운 원소를 만들어 낼 수 있다.
금속은 별의 진화와 파괴 과정의 결과로 행성에서 응축됩니다.항성은 수명이 다한 후에 방출될 때 질량의 상당 부분을 잃고, 그 후에 중성자별이 [20][n 4]합쳐지면서 성간 매질에서 헬륨보다 무거운 원소의 양이 증가합니다.중력 때문에 이 물질이 합쳐지고 붕괴될 때 새로운 별과 행성이 [22]형성된다.
와

지구의 지각은 무게 기준 금속의 약 25%로 구성되어 있으며, 그 중 80%는 나트륨, 마그네슘, 알루미늄과 같은 경금속입니다.~75%의 비율구리와 같은 일부 중금속의 전반적인 부족에도 불구하고, 그것들은 산의 건설, 침식 또는 다른 지질학적 과정의 결과로 경제적으로 추출할 수 있는 양으로 농축될 수 있다.
금속은 주로 암석을 좋아하는 친석성 또는 친석성(식인성)으로 발견됩니다.친석성 금속은 주로 s-블록 원소, d-블록 원소, f-블록 원소이다.이들은 산소에 강한 친화력을 가지고 있으며 대부분 비교적 저밀도 규산염 광물로 존재한다.친석 금속은 주로 반응성이 낮은 d-블록 원소와 4-6 p-블록 금속이다.그것들은 보통 황화물 광물에서 발견됩니다.석석보다다다밀밀밀다다다다다다로로로있있있있있있있있있있있있있있있있있있있있있있있있있있있있있있있?
반면에, 금은 철을 좋아하는 친철 원소이다.산소나 유황과는 쉽게 화합물을 형성하지 않는다.지구가 형성될 당시, 그리고 금속 중 가장 고귀한(insert) 금속으로서, 금은 고밀도 금속 합금을 형성하는 경향으로 인해 중심부에 가라앉았다.따라서 비교적 희귀한 금속이다.몰리브덴, 레늄, 백금족 금속(루테늄, 로듐, 팔라듐, 오스뮴, 이리듐, 백금), 게르마늄, 주석 등 일부 다른 귀금속은 친철성 물질로 간주될 수 있지만 지구(핵심, 맨틀, 지각)에서 주로 발생하는 물질로만 볼 수 있습니다.이 금속들은 그렇지 않으면 주로 칼코파일로 지각에서 소량 발생한다.[n 5]
대부분 철로 구성된 지구 내부의 회전하는 유체 외핵은 지구 보호 자기장의 [n 6]근원으로 생각됩니다.핵은 지구의 단단한 내부 핵 위와 맨틀 아래에 있습니다.5m2(54평방피트) 크기의 기둥으로 재배열할 수 있다면 높이는 거의 700광년이 될 것이다.자기장은 태양풍의 대전 입자, 그리고 그렇지 않으면 상층 대기를 제거해 버릴 우주선으로부터 지구를 보호한다.
.
금속은 종종 보크사이트와 같은 필수 원소의 풍부한 원천인 광석을 채굴하여 지구로부터 추출됩니다.광석은 탐사 기법에 의해 위치 결정되며, 이어서 광상의 탐사와 조사가 이루어진다.광물 자원은 일반적으로 중장비를 이용해 굴착하여 채굴하는 지표면 기뢰와 지표면 기뢰로 나뉜다.경우에 따라서는 관련된 금속의 판매가격으로 인해 저농도 광원을 채굴하는 것이 경제적으로 실현될 수 있습니다.
일단 광석이 채굴되면, 금속은 보통 화학적 또는 전해적 감소에 의해 추출되어야 한다.파이로메탈리는 광석을 원금속으로 변환하기 위해 고온을 사용하는 반면, 하이드로메탈리는 같은 목적을 위해 수성 화학을 사용합니다.사용되는 방법은 금속과 그 오염물질에 따라 달라집니다.
금속 광석이 해당 금속과 비금속인 이온 화합물인 경우, 보통 순수한 금속을 추출하기 위해 광석을 용해(환원제로 가열)해야 합니다.철과 같은 많은 일반적인 금속들은 탄소를 환원제로 사용하여 제련된다.알루미늄이나 나트륨과 같은 일부 금속은 상업적으로 실용적인 환원제가 없으며 대신 [23][24]전기 분해를 사용하여 추출됩니다.
황화물 광석은 금속으로 직접 환원되지 않고 공기 중에서 구워 산화물로 변환됩니다.
금속은 현대 생활의 거의 모든 측면에 존재한다.중금속인 철은 모든 정제 금속의 90%를 차지하기 때문에 가장 흔할 수 있습니다. 경금속인 알루미늄은 다음으로 가장 일반적으로 정제된 금속입니다.순철은 그램당 미화 0.07달러의 비용으로 가장 저렴한 금속 원소가 될 수 있다.그 광석은 널리 퍼져 있고, 정제하기 쉬우며, 관련된 기술은 수백 년 동안 발전해 왔다.주철은 그램당 미화 0.01달러로 훨씬 더 저렴합니다. 이는 후속 정제가 필요 없기 때문입니다.그램당 약 27달러의 비용이 드는 플래티넘은 매우 높은 녹는점, 내식성, 전기 전도성 및 내구성을 고려할 때 가장 보편적일 수 있습니다.그것은 전체 소비재의 20%에서 발견되거나 생산에 사용된다고 한다.폴로늄은 희소성과 초소형 생산으로 인해 [citation needed]그램당 약 1억 달러의 명목상 비용을 지불하고 가장 비싼 금속이 될 것이다.
일부 금속 및 금속 합금은 단위 질량당 구조 강도가 높기 때문에 큰 하중을 운반하거나 충격 손상을 방지하는 데 유용한 재료입니다.금속 합금은 전단, 토크 및 변형에 대한 높은 저항성을 갖도록 설계될 수 있습니다.그러나 같은 금속도 반복 사용 또는 부하 용량을 초과했을 때 갑작스러운 응력 장애에 의한 피로 손상에 취약할 수 있다.금속의 강도와 탄성 덕분에 대부분의 차량, 많은 장비, 공구, 파이프 및 철도 선로뿐만 아니라 고층 건물과 교량 건설에도 자주 사용되고 있습니다.
금속은 우수한 전도체로, 전기 기구에 유용하고 에너지 손실이 거의 없는 먼 거리에 전류를 전달하는 데 유용합니다.전력망은 배전을 위해 금속 케이블에 의존합니다.가정용 전기 시스템은 대부분 양호한 전도성을 위해 구리 와이어로 배선되어 있습니다.
금속의 열 전도율은 용기가 불꽃 위에 재료를 가열하는 데 유용합니다.금속은 또한 민감한 기기를 과열로부터 보호하기 위해 방열판에도 사용됩니다.
일부 금속은 반사율이 높기 때문에 정밀천문기기를 포함한 거울에 사용할 수 있으며 금속 장신구의 미학을 더한다.
일부 금속은 특수한 용도로 사용됩니다. 수은은은 상온의 액체이며 스위치 접점을 흐를 때 회로를 완성하기 위해 스위치에 사용됩니다.우라늄과 플루토늄과 같은 방사성 금속은 핵분열을 통해 에너지를 생산하는 원자력 발전소의 연료이다.형상 기억 합금은 파이프, 고정 장치 및 혈관 스텐트와 같은 용도에 사용됩니다.
금속은 유기, 무기, 생물, 고분자 등 외부 분자와 도핑될 수 있다.이 도핑은 게스트 분자에 의해 유도되는 새로운 성질을 가진 금속을 수반합니다.촉매 작용, 의약품, 전기 화학 세포, 부식 등에 대한 응용 분야가 [25]개발되었습니다.
★★★★★
인프라, 건설, 제조 및 소비재에 사용되는 금속의 수요는 경제성장과 밀접하게 관련되어 있습니다.20세기 동안, 사회에서 사용되는 금속의 종류는 빠르게 증가했다.오늘날, 중국이나 인도와 같은 주요 국가의 발전과 기술의 발전은 그 어느 때보다 더 많은 수요를 촉진하고 있습니다.그 결과 광업활동이 확대되고 있으며, 전 세계 금속재고는 미사용 매장량이 아닌 지상에서 사용되고 있다.예를 들어, 구리의 사용 중 재고가 있습니다.1932년과 1999년 사이에 미국에서 사용되는 구리는 1인당 [26]73g에서 238g으로 증가했다.
금속은 본질적으로 재활용이 가능하기 때문에 원칙적으로 여러 번 사용할 수 있으며, 이러한 부정적인 환경 영향을 최소화하고 에너지를 절약할 수 있습니다.예를 들어, 보크사이트 광석에서 알루미늄을 만드는 데 사용되는 에너지의 95%는 재활용 [27]재료를 사용하여 절약됩니다.
세계적으로 금속 재활용은 일반적으로 낮습니다.2010년, 유엔 환경 프로그램 주최의 국제 자원 패널(International Resource Panel)은, 사회내에[28] 존재하는 금속의 재고와 그 재활용율에 [26]관한 리포트를 발표했습니다.이 보고서의 저자들은 사회의 금속 재고는 지상의 거대한 광산 역할을 할 수 있다는 것을 관찰했다.그들은 휴대폰, 하이브리드 자동차용 배터리 팩, 연료 전지와 같은 용도에 사용되는 일부 희귀 금속의 재활용률이 너무 낮아서 미래의 수명이 다하지 않는 한 이러한 중요한 금속은 현대 기술에서 사용할 수 없게 될 것이라고 경고했다.
산화 환원 [29]효소에서 칼슘의 역할에 대한 자세한 섹션을 포함하여 세포 생화학 진화에 있어 금속 원소의 역할이 검토되었다.
철, 코발트, 니켈, 구리, 아연 중 하나 또는 그 이상의 원소는 모든 고등 생명체에 필수적입니다.몰리브덴은 비타민 B12의 필수 성분이다.다른 모든 전이 원소 및 전이 후 원소의 화합물은 안티몬 및 주석의 특정 화합물과 같은 예외를 제외하고는 다소 독성이 있다.금속 중독의 잠재적 원인에는 광산, 미행, 산업 폐기물, 농업 유출, 직업상 노출, 페인트 및 처리된 목재 등이 포함됩니다.
★★★
구리는 다른 돌이나 조약돌에 비해 독특한 생김새, 무거움, 가단성을 감안할 때 처음 발견된 금속일 수 있다.금, 은, 철(운석 철)과 납도 마찬가지로 선사시대에도 발견되었다.구리와 아연의 합금인 황동의 형태는 이러한 금속의 광석을 동시에 제련하여 만들어진 것으로서, 이 시기에 유래했다(순수 아연은 13세기까지 분리되지 않았다.고체 금속의 가단성은 금속 장신구, 도구, 무기를 만드는 첫 번째 시도로 이어졌다.니켈을 함유한 운석철은 때때로 발견되었으며, 어떤 면에서는 합금강이 [30]두드러지게 된 1880년대까지 제조된 어떤 산업용 강철보다도 우수했습니다.
★★★
청동(구리와 비소 또는 주석의 합금)의 발견은 사람들이 이전에 가능했던 것보다 더 단단하고 더 내구성이 좋은 금속 물체를 만들 수 있게 했다.청동 도구, 무기, 갑옷, 장식용 기와 같은 건축 재료는 이전의 돌이나 구리보다 단단하고 내구성이 뛰어났다.처음에 청동은 구리와 비소의 광석을 자연 제련하거나 인공적으로 혼합하여 구리와 비소([31]비소 청동)로 만들어졌다.지금까지 알려진 가장 초기의 유물들은 기원전 [32]5천 년기의 이란 고원에서 나왔다.기원전 [33]3천년 후반에야 주석의 주요 비구리 성분이 되었다.순수한 주석 자체는 기원전 1800년 중국과 일본의 금속공장에 의해 처음 분리되었다.
수은은 기원전 2000년 이전에 고대 중국인들과 인도인들에게 알려졌고 기원전 1500년 전 이집트 무덤에서 발견되었다.
철-탄소 합금인 강철의 최초 생산은 아나톨리아 고고학 유적지(카만-칼레호예크)에서 발굴된 철기 조각에서 볼 수 있으며 기원전 [34][35]1800년으로 거슬러 올라가는 거의 4,000년 전의 것이다.
기원전 500년경부터 스페인 톨레도의 검 제작자들은 텅스텐과 망간을 함유한 울프라마이트라고 불리는 광물을 철광석(및 탄소)에 첨가하여 초기 형태의 합금강을 만들고 있었다.그 결과 나온 톨레도 강철은 포에니 전쟁에서 한니발이 사용했을 때 로마의 주목을 받게 되었다.그것은 곧 로마 군단의 무기의 기초가 되었다; 그들의 칼은 "그들이 [citation needed][n 8]자를 수 없는 투구가 없을 정도로 예리했다"고 한다.
콜럼버스 이전의 아메리카에서는 구리와 금의 합금인 텀바가로 만들어진 물건들이 기원후 300년에서 500년 사이에 파나마와 코스타리카에서 생산되기 시작했다.작은 금속 조각들은 흔했고 다양한 종류의 텀바가 장식품들은 신분이 높은 사람들의 일상적인 레갈리아를 구성했다.
비슷한 시기에 에콰도르 원주민들은 황금과 소량의 팔라듐, 로듐, 이리듐이 함유된 자연발생 백금 합금을 결합하여 백금-백금 합금으로 구성된 미니어처와 마스크를 생산했습니다.금속공장은 금을 백금 합금과 함께 가열해 금을 녹여 금 안에 백금족 금속이 결합했다.냉각 후, 합성물을 망치질하고 재가열하여 관련된 모든 금속이 함께 용해된 것처럼 균질화되었습니다(해당되는 백금족 금속의 용해점은 당시의 [36][n 9]기술 범위를 벗어났습니다).
중세 시대
금은 주인에게, 은은 하녀에게 있다.
장사를 잘 하는 장인에게 줄 구리.
"좋아요!" 남작은 홀에 앉아 말했다.
"하지만 철, 즉 차가운 철은 모든 것의 달인이다."
from Cold Iron by Rudyard Kipling[37]
아랍과 중세 연금술사들은 모든 금속과 물질은 모든 금속의 아버지이자 가연성 성질을 지닌 유황의 원리와 모든 금속의[n 10] 어머니이자 유동성, 용융성, 휘발성 성질을 지닌 운반체인 수은의 원리로 구성되어 있다고 믿었다.이러한 원리는 대부분의 실험실에서 볼 수 있는 황과 수은의 흔한 물질은 아니었다.이 이론은 모든 금속이 열, 소화, 시간, 그리고 연금술의 [n 11]지식과 방법을 통해 개발되고 촉진될 수 있는 오염물질의 적절한 조합을 통해 지구의 장에서 금이 될 운명이라는 믿음을 강화했다.
비소, 아연, 안티몬, 비스무트는 불변성 때문에 처음에는 세미메탈 또는 사생 금속으로 불렸다.이 4개 모두 초기에 그 성격을 인식하지 못한 채 우연히 사용되었을 수 있습니다.알베르투스 마그누스는 1250년 비소 삼황화물과 함께 비누를 가열하여 화합물에서 비소를 분리한 최초의 사람으로 여겨진다.불순하면 부서지기 쉬운 금속 아연은 서기 1300년에 인도에서 분리되었다.안티몬을 분리하는 방법에 대한 첫 번째 설명은 Vanoccio Biringuccio의 1540년 책 De la pirotechnia에 있습니다.비스무트는 De Natura Foscellium (1546)에서 아그리콜라에 의해 기술되었다; 그것은 초기에 주석과 납과 비슷했기 때문에 혼동되었다.
르네상스

광업과 야금술에 관한 최초의 체계적인 텍스트는 금속의 검사, 융합, 가공을 다루는 Vannoccio Biringuccio의 De la Pirotechnia (1540년)였다.
16년 후, Georgius Agricola는 1556년 De Re Metalica를 출판했는데, 이것은 광업, 야금, 부속 예술과 과학의 직업에 대한 명확하고 완전한 설명일 뿐만 아니라 16세기까지 화학 산업에 대한 가장 위대한 논문으로 인정되었습니다.
그는 De Natura Foscellium (1546)에서 금속에 대해 다음과 같이 기술했다.
금속은 본질적으로 액체이거나 다소 단단한 광물체이다.후자는 불의 열로 녹을 수 있지만, 다시 차가워져 모든 열을 잃게 되면 다시 딱딱해져서 원래의 형태를 되찾는다.이 점에서 그것은 불에 녹는 돌과는 다르다. 왜냐하면 후자는 단단함을 되찾았지만 원래의 형태와 특성을 잃었기 때문이다.
전통적으로 금, 은, 구리, 철, 주석, 납 등 6가지 금속이 있다.퀵실버는 금속이지만 연금술사들은 이 주제에 대해 우리와 의견이 다르며 비스무트도 마찬가지입니다.고대 그리스 작가들은 비스무트에 대해 무지했던 것 같다, 그래서 암모니우스는 우리에게 알려지지 않은 많은 금속, 동물, 식물이 있다고 올바르게 말한다.스티비움은 도가니에서 제련되고 정제될 때 작가들에 의해 납으로 인정받는 만큼 고유 금속으로 간주될 권리가 있다.양철에 일정부분을 첨가하면 서점용 합금이 생산되며, 이 합금은 종이책을 인쇄하는 사람이 사용하는 활자로 만들어진다.
각 금속은 혼합된 금속과 분리될 때 보존되는 고유한 형태를 가지고 있습니다.따라서 일렉트로넘이나 스탠넘은 (우리 주석의 의미는 아님) 진짜 금속이 아니라 두 금속의 합금입니다.일렉트로넘은 금과 은의 합금, 납과 은의 스탠넘입니다.그러나 은이 일렉트로넘에서 분리되면 금은 일렉트로넘이 아니라 남는다. 은을 스탄넘에서 빼앗기면 납은 남고 스탄넘은 남는다.
그러나 놋쇠가 토종 금속인지 아닌지는 어떤 보증도 할 수 없다.우리는 오직 칼라민 광물질의 색깔로 착색된 구리로 구성된 인공 황동만을 알고 있다.파헤쳐진다면 그건 진짜 금속일 거야검은색과 흰색 구리는 빨간색과 다른 것 같아요.
따라서 금속은 내가 말했듯이 고체이거나 퀵실버의 독특한 경우처럼 유동적이다.
하지만 이제 단순한 [38]종류들에 대해서는 충분합니다.
금과 은에 이은 세 번째 귀금속인 플래티넘은 1736년부터 1744년까지 스페인 천문학자 안토니오 데 울로아와 그의 동료 수학자 호르헤 후안 이 산타실리아에 의해 에콰도르에서 발견되었다.울로아는 1748년에 금속에 대한 과학적인 설명을 쓴 최초의 사람이었다.
1789년, 독일의 화학자 마틴 하인리히 클라프로트는 금속 그 자체라고 생각했던 우라늄의 산화물을 분리했다.클라프로스는 그 후 우라늄을 발견한 사람으로 인정받았다.1841년이 되어서야 프랑스의 화학자 외젠-멜키오르 페리고가 우라늄 금속의 첫 샘플을 준비했다.헨리 베크렐은 1896년 우라늄을 이용해 방사능을 발견했다.
1790년대에 조셉 프리스틀리와 네덜란드의 화학자 마르티누스 반 마룸은 알코올의 탈수소 작용에 대한 금속 표면의 변형 작용을 관찰했고, 1831년에는 백금 촉매를 이용한 황산의 산업 규모 합성을 이끌었다.
1803년, 세륨은 스웨덴의 바스트내스에서 옌스 야콥 베르젤리우스와 빌헬름 히신저에 의해, 그리고 독일의 마틴 하인리히 클라프로트에 의해 독립적으로 발견된 최초의 란타늄 금속이었다.란타니드 금속은 1960년대까지 기이한 금속으로 간주되어 왔으며, 그 때 서로 보다 효율적으로 분리하는 방법이 개발되었습니다.그 후 휴대폰, 자석, 레이저, 조명, 배터리, 촉매변환기 및 현대 기술을 가능하게 하는 기타 응용 분야에서 용도를 찾아냈습니다.
이 기간 동안 발견되고 제조된 다른 금속들은 코발트, 니켈, 망간, 몰리브덴, 텅스텐, 그리고 크롬이었다; 그리고 백금족 금속들, 팔라듐, 오스뮴, 이리듐, 그리고 로듐이다.
경금속
1809년까지 발견된 모든 금속은 비교적 높은 밀도를 가지고 있었고, 그 중량은 유일하게 구별되는 기준으로 간주되었다.1809년부터 나트륨, 칼륨, 스트론튬과 같은 경금속들이 분리되었다.그들의 낮은 밀도는 금속의 성질에 대한 통념에 도전했다.그러나 그들은 화학적으로 금속으로 작용했고, 이후 그렇게 인식되었다.
알루미늄은 1824년에 발견되었지만 1886년에야 산업적인 대규모 생산 방법이 개발되었습니다.알루미늄 가격은 떨어졌고 알루미늄은 1890년대와 20세기 초에 보석, 일상용품, 안경테, 광학기기, 식기, 호일 등에 널리 쓰이게 되었다.알루미늄은 단단하면서도 가벼운 합금을 다른 금속과 형성할 수 있는 능력이 그 당시에 많이 사용되었습니다.제1차 세계 대전 동안, 주요 정부들은 가볍고 튼튼한 기체를 위한 알루미늄의 대량 출하를 요구했습니다.오늘날 전력 전송에 사용되는 가장 일반적인 금속은 알루미늄-도체강 강화입니다.또한 올 알루미늄 합금 도체도 많은 활용을 볼 수 있습니다.알루미늄은 동등한 저항 구리 케이블의 약 절반 무게(비전도율이 낮기 때문에 직경이 커짐)를 가지고 있을 뿐만 아니라 값도 저렴하기 때문에 사용됩니다.구리는 과거에 더 많이 사용되었고 특히 낮은 전압과 접지에 여전히 사용되고 있습니다.
순수 금속 티타늄(99.9%)은 1910년에 처음 제조되었지만 1932년까지 실험실 밖에서 사용되지 않았습니다.1950년대와 1960년대에 소련은 냉전과 관련된 프로그램의 일환으로 군사 및 잠수함 분야에서 티타늄 사용을 개척했다.1950년대 초부터 티타늄은 F-100 슈퍼 세이버와 록히드 A-12와 SR-71과 같은 항공기를 시작으로 군용 항공, 특히 고성능 제트기에 광범위하게 사용되었습니다.
금속 스칸듐은 1937년에 처음으로 생산되었다.최초의 99% 순수 스칸듐 금속 파운드는 1960년에 생산되었다.알루미늄-스칸듐 합금의 생산은 1971년 미국 특허에 따라 시작되었다.알루미늄-스칸듐 합금도 소련에서 개발되었다.
강철의 시대
현대 제철의 시대는 1855년 헨리 베세머의 베세머 공정의 도입으로 시작되었는데, 이 공정의 원료는 선철이었다.그의 방법은 값싸게 많은 양의 강철을 생산할 수 있게 해주었고, 따라서 연강은 이전에 단철을 사용하던 대부분의 용도로 사용되게 되었다.Gilchrist-Thomas 공정(또는 기본 베세머 공정)은 변환기에 인을 제거하기 위한 기본 재료를 라이닝하여 만든 베세머 공정을 개선한 것입니다.
강철은 높은 인장 강도와 낮은 비용 때문에 건물, 인프라, 공구, 선박, 자동차, 기계, 가전제품, 무기에 사용되는 주요 부품이 되었습니다.
1872년, 영국인 클라크와 우즈는 오늘날 스테인리스강으로 여겨지는 합금을 특허 취득했다.철-크롬 합금의 내식성은 1821년 프랑스 야금학자 피에르 베르티에에 의해 인정되었다.그는 일부 산의 공격에 대한 그들의 저항력에 주목하고 식기류에 사용할 것을 제안했다.19세기의 금속학자들은 대부분의 현대 스테인리스강에서 볼 수 있는 낮은 탄소와 높은 크롬의 조합을 생산할 수 없었고, 그들이 생산할 수 있는 높은 크롬 합금은 실용적이기에는 너무 취약했다.1912년이 되어서야 영국, 독일, 미국에서 스테인리스 합금의 산업화가 이루어졌다.
마지막으로 안정된 금속 원소는
1900년까지 가장 무거운 안정 금속인 납(#82)보다 적은 원자 번호를 가진 세 개의 금속, 즉 71, 72, 75 원소가 발견되었다.
1906년 폰 웰스바흐는 오래된 이터비움에도 카시오페움이라는 새로운 원소가 들어있다는 것을 증명했다.Urbain은 동시에 이것을 증명했지만, 그의 샘플은 매우 불순했고 새로운 원소의 미량만을 포함하고 있었다.그럼에도 불구하고, 그가 선택한 이름인 루테튬은 채택되었다.
1908년 오가와 씨는 토리아나이트에서 75원소를 발견했지만 75원소가 아닌 43원소로 지정해 니포늄으로 명명했다.1925년 월터 노닥, 아이다 에바 타케, 그리고 오토 버그는 가돌리네이트로부터 분리되었다고 발표했고 현재의 이름인 레늄이라는 이름을 붙였다.
Georges Urbain은 희토류 잔류물에서 72번 원소를 발견했다고 주장한 반면, Vladimir Vernadsky는 독립적으로 오르타이트에서 72번 원소를 발견했습니다.그들이 보고한 화학물질이 현재 하프늄으로 알려진 것과 일치하지 않기 때문에, 제1차 세계대전 때문에 두 주장 모두 확인되지 않았고, 나중에 확인될 수도 없었다.전후인 1922년 코스터와 헤베시는 노르웨이 지르콘에서 X선 분광 분석을 통해 이를 발견했다.하프늄은 따라서 발견된 마지막 안정 원소였다.
제2차 세계대전이 끝날 때까지 과학자들은 네 개의 우라늄 이후의 원소를 합성했는데, 이 원소들은 모두 방사성 금속이다: 넵투늄(1940년), 플루토늄(1940년-41년), 퀴륨과 아메리슘(194년), 93년부터 96년까지를 나타낸다.이들 중 처음 두 마리도 결국 자연에서 발견되었다.큐륨과 아메리슘은 1945년 세계 최초의 원자폭탄을 생산한 맨해튼 프로젝트의 부산물이었다.이 폭탄은 약 150년 전에 처음 발견된 것으로 알려진 우라늄의 핵분열을 기반으로 만들어졌다.
제2차 세계 대전 후의 발전
초합금
Fe, Ni, Co, Cr의 조합과 적은 양의 W, Mo, Ta, Nb, Ti 및 Al로 구성된 초합금은 제2차 세계대전 직후 650°C(1,200°F 이상)의 고온에서 고성능 엔진에 사용하기 위해 개발되었습니다.이러한 조건 하에서 대부분의 강도를 장기간 유지하고, 우수한 저온 연성과 부식 또는 산화 방지성을 결합합니다.초합금은 이제 육상, 해양 및 항공 우주 터빈, 화학 및 석유 플랜트 등 다양한 분야에서 찾아볼 수 있습니다.
트랜스쿠륨 금속
제2차 세계대전이 끝난 후 원자폭탄의 성공적인 개발은 새로운 원소를 합성하려는 노력을 촉발시켰는데, 이들 원소는 거의 모두 금속이며, 방사성 원소가 될 것으로 예상되고 있다.1949년이 되어서야 96번 원소 다음으로 97번 원소(버켈륨)가 아메리슘 표적을 향해 알파 입자를 발사하여 합성되었다.1952년 최초의 수소 폭탄 폭발 잔해에서 100원소가 발견되었고, 비금속인 수소는 거의 200년 전에 원소로서 확인되었다.1952년 이후, 101번 원소(멘델레비움)부터 118번 원소(오가네손)가 합성되었다.
벌크 메탈릭 글라스
금속 유리(아모퍼스 또는 유리 금속이라고도 함)는 원자 규모의 구조가 무질서한 고체 금속 물질로, 보통 합금입니다.대부분의 순수 금속과 합금 금속은 고체 상태에서 원자가 고순서 결정 구조로 배열되어 있다.비정질 금속은 비결정성 유리 같은 구조를 가지고 있다.그러나 전형적인 전기 절연체인 유리창과 같은 일반적인 유리창과는 달리 비정질 금속은 전기 전도성이 좋다.비정질 금속은 매우 빠른 냉각, 물리적 증기 증착, 고체 반응, 이온 조사 및 기계적 합금을 포함한 여러 가지 방법으로 생산됩니다.최초로 보고된 금속 유리는 1960년 Caltech에서 생산된 합금(AuSi7525)이었다.최근에는 기존 강철 합금의 3배 강도를 가진 비정질강 묶음이 생산되었습니다.현재 가장 중요한 응용 분야는 일부 강자성 금속 유리의 특수 자기 특성에 의존합니다.낮은 자화 손실은 고효율 변압기에서 사용됩니다.도난 방지 ID 태그 및 기타 물품 감시 체계에서는 이러한 자석 특성 때문에 금속 안경을 사용하는 경우가 많습니다.
형상 기억 합금
형상기억합금(SMA)은 원래 모양을 "기억"하고 가열하면 변형된 형태로 되돌아가는 합금입니다.형상 기억 효과는 1932년에 Au-Cd 합금에서 처음 관찰되었지만, 1962년에 Ni-Ti 합금에서 효과가 우연히 발견되고 나서 본격적으로 연구가 시작되었고, 상업적인 응용이 나타나기 10년이 더 전에야 시작되었다.SMA는 로봇, 자동차, 항공우주 및 바이오메디컬 산업에 응용되고 있습니다.강한 자기장 하에서 모양을 바꾸는 강자성 형상 기억 합금(FSMA)이라고 불리는 또 다른 형태의 SMA가 있습니다.이 재료들은 자기 반응이 온도에 의한 반응보다 더 빠르고 효율적인 경향이 있기 때문에 특히 관심을 끈다.
준시리스탈린 합금
1984년 이스라엘의 화학자 댄 셰흐트만은 결정구조가 2배, 3배, 4배, 6배의 대칭을 가질 수 있다는 당시의 결정학적 관례를 어기고 5배의 대칭을 가진 알루미늄-망간 합금을 발견했다.과학계의 반응에 대한 두려움 때문에 그는 2011년 노벨 화학상을 받은 결과를 발표하는 데 2년이 걸렸다.그 이후로 수백 개의 준결정성이 보고되고 확인되었다.그것들은 많은 금속 합금(및 일부 중합체)에 존재한다.준결정체는 알루미늄 합금(Al-Li-Cu, Al-Mn-Si, Al-Ni-Co, Al-Pd-Mn, Al-Cu-Fe, Al-Cu-V 등)에서 가장 많이 발견되지만, 다른 수많은 조성물(Cd-Yb, Ti-Z)도 알려져 있다.준결정체는 실질적으로 무한히 큰 단위 세포를 가지고 있다.자연에서 발견된 최초의 준결정인 이코세드라이트 AlCuFe는632413 2009년에 발견되었다.대부분의 준결정(quasicrystal)은 낮은 전기 전도율(절연체에서 볼 수 있는 값 접근)과 낮은 열 전도율, 높은 경도, 취약성 및 내식성 및 비접착성 등의 세라믹 유사 특성을 가지고 있습니다.준결정체는 단열재, LED, 디젤 엔진 및 열을 전기로 변환하는 신소재를 개발하는 데 사용되어 왔다.새로운 응용 분야에서는 일부 준결정 재료의 낮은 마찰 계수와 경도를 활용할 수 있습니다. 예를 들어 플라스틱에 입자를 내장하여 견고하고 마모성이 높은 저마찰 플라스틱 기어를 만들 수 있습니다.기타 잠재적 적용으로는 전력 변환을 위한 선택적 태양 흡수기, 광파장 반사기, 생체적합성, 저마찰 및 내식성이 요구되는 뼈 수리 및 보형물 애플리케이션이 있다.
복합 금속 합금
복합금속합금(CMAs)은 수십에서 수천개의 원자로 이루어진 큰 단위세포, 잘 정의된 원자 클러스터(흔히 20면체 대칭)의 존재 및 결정격자 내의 부분 무질서를 특징으로 하는 금속간 화합물이다.두 개 이상의 금속 원소로 구성되며, 때로는 금속이나 카르코게니드가 첨가되기도 합니다.예를 들어 NaCd2는 단위 셀에 348개의 나트륨 원자와 768개의 카드뮴 원자를 포함하고 있습니다.라이너스 폴링은 1923년에 NaCd의 구조를2 설명하려고 시도했지만 1955년까지 성공하지 못했다.처음에 "거대 단위 세포 결정"이라고 불렸던 CMA에 대한 관심은 2002년이 되어서야 회복되었고, "구조적으로 복잡한 합금 위상"이라는 논문이 제8회 준결정 국제회의에서 발표되었습니다.CMA의 잠재적 적용에는 단열재로서, 태양열 가열, 자기 냉장고, 전기를 생성하기 위해 폐열을 사용하는 것, 그리고 군사 엔진의 터빈 블레이드에 대한 코팅이 포함됩니다.
고엔트로피 합금
AlLiMgScTi 등의 High-Entropy 합금(HEA)은 5개 이상의 금속이 동등하거나 거의 동일한 양으로 구성되어 있다.HEA는 기본 금속이 하나 또는 두 개뿐인 기존 합금에 비해 중량 대비 강도가 상당히 우수하고 인장 강도가 높으며 균열, 부식 및 산화에 대한 저항성이 더 높습니다.HEA는 1981년에 기술되었지만, 2010년대까지 큰 관심을 끌지 못했다. HEA는 바람직한 성질에 대한 잠재력 때문에 재료 과학 및 공학 분야의 연구의 초점이 되고 있다.
MAX상 합금
| 맥스. | M | A | X |
|---|---|---|---|
| Hf2SnC | HF | Sn | C |
| Ti4AlN3 | 티 | 알 | N |
| Ti3SiC2 | 티 | Si | C |
| Ti2AlC | 티 | 알 | C |
| CralC22 | Cr | 알 | C |
| Ti3AlC2 | 티 | 알 | C |
M은 조기 전이 금속이고, A는 A족 원소(대부분 IIIA, IVA 또는 13, 14족)이며, X는 탄소 또는 질소 중 하나이다.예를 들어 HfSnC2 및 TiAlN이43 있습니다.이러한 합금은 금속과 세라믹의 가장 좋은 특성을 가지고 있다.이러한 특성에는 높은 전기 및 열전도율,[39] 내열충격성, 손상 내성, 기계가공성, 높은 탄성 강성 및 낮은 열팽창계수가 포함됩니다.</ref> 전기 전도성이 뛰어나 금속 광택으로 연마할 수 있습니다.기계적 테스트에서 다결정 TiSiC32 실린더는 상온에서 최대 1GPa의 응력까지 반복적으로 압축되어 부하 제거 시 완전히 회복될 수 있는 것으로 확인되었습니다.또한 일부 MAX 단계는 화학 공격(예: TiSiC32) 및 공기 중 고온 산화(TiAlC2, CrAlC22 및 TiAlC32)에 대한 내성이 매우 높습니다.MAX 상 합금의 잠재적 적용에는 견고하고 가공 가능한 내열성 내화물, 고온 가열 소자, 전기 접점을 위한 코팅 및 원자력 적용을 위한 중성자 조사 내구성 부품이 포함된다.1960년대에 MAX상 합금이 발견되었지만, 이 주제에 대한 첫 번째 논문은 1996년에야 발표되었습니다.
「 」를 참조해 주세요.
메모들
- ^ 이것은 간단한 설명입니다. 다른 요인에는 원자 반지름, 핵 전하, 결합 궤도 수, 궤도 에너지의 중첩, 결정 [6]형태가 포함될 수 있습니다.
- ^ 풍부도가 같거나 1조당 1ppm 미만인 트레이스 요소(예를 들어 Tc, Pm, Po, At, Ra, Ac, Pa, Np 및 Pu)는 표시되지 않습니다.
- ^ 예를 들어 고에너지 감마선이 존재하거나 매우 고온의 수소 농도가 높은 환경에서 실험 대상 핵은 중성자 손실 또는 양성자 이득을 경험하여 (비교적으로 드문) 중성자 결핍 [18]동위원소를 생성할 수 있다.
- ^ 두 중성자별이 충돌할 때 물질이 방출되는 것은 조력, 지각 교란 가능성, 충격 가열(엔진 차가울 때 가속 페달을 밟으면 엔진이 [21]차가워진다.
- ^ 철, 코발트, 니켈, 주석도 지구 전체에서 볼 때 친철성입니다.
- ^ 철분의 또 다른 생명을 가능하게 하는 역할은 헤모글로빈의 핵심 성분으로서 폐에서 몸의 나머지 부분으로 산소를 운반할 수 있게 해줍니다.
- ^ 청동은 주로 구리로 구성되어 있으며, 일반적으로 주석의 약 12%가 함유되어 있으며, 종종 다른 금속(알루미늄, 망간, 니켈, 아연 등)을 첨가하거나 비소, 인 또는 실리콘과 같은 비금속 또는 금속을 첨가합니다.
- ^ 소아시아의 폰투스의 칼리빈족은 철과 강철에서 동시에 일했다는 이유로 축하를 받고 있었다.그들이 모르는 사이에, 그들의 철은 많은 양의 망간을 함유하고 있어서, 우수한 형태의 강철을 생산할 수 있었다.
- ^ 시리아 다마스쿠스에서는 검은 바탕에 빛에 식각된 지역의 소용돌이 무늬로 구성된 독특한 표면 패턴의 칼과 칼을 제작했다.이 칼날들은 전설적인 절단 능력을 가지고 있었다.대장장이들이 사용하던 철은 인도에서 공급되었으며 V, Mo, Cr, Mn 및 Nb와 같은 탄화물 생성 원소를 하나 이상 포함하고 있었습니다.이들 무기의 현대적 분석 결과 이들 원소가 탄소나노튜브의 촉매 형성을 뒷받침하는 것으로 나타났고, 이는 다시 시멘트(Fe3C) 나노와이어의 형성을 촉진했다.카본 나노튜브의 가단성은 시멘타이트의 부서지기 쉬운 성질을 상쇄하고 강철에 고유한 강도와 유연성 조합을 부여했습니다.다마스쿠스강이라고 불리는 것을 만드는 방법에 대한 지식은 아마도 불순물의 적절한 조합을 가진 광원의 고갈로 인해 18세기에 사라졌다.관련된 기술은 2009년까지 재발견되지 않았다.
- ^ 고대에는 납이 모든 금속의 아버지로 여겨졌다.
- ^ 후기 독일 르네상스 작가인 파라셀수스는 그의 삼원칙에서 비휘발성과 불연성을 지닌 소금의 세 번째 원리를 추가했다.이 이론들은 유황, 수은, 그리고 소금의 조성의 기초가 되는 네 가지 고전적인 요소들을 유지했다.
레퍼런스
- ^ 치앙, CD(1977년)."국토 polythiazyl 브롬 화물의 광학적 성질:(SNBr0.4))".NAND통신. 23(9):607–612. doi:10.1016(77)90530-0.;.Greenwood, 잘 자라, 언소, A(1998년).요소의 화학.옥스포드:Butterworth-Heinemann. 우편 727. 아이 에스비엔 978-0-7506-3365-9.;.Mutlu, H;Theato, P(2021년)."sulfur-nitrogen 채권과 폴리머".장, X, Theato, P(eds.)에서.Sulfur-Containing 폴리머:종합 기능성 물질까지.Weinheim:Wiley-VCH. p. 191–234(191).아이 에스비엔 978-3-527-34670-7.
- ^ Yonezawa, F. (2017). Physics of Metal-Nonmetal Transitions. Amsterdam: IOS Press. p. 257. ISBN 978-1-61499-786-3.
Sir Nevill Mott (1905-1996) wrote a letter to a fellow physicist, Prof. Peter P. Edwards, in which he notes... I've though a lot about 'What is a metal?' and I think one can only answer the question at T = 0 (the absolute zero of temperature). There a metal conducts and a nonmetal doesn't.
- ^ Martin, John C. "What we learn from a star's metal content". John C. Martin's Homepage. Retrieved March 25, 2021.
{{cite web}}: CS1 maint :url-status (링크) - ^ Martin, John C.; Morrison, Heather L. (May 18, 1998) [1998]. "A New Analysis of RR Lyrae Kinematics in the Solar Neighborhood". The Astronomical Journal (published October 1, 1998). 116 (4): 1724–1735. arXiv:astro-ph/9806258. Bibcode:1998AJ....116.1724M. doi:10.1086/300568. S2CID 18530430 – via IOPscience.
- ^ Roe, J.; Roe, M. (1992). "World's coinage uses 24 chemical elements". World Coinage News. 19 (4, 5): 24–25, 18–19.
- ^ a b c d e Mortimer, Charles E. (1975). Chemistry: A Conceptual Approach (3rd ed.). New York: D. Van Nostrad Company.
- ^ "Ductility – strength (mechanics) of materials".
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Russell, A. M.; Lee, K. L. (2005). Structure–Property Relations in Nonferrous Metals. Structure-Property Relations in Nonferrous Metals. Hoboken, NJ: John Wiley & Sons. pp. passim. Bibcode:2005srnm.book.....R. ISBN 978-0-471-64952-6.
- ^ Metal contamination. Editions Quae. 2006. ISBN 978-2-7592-0011-5.
- ^ Tunay, Olcay; Kabdasli, Isik; Arslan-Alaton, Idil; Olmez-Hanci, Tugba (2010). Chemical Oxidation Applications for Industrial Wastewaters. IWA Publishing. ISBN 978-1-84339-307-8.
- ^ Walther, John V. (2013). Earth's Natural Resources. Jones & Bartlett Publishers. ISBN 978-1-4496-3234-2.
- ^ Abdul-Rahman, Yahia (2014). The Art of RF (Riba-Free) Islamic Banking and Finance: Tools and Techniques for Community-Based Banking. John Wiley & Sons. ISBN 978-1-118-77096-2.
- ^ a b Cox 1997, 페이지 73–89 : 1997
- ^ Cox 1997, 페이지 32, 63, 85 : 1997
- ^ 포도섹 2011, 페이지 482
- ^ 파드마나반 2001, 234페이지
- ^ Rehder 2010, 32, 33페이지
- ^ 호프만 2002, 23~24페이지
- ^ 하다지 2016
- ^ 찹투익, 레너 & 프레토리아스 2015, 383페이지
- ^ Cox 1997, 페이지 83, 91, 102–103 : 1997
- ^ "Los Alamos National Laboratory – Sodium". Retrieved 2007-06-08.
- ^ "Los Alamos National Laboratory – Aluminum". Retrieved 2007-06-08.
- ^ Avnir, David (2014). "Molecularly doped metals". Acc. Chem. Res. 47 (2): 579–592. doi:10.1021/ar4001982. PMID 24283194.
- ^ a b 금속 재활용률: Wayback Machine 2010, 국제자원패널, UN환경프로그램의 2016-01년 현황보고서 아카이브
- ^ 가볍게 걷기: 알루미늄 공격 Carolyn Fry, Guardian.co.uk, 2008년 2월 22일.
- ^ 사회에서의 금속주: Wayback Machine 2010, 국제 자원 패널, 유엔 환경 프로그램에서 2016-01-01 과학 합성 아카이브
- ^ "About the Editors". Metals, Microbes, and Minerals - the Biogeochemical Side of Life. De Gruyter. 2021. pp. v–vi. doi:10.1515/9783110589771-001. ISBN 9783110589771. S2CID 242357865.
- ^ Reardon, Arthur C. (2011). Metallurgy for the non-metallurgist. Materials Park, Ohio: ASM International. pp. 73–84. ISBN 978-1-61503-845-9. OCLC 780082219.
- ^ Tylecote, R. F. (1992). A History of Metallurgy, Second Edition. London: Maney Publishing, for the Institute of Materials. ISBN 978-1-902653-79-2. Archived from the original on 2015-04-02.
- ^ Thornton, C.; Lamberg-Karlovsky, C. C.; Liezers, M.; Young, S. M. M. (2002). "On pins and needles: tracing the evolution of copper-based alloying at Tepe Yahya, Iran, via ICP-MS analysis of Common-place items". Journal of Archaeological Science. 29 (12): 1451–1460. doi:10.1006/jasc.2002.0809.
- ^ Kaufman, Brett. "Metallurgy and Archaeological Change in the Ancient Near East". Backdirt: Annual Review. 2011: 86.
- ^ Akanuma, H. (2005). "The significance of the composition of excavated iron fragments taken from Stratum III at the site of Kaman-Kalehöyük, Turkey". Anatolian Archaeological Studies. Tokyo: Japanese Institute of Anatolian Archaeology. 14: 147–158.
- ^ "Ironware piece unearthed from Turkey found to be oldest steel". The Hindu. Chennai, India. 2009-03-26. Archived from the original on 2009-03-29. Retrieved 2009-03-27.
- ^ Knauth, P. (1976). The Metalsmiths, revised edition. London: Time-Life International. pp. 133, 137.
- ^ 1909년 9월 <델리네이터>에 실렸다.1910년에 보상과 요정의 소개로 전재되었습니다.
- ^ Georgius Agricola, De Re Metalica (1556) Tr.Herbert Clark Hoover & Lou Henry Hoover (1912); De Natura Fosculium (1546), 페이지 180을 인용한 각주
- ^ Max phase 복합 재료 과학 및 엔지니어링 A
추가 정보
- Choptuik M. W., Lehner L. & Pretoras F. 2015, 수치 시뮬레이션을 통한 강장 중력 추진 A. Ashtekar, B. K. Berger, J. Isenberg & M. MacCallum(에드), 일반상대성과 중력: 100주년 전망, 케임브리지 대학 출판부, ISBN 978-1-107-037-1.
- Cox P. A. 1997, 요소: 기원, 풍부함, 분포, 옥스퍼드 대학 출판부, ISBN 978-0-19-855298-7
- 크로우 J. M. 2016, "불가능한 합금: "전혀 볼 수 없는 금속을 만드는 방법" 뉴사이언티스트, 10월 12일
- Hadhazy A. 2016, "자연의 가장 무거운 원소의 기원을 설명하는 은하계 '금광'," 사이언스 스포트라이트, 2016년 5월 10일, 2016년 7월 11일.
- Hofmann S. 2002, On Beyond Uranium: Journey to the End the Periodic Table, Taylor & Francis, London, ISBN 978-0-415-28495-0.
- Padmanabhan T. 2001, 천체물리학 이론, 제2권, 캠브리지 대학 출판부, ISBN 978-0-521-56241-6.
- Passis R. V. 1977, The metal lements, Longman, 런던, ISBN 978-0-582-44278-8
- Podosek F. A. 2011, H.D.의 "귀한 가스"홀랜드 & K. K. 투레키안(eds), 동위원소 지구화학: 암스테르담 엘세비에르 지구화학 논문, 467–492페이지, ISBN 978-08-096710-3.
- 레이먼드 R. 1984, 불타는 용광로 밖으로: 금속이 인류 역사에 미치는 영향, 맥밀런 호주, 멜버른, ISBN 978-0-333-38024-6
- Rehder D. 2010, Chemistry in Space: From Interstellar Matter to the Origin of Life, Wiley-VCH, Weinheim, ISBN 978-3-527-3289-1.
- Russell A. M. & Lee K. L. 2005, 비철금속 구조-특성 관계, 뉴저지 호보켄, ISBN 978-0-471-64952-6
- Street A. & Alexander W. 1998, Metals in man, 11th ed, Penguin Books, 런던, ISBN 978-0-14-025776-2
- Wilson A. J. 1994, 살아있는 바위: 초창기부터 금속의 토리와 그것이 문명에 미치는 영향, 케임브리지 우드헤드 출판사, ISBN 978-1-85573-154-7
외부 링크
- ASM International(구 미국 금속 협회)
- 광물 금속 물질 협회