오르가노타늄 화합물
Organotitanium compound유기농 화학에서 오르간오티타늄 화합물은 탄소-티타늄 화학 결합을 포함한다. 오르가니타늄 화학은 오르가노타늄 화합물의 물리적 특성, 합성 및 반응을 설명하는 과학이다. 유기화학 분야의 시약으로 주요 산업 과정에 관여하고 있다.[1]
간략한 역사
오르간오타늄 화합물을 준비하려는 첫 번째 시도는 1861년으로 거슬러 올라가지만, 첫 번째 예는 1954년까지 보고되지 않았다. 그 해에 티타노세 디클로로이드 는 윌킨슨과 버밍엄에 의해 묘사되었다. 독립적으로, 티타늄 기반의 지글러-나타 촉매제가 주요 상업적 응용으로 이어지며, 1963년 노벨 화학상이 수여되었다. 이 기술은 오르간오티타늄 화학의 기술적 중요성을 강조했다.
특성.
티타늄 전자 구성([Ar]3d4s22)은 막연하게 탄소 구성과 닮아 있으며, 탄소처럼 +4 산화 상태가 지배적이다. 그러나 티타늄은 탄소보다 훨씬 더 큰 원소로, Ti-C 결합 길이가 약 30% 더 길다는 것을 반영한다. 예를 들어, 테트라벤질티타늄의 210 pm과 155 pm의 일반적인 C-C 결합이다. 그러나 티타늄의 큰 크기와 그것의 사면체 복합체의 전자 결핍 특성 때문에 단순한 사면체 화합물은 일반적으로 분리할 수 없다. 단순한 테트라알킬 화합물보다 더 풍부하고 유용한 것은 알카산화물과 사이클로펜타디엔틸콜리간드를 혼합한 리간드 복합체들이다. 티타늄은 조정 번호가 높은 콤플렉스를 형성할 수 있다.
산화 상태의 관점에서 대부분의 유기농 화학은 적어도 용액에서 Ti(IV)와 Ti(III)의 파생상품에 초점을 맞춘다. 티타노세 디카보닐과 티(CH3)(2dmpe)의 예로는 Ti(II) 화합물이 드물다.2 [Ti(CO)]62−는 공식적으로 Ti(-II)의 콤플렉스다.[3] 티(III)가 지글러-나타 카탈루션에 관여하지만 티(III)의 유기적 파생상품은 흔치 않다. 한 예로 조광기 [CpTiCl2III]2[4]가 있다.
티타늄의 낮은 전기율 때문에 Ti-C 결합은 탄소를 향해 양극화된다. 결과적으로, 많은 티타늄 화합물에서 알킬 리간드는 핵성분이다. 티타늄은 특징적으로 옥소필로 되어 있어 무공해 기법의 사용을 권장하고 있다. 한편, 높은 옥소독성은 아래에서 논의한 바와 같이 티타늄 알킬이 옥소 집단을 위한 오르가닐 리간드를 추상화하거나 교환하는데 효과적이라는 것을 의미한다.
화합물
알킬 티타늄 염화물 및 알크산화물
티타늄의 단순한 알킬 복합체(예: Ti(CHCH265))4[6]는 드물다. 여러 알킬-티타늄-할리드와 알킬-티타늄-알코산시드가 유기합성에 활용되는 경우가 많지는 않지만, 유기합성에 활용된다.[7] 적어도 상업적 관점에서는 가장 유용한 오르가노타늄 화합물이 티타늄(III) 염화물과 디에틸알루미늄을 결합하여 생성된다. 지글러-나타 촉매로서, 그러한 종은 에테네의 중합성을 효율적으로 촉매한다. 이 과정은 이질적이며 어떤 유기농 중간체도 이 과정에 대해 잘 특징지어지지 않았다.
티타늄 테트라클로라이드, 티타늄 테트라알코산화물 또는 그 혼합물을 오가놀리늄, 오르가노마그네슘, 오르가노진크 화합물과 결합하여 수많은 오르가노타늄 시약이 생산된다. 그러한 화합물은 유기합성 시약으로 가끔 사용된다. 명목상 CHTiCl인33 Methyltitanium trichloride는 티타늄(titan)을 처리하여 준비할 수 있다.IV) -78°C에서 디클로로메탄에 디메틸진크(dimethylzinc)를 첨가한 염화물. 카보닐 화합물과 알킬 할로겐에 메틸 그룹을 전달한다. "Methyltriopropoxytitanium"은 관련 시약이다.[8] 다이얼키타늄 종은 그리그나드 시약과 에스테르에서 시작되는 티가 촉진하는 사이클로프로판화에 관여한다. 이러한 반응은 쿨린코비치 반응의 근간이다.[9]
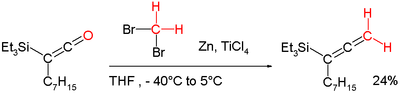
"롬바르도의 시약"은 메틸렌화에 사용된다.[10] 기능적으로 디브로모메탄-진크-타이타늄(Dibromomethane-Zinc-Titanium)과 관련이 있다.IV)[11] 염화물 시약 이 화학은 스테레오케미컬 무결성(롬바르도 메틸렌화) 손실 없이 에놀리스성 카르보닐 그룹을 메틸렌화함으로써 위티그 시약의 단점을 해결한다. 예를 들어, 케틴을 알렌으로 변환할 때도 적용할 수 있다.[7][12]
타이타노세 유도체
"티타노세(titanocene)"의 합성 시도, 즉, Ti(CH55)는 풀발렌 콤플렉스를 생산한다.2[13][15] 타이타노세 다이머는 1970년대에[15][16][17] 인식되었지만 1992년까지 구조적으로 특징지어지지 않았고,[14] 조사 결과 티타늄의 사이클로펜타디엔틸 복합체에 대한 많은 혁신이 이루어졌다.[13] 1998년에야 비로소 진짜 타이타노세 파생상품인 파라자성종(CMeSiMe543)2Ti가 확인되었다.[18]
타이타노세 그 자체와는 대조적으로, 티타노세 디클로로이드와 어느 정도는 티타노세 모노클로라이드는 풍부하고 잘 정의된 화학물질을 가지고 있다.[13] 티타노세 디클로로이드와 트리메틸알루미늄에서 제조된 테베의 시약은 메틸렌화제(RC2=O to RC2=CH)로2 사용된다.
테베의 시약은 타이타노시클로부탄(titanocyclobutanes)을 주기 위해 간단한 알케인을 첨가하는데, 이것은 안정적인 올레핀 메타텍스 매개체로 간주될 수 있다. 이 화합물들은 그 자체로 시약인 11-bis(사이클로펜타디닐)-3,3-dimethyltitanocyclobutane과 같은 시약들이다.[19]

페타시스 시약 또는 디메틸 타이타노세(1990)는 디에틸에테르에 함유된 티타노세 디클로로이드와 메틸리튬에서 제조된다. 테베의 시약에 비해 준비는 쉽고 취급은 쉽다. 메틸렌화 시약이기도 하다.[19]
누겐트-라잔바부 시약은[20] 마르코브니코프 링-오픈 에폭시드를 통해 알코올 생성을 위한 합성 유기화학에 사용되는 1전자기 환원제로, 조광제[( dim-Cp5)2Ti(μ-Cl)]2로 생성되며 타이타노신 디클로로시드로부터 현장에서 사용된다.[4][21][22][23]
MonoCp 화합물
유기화학에서는 덜 유용하지만 여전히 두드러진 것은 (사이클로펜타디닐)티타늄 트리클로라이드, (CH55)TiCl의3 많은 파생상품이다. 이 피아노 스툴 콤플렉스는 티타노세 디클로로이드와 티타늄 테트라클로라이드의 재분배 반응으로 얻어진다. 전자수치가 12로 16e 타이타노세 디클로로이드보다 훨씬 더 전기영양적이다.
아레네 단지
테트라클로라이드 티타늄은 헥사메틸벤젠과 반응하여 [(η-CMe666)TiCl3]+염분을 준다. 감소된 아레네 복합체에는 산화 상태 -1, 0, +1이 포함된다.[24][25]
카보닐 복합체
[Ti(CO)]62−의 염류가 알려져 있다.[26]
참조
- ^ "유기합성에서의 유기물 시약 (유기화학에서의 활성성 및 구조 개념, Vol 24)" 맨프레드 T. 레츠 1986 ISBN0-387-15784-0
- ^ Michel Ephritikhine (1998). "A new look at the McMurry reaction". Chem. Commun. (23): 2549–2554. doi:10.1039/a804394i.
- ^ 엘센브로이치, C. "Oganometalics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ a b Manzer, L. E.; Mintz, E. A.; Marks, T. J. (1982). Cyclopentadienyl Complexes of Titanium(III) and Vanadium(III). Inorg. Synth. Inorganic Syntheses. Vol. 21. pp. 84–86. doi:10.1002/9780470132524.ch18. ISBN 9780470132524.
- ^ Z. Dawoodi; M. L. H. Green; V. S. B. Mtetwa; K. Prout; A. J. Schultz; J. M. Williams; T. F. Koetzle (1986). "Evidence for Carbon–Hydrogen–Titanium Interactions: Synthesis and Crystal Structures of the Agostic alkyls [TiCl3(Me2PCH2CH2PMe2)R] (R = Et or Me)". J. Chem. Soc., Dalton Trans. (8): 1629. doi:10.1039/dt9860001629.
- ^ Davies, Gwyneth R.; Jarvis, J. A. J.; Kilbourn, B. T. (1971). "The Crystal and Molecular Structures (At –40 °C) of the Tetrabenzyls of Titanium, Hafnium, and Tin". J. Chem. Soc. D (23): 1511–1512. doi:10.1039/C29710001511.
- ^ a b Hartwig, J. F. Organotrition Metal Chemistry, 본딩에서 카탈루션까지; University Science Books: New York, 2010. ISBN 1-891389-53-X
- ^ Imwinkelried, René; Seebach, Dieter (1989). "3'-Nitro-1-Phenylethanol by Addition of Methyltriisopropoxytitanium to m-Nitrobenzaldehyde". Organic Syntheses. 67: 180. doi:10.15227/orgsyn.067.0180.
- ^ Cha, Jin Kun; Kulinkovich, Oleg G. (2012). "The Kulinkovich cyclopropanation of carboxylic acid derivatives". Organic Reactions. 77: 1–159. doi:10.1002/0471264180.or077.01. ISBN 978-0471264187.
- ^ Luciano Lombardo (1987). "Methylenation of Carbonyl Compounds: (+)-3-Methylene-cis-p-menthane". Organic Syntheses. 65: 81. doi:10.15227/orgsyn.065.0081.
- ^ Takai, K.; Hotta, Y.; Oshima, K.; Nozaki, H. Tetrahedron Lett. 1978: 2417–2420.
{{cite journal}}: 누락 또는 비어 있음title=(도움말) - ^ Marsden, Stephen P; Ducept, Pascal C (2005). "Synthesis of highly substituted allenylsilanes by alkylidenation of silylketenes". Beilstein Journal of Organic Chemistry. 1: 5. doi:10.1186/1860-5397-1-5. PMC 1399453. PMID 16542018.
- ^ a b c d Mehrotra, R. C.; Singh, A. (2000). "4.3.6 η5-Cyclopentadienyl d-Block Metal Complexes". Organometallic Chemistry: A Unified Approach (2nd ed.). New Delhi: New Age International Publishers. pp. 243–268. ISBN 9788122412581.
- ^ a b Troyanov, Sergei I.; Antropiusová, Helena; Mach, Karel (1992). "Direct proof of the molecular structure of dimeric titanocene; The X-ray structure of μ(η5:η5-fulvalene)-di-(μ-hydrido)-bis(η5-cyclopentadienyltitanium)·1.5 benzene". J. Organomet. Chem. 427 (1): 49–55. doi:10.1016/0022-328X(92)83204-U.
- ^ a b Wailes, P. C.; Coutts, R. S. P.; Weigold, H. (1974). "Titanocene". Organometallic Chemistry of Titanium, Zirconium, and Hafnium. Organometallic Chemistry. Academic Press. pp. 229–237. ISBN 9780323156479.
- ^ Antropiusová, Helena; Dosedlová, Alena; Hanuš, Vladimir; Karel, Mach (1981). "Preparation of μ-(η5:η5-Fulvalene)-di-μ-hydrido-bis(η5-cyclopentadienyltitanium) by the reduction of Cp2TiCl2 with LiAlH4 in aromatic solvents". Transition Met. Chem. 6 (2): 90–93. doi:10.1007/BF00626113. S2CID 101189483.
- ^ Cuenca, Tomas; Herrmann, Wolfgang A.; Ashworth, Terence V. (1986). "Chemistry of oxophilic transition metals. 2. Novel derivatives of titanocene and zirconocene". Organometallics. 5 (12): 2514–2517. doi:10.1021/om00143a019.
- ^ Chirik, Paul J. (2010). "Group 4 Transition Metal Sandwich Complexes: Still Fresh after Almost 60 Years". Organometallics. 29 (7): 1500–1517. doi:10.1021/om100016p.
- ^ a b Hartley, Richard C.; Li, Jianfeng; Main, Calver A.; McKiernan, Gordon J. (2007). "Titanium carbenoid reagents for converting carbonyl groups into alkenes". Tetrahedron. 63 (23): 4825–4864. doi:10.1016/j.tet.2007.03.015.
- ^ Rosales, Antonio; Rodríguez-Garcia, Ignacio; Muñoz-Bascón, Juan; Roldan-Molina, Esther; Padial, Natalia M.; Morales, Laura P.; García-Ocaña, Marta; Oltra, J. Enrique (2015). "The Nugent Reagent: A Formidable Tool in Contemporary Radical and Organometallic Chemistry". Eur. J. Org. Chem. 2015 (21): 4567–4591. doi:10.1002/ejoc.201500292.
본 검토 기사는 다음과 같은 방법으로 "Nugent 시약"이 아닌 "Nugent-Rajan Babu 시약"을 참조하도록 수정되었다.
Rosales, Antonio; Rodríguez-Garcia, Ignacio; Muñoz-Bascón, Juan; Roldan-Molina, Esther; Padial, Natalia M.; Morales, Laura P.; García-Ocaña, Marta; Oltra, J. Enrique (2015). "The Nugent–RajanBabu Reagent: A Formidable Tool in Contemporary Radical and Organometallic Chemistry". Eur. J. Org. Chem. 2015 (21): 4592. doi:10.1002/ejoc.201500761. - ^ Handa, Yuichi; Inanaga, Junji (1987). "A highly stereoselective pinacolization of aromatic and α, β-unsaturated aldehydes.dta mediated by titanium(III)-magnesium(II) complex". Tetrahedron Lett. 28 (46): 5717–5718. doi:10.1016/S0040-4039(00)96822-9.
- ^ Nugent, William A.; RajanBabu, T. V. (1988). "Transition-metal-centered radicals in organic synthesis. Titanium(III)-induced cyclization of epoxy olefins". J. Am. Chem. Soc. 110 (25): 8561–8562. doi:10.1021/ja00233a051.
- ^ Jungst, Rudolph; Sekutowski, Dennis; Davis, Jimmy; Luly, Matthew; Stucky, Galen (1977). "Structural and magnetic properties of di-μ-chloro-bis[bis(η5-cyclopentadienyl)titanium(III)] and di-μ-bromo-bis[bis(η5-methylcyclopentadienyl)titanium(III)]". Inorg. Chem. 16 (7): 1645–1655. doi:10.1021/ic50173a015.
- ^ Blackburn, David W.; Britton, Doyle; Ellis, John E. (1992). "A New Approach to Bis(arene)titanium(0) and -titanium(–I) Complexes; Structure of Bis(arene)titanates(1–)". Angewandte Chemie International Edition in English. 31: 1495–1498. doi:10.1002/anie.199214951.
- ^ Calderazzo, Fausto; Ferri, Isabella; Pampaloni, Guido; Englert, Ulli; Green, Malcolm L. H. (1997). "Synthesis of [Ti(η6-1,3,5-C6H3iPr3)2][BAr4] (Ar = C6H5, p-C6H4F, 3,5-C6H3(CF3)2), the First Titanium(I) Derivatives". Organometallics. 16: 3100–3101. doi:10.1021/om970155o.
- ^ Ellis, J. E. (2003). "Metal Carbonyl Anions: from [Fe(CO)4]2− to [Hf(CO)6]2− and Beyond". Organometallics. 22 (17): 3322–3338. doi:10.1021/om030105l.