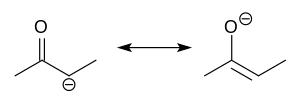
에놀레이트
Enolate에놀레이트는 카르보닐 화합물의 탈양성자에서 유래한 유기 음이온이다.거의 분리되지 않아 유기 [1][2][3][4]화합물 합성에 시약으로 널리 사용됩니다.
본딩 및 구조
에놀레이트 음이온은 알릴 음이온과 전자적으로 관련이 있다.음이온 전하가 산소와 두 탄소 부위 위에서 탈국소화된다.따라서 알콕시드와 카르보니온의 [5]특성을 모두 가지고 있습니다.
단순 소금으로 그려지는 경우가 많지만, 실제로는 [6]골재를 특징으로 하는 복잡한 구조를 채택하는 경우가 많다.

준비
에놀화성 케톤, 알데히드 및 에스테르 탈양성자는 에놀산염을 [8][9]생성한다.강력한 기반과 함께, 탈양성화는 양적이다.일반적으로 에놀레이트는 리튬디이소프로필아미드(LDA)[10]를 사용하여 생성됩니다.
흔히 기존의 클라이젠 응축, 만니히 반응 및 알돌 응축과 같이 에놀레이트는 알콕시드 염기와 함께 저농도로 생성된다.이러한 조건에서는 저농도로 존재하지만 여전히 친전자성 물질과 반응한다.많은 요인들이 에놀레이트, 특히 용제, 첨가제(예: 디아민) 및 대항제+(Li vs+ Na 등)의 거동에 영향을 미친다.비대칭 케톤의 경우 탈양성자의 위치 [11]화학을 제어하는 방법이 존재한다.

탄소산의 탈양성자는 운동학적 또는 열역학적 반응 제어로 진행될 수 있다.예를 들어 페닐아세톤의 경우 탈양성자는 두 가지 다른 에놀레이트를 생성할 수 있다.LDA는 탈양성자의 운동 과정인 메틸기를 탈양성자화하는 것으로 나타났다.키네틱 생성물의 생산을 보장하기 위해 약간의 리튬 디이소프로필아미드를 사용하고 케톤을 -78°C에서 베이스에 첨가한다.케톤은 신속하고 양적으로 에놀라트로 변환되며 염기가 항상 과잉으로 존재하기 때문에 케톤은 열역학 생성물의 점진적 형성을 촉매하는 양성자 셔틀 역할을 할 수 없다.기질을 가역적으로 탈양성자화하는 알콕시드와 같은 약한 염기는 보다 열역학적으로 안정된 벤질 에놀라트를 제공한다.
에놀레이트는 산소에서 발생하는 아실화와 실릴화에 의해 갇힐 수 있습니다.시릴 에놀에테르(Silyl Enol ether)는 무카이야마 알돌 [13]반응에서 알 수 있듯이 유기 합성의 일반적인 시약입니다.
반응
강력한 핵 친핵체로서 에놀레이트는 다양한 전자 친핵체와 쉽게 반응한다.이러한 반응은 새로운 C-C 결합과 종종 새로운 스테레오 센터를 생성합니다.입체선택성과 위치선택성은 첨가제, 용매, 대향 등에 의해 영향을 받는다.친전자체의 중요한 한 부류는 할로겐화 알킬이며, 이 경우 전형적인 문제가 발생한다: O-알킬화 대 C-알킬화.이 선택성을 제어하는 것은 많은 관심을 끌었다.에놀레이트의 음전하는 산소에 집중되지만, 그 중심은 또한 높은 용해도로 C-알킬화를 [14]일으킨다.
다른 중요한 전자 친필로는 알데히드/케톤과 마이클 수용체입니다.[15]
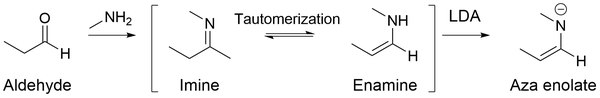
아자 에놀레이트
아자 에놀레이트([16]이민 음이온, 에나미드, 금속 쉬프 염기 및 메탈로아민이라고도 함)는 에놀레이트와 유사한 질소이다.이민을 LDA와 같은 강한 염기로 처리하면 고구핵성 아자에놀레이트가 생성된다.
아자 에놀레이트를 사용하는 주된 장점은 염기성 용액이나 중성 용액에서 자가 응축(알데히드에 대한 알돌 반응)을 거치지 않고 오히려 알파 [17]탄소에 대한 알킬화를 선호한다는 것입니다.이는 산소-탄소 이중 결합을 포함하는 알데하이드와 달리 이미인이 탄소-질소 이중 결합을 포함하고 있기 때문이다.산소는 질소보다 전기음성적이기 때문에 카보닐 탄소로부터 더 많은 전자 밀도를 끌어당겨 탄소에 부분적으로 더 큰 양의 전하를 유발합니다.따라서, 더 많은 친전자성 탄소와 함께, 알데히드는 탄소-산소 이중 결합의 탄소에 더 나은 친핵성 첨가를 가능하게 한다.
한편, 이민은 카르보닐-카본에 약한 부분 양전하를 유도하는 전기음성 질소가 적다.결과적으로, 이미인은 여전히 유기 리시움과 반응할 수 있지만, 그들은 친핵성 [18]첨가를 받기 위해 다른 친핵성 물질들과 반응하지 않습니다.
대신 에놀레이트는 에놀레이트와 유사하게 반응하여 SN2 알킬화 생성물을 [17]형성합니다.질소 론쌍의 결합을 통해 β-탄소는 친핵성 부위가 되고, 아자에놀레이트가 알킬화 [19]반응을 일으킬 수 있다.따라서 에놀레이트는 에폭시드 및 할로겐화 알킬과 같은 수많은 전자 친유물과 반응하여 [16]β-탄소 결합을 형성할 수 있다.
다음 두 가지 잠재적 반응 메커니즘을 보여 줍니다.
에폭시드는 3원 고리 분자이기 때문에 고리의 변형도가 높다.링 계통의 탄소는 사면체이며, 각 원자 사이에 109.5도를 선호하지만, 에폭시드는 링 각도를 60도로 변형시킨다.이 효과에 대항하기 위해 친핵성 아자 에놀레이트는 에폭시드와 쉽게 반응하여 고리 균주를 감소시킨다.
에폭시드와 반응하는 것 외에 아자 에놀레이트는 알킬 할로겐화물(또는 위에서 설명한 할로겐화알킬)과 반응하여 새로운 탄소-탄소 시그마 결합을 형성할 수 있다.이 반응은 수컷 공격성 페로몬인 Oulema melanopus의 [21]합성에 있어 중요한 단계 중 하나입니다.피발알데히드와 반응하는 LDA에 의해 아자 에놀라트가 생성되고, 이어서 알킬 할로겐화물과 반응하여 Oulema melanopus 중간체를 형성한다.
아자 에놀레이트는 그리냐드 시약과 함께 형성될 수 있으며 마이클 [16]수용체를 포함한 다른 연질 전자파일과 반응할 수 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Stolz, Daniel; Kazmaier, Uli (2010). "Metal Enolates as Synthons in Organic Chemistry". PATai's Chemistry of Functional Groups. doi:10.1002/9780470682531.pat0423. ISBN 9780470682531.
- ^ Hart, David J.; Ha, Deok Chan (1989). "The ester enolate-imine condensation route to .beta.-lactams". Chemical Reviews. 89 (7): 1447–1465. doi:10.1021/cr00097a003.
- ^ Wu, George; Huang, Mingsheng (2006). "Organolithium Reagents in Pharmaceutical Asymmetric Processes". Chemical Reviews. 106 (7): 2596–2616. doi:10.1021/cr040694k. PMID 16836294.
- ^ Curti, Claudio; Battistini, Lucia; Sartori, Andrea; Zanardi, Franca (2020). "New Developments of the Principle of Vinylogy as Applied to π-Extended Enolate-Type Donor Systems". Chemical Reviews. 120 (5): 2448–2612. doi:10.1021/acs.chemrev.9b00481. PMC 7993750. PMID 32040305.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "Enolates" . doi : 10.1351 / goldbook . E02123
- ^ Reich, Hans J. (2013). "Role of Organolithium Aggregates and Mixed Aggregates in Organolithium Mechanisms". Chemical Reviews. 113 (9): 7130–7178. doi:10.1021/cr400187u. PMID 23941648.
- ^ Nichols, Michael A.; Leposa, Christina M.; Hunter, Allen D.; Zeller, Matthias (2007). "Crystal Structures of Hexameric and Dimeric Complexes of Lithioisobutyrophenone". Journal of Chemical Crystallography. 37 (12): 825–829. doi:10.1007/s10870-007-9255-0. S2CID 97183362.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Manfred Braun (2015). Modern Enolate Chemistry: From Preparation to Applications in Asymmetric Synthesis. Wiley‐VCH. doi:10.1002/9783527671069. ISBN 9783527671069.
- ^ Christine Wedler, Hans Schick (1998). "Synthesis of Β-lactones By Aldolization of Ketones with Phenyl Ester Enolates: 3,3-Dimethyl-1-oxaspiro[3.5]nonan-2-one". Org. Synth. 75: 116. doi:10.15227/orgsyn.075.0116.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Gall, Martin and House, Herbert O. (1972). "The Formation and Alkylation of Specific Enolate Anions from an Unsymmetrical Ketone: 2-Benzyl-2-methylcyclohexanone and 2-Benzyl-6-methylcyclohexanone". Org. Synth. 52: 39. doi:10.15227/orgsyn.052.0039.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Kong, Jianshe; Meng, Tao; Ting, Pauline and Wong, Jesse (2010). "Preparation of Ethyl 1-Benzyl-4-Fluoropiperidine-4-Carboxylate". Organic Syntheses. 87: 137. doi:10.15227/orgsyn.087.0137.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Mukaiyama, Teruaki; Kobayashi, Shū (1994). "Tin(II) Enolates in the Aldol, Michael, and Related Reactions". Organic Reactions. pp. 1–103. doi:10.1002/0471264180.or046.01. ISBN 0471264180.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, p. 551, ISBN 978-0-471-72091-1
- ^ Seebach, Dieter (1988). "Structure and Reactivity of Lithium Enolates. From Pinacolone to SelectiveC-Alkylations of Peptides. Difficulties and Opportunities Afforded by Complex Structures". Angewandte Chemie International Edition in English. 27 (12): 1624–1654. doi:10.1002/anie.198816241.
- ^ a b c Aslam, O. (28 September 2012). Development of catalytic aza enolate reactions (Doctoral). UCL (University College London).
- ^ a b Clayden, Jonathan (2012). Organic chemistry (2nd ed.). Oxford: Oxford University Press. pp. 465, 593–594. ISBN 9780199270293.
- ^ Cranwell, Philippa. "Enamines/aza-enolates – Mechanism Mordor". sites.google.com. Archived from the original on 2021-09-03. Retrieved 2020-11-28.
- ^ Carey, Francis A. (2007). Advanced organic chemistry. Part B, Reactions and synthesis (5th ed.). New York, NY: Springer. pp. 46–47. ISBN 978-0-387-68350-8.
- ^ Hudrlik, Paul F.; Wan, Chung-Nan (October 1975). "Reactions of oxetane with imine salts derived from cyclohexanone". The Journal of Organic Chemistry. 40 (20): 2963–2965. doi:10.1021/jo00908a027.
- ^ a b Chevalley, Alice; Férézou, Jean-Pierre (2012). "One-pot formation of aza-enolates from secondary amines and condensation to esters and alkyl bromides". Tetrahedron. 68 (29): 5882–5889. doi:10.1016/j.tet.2012.04.105.