환원 제거
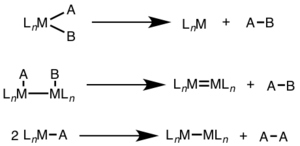
Reductive elimination환원성 제거는 두 리간드 사이에 새로운 공밸런트 결합을 형성하면서 금속중심의 산화 상태가 감소하는 유기물 화학의 기본적인 단계다.산화 첨가물의 미세한 역순으로, 많은 촉매 공정에서 제품 형성 단계가 되는 경우가 많다.산화 첨가 및 환원 제거는 역반응이므로 두 공정 모두에 동일한 메커니즘이 적용되며, 제품 평형은 양 방향의 열역학에 따라 달라진다.[1][2]
일반 정보
환원성 제거는 더 높은 산화 상태에서 흔히 볼 수 있으며, 단일 금속 중심(단핵)에서 2전자의 변화 또는 두 금속 중심 각각에서 1전자의 변화를 수반할 수 있다(비핵화, 이핵화 또는 바이메탈릭).[1][2]
단핵 환원 제거의 경우 금속의 산화 상태는 2 감소하는 반면 금속의 d전자 수는 2 증가한다.이 경로는 d금속8 Ni(II), Pd(II), Au(III) 및 d금속6 Pt(IV), Pd(IV), Ir(III), Rh(III)에 공통적이다.또한 단핵 환원 제거는 제거되는 집단이 금속 중심에서 서로 시스(cis)되어야 함을 요구한다.[3]
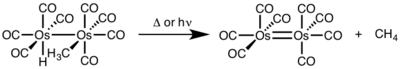
이핵 환원 제거의 경우 각 금속의 산화 상태는 1씩 감소하는 반면 각 금속의 d전자 수는 1씩 증가한다.이러한 유형의 반응성은 일반적으로 산화 상태의 단일 단위 변화를 선호하는 1열 금속과 함께 나타나지만 2열 및 3열 금속 모두에서 관찰되었다.[4]
메커니즘
산화 첨가와 마찬가지로 환원 제거와 함께 여러 메커니즘이 가능하다.두드러진 메커니즘은 일치된 경로로, 입체화학이 보존된 비극, 3중심의 전환 상태라는 뜻이다.또, 스테레오 화학의 역전을 진행하는 S2N 메커니즘이나, 스테레오 화학의 소멸을 진행하는 급진적 메커니즘도, 환원성 제거를 위한 다른 가능한 경로다.[1]3
옥타헤드 복합체
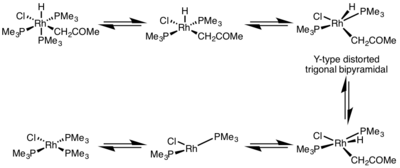
환원 제거율은 금속 복합체의 기하학적 구조에 의해 크게 영향을 받는다.팔면체 복합체에서 환원 제거는 조정 포화 중심에서 매우 느릴 수 있으며, 종종 환원 제거는 5개의 조정체 복합체를 만들기 위해 리간드가 초기에 분리해야 하는 분리 메커니즘을 통해서만 진행된다.이 단지는 Y형 일변삼각형 삼각형 구조를 채택하고 있는데, 이 구조는 bas-도너 리간드가 기저 위치에 있고 제거될 두 집단이 매우 가깝게 모인다.제거 후 T자형 3좌표 콤플렉스가 형성되는데, 리간드와 결부되어 사각 평면 4좌표 콤플렉스를 형성하게 된다.[5]
사각 평면 복합체
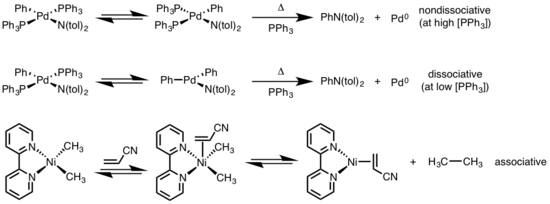
사각 평면 단지의 환원적 제거는 분산, 비분해 및 연관성의 다양한 메커니즘을 통해 진행될 수 있다.팔면체 복합체와 유사하게, 사각 평면 복합체에 대한 분산 메커니즘은 리간드를 상실하면서 시작되며, 단일 결합 금속 복합체를 생성하기 위해 환원 제거 과정을 거치는 세 개의 좌표 중간을 생성한다.비분산적인 경로의 경우, 2개의 조정된 복합체를 수용하기 위해 4개의 좌표계로부터 환원적 제거가 발생한다.제거 리간드가 서로 교환되는 경우, 단지는 제거하기 전에 먼저 시스 이소머화(trans-trans-trans-to cisomerization)를 거쳐야 한다.연관 메커니즘에서, 리간드는 팔면체 콤플렉스의 분리 메커니즘과 동의어인 환원 제거 과정을 거치는 5개의 조정체 콤플렉스를 생성하기 위해 처음에 4개의 좌표 금속 콤플렉스와 연관되어야 한다.[6][7]
환원 제거에 영향을 미치는 요인
환원성 제거는 1) 금속 정체성과 전자 밀도, 2) 스테틱스, 3) 참여 리간드, 4) 조정 번호, 5) 기하학, 6) 광분해/산소화를 포함한 다양한 요인에 민감하다.또한 환원성 제거와 산화성 첨가제는 역반응이기 때문에 환원성 제거율을 높이는 모든 스테틱스 또는 전자제품은 열역학적으로 산화성 첨가 속도를 방해해야 한다.[2]
금속 아이덴티티와 전자 밀도
1열 금속단지는 2열 금속단지에 비해 환원 제거 속도가 빠른 편으로 3열 금속단지에 비해 빠른 편이다.이는 1열 단지의 금속 리간드 본드가 3열 단지의 금속 리간드 본드보다 약해지는 등 본드 강도 때문이다.또한, 전자가 부족한 금속 센터는 전자가 풍부한 금속 센터보다 더 빨리 환원 제거를 겪는다. 그 결과 금속은 환원 제거 시 전자 밀도를 얻기 때문이다.[8]
스테릭스
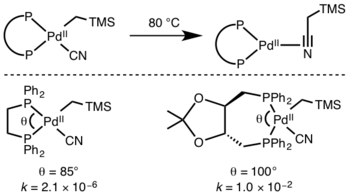
환원성 제거는 일반적으로 환원성 제거 시 장력 방해물이 완화되기 때문에 보다 장력 장애가 있는 금속 중심에서 더 빠르게 발생한다.또한 넓은 리간드 물림 각도는 일반적으로 환원성 제거를 가속화하는데, 이는 스테릭스가 제거 그룹을 더 가깝게 만들어 궤도 중첩을 더 많이 허용하기 때문이다.[9]
참가 리간즈
환원 제거를 위한 운동학적 반응은 예측하기 어렵지만 전환 상태에서 궤도 중첩의 영향으로 하이드라이드를 수반하는 반응은 특히 빠르다.[10]
조정번호
환원 제거는 4개 또는 6개 조정 금속 중심보다 3개 또는 5개 조정 금속 중심 복합체에 더 빠르게 발생한다.조정 번호 콤플렉스의 경우, 환원 제거는 강한 금속 리거 및 항균 궤도(Antibranting orbit)를 가진 중간으로 이어진다.홀수 조정 번호 콤플렉스에서 환원 제거가 발생할 경우, 그 결과 중간은 비결합 분자 궤도(nonbonding molecular arbit)를 차지한다.[11]
기하학
환원 제거는 일반적으로 구조물이 제품과 유사한 복합체에서 더 빨리 발생한다.[2]
광분해/산소화
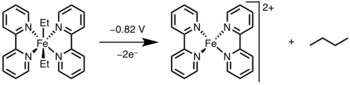
환원성 제거는 빛이나 산화제를 통해 금속 중심을 더 높은 산화 상태로 산화시킴으로써 유도될 수 있다.[12]
적용들
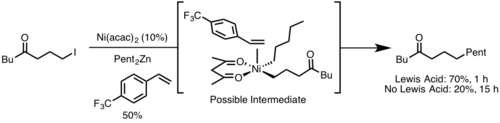
환원성 제거는 학계와 산업계에 광범위하게 적용되고 있으며, 가장 주목할 만한 것은 수소화,[13] 몬산토 아세트산 공정,[14] 수산화,[15] 교차 결합 반응이다.[16]이러한 촉매 사이클의 많은 부분에서 환원성 제거는 제품 형성 단계로서 촉매를 재생하지만, Heck reaction과[17] Wacker 공정에서는 환원성 제거는 촉매 재생에만 관여한다.[18] 이러한 반응의 제품들은 β–수소 제거에 의해 형성되기 때문이다.
참조
- ^ a b c Crabtree, Robert H. (2014). The Organometallic Chemistry of the Transition Metals (6 ed.). Wiley. p. 173. ISBN 978-1-118-13807-6.
- ^ a b c d Hartwig, John F. (2010). Organotransition Metal Chemistry, from Bonding to Catalysis. University Science Books. p. 321. ISBN 978-1-891389-53-5.
- ^ Gillie, A.; Stille, J. K. (1980). "Mechanisms of 1,1-Reductive Elimination from Palladium". J. Am. Chem. Soc. 102 (15): 4933–4941. doi:10.1021/ja00535a018.
- ^ Okrasinski, S. J.; Nortom, J. R. (1977). "Mechanism of Reductive Elimination. 2. Control of Dinuclear vs. Mononuclear Elimination of Methane from cis-Hydridomethyltetracarbonylosmium". J. Am. Chem. Soc. 99: 295–297. doi:10.1021/ja00443a076.
- ^ Milstein, D. (1982). "The First Isolated, Stable cis-Hydridoalkylrhodium Complexes and Their reductive Elimination Reaction". J. Am. Chem. Soc. 104 (19): 5227–5228. doi:10.1021/ja00383a039.
- ^ Driver, M. S.; Hartwig, J. F. (1997). "Carbon−Nitrogen-Bond-Forming Reductive Elimination of Arylamines from Palladium(II) Phosphine Complexes". J. Am. Chem. Soc. 119 (35): 8232–8245. doi:10.1021/ja971057x.
- ^ Yamamoto, T.; Yamamoto, A.; Ikeda, S. (1971). "Study of Organo(dipyridyl)nickel Complexes. I. Stability and Activation of the Alkyl-Nickel Bonds of Dialkyl(dipyridyl)nickel by Coordination with Various Substituted Olefins". J. Am. Chem. Soc. 93: 3350. doi:10.1021/ja00743a009.
- ^ Giovannini, R.; Stüdemann, T.; Dussin, G.; Knochel, P. (1998). "An Efficient Nickel-Catalyzed Cross-Coupling Between sp3 Carbon Centers". Angew. Chem. Int. Ed. 37 (17): 2387–2390. doi:10.1002/(SICI)1521-3773(19980918)37:17<2387::AID-ANIE2387>3.0.CO;2-M.
- ^ Marcone, J. E.; Moloy, K. G. (1998). "Kinetic Study of Reductive Elimination from the Complexes (Diphosphine)Pd(R)(CN)". J. Am. Chem. Soc. 120 (33): 8527–8528. doi:10.1021/ja980762i.
- ^ Low, J. J.; Goddard, III, W. A. (1984). "Reductive Coupling of Hydrogen-Hydrogen, Hydrogen-Carbon, and Carbon-Carbon Bonds from Palladium Complexes". J. Am. Chem. Soc. 106 (26): 8321–8322. doi:10.1021/ja00338a067.
- ^ Crumpton-Bregel, D. M.; Goldberg, K. I. (2003). "Mechanisms of C-C and C-H Alkane Reductive Eliminations from Octahedral Pt(IV): Reaction via Five-Coordinate Intermediates or Direct Elimination?". J. Am. Chem. Soc. 125: 9442. doi:10.1021/ja029140u. PMID 12889975.
- ^ Lau, W.; Huffman, J. C.; Kochi, J. K. (1982). "Electrochemical Oxidation-Reduction of Organometallic Complexes. Effect of the Oxidation State on the Pathways for Reductive Elimination of Dialkyliron Complexes". Organometallics. 1: 155–169. doi:10.1021/om00061a027.
- ^ de Vries, J. G. (2007). The Handbook of Homogeneous Hydrogenation. Wiley. ISBN 978-3-527-31161-3.
- ^ Paulik, F. E.; Roth, J. F. (1968). "Novel Catalysts for the Low-pressure Carbonylation of Methanol to Acetic Acid". Chem. Commun. (24): 1578. doi:10.1039/C1968001578A.
- ^ Ojima, I.; Tsai, C.-H.; Tzamarioudaki, M.; Bonafoux, D. (2004). "The Hydroformylation Reaction". Organic Reactions. 56: 1–354. doi:10.1002/0471264180.or056.01. ISBN 0471264180.
- ^ 교차 결합의 새로운 추세: 토마스 콜라콧 (편집자) 2014 ISBN 978-1-84973-896-5
- ^ de Vries, J. G. (2001). "The Heck reaction in the production of fine chemicals" (PDF). Can. J. Chem. 79 (5–6): 1086–1092. doi:10.1139/v01-033. hdl:11370/31cf3b82-e13a-46e2-a3ba-facb1e2bffbf.
- ^ Dong, J. J.; Browne, W. R.; Feringa, B. L. (2015). "Palladium-Catalyzed anti-Markovnikov Oxidation of Terminal Alkenes". Angew. Chem. Int. Ed. 54 (3): 734–744. doi:10.1002/anie.201404856. PMID 25367376.