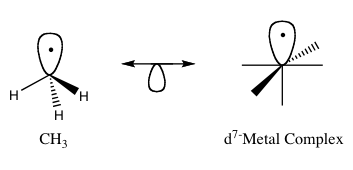
아이솔로발 원리
Isolobal principle아이솔로발 원리(보다 공식적으로 아이솔로발 유추로 더 많이 알려져 있음)는 유기농 화학에서 유기농 화합물의 결합 특성을 예측하기 위해 유기농 분자 조각과 무기 분자 조각의 구조를 연관시키기 위해 사용하는 전략이다.[1]Roald Hoffmann은 분자 조각을 "만약 개수와 대칭 특성, 대략적인 에너지와 프런티어 궤도의 모양, 그리고 그 안에 있는 전자 수가 비슷하다면 - 동일하지는 않지만 유사하다"[2]고 설명했다.만일 두 분자 조각이 유사한 프런티어 궤도, 가장 높은 점유 분자 궤도(HOMO), 가장 낮은 미점용 분자 궤도(LUMO)를 가지고 있다면, 더 잘 알려지지 않은 종의 결합과 반응성을 예측해 볼 수 있다.아이솔로발 화합물은 동일한 수의 발란스 전자와 구조를 공유하는 등전자 화합물과 유사하다.아래 궤도 반을 가진 이중 머리 화살표를 통해 연결된 등산화질소 쌍을 가진 등산화질소 구조물의 그래픽 표현은 그림 1에서 확인할 수 있다.
고립된 비유에 관한 연구로 호프만은 1981년 후쿠이 겐이치(福井一)와 함께 노벨 화학상을 받았다.[3]호프만은 노벨상 강연에서 고립된 비유는 유용하지만 단순하며, 따라서 어떤 경우에는 실패할 수밖에 없다고 강조했다.[1]
아이솔로발 파편 제작
아이솔로발 파편을 생성하기 위해서는 분자가 특정 기준을 따라야 한다.[4]주요 그룹 원소를 중심으로 한 분자는 모든 본딩 및 비본딩 분자 궤도(MO)가 채워지고 모든 항균 MO가 비어 있을 때 옥텟 규칙을 충족해야 한다.예를 들어, 메탄은 주요 그룹 파편을 형성하는 단순한 분자다.메탄에서 수소 원자를 제거하면 메틸 라디칼이 생성된다.분자는 분자 기하학을 수소 원자가 사라진 방향으로 프런티어 궤도 지점으로 유지한다.수소를 더 제거하면 제2의 프런티어 궤도 형성이 된다.이 과정은 분자의 중심 원자에 오직 하나의 결합만이 남을 때까지 반복될 수 있다.그림 2는 아이솔로발 조각의 단계별 생성 예를 보여준다.
타입 ML과6 같은 옥타헤드 복합체의 아이솔로발 파편도 비슷한 방식으로 만들 수 있다.전환 금속 단지는 처음에 18개의 전자 규칙을 만족시켜야 하고, 순전하가 없어야 하며, 리간드는 두 개의 전자 기증자(Lewis base)가 되어야 한다.따라서 ML6 시작점에 대한 금속 중심은 d여야6 한다.리간드를 제거하는 것은 앞의 예에서 메탄의 수소를 제거하여 제거된 리간드를 가리키는 프런티어 궤도(frontinent orbit)가 되는 것과 유사하다.금속 중심과 하나의 리간드 사이의 결합을 분리하면 ML급−
5 복합체가 된다.제로 충전 기준을 충족하기 위해 금속 중심을 변경해야 한다.예를 들어, MoL6 복합체는 d와6 중성이다.그러나 리간드를 제거하여 첫 번째 프런티어 궤도 형성을 하게 되면 MoL−
5 콤플렉스가 생기게 되는데, Mo가 추가로 전자를 얻어 d를7 만들었기 때문이다.이를 개선하기 위해 Mo를 그림 3과 같이 이 경우 중성 d단지를7 형성하게 되는 Mn과 교환할 수 있다.이 경향은 오직 하나의 리간드만이 금속 중심부에 조정될 때까지 계속될 수 있다.
사면 조각과 팔면 조각의 관계
4면체 분자와 8면체 분자의 아이솔로발 파편들은 관련될 수 있다.같은 수의 프론티어 궤도를 가진 구조물들은 서로 고립되어 있다.예를 들어, 두 개의 수소 원자가 제거된 메탄은 CH가2 팔면체 시작 복합체에서 형성된7 d4 ML 복합체로 고립되어 있다(그림 4).
MO 이론의존성
어떤 종류의 포화 분자도 아이솔로발 파편을 생성하는 출발점이 될 수 있다.[5][6]분자의 결합과 비결합 분자 궤도(MO)를 채우고 항균 MO를 비워야 한다.아이솔로발 파편의 각 연속적인 생성으로, 결합 궤도로부터 전자가 제거되고 프런티어 궤도(frontinent arbital)가 생성된다.프런티어 궤도들은 본딩과 비본딩 MO들보다 더 높은 에너지 수준에 있다. 각각의 프런티어 궤도들은 하나의 전자를 포함하고 있다.예를 들어, 사면체 및 팔면체 분자의 프런티어 궤도 생산을 보여주는 그림 5를 생각해 보자.
위에서 보듯이 CH로부터4 파편이 형성되면 본딩에 관여하는 sp3 하이브리드 궤도 중 하나가 비결합으로 점용되는 단독 프런티어 궤도궤도가 된다.프런티어 궤도상의 증가된 에너지 수준도 그림에서 볼 수 있다.마찬가지로 d-ML과66 같은 금속 복합체로 시작할 때 dsp 하이브리드23 궤도도 영향을 받는다.게다가, 비결합2g 금속 궤도는 변경되지 않았다.
유추의 연장
아이솔로발 유추법은 단순한 옥타헤드 콤플렉스를 넘어서는 응용이 가능하다.다양한 리간드, 충전종, 비옥타헤드 복합체와 함께 사용할 수 있다.[7]
등전자 파편
아이솔로볼 유사점은 동일한 조정 번호를 가진 등전자 파편에도 사용할 수 있어 충전된 종을 고려할 수 있다.예를 들어, Re(CO)5는 CH와3 등각형이기 때문에 [Ru(CO)]5+와 [Mo(CO)]5−도 CH와3 등각형이다.17개 전자 금속 단지는 이 예에서 이등분할 것이다.
비슷한 의미에서 두 개의 아이솔로발 파편에서 전자를 추가하거나 제거하면 두 개의 새로운 아이솔로발 파편이 생긴다.Re(CO)5는 CH와3 등각형이기 때문에 [Re(CO)]5+는 CH와+
3 등각형이다.[8]
비옥타헤드 복합체
| 팔면체 MLn | 평방평형 MLn−2 |
|---|---|
| d6: Mo(CO)5 | d8: [PdCl3]− |
| d8: Os(CO)4 | d10: 니(PR3)2 |
이 비유는 사면체 및 팔면체 기하학 외에 다른 형태에도 적용된다.팔면 기하학에서 사용되는 파생은 대부분의 다른 기하학에도 유효하다.정사각형 평면 단지는 전형적으로 16전자의 규칙을 준수하기 때문에 예외는 정사각형 평면이다.리간드가 2-전자 기증자의 역할을 한다고 가정하면, 평방평형 분자의 금속 중심은 d이다8.M이 정사각형 평면 유사 파편과x d 전자 구성을 갖는 팔면체 파편n, M이 dx+2 전자 구성을 갖는 ML을n−2 연관시키려면, M이 d 전자 구성을 갖는 공식 ML을 따라야 한다.
다양한 형태와 형태의 아이솔로발 유추의 추가 예는 그림 8에 나와 있다.
참조
- ^ a b Hoffmann, R. (1982). "Building Bridges Between Inorganic and Organic Chemistry (Nobel Lecture)" (PDF). Angew. Chem. Int. Ed. 21 (10): 711–724. doi:10.1002/anie.198207113.
- ^ 호프만은 노벨상 수상 소감 중 10개를 인용하면서 "이솔로발"이라는 용어는 참조 1e, Elian, M.; Chen, M. M.-L.; Mingos, D. M. P.; Hoffmann, R. (1976). "Comparative bonding study of conical fragments". Inorg. Chem. 15 (5): 1148–1155. doi:10.1021/ic50159a034."에서 도입되었지만 개념은 더 오래되었다고 말한다.
- ^ "The Nobel Prize in Chemistry 1981: Kenichi Fukui, Roald Hoffmann". nobelprize.org. Retrieved December 22, 2010.
- ^ Department of Chemistry. Modern Approaches to Inorganic Bonding. University of Hull.
- ^ Gispert, Joan Ribas (2008). Coordination Chemistry. Wiley-VCH. pp. 172–176.
- ^ Shriver, D.F.; Atkins, P.; Overton, T.; Rourke, J.; Weller, M.; Armstrong, F. (2006). Inorganic Chemistry. Freeman.
- ^ Miessler, G. L.; Tarr, D. A. (2008). Inorganic Chemistry (3rd ed.). Pearson Education.
- ^ Douglas, B.; McDaniel, D.; Alexander, J. (1994). Concepts and Models of Inorganic Chemistry (3rd ed.). Wiley & Sons.