하시모토 갑상샘염
Hashimoto's thyroiditis| 하시모토 갑상샘염 | |
|---|---|
| 기타이름 | 만성 림프구성 갑상샘염, 자가면역 갑상샘염, 흉선 림프종, 하시모토병 |
 | |
| 현미경으로 본 하시모토 갑상샘염 환자의 갑상선은 저배율로 볼 수 있습니다. | |
| 전문 | 내분비학 |
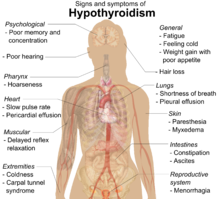
| 증상 | 무통, 체중증가, 피로감, 변비, 우울증, 피부건조증, 탈모[1] |
| 합병증 | 갑상선 림프종.[2] |
| 보통발병 | 30[1][3]~50세 |
| 원인들 | 유전적 요인과 환경적 요인.[4] |
| 위험요소 | 가족력, 또 다른 자가면역질환[1]. |
| 진단방법 | TSH, T4, 항갑상선 자가항체[1] |
| 감별진단 | 그레이브스병, 무독성 결절성 고티터[5] |
| 치료 | 레보티록신, 수술[1][5]. |
| 빈도수. | 어떤[4] 시점에서 2%. |


만성 림프구성 갑상선염, 하시모토병으로도 알려진 하시모토 갑상선염은 갑상선이 점차 파괴되는 자가면역질환입니다.[1][6] 자가면역 갑상샘염은 괴테가 없는 유사한 상태를 설명하는 데도 사용된다는 것 외에는 조금 더 넓은 용어입니다.[7][8]
초기에는 증상을 눈치채지 못할 수 있습니다.[1] 시간이 지나면 갑상선이 팽창하여 통증이 없는 갑상샘을 형성할 수 있습니다.[1] 어떤 사람들은 결국 체중 증가, 피로감, 변비, 우울증, 탈모, 전신통증과 함께 갑상선 기능 저하증이 발생합니다.[1] 수년이 지나면 갑상선은 일반적으로 크기가 줄어듭니다.[1] 잠재적 합병증으로는 갑상선 림프종이 있습니다.[2] 또한 치료되지 않은 하시모토병 환자의 경우 갑상선 기능 저하증이 발생하는 것이 일반적이기 때문에 추가적인 합병증에는 높은 콜레스테롤, 심장병, 심부전, 고혈압, 점액 부종 및 잠재적인 임신 문제가 포함될 수 있지만 이에 국한되지는 않습니다.[9]
하시모토씨의 갑상선염은 유전적 요인과 환경적 요인이 복합적으로 작용하기 때문인 것으로 생각됩니다.[4] 위험 요소에는 이 질환의 가족력과 또 다른 자가 면역 질환이 있습니다.[1] TSH, T4, 항갑상선 자가항체에 대한 혈액검사로 진단을 확인합니다.[1] 유사한 증상을 유발할 수 있는 다른 질환으로는 그레이브스병과 무독성 결절성 갑상선종이 있습니다.[5]
하시모토 갑상샘염은 일반적으로 레보티록신으로 치료합니다.[1][10] 갑상선 기능 저하증이 없는 경우, 어떤 사람들은 치료를 하지 않는 것을 권장할 수도 있고, 다른 사람들은 갑각류의 크기를 줄이려고 치료를 할 수도 있습니다.[1][11] 영향을 받은 사람들은 많은 양의 요오드를 섭취하는 것을 피해야 합니다. 그러나 특히 임신 중에는 충분한 요오드가 필요합니다.[1] 갑상샘을 치료하기 위해 수술이 거의 필요하지 않습니다.[5]
하시모토 갑상샘염은 백인의 삶의 어느 시점에서 약 5%에 영향을 미칩니다.[4] 요오드가 풍부한 지역에서 갑상선 기능 저하증을 일으키는 가장 흔한 원인입니다.[12] 일반적으로 30세에서 50세 사이에 시작되며 남성보다 여성에서 훨씬 더 흔합니다.[1][3] 질병의 비율이 증가하고 있는 것 같습니다.[5] 1912년 일본 의사 하시모토 하카루가 처음 기술했습니다.[13] 1957년, 자가면역질환으로 인정받았습니다.[14]
징후 및 증상

많은 증상들이 하시모토 갑상샘염의 발병에 기인합니다. 가장 흔한 증상은 피로감, 체중 증가, 창백하거나 부은 얼굴, 추위, 관절통 및 근육통, 변비, 모발 건조 및 가늘어짐, 생리 흐름이 심하거나 불규칙한 기간, 우울증, 공황장애, 심박수 둔화, 임신 및 유산 문제 등입니다.[15]
질병 초기의 일부 환자들은 간헐적인 갑상선 파괴로 인한 갑상선 호르몬의 분비로 갑상선 기능 항진증 증상을 경험할 수 있습니다.[16]
하시모토 병은 남성보다 여성에게 약 7배 더 많이 발생합니다. 10대와 젊은 여성에서 발생할 수 있지만 특히 남성의 경우 중년에 더 흔하게 나타납니다. 하시모토병에 걸린 사람은 갑상선이나 다른 자가면역질환이 있는 가족이 있는 경우가 많고, 때로는 다른 자가면역질환이 있는 경우도 있습니다.[17]
자가면역 갑상샘염의 초기 단계는 갑상샘이 있거나 없는 경우 정상적인 신체검사를 받을 수 있습니다.[18] 갑상샘은 앞목에 보이는 갑상선의 미만성, 종종 대칭적인 부종으로 발생할 수 있습니다.[18] 하시모토 갑상선염은 갑상선이 단단하고 크고 소엽화되어 있을 수 있지만, 갑상선의 변화는 눈에 띄지 않을 수도 있습니다.[19] 갑상선의 비대는 조직의 비대라기보다는 림프구 침윤과 섬유화 때문입니다. 난포의 초기 파괴에서 그들의 역할은 불분명하지만, 갑상선 과산화효소 또는 티로글로불린에 대한 항체는 질병과 그 심각성을 감지하는 지표 역할을 하기 때문에 관련이 있습니다.[20] 그들은 T세포 매개에 의한 샘 파괴의 2차 생성물로 생각됩니다.[21]
림프구 침윤이 진행됨에 따라 환자는 더 큰 갑상샘, 체중 증가, 감기 불내증, 피로, 점액 부종, 변비, 생리 장애, 창백하거나 건조한 피부, 건조하고 부서지기 쉬운 모발, 우울증, 운동실조 및 근육 약화를 포함하지만 이에 국한되지는 않는 여러 신체 시스템에서 갑상선 기능 저하의 징후를 보일 수 있습니다.[18][12]
자가면역 갑상샘염을 수년간 앓아온 갑상샘 환자들은 갑상샘이 파괴되어 갑상샘이 병의 후기 단계에서 갑상샘이 위축될 수 있습니다.[16]
드물지만 자가면역 갑상샘염으로 인한 갑상샘기능저하증의 더 심각한 합병증은 심낭삼출, 흉막삼출, 내분비계 응급인 점액부 혼수상태입니다.[12]
역학
자가면역 갑상샘염은 충분한 요오드 환경에서 갑상샘기능저하증의 가장 흔한 원인입니다.[12] 전 세계 인구의 2%에 영향을 미치는 것으로 추정됩니다.[22] 미국 인구의 5%까지 영향을 미칠 수 있습니다.[23] 누구나 이 병에 걸릴 수 있지만 자가면역 갑상샘염은 남성보다 여성에게 10배 정도 더 자주 발병합니다.[22] 성별 간 유병률 차이는 성호르몬의 영향 때문입니다.[24] 발병률은 생애 5년차에 최고조에 이르지만, 환자들은 보통 30-50세 사이에 진단됩니다.[16][23]
유전학
갑상선 자가면역은 가족적일 수 있습니다.[7] 많은 환자들이 자가면역 갑상샘염이나 그레이브스병의 가족력을 보고합니다.[18] 쌍둥이 연구에서 일란성 쌍둥이의 하시모토 병의 일치성이 밝혀졌습니다.[12]
요오드 소비량이 높음
자가면역 갑상샘염은 미국이나 일본처럼 식생활에서 요오드 섭취량이 많은 사회에서 유병률이 더 높습니다. 요오드가 충분한 부위에서 갑상선 기능 저하증의 가장 흔한 원인입니다.[12] 또 한때 요오드 섭취량이 적었던 부위에서 림프구 침윤률이 증가했지만 요오드 보충으로 증가했습니다.[7]
나이
"갑상선 항체 양성 반응의 유병률은 나이가 들수록 증가하며, 70세 이상 여성에서 33%까지 높은 빈도를 보이는 것으로 나타났습니다.[7] 발병률은 생애 5년차에 최고조에 달하고 유병률은 나이가 들수록 증가합니다.[12][23]
다른 자가면역질환과의 관계
그레이브스병은 자가면역 갑상샘염이 발생하기 전이나 후에 발생할 수 있습니다.[24] 환자는 또한 다른 장기의 자가면역 상태가 공존할 수 있습니다. 여기에는 애디슨병, 제1형 당뇨병, 쇼그렌 증후군, 셀리악병, 류마티스 관절염이 포함될 수 있습니다.[18][16] 자가면역 갑상샘염은 1형과 2형 자가면역 다내분비 증후군 환자에게서도 관찰되었습니다.[24]
위험요소
강한 유전적 성분은 38-55%의 일치율로 단형 접합 쌍둥이에 대한 연구에서 입증되며, 순환하는 갑상선 항체의 일치율은 임상적 표현과 관련이 없습니다(단형 접합 쌍둥이의 경우 최대 80%). 두 결과 모두 높은 유전적 공기학에 강한 호의를 제공하는 dizygotic twin에서 비슷한 정도로 관찰되지 않았습니다.[25]
갑상선 기능에 영향을 미치는 약물
특정 약물이나 약물은 갑상선 기능을 변경하고 방해하는 것과 관련이 있습니다. 이 약물들 중에서 이들이 가질 수 있는 간섭의 메커니즘은 크게 두 가지입니다.[citation needed]
간섭의 메커니즘 중 하나는 약물이 갑상선 호르몬 혈청 전달 단백질을 변화시키는 것입니다.[26] 갑상선 결합 글로불린(TBG) 농도는 에스트로겐, 타목시펜, 헤로인, 메타돈, 클로피브레이트, 5-플루오로라실, 미토탄, 퍼페나진 등에 의해 증가합니다.[26] 안드로겐, 다나졸, 글루코코르티코이드, 느린 방출 니코틴산과 같은 단백 동화 스테로이드는 모두 TBG 농도를 감소시킵니다. 푸로세미드, 페노플레낙, 메페남산, 살리실레이트, 페니토인, 디아제팜, 설포닐우레아, 유리 지방산 및 헤파린은 모두 갑상선 호르몬이 TBG 및/또는 트랜스티레틴에 결합하는 것을 방해합니다.[citation needed]
갑상선 기능을 방해하기 위해 약물이 활용할 수 있는 또 다른 메커니즘은 갑상선 호르몬의 갑상선 외 대사를 변경하는 것입니다. 프로필티오우라실, 글루코코르티코이드, 프로프라놀롤, 이온화 조영제, 아미오다론 및 클로미프라민은 모두 T4 및 T3의 전환을 억제합니다.[26] 페노바르비탈, 리팜핀, 페니토인, 카르바마제핀 모두 간 대사를 증가시킵니다.[26] 마지막으로 콜레스트리아민, 콜레스티폴, 수산화알루미늄, 황산제1철, 수크랄페이트 등은 T4 흡수를 감소시키거나 배설을 강화시키는 약제입니다.[26]
HLA유전자
자가면역 갑상선 질환과 관련된 첫 번째 유전자 유전자좌는 염색체 6p21의 주요 조직적합성 복합체(MHC) 영역이었습니다. HLA를 인코딩합니다. 특정 HLA 대립유전자는 자가항원성 갑상선 펩타이드와 더 높은 친화력을 가지며 자가면역 갑상선 질환 발병에 기여할 수 있습니다. 특히 하시모토병에서는 갑상선세포에 대한 HLA II의 비정상적인 발현이 입증되었습니다. 그들은 갑상선 자가 항원을 제시하고 자가 면역 갑상선 질환을 시작할 수 있습니다.[27] 하시모토병은 감수성 대립유전자가 일치하지 않습니다. 백인에서는 DR3, DR5, DQ7 등 다양한 대립유전자가 이 질병과 관련이 있는 것으로 보고되고 있습니다.[28][29]
CTLA-4 유전자
이 유전자는 자가면역 갑상선 질환과 관련된 두 번째 주요 면역 조절 유전자입니다. CTLA-4 유전자 다형성은 T세포 증식 억제를 감소시키고 자가면역 반응에 대한 민감도를 증가시키는 데 기여할 수 있습니다.[30] CTLA-4는 주요 갑상선 자가항체 감수성 유전자입니다. 갑상선 자가항체의 존재에 대한 CTLA-4 영역의 연결은 전체 유전체 연결 분석에 의해 입증되었습니다.[31] CTLA-4가 갑상선 자가항체의 주요 유전자좌로 확인되었습니다.[32]
단백질 티로신 포스파타제 비수용체형 22 유전자
PTPN22는 자가면역 갑상선 질환과 관련된 가장 최근에 확인된 면역 조절 유전자입니다. 1p13번 염색체에 위치하며 림프구로 발현됩니다. T 세포 활성화의 음성 조절 역할을 합니다. 이 유전자의 돌연변이는 많은 자가면역질환의 위험인자입니다. T 세포 신호 전달이 약하면 자가 반응성 T 세포의 흉선 결손이 손상될 수 있으며 PTPN22 기능이 증가하면 자가면역으로부터 보호하는 조절 T 세포가 억제될 수 있습니다.[33]
IFN- γ은 갑상선 돌연변이에 대한 세포 매개 세포독성을 촉진하여 IFN- γ의 생산을 증가시키는 것은 갑상선 기능 저하증의 심각성과 관련이 있습니다. 심각한 갑상선 기능 저하증은 IL-4(Th2 cytokine 억제 세포 매개 자가면역)의 낮은 생산,[35] TGF-β(cytokine 생산 억제제)의 낮은 분비,[36] 그리고 Tregs 개발에 필수적인 조절 인자인 FoxP3의 돌연변이를 초래하는 돌연변이와 관련이 있습니다.[37] 하시모토 병의 발병은 TNF-α(IFN- γ 생성의 자극제) 유전자의 돌연변이와 관련이 있어 고농도를 유발했습니다.
높은 요오드 섭취, 셀레늄 결핍, 전염병 및 특정 약물을 포함한 예방 가능한 환경 요인은 유전적으로 취약한 개인의 자가 면역 갑상선 질환 발병과 관련이 있습니다.[39]
요오드
요오드 과다섭취는 갑상선 자가면역 유발을 위한 환경적 요인으로 잘 정립되어 있습니다. 갑상선 자가항체의 유병률은 요오드 공급이 많은 지역에서 더 높습니다. 요오드가 갑상선 자가면역을 촉진할 수 있는 몇 가지 기전이 제안되었습니다. 요오드 노출은 티로글로불린의 요오드화를 증가시켜 새로운 요오드 함유 항원결정부를 생성하거나 비밀 항원결정부를 노출시킴으로써 면역원성을 증가시킵니다. APC에 의한 제시를 용이하게 하고, T 세포 수용체의 결합 친화력을 향상시키며, 특정 T 세포를 활성화시킬 수 있습니다.[40]
요오드 노출은 활성 산소 종의 수치를 증가시키는 것으로 나타났습니다. 그들은 갑상선 여포 세포에서 세포 내 접착 분자-1의 발현을 향상시켜 면역 능력이 있는 세포를 갑상선으로 유인할 수 있습니다.[41]
요오드는 활성이 높은 산소종이 막 지질 및 단백질과 결합할 수 있기 때문에 갑상선 세포에 독성이 있습니다. 갑상선 세포 손상 및 자가 항원 방출을 유발합니다. 요오드는 또한 난포세포의 세포자멸사를 촉진하고 면역세포에 영향을 미칩니다(수지상세포의 증가된 성숙, T세포의 수 증가, B세포 면역글로불린 생성 촉진).[42][43]
덴마크 요오드 섭취 및 갑상선 질환 조사의 데이터에 따르면 요오드 결핍이 중간 및 경미한 두 집단(남성, 여성) 내에서 갑상선 과산화효소와 티로글로불린 항체의 수치가 모두 여성에서 더 높으며 두 항체의 유병률은 나이가 들수록 증가합니다.[44]
섹스.
건강한 덴마크 쌍둥이를 세 그룹(단일 접합체와 이접합체 동성, 이성 쌍둥이 쌍)으로 나눈 연구 결과 갑상선 과산화효소 항체 민감도에 대한 유전적 기여는 남성 61%, 여성 72%였으며 티로글로불린 항체 민감도에 대한 기여는 남성 39%, 여성 75%로 추정되었습니다.[45]
갑상선 자가면역의 높은 여성 우세는 X 염색체와 관련이 있을 수 있습니다. 면역 관용을 담당하는 성 및 면역 관련 유전자가 포함되어 있습니다.[46] 갑상선 자가면역의 발병률은 말초 백혈구에서 X-염색체 단핵종의 비율이 더 높은 환자에서 보고되었습니다.[47]
또 다른 잠재적 메커니즘은 왜곡된 X-염색체 비활성화일 수 있으며, 이는 흉선에서 X-연결된 자가 항원의 발현을 탈출시키고 T-세포 내성을 상실하게 합니다.[citation needed]
다른 자가면역질환을 가지고 있는 것은 하시모토 갑상샘염 발생의 위험인자이며, 그 반대의 경우도 마찬가지입니다.[1] 하시모토 갑상샘염과 가장 흔하게 연관되는 자가면역질환으로는 셀리악병, 제1형 당뇨병, 백반증, 탈모증 등이 있습니다.[48]
관련된 유전자는 인종에 따라 다르며 일반적으로 티로글로불린 및 티로퍼옥시다제에 대한 자가항체와 관련된 터너, 다운 및 클라인펠터 증후군을 포함하여 염색체 장애가 있는 사람에서 발병률이 증가합니다. 세포독성 면역 반응으로 이러한 세포가 점진적으로 고갈되면 낮은 T3/T4 수준과 TSH의 보상적 상승을 나타내는 일차 갑상선 기능 저하증이 더 높아집니다.[citation needed]
병태생리학
자가면역 갑상샘염의 발생 기전은 잘 알려져 있지 않지만, 유전적 요인과 환경적 요인이 복합적으로 작용하여 발생하는 것으로 생각됩니다.[22] 갑상선 자가항체는 대부분 표적 장기에 림프구가 있는 상태로 나타납니다.[7][49] 림프구는 세 가지 다른 갑상선 단백질을 표적으로 하는 항체를 생성합니다. 갑상선 과산화효소 항체(TPOAb), 티로글로불린 항체(TgAb), 갑상선 자극 호르몬 수용체 항체(TRAb).[7][50] 항체 공격은 궁극적으로 난포 세포를 실질 조직으로 대체하여 발생하는 갑상선 기능 저하증으로 이어집니다.[51]
자가면역 갑상샘염에서 가장 일반적으로 관련된 두 가지 항체는 갑상선 과산화효소(TPOAb)와 티로글로불린(TgAb)에 대한 항체입니다.[22] 이들은 T-림프구가 갑상선 손상의 원인이 아니라 잔류 갑상선 과산화효소와 티로글로불린에 감작되는 갑상선 손상의 결과로 발생하는 것으로 추정됩니다.[22] 그러나, 그들은 보체계를 결합하고 갑상선 세포의 세포자멸사를 유발함으로써 갑상선 파괴를 더욱 악화시킬 수 있습니다.[22] 환자가 이러한 유형의 면역 조절 장애에 걸리기 쉬운 환경적 요인에는 독소, 약물, 식이 요인 및 감염원이 포함됩니다.[24]
건강하거나 무증상인 일부 환자는 이러한 항체 중 하나 이상에 대해 양성 반응을 보일 수 있습니다. 이러한 환자를 돌보는 의사들은 시간이 지남에 따라 어떤 종류의 기능 장애가 발생할 가능성이 있기 때문에 이러한 환자를 관찰할 가능성이 높습니다.[50]
갑상선 내의 전반적인 형태학적 변화는 일반적인 종대에서 볼 수 있으며, 이는 (갑상선 기능 항진증과 같은) 더 많은 확산 패턴보다 훨씬 더 국소적으로 결절성이고 불규칙합니다. 캡슐은 손상되지 않았고 샘 자체는 여전히 주변 조직과 구별되지만 현미경 검사를 통해 손상 정도를 더 명확하게 알 수 있습니다.[52]
병리학
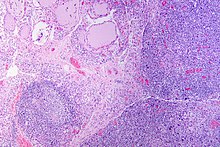
자가면역 갑상샘염이 있는 갑상샘의 육안적 병리는 대칭적으로 확대된 갑상샘을 보일 수 있습니다.[22] 일반적인 갑상선 조직인 적갈색에 비해 색이 창백한 경우가 많습니다.[22] 현미경 검사에서 림프구와 형질 세포의 침윤이 관찰됩니다. 림프구는 주로 CD4 양성 세포와 CD8 양성 세포를 모두 나타내는 T-림프구입니다.[22] 혈장 세포는 다클론성이며, 현재 생식 중심은 림프절의 구조와 유사합니다.[22] 섬유 조직은 영향을 받은 갑상선 전체에서도 발견될 수 있습니다.[22] 일반적으로 갑상선의 병리학적 소견은 기존 갑상선 기능의 양과 관련이 있습니다 - 침윤 및 섬유화가 많을수록 환자가 정상 갑상선 기능을 가질 가능성이 줄어듭니다.[22] 질병의 말기에는 갑상선이 위축될 수 있습니다.[12]
조직학적으로 과민성은 림프구, 특히 혈장 B 세포에 의한 미만성 실질 침윤으로 보이며, 이는 종종 이차 림프 여포(배아 중심부, 갑상선을 구성하는 정상적으로 존재하는 콜로이드가 채워진 여포와 혼동되지 않음)로 볼 수 있습니다. 콜로이드체의 위축은 Hürthle 세포에 의해 정렬되어 있는데, Hürthle 세포는 강력한 호산구성 과립상 세포질을 가지고 있으며, 갑상선 여포의 안감을 구성하는 정상적인 직육면체 세포의 대사생성물입니다. 심각한 갑상선 위축은 종종 갑상선 캡슐의 범위 내에 남아 있는 콜라겐의 섬유질 밴드가 더 조밀하게 나타납니다.[52]
또한 백혈구, 주로 T-림프구에 의한 갑상선 조직의 침윤이 특징입니다. 드물지만 심각한 합병증은 갑상선 림프종, 일반적으로 B세포형, 비호지킨 림프종입니다.[53]
진단.

진단은 대개 혈청 내 항갑상선 과산화효소 항체 수치가 상승한 것을 검출하여 이뤄지지만, 혈청 음성(순환하는 자가항체가 없는) 갑상선염도 가능합니다.[54] 초음파는 하시모토 갑상선염 환자의 초음파에서 검출된 주요 특징인 "에코제닉, 이질성, 과혈관성, 작은 낭종의 존재"로 인해 특히 혈청 음성 갑상선염 환자에서 하시모토 갑상선염을 검출하는 데 유용할 수 있습니다.[55]
제시되는 증상에 따라 다양한 검사를 선택할 수 있습니다. 자가면역 갑상샘염 환자의 경우, 많은 환자들이 어떤 증상을 나타내기 전에 순환 항체를 가지고 있을 수 있다고 알려져 있지만, 환자들은 의사에게 갑상선 기능 저하증의 증상에 대한 평가를 위해 제시할 수 있습니다.[12] 의사는 종종 보고된 증상을 평가하고 목 검사를 포함한 철저한 신체 검사를 수행하는 것으로 시작합니다.[12]
하시모토 갑상샘염은 초기 갑상샘기능저하증의 비교적 비특이적인 증상을 감안할 때 우울증, 사이클로티미아, 월경전증후군, 만성피로증후군, 섬유근육통 등으로 오진되는 경우가 많고, 발기부전이나 불안장애 등으로 오진되는 경우가 많습니다. 육안 검사에서, 접촉에 고통스럽지 않은 단단한 갑상샘이 종종 나타납니다.[52] 특히 임상적으로 관련된 갑상샘 기능 저하증의 일반적인 점진적인 발달을 고려할 때, 갑상선 기능 저하증에서 볼 수 있는 다른 증상들은 반응의 현재 진행 상태에 따라 달라집니다. 갑상선 자극 호르몬(TSH), 유리 T3, 유리 T4, 항티로글로불린 항체(anti-Tg), 항갑상선 과산화효소 항체(anti-TPO 또는 TPOAb) 및 항마이크로솜 항체를 검사하면 정확한 진단을 받을 수 있습니다.[56] 환자에 대한 초기 평가는 일시적인 갑상선 중독증으로 인해 높은 티로글로불린 수치를 나타낼 수 있습니다. 갑상선 내 염증이 티로글로불린의 갑상선 난포 저장의 완전성을 손상시키는 원인이 됨에 따라; 감소된 혈청 갑상선 호르몬에 대한 부차적인 부정적인 피드백 억제의 감소에 반응하여 뇌하수체 전엽으로부터의 TSH 분비가 증가함. 일반적으로 갑상선 기능 저하증의 경우 T4가 선호되는 갑상선 호르몬 검사입니다.[57] 이전에 분리된 갑상선 효소의 상당한 양에 대한 신체의 이러한 노출은 내성 붕괴의 악화에 기여하여 질병의 후반부에 볼 수 있는 더 뚜렷한 증상을 유발하는 것으로 생각됩니다. 갑상선 관련 조직의 림프구 침윤은 종종 갑상선 내의 생식 중심 발달의 조직학적으로 중요한 발견으로 이어집니다.[citation needed]
하시모토가 마니아로 내세우는 것은 이를 처음 기술한 정신과 의사 아쇼크 프라사드의 이름을 따서 프라사드 증후군으로 알려져 있습니다.[58]
실험실 값
초기 진단 평가는 혈장 갑상선 자극 호르몬(TSH) 농도로 시작됩니다.[16] 상승된 경우 갑상선 기능 저하증을 의미합니다.[16] 고도는 일반적으로 정상 범위에 걸쳐 현저한 증가이며 일반적으로 20 mg/dl 이상입니다.[18] 유리 T4 수치는 보통 낮아지지만 때로는 정상일 수 있습니다.[59]
의사는 티로글로불린 검사를 시행할 때마다 티로글로불린 항체(TgAb)를 확인해 항체가 간섭하는지 확인할 수 있습니다. TgAb도 갑상선암 진단을 받은 후 일정 간격으로 주문할 수 있으며, TPOAb와 마찬가지로 하시모토 갑상선염과 연관이 있을 수 있습니다.[50] 자가면역 갑상샘염 환자에서 실험실 값의 가장 흔한 보완물은 높은 TSH, 낮은 T4 및 양성 TPO 항체입니다.[59]
초음파

검사실 수치는 정상이지만 자가면역 갑상샘염 증상이 있을 때 초음파가 진단에 역할을 합니다.[16] 초음파로 얻은 영상은 갑상선의 크기를 평가하고 추가적으로 자가면역 갑상샘염 진단을 지원하거나 결절의 존재를 밝히거나 다른 갑상샘 상태 진단의 단서를 제공할 수 있습니다.[16]
치료
호르몬 수치 관리

하시모토 갑상샘염에 의한 갑상샘기능저하증은 레보티록신, 트라이아이오도티로닌 등의 갑상샘호르몬 대체제나 건조갑상샘추출물로 치료합니다. 하루에 한 번 복용하는 정제는 일반적으로 갑상선 호르몬 수치를 정상으로 유지합니다. 대부분의 경우 평생 치료를 받아야 합니다. 갑상선 기능 저하증이 하시모토 갑상샘염에 의한 것이라면 TSH 수치는 3.0 mIU/l 이하로 유지하는 것이 좋습니다.[60]
내인성 T4와 같은 구조의 경구제인 레보티록신 요법이 치료의 기준입니다.[22] 레보티록신은 체중, 가장 일반적으로 TSH 상승에 따라 투여할 수 있습니다.[22] 일반적으로 처방된 용량은 1.6 mcg/kg에서 1.8 mcg/kg까지 다양하지만 각 환자에 따라 조정할 수 있습니다.[12] 예를 들어 고령 환자나 특정 심장 질환 환자의 경우 용량을 낮출 수 있지만 임신한 환자의 경우 용량을 늘려야 합니다.[12] 일정한 일정에 따라 투여해야 합니다.[22] 일부 환자는 합성 T3인 레보티록신과 리오티로닌을 병용요법을 선택하지만 병용요법에 대한 연구는 제한적입니다.[22]
갑상선 대체 요법의 부작용은 의인성 갑상선 기능 항진증과 관련이 있습니다.[22] 주의해야 할 증상에는 불안, 떨림, 체중 감소, 열 민감성, 설사, 호흡 곤란 등이 포함되지만 이에 국한되지는 않습니다. 더 걱정스러운 증상으로는 심방세동과 골밀도 저하가 있습니다.[22]
모니터링
TSH는 레보티로이신으로 치료에 대한 반응을 모니터링하기 위해 선택한 실험실 값입니다.[59] 치료가 처음 시작되면 TSH 수치를 6-8주 간격으로 자주 모니터링할 수 있습니다.[59] 용량을 조정할 때마다 정확한 용량이 결정될 때까지 해당 주파수에서 TSH 수치를 측정할 수 있습니다.[59] 적정 용량으로 적정되면 TSH 수치가 매년 모니터링됩니다.[59]
수술시 고려사항
수술은 자가면역을 선택하는 초기 치료법이 아니며 갑상선 절제술의 적응증도 아닙니다.[22] 환자는 일반적으로 심각한 압박 증상, 미용 문제 또는 초음파에 결절이 있는 경우 의사와 수술에 대한 논의를 시작할 수 있습니다.[22]
예후
명백한 증상성 갑상선 기능 장애는 가장 흔한 합병증으로, 매년 약 5%의 무증상 갑상선 기능 저하증과 만성 자가면역 갑상선염 환자가 갑상선 기능 부전으로 진행됩니다. 갑상선 중독증(갑상선의 과잉 활동)의 일시적인 기간이 간혹 발생하며, 드물게는 활성 안와병(볼록하고 염증이 있는 눈)을 동반한 완전 갑상선 기능 항진증(hyperothy graves) 질환으로 진행될 수 있습니다. 섬유성 자가면역 갑상샘염은 드물게 공격적인 갑상샘 종양과 유사하게 심한 호흡곤란과 삼키기 어려운 증상이 나타나지만 수술이나 코르티코스테로이드 치료로 그러한 증상이 항상 호전됩니다. 원발성 갑상선 B세포 림프종은 1000명 중 1명 미만에서 영향을 미치지만 하시모토 갑상샘염 환자에서 원발성 갑상선 림프종이 발생할 위험이 67~80배 증가하기 [61]때문에 장기간 자가면역 갑상샘염 환자에게 영향을 미칠 가능성이 더 높습니다.[62]
역학
하시모토 갑상샘염 질환은 북미에서 원발성 갑상샘기능저하증의 가장 흔한 원인으로 생각됩니다.[52] 역학의 개인, 장소 및 시간 기술 동향 내에서 하시모토 갑상샘염이 다양한 인구에서 어떻게 발병하고 영향을 미치는지 더 명확해집니다.
개인특성동향
전반적으로 하시모토 갑상샘염은 일반인의 2%까지 영향을 미칩니다.[25] 백인의 약 5%가 일생의 어느 시점에 하시모토를 발전시킬 것입니다.[4] 미국에서는 아프리카계 미국인이 덜 흔하게 경험하지만 관련 사망률이 더 높습니다.[63] 또한 아시아 인구에서는 덜 빈번합니다.[64] 약 1000명 중 1.0~1.5명이 언제든지 이 병에 걸립니다.[52] 남성보다 여성에서 8배에서 15배 정도 더 자주 발생합니다. 어떤 연구는 성차에 대한 설명으로 태반의 역할과 연관성을 제시합니다.[65] 어린이를 포함한 모든 연령에서 발생할 수 있지만 30세에서 60세 사이의 여성에서 가장 많이 관찰됩니다.[61] 한 연구에서 가장 높은 유병률은 지역 사회의 노인 구성원에서 발견되었습니다.[66]
이미 자가면역질환을 가지고 있는 사람들은 일반적으로 그 질병들이 서로 공존하기 때문에 하시모토 병에 걸릴 위험이 더 큽니다.[25] 하시모토 병과 공존하는 일반적인 질병으로는 셀리악병, 다발성 경화증, 제1형 당뇨병, 백반증, 류마티스 관절염 등이 있습니다.[citation needed]
선천성 갑상선기능저하증은 신생아 3500~4000명 중 1명꼴로 발생하며 조기에 걸리면 치료가 가능한 지적장애의 일종이지만 어린 나이에 증상이 미미해 진단이 어려울 수 있습니다.[66] 선천성 갑상샘기능저하증은 일반적으로 갑상샘의 결함으로 발생하지만 유럽, 아시아, 아프리카 등 대부분의 경우 요오드 섭취가 신생아의 갑상샘기능저하증을 유발할 수 있습니다.
식생활 트렌드의 지리적 영향
요오드 섭취량이 적거나 많은 음식은 갑상선 관련 질환의 발병 위험을 결정합니다.[67] 요오드 섭취량이 많은 지역과 유전적으로 민감한 사람들 사이에서 더 흔합니다.[61] 지리학은 지역이 요오드가 낮거나 높은 식단에 접근할 수 있는 큰 역할을 합니다. 위험에 처한 사람들이 갑상선 기능 저하증에 걸리지 않도록 보호하기 위해 물과 소금의 요오드 수치를 철저히 모니터링해야 합니다.[68]
갑상선 기능 저하증의 지리적 경향은 장소에 따라 질병을 정의하고 사례를 보고하는 방법이 다르기 때문에 전 세계적으로 다양합니다. 분산되거나 잘 정의되지 않은 모집단은 예상치 못한 방식으로 데이터를 왜곡할 수 있습니다.[25]
요오드 결핍증(IDD)은 사람의 식단에서 요오드의 증가를 사용하여 치료합니다. 식단에 극적인 변화가 생기면 갑상선 기능 저하증과 다른 갑상선 질환에 걸릴 위험이 높아집니다. 염분 섭취가 많은 IDD와 싸우는 것은 하시모토의 위험이 높아질 수 있으므로 신중하고 신중하게 해야 합니다.[67] 식단을 변경하는 경우 권장 사항이 개인마다 다를 수 있으므로 임상의의 재량을 사용하여 식단 변경이 최선의 선택인지 확인하는 것이 중요합니다.[citation needed]
세속적 경향
갑상선 기능 저하증의 세속적인 추세는 기술과 치료 옵션의 변화를 고려할 때 질병이 시간이 지남에 따라 어떻게 변했는지를 보여줍니다. 초음파 기술과 치료 방법이 개선됐음에도 미국과 유럽에 초점을 맞춘 데이터에 따르면 갑상선 기능 저하증 발생률이 증가했습니다. 1993년에서 2001년 사이에 여성 1000명당 이 질병은 3.9에서 4.89 사이로 다양한 것으로 나타났습니다. 1994년에서 2001년 사이에, 남자 1000명당, 그 질병은 0.65에서 1.01로 증가했습니다.[66]
갑상선 기능 저하증의 정의와 치료 옵션의 변화는 전체적으로 질병의 발병률과 유병률을 수정합니다. 레보티록신을 사용한 치료는 개별화되므로 시간이 지남에 따라 질병을 더 잘 관리할 수 있지만 질병의 치료제로 작동하지는 않습니다.[25]
역사
하시모토 병으로도 알려진 하시모토 갑상샘염은 규슈 대학 의과대학의 일본인 의사 하시모토 하카루(1881~1934)의 이름을 따서 명명되었는데,[69] 그는 갑상선 내 림프구의 극심한 침윤인 흉선 림프종 환자의 증상을 처음 기술했습니다. 1912년에 Archiv für Klinische Chirurgie 라는 독일 잡지에.[3][70] 이 논문은 갑상선 조직의 조직학적 변화를 설명하는 30페이지와 5개의 삽화로 구성되었습니다. 게다가, 그의 첫 번째 연구의 모든 결과는 4명의 여성들로부터 수집되었습니다. 이러한 결과는 이러한 여성들에게서 관찰되는 병리학적 특징들을 설명해 주었는데, 특히 림프구와 형질세포의 침윤뿐만 아니라 내강 내에 생식 중심, 섬유화, 퇴행성 갑상선 상피세포 및 백혈구를 가진 림프 여포의 형성을 설명해 주었습니다.[3] 그는 이러한 특성이 조직학적으로 미쿨릭병과 유사하다고 설명했습니다. 위에서 언급한 바와 같이, 그는 이 새로운 질병에서 이러한 특성을 발견한 후 그 질병을 흉선 림프종이라고 이름 지었습니다. 이 질병은 이전에 보고된 적이 없는 림프 세포 침윤과 배아 중심을 가진 림프 여포의 형성을 강조했습니다.[3]
박사님에도 불구하고. 하시모토의 발견과 출판, 이 질병은 당시 유럽에서 흔한 질병이었던 레이델의 갑상샘염과 구별되는 것으로 인식되지 않았습니다. 다른 연구자들에 의해 다른 많은 논문들이 보고되고 발표되었지만, 하시모토의 흉선 림프종은 1900년대 초 레이델 갑상샘염의 초기 단계로만 인식되었습니다. 1931년에 클리블랜드의 연구자 앨런 그레이엄(Allen Graham) 등이 하카루(Hakaru)와 같은 세부적인 방식으로 병의 증상과 발표를 보고하면서 이 병이 그 자체로 질병으로 인식되기 시작했습니다.[3]
1956년에, Drs. Rose와 Witebsky는 다른 설치류의 갑상선 추출물로 특정 설치류의 면역이 Hakaru와 다른 연구자들이 설명하려고 노력했던 질병과 어떻게 유사한지를 입증할 수 있었습니다.[3] 이 의사들은 또한 같은 동물의 혈액 혈청 샘플에서 항티로글로불린 항체를 기술할 수 있었습니다.[citation needed]
같은 해 말, 런던의 미들섹스 병원의 연구원들은 비슷한 증상을 보이는 환자들을 대상으로 인체 실험을 수행할 수 있었습니다. 그들은 그들의 혈청에서 항티로글로불린 항체를 정제했고 이 아픈 환자들이 인간의 티로글로불린에 면역학적 반응을 보였다는 결론을 내릴 수 있었습니다.[3] 이 자료로부터 하시모토의 흉선이 갑상선의 자가면역질환일 수 있음이 제시되었습니다.
1957년 자가면역질환으로 인정받아 최초로 확인된 장기 특이 자가면역질환이었습니다.[14]
이러한 인식에 따라 미들섹스 병원의 같은 연구자들은 1962년 란셋에 하시모토 하카루의 초상화를 포함하는 기사를 발표했습니다.[3] 그 순간부터 병이 더 많이 알려졌고, 하시모토 병은 교과서에 더 자주 등장하기 시작했습니다.[citation needed]
그 발견 이후, 많은 자가면역 질환들이 발견되었고, 그 중 몇몇은 갑상선 특이적 항체와 관련이 있습니다.[citation needed]
임신
하시모토 갑상샘염 양성인 임산부는 갑상샘 기능이 저하되거나 샘이 완전히 소실될 수 있습니다.[71] 만약 여성이 TPOAb 양성 반응을 보인다면, 만약 질병이 치료되지 않는다면, 임상의들은 그녀 자신과 그녀의 유아에 대한 위험을 알릴 수 있습니다. "임신부의 10%에서 갑상선 과산화효소 항체(TPOAb)가 검출되어 임신에 위험을 초래합니다.[71] 갑상선 기능이 안정화되지 않은 여성의 경우 저체중, 신생아 호흡곤란, 수두증, 저체온증, 유산, 조기분만 등의 영아를 낳을 위험이 더 큽니다.[71][72] 하시모토를 치료하면 배아 이식률과 성공적인 임신 결과가 향상됩니다.[72] 임산부가 임신 기간 내내 TPOAb 양성인 경우에만 치료하고 모든 임산부의 갑상선 수치를 검사하는 것이 좋습니다.[71] 내분비과 의사와 산부인과 의사의 긴밀한 협력은 여성과 유아에게 도움이 됩니다.[71][73][74] 내분비학회에서는 갑상선 자가면역질환 고위험군으로 꼽히는 임산부에서 검진을 권고하고 있습니다.[75]
임신 결과와 관계없이 임신한 적이 있는 여성에게는 갑상선 과산화물 항체 검사를 권장합니다. "[P]이전 임신은 폐경 전 여성의 자가면역 명백한 갑상선 기능 저하증 발병에 큰 역할을 하며, 젊은 여성의 갑상선 기능 저하증 위험을 평가할 때 이전 임신의 수를 고려해야 합니다."[76]
주요 면역 조절 분자의 호르몬 변화와 영양막 발현은 면역 억제와 태아 내성으로 이어집니다. 면역 반응을 조절하는 주요 역할은 Tregs입니다. 세포매개성 면역반응과 체액성 면역반응이 모두 약해져 면역관용성과 자가면역 억제가 발생합니다. 임신 중에는 갑상선 과산화효소와 티로글로불린 항체 수치가 감소하는 것으로 보고되었습니다. 출산 후 트레그가 급격히 감소하고 면역 반응이 다시 형성됩니다. 자가면역 갑상샘질환의 발생 또는 악화를 초래할 수 있습니다.[77] 임신 초기 갑상선 과산화효소 항체를 가진 여성의 최대 50%에서 산후기 갑상선 자가면역은 산후 갑상샘염의 형태로 악화됩니다.[78] IFN- γ과 IL-4의 분비가 높고 임신 중 혈장 코르티솔 농도가 낮은 것은 건강한 여성보다 산후 갑상샘염이 있는 여성에서 보고되었습니다. 임신 중 면역 억제력이 약해지면 산후 갑상선 기능 장애의 원인이 될 수 있음을 나타냅니다.[79]
태아 마이크로 키메라증
분만 후 몇 년이 지나면 키메라 남성 세포는 모체 말초혈액, 갑상선, 폐, 피부 또는 림프절에서 검출될 수 있습니다. 모체 갑상선의 태아 면역세포가 활성화되어 자가면역 갑상선 질환을 시작하거나 과장할 수 있는 계기로 작용할 수 있습니다. 하시모토병 환자에서 태아 미세 키메라 세포가 건강한 여성보다 갑상선에서 현저히 많은 수로 검출됐습니다.[80]
기타생물
하시모토병은 닭(Gallus domesticus),[81][82] 쥐(Rattus rattus),[82] 쥐(Mus musculus),[82] 개(Canis familyis),[82] 마모셋(Callitrichidae)에서도 알려져 있습니다.[82]
참고 항목
참고문헌
- ^ a b c d e f g h i j k l m n o p q "Hashimoto's Disease". NIDDK. May 2014. Archived from the original on 22 August 2016. Retrieved 9 August 2016.
- ^ a b Noureldine SI, Tufano RP (January 2015). "Association of Hashimoto's thyroiditis and thyroid cancer". Current Opinion in Oncology. 27 (1): 21–25. doi:10.1097/cco.0000000000000150. PMID 25390557. S2CID 32109200.
- ^ a b c d e f g h i Hiromatsu Y, Satoh H, Amino N (January 2013). "Hashimoto's thyroiditis: history and future outlook". Hormones. 12 (1): 12–18. doi:10.1007/BF03401282. PMID 23624127. S2CID 38996783.
- ^ a b c d e Pyzik A, Grywalska E, Matyjaszek-Matuszek B, Roliński J (2015). "Immune disorders in Hashimoto's thyroiditis: what do we know so far?". Journal of Immunology Research. 2015: 979167. doi:10.1155/2015/979167. PMC 4426893. PMID 26000316.
- ^ a b c d e Akamizu T, Amino N, Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dungan K, Grossman A, Hershman JM, Hofland J, Kaltsas G, Koch C, Kopp P, Korbonits M, McLachlan R, Morley JE, New M, Purnell J, Singer F, Stratakis CA, Trence DL, Wilson DP (2000). "Hashimoto's Thyroiditis". In Akamizu T, Amino N (eds.). Endotext. MDText. PMID 25905412.
- ^ "Hashimoto's disease". Office on Women's Health, U.S. Department of Health and Human Services. 12 June 2017. Archived from the original on 28 July 2017. Retrieved 17 July 2017.
 이 문서는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다.
이 문서는 공용 도메인에 있는 이 소스의 텍스트를 통합합니다. - ^ a b c d e f Dayan, Dayan, Colin M; Dayan, Colin M.; Gilbert H. Daniels (1996). "Chronic Autoimmune Thyroiditis". The New England Journal of Medicine. 335 (2): 99–107. doi:10.1056/nejm199607113350206. PMID 8649497.
{{cite journal}}: CS1 maint: 다중 이름: 저자 목록 (링크) - ^ "Autoimmune thyroiditis". Autoimmune Registry Inc. Retrieved 15 June 2022.
- ^ "Hashimoto's Disease NIDDK". National Institute of Diabetes and Digestive and Kidney Diseases. Retrieved 28 November 2021.
- ^ "Hashimoto Thyroiditis – Endocrine and Metabolic Disorders". Merck Manuals Professional Edition. July 2016. Retrieved 30 December 2017.
- ^ "Hashimoto Thyroiditis – Hormonal and Metabolic Disorders". Merck Manuals Consumer Version. Retrieved 30 December 2017.
- ^ a b c d e f g h i j k l Mincer, Dana L.; Jialal, Ishwarlal (2022), "Hashimoto Thyroiditis", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 29083758, retrieved 23 January 2023
- ^ Shoenfeld Y, Cervera R, Gershwin ME, eds. (2010). Diagnostic Criteria in Autoimmune Diseases. Springer Science & Business Media. p. 216. ISBN 978-1-60327-285-8.
- ^ a b Moore EA, Wilkinson S (2009). The Promise of Low Dose Naltrexone Therapy: Potential Benefits in Cancer, Autoimmune, Neurological and Infectious Disorders. McFarland. p. 30. ISBN 978-0-7864-5258-3.
- ^ "Hashimoto's disease – Symptoms and causes". Mayo Clinic. Retrieved 5 October 2018.
- ^ a b c d e f g h "Hashimoto's Disease NIDDK". National Institute of Diabetes and Digestive and Kidney Diseases. Retrieved 23 January 2023.
- ^ "Hashimoto's disease fact sheet". Office on Women's Health, U.S. Department of Health and Human Services, womenshealth.gov (or girlshealth.gov). 16 July 2012. Archived from the original on 2 December 2014. Retrieved 23 November 2014.
- ^ a b c d e f Singh, Sudhir; Clutter, William E. (2020). The Washington Manual®, The Endocrinology - Subspecialty Consult (4th ed.). Philadelphia, PA: Lippincott Williams & Wilkins. pp. 70–76. ISBN 978-1-9751-1333-9.
- ^ 56페이지 인:
- ^ "Pathogenesis of Hashimoto's thyroiditis (chronic autoimmune thyroiditis)". UpToDate.
- ^ Mincer, D. L.; Jialal, I. (2019). "Hashimoto Thyroiditis". NCBI StatPearls. PMID 29083758.
- ^ a b c d e f g h i j k l m n o p q r s t Ramos-Levi, Ana M.; Marazuela, Monica (2023). DeGroot's Endocrinology, Basic Science and Clinical Practice (8th ed.). Philadelphia, PA: Elsevier. pp. 1214–1233. ISBN 978-0- 323694124.
- ^ a b c Biddinger, Paul W. (2020). Diagnostic Pathology and Molecular Genetics of the Thyroid: A Comprehensive Guide for Practicing Thyroid Pathology (3rd ed.). Philadelphia, PA: Lippincott Williams & Wilkins. pp. 59–72. ISBN 978-1-4963-9653-2.
- ^ a b c d Weetman, Anthony P. (2021). Werner & Ingbar's The Thyroid: A Fundamental and Clinical Text (11th ed.). Philadelphia, PA: Lippincott Williams & Wilkins. pp. 531–541. ISBN 978-1-975112-96-7.
- ^ a b c d e Chistiakov DA (March 2005). "Immunogenetics of Hashimoto's thyroiditis". Journal of Autoimmune Diseases. 2 (1): 1. doi:10.1186/1740-2557-2-1. PMC 555850. PMID 15762980.
- ^ a b c d e Surks MI, Sievert R (December 1995). Wood AJ (ed.). "Drugs and thyroid function". The New England Journal of Medicine. 333 (25): 1688–1694. doi:10.1056/NEJM199512213332507. PMID 7477223.
- ^ Jacobson EM, Huber A, Tomer Y (2008). "The HLA gene complex in thyroid autoimmunity: from epidemiology to etiology". Journal of Autoimmunity. 30 (1–2): 58–62. doi:10.1016/j.jaut.2007.11.010. PMC 2244911. PMID 18178059.
- ^ Tandon N, Zhang L, Weetman AP (May 1991). "HLA associations with Hashimoto's thyroiditis". Clinical Endocrinology. 34 (5): 383–386. doi:10.1111/j.1365-2265.1991.tb00309.x. PMID 1676351. S2CID 28987581.
- ^ Bogner U, Badenhoop K, Peters H, Schmieg D, Mayr WR, Usadel KH, Schleusener H (January 1992). "HLA-DR/DQ gene variation in nongoitrous autoimmune thyroiditis at the serological and molecular level". Autoimmunity. 14 (2): 155–158. doi:10.3109/08916939209083135. PMID 1363895.
- ^ Zaletel K, Gaberšček S (December 2011). "Hashimoto's Thyroiditis: From Genes to the Disease". Current Genomics. 12 (8): 576–588. doi:10.2174/138920211798120763. PMC 3271310. PMID 22654557.
- ^ Tomer Y, Greenberg DA, Barbesino G, Concepcion E, Davies TF (April 2001). "CTLA-4 and not CD28 is a susceptibility gene for thyroid autoantibody production". The Journal of Clinical Endocrinology and Metabolism. 86 (4): 1687–1693. doi:10.1210/jcem.86.4.7372. PMID 11297604.
- ^ Ban Y, Davies TF, Greenberg DA, Kissin A, Marder B, Murphy B, et al. (December 2003). "Analysis of the CTLA-4, CD28, and inducible costimulator (ICOS) genes in autoimmune thyroid disease". Genes and Immunity. 4 (8): 586–593. doi:10.1038/sj.gene.6364018. PMID 14647199. S2CID 6920190.
- ^ Burn GL, Svensson L, Sanchez-Blanco C, Saini M, Cope AP (December 2011). "Why is PTPN22 a good candidate susceptibility gene for autoimmune disease?". FEBS Letters. 585 (23): 3689–3698. doi:10.1016/j.febslet.2011.04.032. PMID 21515266. S2CID 21572847.
- ^ Ito C, Watanabe M, Okuda N, Watanabe C, Iwatani Y (August 2006). "Association between the severity of Hashimoto's disease and the functional +874A/T polymorphism in the interferon-gamma gene". Endocrine Journal. 53 (4): 473–478. doi:10.1507/endocrj.k06-015. PMID 16820703.
- ^ Nanba T, Watanabe M, Akamizu T, Iwatani Y (March 2008). "The -590CC genotype in the IL4 gene as a strong predictive factor for the development of hypothyroidism in Hashimoto disease". Clinical Chemistry. 54 (3): 621–623. doi:10.1373/clinchem.2007.099739. PMID 18310157.
- ^ Yamada H, Watanabe M, Nanba T, Akamizu T, Iwatani Y (March 2008). "The +869T/C polymorphism in the transforming growth factor-beta1 gene is associated with the severity and intractability of autoimmune thyroid disease". Clinical and Experimental Immunology. 151 (3): 379–382. doi:10.1111/j.1365-2249.2007.03575.x. PMC 2276968. PMID 18190611.
- ^ Inoue N, Watanabe M, Morita M, Tomizawa R, Akamizu T, Tatsumi K, et al. (December 2010). "Association of functional polymorphisms related to the transcriptional level of FOXP3 with prognosis of autoimmune thyroid diseases". Clinical and Experimental Immunology. 162 (3): 402–406. doi:10.1111/j.1365-2249.2010.04229.x. PMC 3026543. PMID 20942809.
- ^ Inoue N, Watanabe M, Nanba T, Wada M, Akamizu T, Iwatani Y (May 2009). "Involvement of functional polymorphisms in the TNFA gene in the pathogenesis of autoimmune thyroid diseases and production of anti-thyrotropin receptor antibody". Clinical and Experimental Immunology. 156 (2): 199–204. doi:10.1111/j.1365-2249.2009.03884.x. PMC 2759465. PMID 19250279.
- ^ Saranac L, Zivanovic S, Bjelakovic B, Stamenkovic H, Novak M, Kamenov B (2011). "Why is the thyroid so prone to autoimmune disease?". Hormone Research in Paediatrics. 75 (3): 157–165. doi:10.1159/000324442. PMID 21346360.
- ^ Rose NR, Bonita R, Burek CL (February 2002). "Iodine: an environmental trigger of thyroiditis". Autoimmunity Reviews. 1 (1–2): 97–103. CiteSeerX 10.1.1.326.5700. doi:10.1016/s1568-9972(01)00016-7. PMID 12849065.
- ^ Burek CL, Talor MV (November 2009). "Environmental triggers of autoimmune thyroiditis". Journal of Autoimmunity. 33 (3–4): 183–189. doi:10.1016/j.jaut.2009.09.001. PMC 2790188. PMID 19818584.
- ^ Fountoulakis S, Philippou G, Tsatsoulis A (January 2007). "The role of iodine in the evolution of thyroid disease in Greece: from endemic goiter to thyroid autoimmunity". Hormones. 6 (1): 25–35. PMID 17324915.
- ^ Yu X, Li L, Li Q, Zang X, Liu Z (November 2011). "TRAIL and DR5 promote thyroid follicular cell apoptosis in iodine excess-induced experimental autoimmune thyroiditis in NOD mice". Biological Trace Element Research. 143 (2): 1064–1076. doi:10.1007/s12011-010-8941-5. PMID 21225479. S2CID 10926594.
- ^ Pedersen IB, Knudsen N, Jørgensen T, Perrild H, Ovesen L, Laurberg P (January 2003). "Thyroid peroxidase and thyroglobulin autoantibodies in a large survey of populations with mild and moderate iodine deficiency". Clinical Endocrinology. 58 (1): 36–42. doi:10.1046/j.1365-2265.2003.01633.x. PMID 12519410. S2CID 23758580.
- ^ Hansen PS, Brix TH, Iachine I, Kyvik KO, Hegedüs L (January 2006). "The relative importance of genetic and environmental effects for the early stages of thyroid autoimmunity: a study of healthy Danish twins". European Journal of Endocrinology. 154 (1): 29–38. doi:10.1530/eje.1.02060. PMID 16381988. S2CID 25372591.
- ^ McCombe PA, Greer JM, Mackay IR (December 2009). "Sexual dimorphism in autoimmune disease". Current Molecular Medicine. 9 (9): 1058–1079. doi:10.2174/156652409789839116. PMID 19747114.
- ^ Invernizzi P, Miozzo M, Selmi C, Persani L, Battezzati PM, Zuin M, et al. (July 2005). "X chromosome monosomy: a common mechanism for autoimmune diseases". Journal of Immunology. 175 (1): 575–578. doi:10.4049/jimmunol.175.1.575. PMID 15972694. S2CID 40557667.
- ^ Radetti G (2014). "Clinical Aspects of Hashimoto's Thyroiditis". Paediatric Thyroidology. Endocrine Development. Vol. 26. pp. 158–170. doi:10.1159/000363162. ISBN 978-3-318-02720-4. PMID 25231451.
- ^ Weetman, A. P.; A. M. McGregor; H. Lazarus; R. Hall (April 1982). "Thyroid Antibodies are Produced by Thyroid- Derived Lymphocytes". Clin Exp Immunol. 48 (1): 196–200. PMC 1536583. PMID 7044629.
- ^ a b c "Thyroid Antibodies". Retrieved 4 April 2012.
- ^ Berghi, N. (2017). "Immunological Mechanisms Implicated in the Pathogenesis of Chronic Urticaria and Hashimoto Thyroiditis". Iranian Journal of Allergy, Asthma and Immunology. 16 (4): 358–366. PMID 28865416. Retrieved 3 December 2020.
- ^ a b c d e Maitra A (2014). "The Endocrine System". In Kumar V, Abbas AK, Aster JC (eds.). Robbins and Cotran Pathologic Basis of Disease. Elsevier Health Sciences. pp. 1073–1140. ISBN 978-0-323-29635-9.
- ^ Dayan CM, Daniels GH (July 1996). "Chronic autoimmune thyroiditis". The New England Journal of Medicine. 335 (2): 99–107. doi:10.1056/NEJM199607113350206. PMID 8649497.
- ^ Grani G, Carbotta G, Nesca A, D'Alessandri M, Vitale M, Del Sordo M, Fumarola A (June 2015). "A comprehensive score to diagnose Hashimoto's thyroiditis: a proposal". Endocrine. 49 (2): 361–365. doi:10.1007/s12020-014-0441-5. PMID 25280964. S2CID 23026213.
- ^ Klubo-Gwiezdzinska, Joanna; Wartofsky, Leonard (30 March 2022). "Hashimoto thyroiditis: an evidence-based guide to etiology, diagnosis and treatment". Polish archives of internal medicine. 132 (3): 16222. doi:10.20452/pamw.16222. ISSN 0032-3772. PMC 9478900. PMID 35243857.
- ^ Giannini AJ (1986). The Biological Foundations of Clinical Psychiatry. New Hyde Park, NY: Medical Examination Publishing Company. pp. 193–198. ISBN 978-0-87488-449-4.
- ^ 하시모토 갑상샘염~e메디신 운동
- ^ Weiner MJ, Kennedy C (March 1988). "Prasad's syndrome". The British Journal of Psychiatry. 152 (3): 438–439. doi:10.1192/bjp.152.3.438b. PMID 3167392.
- ^ a b c d e f "Hashimoto's Thyroiditis". American Thyroid Association. Retrieved 23 January 2023.
- ^ "Does Your Doctor Know About the New TSH Lab Standards?". Archived from the original on 4 December 2010.
- ^ a b c Monaco F (2012). Thyroid Diseases. Taylor and Francis. p. 78. ISBN 978-1-4398-6839-3.
- ^ Noureldine SI, Tufano RP (January 2015). "Association of Hashimoto's thyroiditis and thyroid cancer". Current Opinion in Oncology. 27 (1): 21–25. doi:10.1097/CCO.0000000000000150. PMID 25390557. S2CID 32109200.
- ^ Boyles S (23 May 2013). "Hypothyroidism Hikes Death Risk in Blacks". MedPage Today.
- ^ McLeod DS, Caturegli P, Cooper DS, Matos PG, Hutfless S (April 2014). "Variation in rates of autoimmune thyroid disease by race/ethnicity in US military personnel". JAMA. 311 (15): 1563–1565. doi:10.1001/jama.2013.285606. PMID 24737370.
- 요약 정리 위치:
- ^ Natri H, Garcia AR, Buetow KH, Trumble BC, Wilson MA (July 2019). "The Pregnancy Pickle: Evolved Immune Compensation Due to Pregnancy Underlies Sex Differences in Human Diseases". Trends in Genetics. 35 (7): 478–488. doi:10.1016/j.tig.2019.04.008. PMC 6611699. PMID 31200807.
- ^ a b c Vanderpump MP (1 September 2011). "The epidemiology of thyroid disease". British Medical Bulletin. 99 (1): 39–51. doi:10.1093/bmb/ldr030. PMID 21893493.
- ^ a b Khattak RM, Ittermann T, Nauck M, Below H, Völzke H (2016). "Monitoring the prevalence of thyroid disorders in the adult population of Northeast Germany". Population Health Metrics. 14: 39. doi:10.1186/s12963-016-0111-3. PMC 5101821. PMID 27833458.
- ^ Katagiri R, Yuan X, Kobayashi S, Sasaki S (10 March 2017). "Effect of excess iodine intake on thyroid diseases in different populations: A systematic review and meta-analyses including observational studies". PLOS ONE. 12 (3): e0173722. Bibcode:2017PLoSO..1273722K. doi:10.1371/journal.pone.0173722. PMC 5345857. PMID 28282437.
- ^ 하시모토 하카루의 이름은?
- ^ Hashimoto H (1912). "Zur Kenntnis der lymphomatösen Veränderung der Schilddrüse (Struma lymphomatosa)" [Knowledge of lymphomatous changes in the thyroid gland (goiter lymphomatosa)]. Archiv für Klinische Chirurgie (in German). 97: 219–248. NAID 10005555208.
- ^ a b c d e Lepoutre T, Debiève F, Gruson D, Daumerie C (1 January 2012). "Reduction of miscarriages through universal screening and treatment of thyroid autoimmune diseases". Gynecologic and Obstetric Investigation. 74 (4): 265–273. doi:10.1159/000343759. PMID 23147711. S2CID 1646888.
- ^ a b Gaberšček S, Zaletel K (September 2011). "Thyroid physiology and autoimmunity in pregnancy and after delivery". Expert Review of Clinical Immunology. 7 (5): 697–706, quiz 707. doi:10.1586/eci.11.42. PMID 21895480.
- ^ Budenhofer BK, Ditsch N, Jeschke U, Gärtner R, Toth B (January 2013). "Thyroid (dys-)function in normal and disturbed pregnancy". Archives of Gynecology and Obstetrics. 287 (1): 1–7. doi:10.1007/s00404-012-2592-z. PMID 23104052. S2CID 24969196.
- ^ Balucan FS, Morshed SA, Davies TF (2013). "Thyroid autoantibodies in pregnancy: their role, regulation and clinical relevance". Journal of Thyroid Research. 2013: 182472. doi:10.1155/2013/182472. PMC 3652173. PMID 23691429.
- ^ "Endocrine Experts Support Screening for Thyroid Dysfunction in Pregnant Women". Endocrine Society. 26 March 2015. Archived from the original on 8 October 2015. Retrieved 4 October 2015.
- ^ Carlé A, Pedersen IB, Knudsen N, Perrild H, Ovesen L, Rasmussen LB, Laurberg P (June 2014). "Development of autoimmune overt hypothyroidism is highly associated with live births and induced abortions but only in premenopausal women". The Journal of Clinical Endocrinology and Metabolism. 99 (6): 2241–2249. doi:10.1210/jc.2013-4474. PMID 24694338.
- ^ Weetman AP (June 2010). "Immunity, thyroid function and pregnancy: molecular mechanisms". Nature Reviews. Endocrinology. 6 (6): 311–318. doi:10.1038/nrendo.2010.46. PMID 20421883. S2CID 9900120.
- ^ Lazarus JH (March 2011). "The continuing saga of postpartum thyroiditis". The Journal of Clinical Endocrinology and Metabolism. 96 (3): 614–616. doi:10.1210/jc.2011-0091. PMID 21378224.
- ^ Kokandi AA, Parkes AB, Premawardhana LD, John R, Lazarus JH (March 2003). "Association of postpartum thyroid dysfunction with antepartum hormonal and immunological changes". The Journal of Clinical Endocrinology and Metabolism. 88 (3): 1126–1132. doi:10.1210/jc.2002-021219. PMID 12629095.
- ^ Koopmans M, Kremer Hovinga IC, Baelde HJ, Harvey MS, de Heer E, Bruijn JA, Bajema IM (June 2008). "Chimerism occurs in thyroid, lung, skin and lymph nodes of women with sons". Journal of Reproductive Immunology. 78 (1): 68–75. doi:10.1016/j.jri.2008.01.002. PMID 18329105.
- ^ Wick, Georg; Möst, Johannes; Schauenstein, Konrad; Krömer, G.; Dietrich, Hermann; Ziemiecki, Andrew; Fässler, Reinhard; Schwarz, Siegfried; Eu, Nithin; Hálaa, Karel (1985). "Spontaneous autoimmune thyroiditis - a bird's eye view". Immunology Today. Elsevier Science Publishers B.V. 12 (6): 359–64. doi:10.1016/0167-5699(85)90095-7. PMID 25291225. S2CID 8191727.
- ^ a b c d e McLachlan, Sandra; Alpi, Kristine; Rapoport, Basil (2011). "Review and Hypothesis: Does Graves' Disease Develop in Non-Human Great Apes?". Immunology, Autoimmunity, and Graves' Ophthalmopathy. Thyroid. Mary Ann Liebert, Inc. (American Thyroid Association (ATA)). 21 (12): 1359–1366. doi:10.1089/thy.2011.0209. PMC 3229821. PMID 22066476.


