CYP17A1
CYP17A1| 스테로이드17-α-히드록실화효소/17,20분해효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| EC 번호 | 1.14.14.19 | ||||||||
| CAS 번호 | 9029-67-8 | ||||||||
| Alt. 이름 | P450c17, CYP17A1, 스테로이드17-α-히드록실화효소/17,20분해효소, CYPXVII, 시토크롬P45016IA1, 시토크롬P450-C17, 시토크롬P450, 17, 패밀리, 스테로이드 서브패드1라아제), 스테로이드 17α-히드록실화효소/17,20 리아제, IPR033282 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| |||||||||
| CYP17A1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 에일리어스 | CYP17A1, CPT7, CYP17, P450C17, S17AH, 시토크롬 P450 패밀리 17 서브패밀리 A멤버 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 외부 ID | OMIM : 609300 MGI : 88586 HomoloGene : 73875 GenCard : CYP17A1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| EC 번호 | 1.14.14.32 1.14.14.19, 1.14.14.32 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
시토크롬 P450 17A1(스테로이드 17α-모노옥시게나아제, 17α-히드록실화효소, 17-알파-히드록실화효소, 17,20-리아제, 17,20-데스몰라아제)은 인간에서 10번 염색체의 CYP17A1 [5]유전자에 의해 암호화되는 히드록실화효소이다.그것은 생식선 [6][7]조직뿐만 아니라 부신 피질의 망상동맥과 파시큘라타 조나를 포함한 많은 조직과 세포 유형에서 널리 발현된다.17α-히드록실화효소 및 17,20-리아제 활성을 모두 가지며, 프로게스틴, 미네랄코르티코이드, 글루코코르티코이드, 안드로겐 및 에스트로겐을 생성하는 스테로이드 생성 경로의 핵심 효소이다.보다 구체적으로 이 효소는 스테로이드 D 고리의 탄소 17 위치(C17)에 수산기(-OH)를 첨가하기 위해 프레그네놀론과 프로게스테론에 작용하거나(17α-히드록실라아제 활성, EC 1.14.19) 17α-히드록시프로게스테론 및 17α-히드록시프레그놀론에 작용한다(스테론).2[7])
구조.
진
CYP17A1 유전자는 10번 염색체 10q24.3에 있으며 8개의 [5]엑손이 포함되어 있다.이 유전자의 cDNA는 1527 [8]bp의 길이에 걸쳐 있다.이 유전자는 시토크롬 P450 슈퍼패밀리의 효소를 암호화한다.시토크롬 P450 단백질은 일반적으로 약물 대사 및 콜레스테롤, 스테로이드 및 기타 지질 합성에 관련된 많은 반응을 촉매하는 모노옥시게나아제로 간주된다.
CYP17A1 유전자는 또한 관상동맥 [9][non-primary source needed]질환의 위험 증가와 관련된 변이를 포함할 수 있다.
단백질
CYP17A1은 시토크롬 P450 [10][11]계열에 속하는 57.4 kDa 단백질이다.cDNA에 의해 코드된 단백질은 508개의 아미노산 잔기로 구성되어 있다.효소로서 CYP17A1은 생합성 [8]반응을 촉매하는 헴 보철기와 관련된 활성 부위를 가지고 있다.두 개의 스테로이드 억제제인 아비라테론과 갈레테론에 결합되어 있는 동안 알려진 구조에 기초하여, CYP17A1은 스테로이드 생성 또는 콜레스테롤 대사에 관여하는 다른 복잡한 P450 효소에 존재하는 표준 시토크롬 P450 접힘을 소유하지만, 스테로이드 리간드는 헴그루와 수직인 F 및 G 헬리크로 향한다.β1 [12][13]시트가 아닌 p.
표현
CYP17A1의 발현은 태반을 제외한 모든 전통적인 스테로이드 발생조직에서 발견되었으며, 여기에는 부신피질의 Zona reticularis 및 zona fasiculata, 고환의 Leydig 세포, 난소의 늑골 세포, 그리고 최근에는 난포의 [14]황체화 과립상세포가 포함된다.CYP17A1은 기존의 스테로이드 생성 조직 외에도 심장, 신장 및 지방 [14]조직에서도 검출되었습니다.태아의 경우 신장, 흉선, [14]비장에서 CYP17A1이 보고되었습니다.
기능.
CYP17A1은 소포체에 국재화된 효소의 시토크롬 P450 슈퍼패밀리의 구성원이다.이 계열의 단백질은 콜레스테롤, 스테로이드 및 기타 지질 합성을 촉매하고 약물 대사에 관여하는 모노옥시게나아제이다.[5]CYP17A1은 17α-히드록실화효소 활성(EC 1.14.19)과 17,20-리아제 활성(EC 1.14.14.32)을 모두 가진다.CYP17A1의 17α-히드록실라아제 활성은 코르티솔과 같은 글루코코르티코이드 생성에 필요하지만, CYP17A1의 17α-히드록실라아제 활성은 17α-히드록실라아제 및 17,20-히드록실라아제 성 스테로이드 생성에 모두 17α-히드록실라아제 활성(디옥실라아제)가 필요하다.이 유전자의 돌연변이는 분리된 스테로이드-17α-히드록실라아제 결핍증, 17α-히드록실라아제/17,20-리아제 결핍증,[5] 의사 헤르마프로디즘 및 부신 과형성과 관련이 있다.
또한 시토크롬 P450 산화환원효소(POR) 시토크롬 b5(CYB5) 및 [16][17][18]인산화효소에 의존하여 이루어지는 17,20-리아제 활성.시토크롬 b5는 CYP17A1의 17,20 리아제 활성의 촉진제 역할을 하며 일부 P450에 제2의 전자를 제공할 수 있다.인간에서 17-OHPreg 및 DHEA에 대한 프레그네놀론을 통한 CYP17A1에 의한 테스토스테론의 생성은 [19]POR를 필요로 한다.인간 CYP17A1 단백질은 cAMP의존성 단백질인산화효소에 의해 세린 및 트레오닌 잔기에 인산화된다.단백질의 인산화효소는 17,20-라아제 활성을 증가시키는 반면, 탈인산화효소는 사실상 이 [18]활성을 제거한다.
임상적 의의
이 유전자의 돌연변이는 선천성 부신 과형성의 희귀한 형태, 특히 17α-히드록실라아제 결핍/17,20-리아제 결핍 및 분리된 17,20-리아제 결핍과 관련이 있다.[20]
인간의 경우 CYP17A1 유전자는 내분비 효과와 스테로이드 호르몬 [21][22][23]대사와 크게 관련되어 있다.또한 CYP17A1 유전자의 돌연변이는 희귀한 형태의 선천성 부신과형성증, 특히 17α-히드록실화효소 결핍/17,20-리아제 결핍 및 격리된 17,20-리아제 결핍과 관련이 있다.전반적으로, CYP17A1은 종양 세포 [24][25]성장에 필요한 안드로겐을 생성하기 때문에 전립선암 치료에 있어 중요한 억제 대상이다.CYP17A1의 효소 활성 감소는 저고나도성 저고나디즘에 의한 불임과 관련이 있다.암컷은 모낭형성을 억제하고 수컷은 간질세포 증식을 수반하는 고환위축과 정자형성을 억제한다.일반적으로 무배란성이지만, 주기적인 [26]월경으로 자발적인 월경수술을 받은 17α-히드록실라아제 결핍 여성에 대한 몇 가지 사례 보고가 있다.
임상 마커
CYP17A1 유전자를 포함한 27개 위치의 조합에 기초한 다중 위치 유전자 위험 점수 연구는 스타틴 치료의 향상된 임상 유익성뿐만 아니라 사고 및 재발 관상 동맥 질환 사건에 대한 위험이 증가한 개인을 식별했다.연구는 커뮤니티 코호트 연구(말모 다이어트 및 암 연구)와 1차 예방 코호트(JUPITER 및 ASCOT)와 2차 예방 코호트(CARE 및 PROFLE IT-TIMI 22)[9]의 4가지 추가 무작위 대조 시험을 기반으로 했다.
약물 표적으로서
CYP17A1억제제
현재 [when?]FDA는 내인성 CYP17A1 기질과 유사한 스테로이드 골격을 포함하는 CYP17A1 억제제인 아비라테론 하나만 승인했다.아비라테론은 구조적으로 스테로이드 형성에 관여하는 다른 시토크롬 P450 효소의 기질과 유사하며, 간섭은 부작용 측면에서 위험을 초래할 수 있다.비스테로이드 발판을 사용하면 CYP17A1과 [25]보다 선택적으로 상호작용하는 화합물의 설계가 가능해질 것으로 기대된다.CYP17A1 효소의 잠재적 억제제는 진행성 전립선암의 [27]이소성 안드로제네시스에 대한 마지막 방어 수단을 제공합니다.
거세 저항성 전립선암 치료에 사용되는 아세트산 아비라테론은 CYP17A1 효소를 억제해 안드로겐의 생합성을 차단한다.아세트산아비라테론은 효소의[28] 활성 부위에 결합하고 피리딘 질소를 통해 헴철을 배위시켜 [29]기질을 모방한다.
2014년부터 갈레톤은 거세 저항성 전립선암에 [30]대한 임상시험 3단계에 들어갔다.
케토코나졸은 현재 거의 사용되지 않는 오래된 CYP17A1 억제제이다.그러나 케토코나졸은 CYP17A1을 경쟁적으로 억제하므로 케토코나졸 농도에 따라 효과가 달라진다.이는 애비라테론 아세테이트가 (경쟁적으로가 아니라) CYP17A1에 결합하면 영구적으로 비활성화되는 것과는 대조적입니다.
세비테로넬(VT-464)은 새로운 CYP17A1 억제제로서 글루코콜로이드 [31]요법의 동시 투여를 방지하는 것을 목적으로 한다.2010년대에는 전립선암이나 유방암에 [32][33]대한 약물로서 다양한 임상 연구와 전임상 모델을 거쳤다.
스테로이드 생성
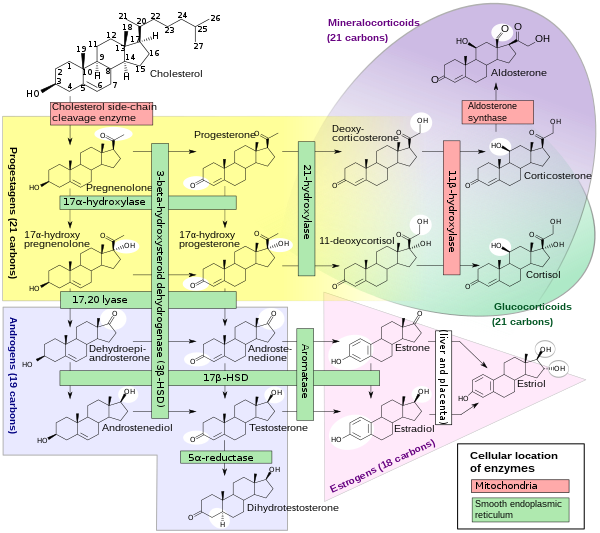 스테로이드 생성, 왼쪽에서 17α-히드록실화효소의 두 가지 반응과 17, 20 리아제의 두 가지 작용을 보여줍니다. |
기타 이미지
「 」를 참조해 주세요.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000148795 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG00000003555 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d "CYP17A1 cytochrome P450 family 17 subfamily A member 1 [Homo sapiens (human)] - Gene - NCBI". www.ncbi.nlm.nih.gov. Retrieved 2016-09-27.
- ^ "BioGPS - your Gene Portal System". biogps.org. Retrieved 2016-10-11.
- ^ a b Boulpaep EL; Boron, WF (2005). Medical physiology: a cellular and molecular approach. St. Louis, Mo: Elsevier Saunders. p. 1180. ISBN 1-4160-2328-3.
- ^ a b Vasaitis TS, Bruno RD, Njar VC (May 2011). "CYP17 inhibitors for prostate cancer therapy". The Journal of Steroid Biochemistry and Molecular Biology. 125 (1–2): 23–31. doi:10.1016/j.jsbmb.2010.11.005. PMC 3047603. PMID 21092758.
- ^ a b Mega JL, Stitziel NO, Smith JG, Chasman DI, Caulfield MJ, Devlin JJ, Nordio F, Hyde CL, Cannon CP, Sacks FM, Poulter NR, Sever PS, Ridker PM, Braunwald E, Melander O, Kathiresan S, Sabatine MS (June 2015). "Genetic risk, coronary heart disease events, and the clinical benefit of statin therapy: an analysis of primary and secondary prevention trials". Lancet. 385 (9984): 2264–71. doi:10.1016/S0140-6736(14)61730-X. PMC 4608367. PMID 25748612.
- ^ "CYP17A1 - Steroid 17-alpha-hydroxylase/17,20 lyase - Homo sapiens (Human) - CYP17A1 gene & protein". www.uniprot.org. Retrieved 2016-10-11.
- ^ Estrada DF, Laurence JS, Scott EE (February 2016). "Cytochrome P450 17A1 Interactions with the FMN Domain of Its Reductase as Characterized by NMR". The Journal of Biological Chemistry. 291 (8): 3990–4003. doi:10.1074/jbc.M115.677294. PMC 4759177. PMID 26719338.
- ^ DeVore NM, Scott EE (February 2012). "Structures of cytochrome P450 17A1 with prostate cancer drugs abiraterone and TOK-001". Nature. 482 (7383): 116–9. Bibcode:2012Natur.482..116D. doi:10.1038/nature10743. PMC 3271139. PMID 22266943.
- ^ Petrunak EM, DeVore NM, Porubsky PR, Scott EE (November 2014). "Structures of human steroidogenic cytochrome P450 17A1 with substrates". The Journal of Biological Chemistry. 289 (47): 32952–64. doi:10.1074/jbc.M114.610998. PMC 4239641. PMID 25301938.
- ^ a b c Storbeck KH, Swart P, Africander D, Conradie R, Louw R, Swart AC (2011). "16α-hydroxyprogesterone: origin, biosynthesis and receptor interaction". Mol. Cell. Endocrinol. 336 (1–2): 92–101. doi:10.1016/j.mce.2010.11.016. PMID 21095220. S2CID 5503049.
- ^ DeVore NM, Scott EE (February 2012). "Structures of cytochrome P450 17A1 with prostate cancer drugs abiraterone and TOK-001". Nature. 482 (7383): 116–9. Bibcode:2012Natur.482..116D. doi:10.1038/nature10743. PMC 3271139. PMID 22266943.
- ^ Udhane SS, Dick B, Hu Q, Hartmann RW, Pandey AV (September 2016). "Specificity of anti-prostate cancer CYP17A1 inhibitors on androgen biosynthesis". Biochemical and Biophysical Research Communications. 477 (4): 1005–10. doi:10.1016/j.bbrc.2016.07.019. PMID 27395338.
- ^ Pandey AV, Miller WL (April 2005). "Regulation of 17,20 lyase activity by cytochrome b5 and by serine phosphorylation of P450c17". The Journal of Biological Chemistry. 280 (14): 13265–71. doi:10.1074/jbc.M414673200. PMID 15687493.
- ^ a b Zhang LH, Rodriguez H, Ohno S, Miller WL (November 1995). "Serine phosphorylation of human P450c17 increases 17,20-lyase activity: implications for adrenarche and the polycystic ovary syndrome". Proceedings of the National Academy of Sciences of the United States of America. 92 (23): 10619–23. Bibcode:1995PNAS...9210619Z. doi:10.1073/pnas.92.23.10619. PMC 40663. PMID 7479852.
- ^ Fukami M, Homma K, Hasegawa T, Ogata T (April 2013). "Backdoor pathway for dihydrotestosterone biosynthesis: implications for normal and abnormal human sex development". Developmental Dynamics. 242 (4): 320–9. doi:10.1002/dvdy.23892. PMID 23073980. S2CID 44702659.
- ^ "Entrez Gene: CYP17A1 cytochrome P450, family 17, subfamily A, polypeptide 1".
- ^ Ma YN, Cao CY, Wang QW, Gui WJ, Zhu GN (October 2016). "Effects of azocyclotin on gene transcription and steroid metabolome of hypothalamic-pituitary-gonad axis, and their consequences on reproduction in zebrafish (Danio rerio)". Aquatic Toxicology. 179: 55–64. doi:10.1016/j.aquatox.2016.08.006. PMID 27571716.
- ^ Legendre A, Elie C, Ramambason C, Manens L, Souidi M, Froment P, Tack K (August 2016). "Endocrine effects of lifelong exposure to low-dose depleted uranium on testicular functions in adult rat". Toxicology. 368–369: 58–68. doi:10.1016/j.tox.2016.08.014. PMID 27544493.
- ^ Yadav R, Petrunak EM, Estrada DF, Scott EE (August 2016). "Structural insights into the function of steroidogenic cytochrome P450 17A1". Molecular and Cellular Endocrinology. 441: 68–75. doi:10.1016/j.mce.2016.08.035. PMC 5235955. PMID 27566228.
- ^ Kostin VA, Zolottsev VA, Kuzikov AV, Masamrekh RA, Shumyantseva VV, Veselovsky AV, Stulov SV, Novikov RA, Timofeev VP, Misharin AY (November 2016). "Oxazolinyl derivatives of [17(20)E]-21-norpregnene differing in the structure of A and B rings. Facile synthesis and inhibition of CYP17A1 catalytic activity". Steroids. 115: 114–122. doi:10.1016/j.steroids.2016.06.002. PMID 27505042. S2CID 205256638.
- ^ a b Bonomo S, Hansen CH, Petrunak EM, Scott EE, Styrishave B, Jørgensen FS, Olsen L (2016-01-01). "Promising Tools in Prostate Cancer Research: Selective Non-Steroidal Cytochrome P450 17A1 Inhibitors". Scientific Reports. 6: 29468. Bibcode:2016NatSR...629468B. doi:10.1038/srep29468. PMC 4942611. PMID 27406023.
- ^ Acién P, Acién M (November 2020). "Disorders of Sex Development: Classification, Review, and Impact on Fertility". Journal of Clinical Medicine. 9 (11): 3555. doi:10.3390/jcm9113555. PMC 7694247. PMID 33158283.
- ^ Bordeau BM, Ciulla DA, Callahan BP (September 2016). "Hedgehog Proteins Consume Steroidal CYP17A1 Antagonists: Potential Therapeutic Significance in Advanced Prostate Cancer". ChemMedChem. 11 (18): 1983–6. doi:10.1002/cmdc.201600238. PMC 5588864. PMID 27435344.
- ^ Fernández-Cancio, Mónica; Camats, Núria; Flück, Christa E.; Zalewski, Adam; Dick, Bernhard; Frey, Brigitte M.; Monné, Raquel; Torán, Núria; Audí, Laura (2018-04-29). "Mechanism of the Dual Activities of Human CYP17A1 and Binding to Anti-Prostate Cancer Drug Abiraterone Revealed by a Novel V366M Mutation Causing 17,20 Lyase Deficiency". Pharmaceuticals. 11 (2): 37. doi:10.3390/ph11020037. PMC 6027421. PMID 29710837.
- ^ PDB: 3ruk; DeVore NM, Scott EE (February 2012). "Structures of cytochrome P450 17A1 with prostate cancer drugs abiraterone and TOK-001". Nature. 482 (7383): 116–9. Bibcode:2012Natur.482..116D. doi:10.1038/nature10743. PMC 3271139. PMID 22266943.
- ^ "Tokai Pharmaceuticals' Reformulated Galeterone Demonstrates Robust PSA Reductions in Advanced Prostate Cancer Patients" (Press release). Tokai Pharmaceuticals. January 29, 2014.
- ^ Bird IM, Abbott DH (October 2016). "The hunt for a selective 17,20 lyase inhibitor; learning lessons from nature". The Journal of Steroid Biochemistry and Molecular Biology. 163: 136–46. doi:10.1016/j.jsbmb.2016.04.021. PMC 5046225. PMID 27154414.
VT464 is another recently developed compound proposed to act as a selective lyase inhibitor, and more complete data is available in the public domain to support this claim. A review of preliminary data released suggest the IC50 for Human CYP17 lyase activity is ten times lower than for hydroxylase 15 and in nonhuman primates VT464 was able to suppress circulating testosterone as effectively as abiraterone, but with minimally depressed cortisol (remaining at 82% control compared to only 9% with aberaterone), and without associated increases in pregnenolone, progesterone and mineralocorticoids otherwise observed with abiraterone. Like Galaterone, VT464 is also in use in clinical trials without co-administration of prednisone. Together with the clear lack of suppression of circulating cortisol in nonhuman primates, these data argue that VT464 may indeed be a selective 17,20 lyase inhibitor.
- ^ Madan RA, Schmidt KT, Karzai F, Peer CJ, Cordes LM, Chau CH, Steinberg SM, Owens H, Eisner J, Moore WR, Dahut WL, Gulley JL, Figg WD (August 2020). "Phase 2 Study of Seviteronel (INO-464) in Patients With Metastatic Castration-Resistant Prostate Cancer After Enzalutamide Treatment". Clinical Genitourinary Cancer. 18 (4): 258–267.e1. doi:10.1016/j.clgc.2019.11.002. PMC 7415516. PMID 32327394.
- ^ Peer CJ, Schmidt KT, Kindrick JD, Eisner JR, Brown VV, Baskin-Bey E, Madan R, Figg WD (October 2019). "A population pharmacokinetic analysis of the oral CYP17 lyase and androgen receptor inhibitor seviteronel in patients with advanced/metastatic castration-resistant prostate cancer or breast cancer". Cancer Chemotherapy and Pharmacology. 84 (4): 759–770. doi:10.1007/s00280-019-03908-0. PMC 8132106. PMID 31367790. S2CID 199056344.
추가 정보
- Miura K, Yasuda K, Yanase T, Yamakita N, Sasano H, Nawata H, Inoue M, Fukaya T, Shizuta Y (October 1996). "Mutation of cytochrome P-45017 alpha gene (CYP17) in a Japanese patient previously reported as having glucocorticoid-responsive hyperaldosteronism: with a review of Japanese patients with mutations of CYP17". The Journal of Clinical Endocrinology and Metabolism. 81 (10): 3797–801. doi:10.1210/jcem.81.10.8855840. PMID 8855840.
- Miller WL, Geller DH, Auchus RJ (1999). "The molecular basis of isolated 17,20 lyase deficiency". Endocrine Research. 24 (3–4): 817–25. doi:10.3109/07435809809032692. PMID 9888582.
- Strauss JF (November 2003). "Some new thoughts on the pathophysiology and genetics of polycystic ovary syndrome". Annals of the New York Academy of Sciences. 997 (1): 42–8. Bibcode:2003NYASA.997...42S. doi:10.1196/annals.1290.005. PMID 14644808. S2CID 23559461.
- Haider SM, Patel JS, Poojari CS, Neidle S (July 2010). "Molecular modeling on inhibitor complexes and active-site dynamics of cytochrome P450 C17, a target for prostate cancer therapy". Journal of Molecular Biology. 400 (5): 1078–98. doi:10.1016/j.jmb.2010.05.069. PMID 20595043.
외부 링크
- CYP17A1+단백질+인간(미국 국립의학도서관 의학 과목 표제(MeSH))
- UCSC Genome Browser의 인간 CYP17A1 게놈 위치 및 CYP17A1 유전자 세부 정보 페이지.