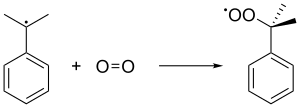커메네 공정
Cumene process쿠메네 공정(쿠메네-페놀 공정, 호크 공정)은 벤젠과 프로필렌에서 페놀과 아세톤을 합성하는 산업 공정이다. 이 용어는 공정 중 중간 물질인 쿠메네(이소프로필 벤젠)에서 유래한다. 그것은 R. 우드리스와 P에 의해 발명되었다. 1942년(USSR) 세르게예프,[1] 1944년[2][3] 하인리히 호크에 의해 독립했다.
이 과정은 상대적으로 값이 싼 두 가지 시작 재료인 벤젠과 프로필렌을 페놀과 아세톤으로 더 값비싼 두 가지 재료로 바꾼다. 필요한 다른 반응 물질은 공기의 산소와 적은 양의 급진적 개시제다. 페놀과 아세톤의 전 세계 생산의 대부분은 현재 이 방법을 기반으로 하고 있다. 2003년, 거의 700만 톤의 페놀은 커멘 공정에 의해 생산되었다.[4] 이 공정이 경제적이 되려면 페놀뿐만 아니라 아세톤 부산물에 대한 수요도 있어야 한다.[5]
프로세스 단계
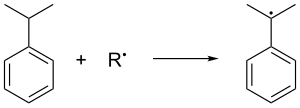
쿠메네는 프로펜에 의한 벤젠의 가스상 프리델-크래프트 알킬화에서 형성된다. 벤젠과 프로펜은 촉매 루이스산이 존재하는 250 °C에서 30 표준기압의 압력으로 함께 압축된다. 인산은 종종 알루미늄 할로겐화물보다 선호된다. 쿠메네는 공기 중에 산화되어 쿠메네에서 3차 벤질 수소를 제거하여 쿠메네 라디칼을 형성한다.
그러면 쿠메네 라디칼은 산소 분자와 결합하여 과산화 쿠메네 라디칼을 주는데, 이는 다시 다른 쿠메네 분자에서 벤질 수소를 추출하여 쿠메네 히드로과산화(CHC(CH653)2OH2)를 형성한다. 이 후자의 커멘은 커민 래디컬로 변환되어 커민 하이드로페록시드의 후속적인 체인 형태로 다시 공급된다. 불안정한 과산화수소가 액체 상태로 유지되도록 하기 위해 5 atm의 압력을 사용한다.
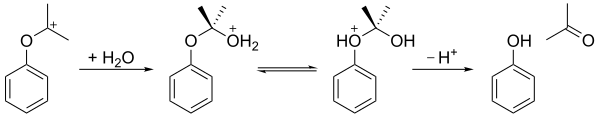
쿠메네 하이드로 과산화수소는 산성 매질(호크 재배열)에서 재배열 반응을 일으켜 페놀과 아세톤을 준다. 첫 번째 단계에서는 단자 수산화 산소 원자가 양성된다. 이에 따라 페닐 그룹이 벤질 탄소로부터 인접한 산소로 이동하며 물 분자가 손실되어 공명이 안정되는 3차 탄수소가 생성된다. 이 단계의 결합 메커니즘은 배이어-빌라이거 산화[6] 및 크리지 재배열 반응의 메커니즘과 유사하며, 또한 수력-산화 과정의 산화 단계도 유사하다.[7] 2009년에 산성화된 벤토나이트 점토는 산성 매개체로 황산보다 경제적인 촉매라는 것이 입증되었다.
그 결과 탄수화물은 물의 공격을 받아 헤미아세트 같은 구조를 형성한다. 히드록시 산소에서 에테르 산소로 양성자를 옮긴 후, 이온은 페놀과 아세톤으로 분해된다.
관련 반응 및 수정
아세톤 공동 생산에 대한 대안
사이클로헥실벤젠은 이소프로필벤젠을 대체할 수 있다. 호크 재배열을 통해 사이클로헥실벤젠 하이드로과산화칼슘을 분해하여 페놀과 사이클로헥사논을 투여한다. 사이클로헥사논은 몇몇 나일론의 중요한 전구체다.[8]
1번과 2번 부테네를 혼합한 벤젠의 알킬화를 시작으로, 쿠민 공정은 페놀과 부타논을 생성한다.[5]
페놀 생산의 대안
- 하이드로퀴논은 벤젠과 프로펜을 다이얼키플레이션으로 만들어 1,4-다이소프로필벤젠을 투여한다. 이 화합물은 공기와 반응하여 비스(수소 과산화수소)를 공급한다. 쿠메네 하이드로과산화수소의 작용과 유사하게, 아세톤과 하이드로퀴논을 주기 위해 산으로 재배열한다. 하이드로퀴논의 산화는 1,4-벤조퀴논을 만든다.[9]
- CH64(CHMe2)2 + 2.5 O2 → CHO642 + 2 OCMe2 + HO2
- 레소르시놀은 1,3-다이소프로필벤젠을 레소르시놀과 아세톤으로 조각하는 비스(수소산화물)로 바꿔 유사하게 준비한다.[10]
- 2-나프톨은 큐멘 공정에 유사한 방법으로도 생산될 수 있다.[11]
- 3-페놀의 염소화에 의해 발생하지 않는 클로로페놀은 클로로벤젠을 프로필렌으로 알킬화하여 쿠메네 공정에 의해 생산될 수 있다.[12]
- 크레졸은 이소프로필톨루엔에서 생산된다.[13]
아세톤 가공
조제 아세톤은 이소프로필 알코올을 주기 위해 라네 니켈이나 구리와 산화 크롬을 혼합한 액체 단계에서 수소를 공급한다. 이 과정은 아세톤 과잉 생산과 결합될 때 유용하다.[14] 미쓰이앤코]는 아세톤 수소화, 프로펜으로 이소프로판올 제품 탈수화 등의 추가 단계를 개발했는데, 이소프로판올 제품은 스타팅 리액션제로 재활용된다.[5]
부산물
페놀과 아세톤을 생산하는 쿠메네 공정의 부산물은 아세토페논과 알파메틸스티렌이다.
참고 항목
- 비스페놀 A
- 다우공정
- 프리델 크래프트 알킬화
- 배이어-빌라이거 산화
- 라스치그-후커 공정(페놀도 생성)
참조
- ^ "Latvian".
- ^ Hock, H. and Lang, S.(1944년), Autoxydation von Khohlenwasserstoffen, IX. 미테일.: 우베르 페록시데 폰 벤졸 데리바텐. 베리히테 데르 도이체첸 게셀샤프트(A 및 B 시리즈), 77: 257–264 도이:10.1002/cber.19470321
- ^ 간결한 백과사전 화학 (1993) 메리 이글소
- ^ 맨프레드 베버, 마르쿠스 베버, 마이클 클라이네-보이만 2004년 울만 산업 화학 백과사전 Wiley-VCH. doi:10.1002/14356007.a19_299.pub2.
- ^ a b c "Direct Routes to Phenol". Archived from the original on 2007-04-09. Retrieved 2006-12-26.
- ^ Streitwieser, A; Heathcock, C.H. (1992). "30". Introduction to Organic Chemistry. Kosower, E.M. (4th ed.). New York: MacMillan. pp. 1018. ISBN 0-02-418170-6.
- ^ K.P.C., Vollhardt; N.E. Schore (2003). "22". Organic Chemistry: Structure and Function (4th ed.). New York: Freeman. p. 988. ISBN 0-7167-4374-4.
- ^ Plotkin, Jeffrey S. (2016-03-21). "What's New in Phenol Production?". American Chemical Society. Archived from the original on 2019-10-27. Retrieved 2018-01-02.
- ^ 게르하르트 프란츠, 로저 A. 울만의 산업 화학 백과사전 Wiley-VCH, Weinheim, 2000 doi:10.1002/14356007.a18_261의 "산소화"
- ^ K. W. Schmiedel, D. Decker (2012). "Resorcinol". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a23_111.pub2.CS1 maint: 작성자 매개변수 사용(링크)
- ^ 2005년 Wiley-VCH, Weinheim의 Ulmann 산업 화학 백과사전 제럴드 부스 "나프탈렌 파생상품" doi:10.1002/14356007.a17_009.
- ^ François Muller, Liliane Caillard (2011). "Chlorophenols". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a07_001.pub2.CS1 maint: 작성자 매개변수 사용(링크)
- ^ Roger A. Sheldon (1983). Patai, Saul (ed.). Syntheses and Uses of Hydroperoxides and Dialkylperoxides. PATAI'S Chemistry of Functional Groups. John Wiley & Sons. doi:10.1002/9780470771730.ch6.
- ^ Papa, A. J. "Propanols". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_173.
외부 링크
| 위키미디어 커먼즈에는 커메네 과정과 관련된 미디어가 있다. |