에너지 레벨
Energy level| 에 관한 일련의 기사의 일부 |
| 양자역학 |
|---|
양자역학적 시스템 또는 입자가 결합(즉, 공간적으로 제한됨)된 경우 에너지 수준이라고 불리는 특정 개별 에너지 값만 취할 수 있습니다.이것은 모든 양의 에너지를 가질 수 있는 고전적인 입자와 대비된다.이 용어는 원자, 이온 또는 분자에 있는 전자의 에너지 수준에 일반적으로 사용되며, 원자핵의 전기장에 의해 결합되어 있지만, 분자의 핵의 에너지 수준이나 진동 또는 회전 에너지 수준을 나타낼 수도 있습니다.이러한 개별 에너지 수준을 가진 시스템의 에너지 스펙트럼은 양자화된다고 한다.
화학과 원자물리학에서, 전자껍질 또는 주요 에너지 수준은 원자의 핵 주위에 있는 하나 이상의 전자의 궤도로 생각될 수 있다.핵에 가장 가까운 껍질은 "1 셸"이라고 불리며, "2 셸" (또는 "L 셸"), "3 셸" (또는 "M 셸") 등의 순서로 핵에서 점점 더 멀리 떨어져 있습니다.셸은 주요 양자 번호(n = 1, 2, 3, 4 ...)에 해당하거나 X선 표기법(K, L, M, N...)에 사용된 문자로 알파벳 순으로 레이블이 지정됩니다.
각 셸은 고정된 수의 전자만 포함할 수 있습니다.첫 번째 셸은 최대 2개의 전자, 두 번째 셸은 최대 8개의 전자, 세 번째 셸은 최대 18개의 전자(2+6+10)를 유지할 수 있습니다.일반적인 공식은 n번째 껍질이 원칙적으로 2n개의2 [1]전자를 수용할 수 있다는 것입니다.전자는 전기적으로 핵에 끌리기 때문에, 원자의 전자는 일반적으로 더 많은 내부 껍질이 이미 다른 전자들에 의해 완전히 채워진 경우에만 바깥 껍데기를 차지할 것입니다.그러나 이것은 엄격한 요건이 아니다: 원자는 불완전한 외피를 두 개 또는 세 개 가질 수 있다(자세한 내용은 마델룽 규칙 참조).이러한 껍질에 전자가 존재하는 이유에 대한 설명은 전자 [2]구성을 참조하십시오.
원자핵이나 분자로부터 무한 거리에서의 위치 에너지가 0으로 설정되면, 일반적인 규칙인 결합 전자 상태는 음의 위치 에너지를 가집니다.
원자, 이온 또는 분자가 가능한 가장 낮은 에너지 수준일 경우, 원자, 이온 또는 분자와 그 전자는 바닥 상태라고 합니다.에너지 레벨이 높을 경우 들뜬 상태 또는 지면 상태보다 높은 에너지를 가진 전자가 들뜬 상태라고 합니다.에너지 레벨은 관련된 측정 가능한 양자역학 상태가 둘 이상 있는 경우 축퇴된 것으로 간주됩니다.
설명.
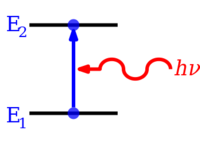
양자화된 에너지 수준은 입자의 에너지와 파장 사이의 관계를 제공하는 입자의 파동 행동에서 비롯됩니다.원자 중의 전자와 같은 제한된 입자에 대해 명확하게 정의된 에너지를 갖는 파동 함수는 [3]정재파의 형태를 가진다.명확하게 정의된 에너지를 가진 상태를 정지 상태라고 합니다.왜냐하면 이들은 시간에 따라 변하지 않는 상태이기 때문입니다.비공식적으로, 이러한 상태는 원자 주위의 원형 궤도(예를 들어 원자가 시작된 곳에서 끝나는 경로)를 따라 파장의 수가 원자 궤도 유형(s-궤도 0, p-궤도 1 등)을 이루는 파장 함수의 전체 파장에 대응합니다.에너지 레벨이 어떻게 생기는지를 수학적으로 보여주는 기본적인 예로는 상자 안의 입자와 양자 조화 진동자가 있습니다.
에너지 상태의 중첩(선형 조합)도 양자 상태이지만, 이러한 상태는 시간에 따라 변화하며 명확하게 정의된 에너지를 가지고 있지 않습니다.에너지를 측정하면 파동 기능이 붕괴되어 단일 에너지 상태로 구성된 새로운 상태가 됩니다.물체의 가능한 에너지 수준을 측정하는 것을 분광학이라고 한다.
역사
원자의 양자화에 대한 첫 번째 증거는 1800년대 초 조지프 폰 프라운호퍼와 윌리엄 하이드 울라스톤에 의해 태양에서 나오는 빛의 스펙트럼 라인을 관찰한 것이다.에너지 수준의 개념은 1913년 덴마크 물리학자 닐스 보어에 의해 원자의 보어 이론에서 제안되었다.슈뢰딩거 방정식의 관점에서 이러한 에너지 수준을 설명하는 현대의 양자역학 이론은 1926년 에르빈 슈뢰딩거와 베르너 하이젠베르크에 의해 발전되었다.
원자
고유 에너지 수준
아래 주어진 원자 내 다양한 수준의 전자 에너지 공식에서, 에너지의 영점은 해당 전자가 원자를 완전히 떠났을 때, 즉 전자의 주요 양자수 n = δ일 때 설정됩니다.전자가 n의 더 가까운 값으로 원자에 결합하면 전자의 에너지는 더 낮아지고 음으로 간주됩니다.
궤도 상태 에너지 수준: 원자/이온(핵 포함) + 전자 1개
주어진 원자 궤도에 수소 유사 원자(이온)에 하나의 전자가 있다고 가정합니다.그 상태의 에너지는 주로 (음)전자와 (양)핵의 정전적 상호작용에 의해 결정된다.원자핵 주위의 전자의 에너지 수준은 다음과 같습니다.
(일반적으로 1eV와3 10eV 사이), 여기서∞ R은 Rydberg 상수, Z는 원자 번호, n은 주요 양자 번호, h는 플랑크의 상수, c는 빛의 속도이다.수소 유사 원자(이온)의 경우에만 Rydberg 수준은 주요 양자수 n에만 의존합니다.
이 방정식은 모든 수소 유사 원소1(아래 참조)에 대한 Rydberg 공식과 E = h h = h c / assuming assuming the the = n 위의 주요 양자수2 n = ( (광자를 방출할 때 전자가 하강하는 에너지 수준의 평균 양자수)를 조합하여 구한다.Rydberg 공식은 경험적 스펙트럼 방출 데이터에서 도출되었다.
에너지 수준을 고유값으로 얻기 위해 고유함수로 파동함수를 사용하는 운동 에너지 해밀턴 연산자와 함께 시간 독립형 슈뢰딩거 방정식으로부터 양자를 기계적으로 도출할 수 있지만, 리드버그 상수는 다른 기초 물리학 상수로 대체될 것이다.
원자에서의 전자-전자 상호작용
원자 주위에 둘 이상의 전자가 있으면 전자-전자 상호작용에 의해 에너지 레벨이 높아집니다.이러한 상호작용은 전자파 함수의 공간적 중첩이 낮으면 무시되는 경우가 많다.
다중 전자 원자의 경우, 전자 사이의 상호작용은 앞의 방정식을 단순히 원자 번호인 Z와 같이 더 이상 정확하지 않게 만든다.이것을 이해하는 간단한(완전하지는 않지만) 방법은 차폐 효과로서, 내부 전자가 핵에 단단히 결합되어 부분적으로 전하를 상쇄하기 때문에 외부 전자가 전하의 효과적인 핵을 보는 것입니다.이는 Z가 주 양자수에 크게 의존하는 Z로eff 상징되는 유효 핵 전하로 치환되는 근사 보정으로 이어진다.
미세 구조 분할
미세 구조는 상대론적 운동 에너지 보정, 스핀-오빗 결합(전자의 스핀과 움직임과 핵의 전기장 사이의 전기역학적 상호작용), 다윈 항(핵 내부의 s[which?] 셸 전자의 접촉항 상호작용)에서 발생한다.이들은 10eV의 일반적인−3 규모 순서로 레벨에 영향을 미친다.
초미세 구조
이 보다 미세한 구조는 전자-핵 스핀-스핀 상호작용으로 인해 에너지 수준의 일반적인 변화가 10eV로 발생한다−4.
외부 장에 의한 에너지 수준
제만 효과
전자 궤도 각운동량 L에서 발생하는 자기 쌍극자 모멘트 μ와L 관련된 상호작용 에너지가 있습니다.
와 함께
- L 2 B {\ {\{\ μ B } {= \ _ { \ }
또한 전자 스핀에서 발생하는 자기 운동량을 고려합니다.
상대론적 효과(디락 방정식)로 인해 전자 스핀에서 발생하는 자기 운동량S μ가 있다.
- S - \ { \ symbol { - \ _ { } _ { } \ { ,
g 전자 스핀 g-인자(약 2), 총S 자기 모멘트 μ,
- L + S({
따라서 상호작용 에너지는
스타크 효과
분자
분자 형태에서 원자 사이의 화학적 결합은 관련된 원자들의 상황을 더 안정되게 만들기 때문에, 일반적으로 분자 내의 관련된 원자들의 총 에너지 수준이 원자들이 그렇게 결합되지 않았을 때보다 낮다는 것을 의미합니다.개별 원자들이 공유 결합을 위해 서로 다가갈 때, 그들의 오비탈은 결합과 반결합 분자 오비탈을 형성하기 위해 서로의 에너지 수준에 영향을 미칩니다.결합 궤도의 에너지 수준은 더 낮고, 반결합 궤도의 에너지 수준은 더 높습니다.분자 내의 결합이 안정되기 위해서는 공유결합 전자가 낮은 에너지결합 오비탈을 차지하고 있으며, 상황에 따라서는 θ 또는 θ 등의 기호로 나타낼 수 있다.대응하는 안티본딩 오비탈은 아스타리스크를 추가하여 θ* 또는 θ* 오비탈을 구함으로써 나타낼 수 있다.분자 중 비결합성 오비탈은 결합에 관여하지 않는 외각 내에 전자를 가진 오비탈이며, 그 에너지 레벨은 구성 원자와 동일하다.이러한 오비탈은 n개의 오비탈로 지정할 수 있습니다.n개 궤도의 전자는 전형적으로 단독 쌍이다.[4] 다원자 분자에서는 서로 다른 진동 및 회전 에너지 수준도 관여합니다.
대략적으로 말하면 분자 에너지 상태(즉, 분자 해밀턴의 고유 상태)는 다음과 같은 전자, 진동, 회전, 핵 및 번역 구성요소의 합이다.
여기서electronic E는 분자의 평형 기하학에서 전자 분자 해밀턴(전위 에너지 표면의 값)의 고유값이다.
분자 에너지 수준은 분자 용어 기호로 표시됩니다.이러한 구성요소의 특정 에너지는 특정 에너지 상태와 물질에 따라 달라집니다.
에너지 레벨도
분자 내 원자 사이의 결합에 대한 에너지 수준 다이어그램에는 다양한 종류가 있습니다.
에너지 레벨의 이행
원자와 분자의 전자는 (전자파 방사의) 광자를 방출하거나 흡수함으로써 에너지 수준을 변화시킬 수 있으며, 그 에너지는 두 수준 사이의 에너지 차이와 정확히 같아야 합니다.전자는 또한 원자, 분자 또는 이온과 같은 화학종에서 완전히 제거될 수 있다.원자에서 전자를 완전히 제거하는 것은 이온화의 한 형태가 될 수 있다.이 이온화는 실질적으로 전자를 무한대의 주요 양자수를 가진 궤도로 이동시켜 실질적으로 나머지 원자(이온)에 영향을 미치지 않도록 한다.다양한 종류의 원자에 대해 원래 지반상태의 원자에서 가장 높은 에너지 전자의 제1, 제2, 제3 등을 제거하기 위한 제1, 제2, 제3의 이온화 에너지가 있다.대응하는 반대 양의 에너지는 또한 전자가 양으로 대전된 이온이나 때로는 원자에 추가될 때, 때로는 광자 에너지의 형태로 방출될 수 있습니다.분자는 또한 진동 또는 회전 에너지 수준에서 변화를 겪을 수 있습니다.에너지 준위 전환은 또한 비방사성일 수 있으며, 이는 광자의 방출이나 흡수가 관여하지 않음을 의미한다.
원자, 이온 또는 분자가 가능한 가장 낮은 에너지 수준일 경우, 원자, 이온 또는 분자와 그 전자는 바닥 상태라고 합니다.에너지 레벨이 높을 경우 들뜬 상태 또는 지면 상태보다 높은 에너지를 가진 전자가 들뜬 상태라고 합니다.이러한 종은 수준 간의 에너지 차이와 동일한 에너지를 가진 광자를 흡수함으로써 더 높은 에너지 수준으로 들뜨게 할 수 있다.반대로 들뜬 종은 에너지 차이에 해당하는 광자를 자발적으로 방출함으로써 낮은 에너지 수준으로 갈 수 있다.광자의 에너지는 플랑크의 상수(h)에 주파수(f)를 곱한 것과 같기 때문에 주파수에 비례하거나 파장(θ)[4]에 반비례한다.
- δE = h f = h c / µ,
빛의 속도인 c는 f µ과[4] 같기 때문에
이에 대응하여 스펙트럼 분석을 통해 얻은 물질의 에너지 수준 및 전자 구조 정보를 포함한 분석 대상 물질에 대한 정보를 제공하기 위해 방출되거나 흡수된 광자의 주파수 또는 파장을 검출하는 데 많은 종류의 분광법이 기초하고 있다.
아스타리스크는 보통 들뜬 상태를 나타내기 위해 사용됩니다.분자의 결합에서 지면 상태에서 들뜬 상태로의 전자는 δ→ δ*, δ→ δ* 또는 n→ δ* 등의 지정을 가질 수 있으며, 이는 δ 결합에서 δ 반결합 궤도로의 전자의 들뜸, δ 반결합 궤도로의 결합에서 n-반결합 [4][5]궤도로의 전자의 들뜸을 의미한다.이러한 모든 유형의 들뜬 분자에 대한 역전자 전이는 또한 δ* → δ, δ* → δ 또는 δ* → n으로 지정될 수 있는 지면 상태로 돌아갈 수 있다.
분자 내 전자의 에너지 준위의 전이는 진동 천이와 결합되어 바이브로닉 천이로 불릴 수 있다.진동 및 회전 천이는 회전 결합에 의해 결합될 수 있다.로비브로닉 커플링에서 전자 천이는 진동 및 회전 천이와 동시에 결합됩니다.전환에 관여하는 광자는 전환 유형에 따라 X선, 자외선, 가시광선, 적외선 또는 마이크로파 방사선과 같은 전자파 스펙트럼의 다양한 범위의 에너지를 가질 수 있다.매우 일반적인 방법으로 전자 상태 간의 에너지 수준 차이는 더 크고, 진동 수준 간의 차이는 중간이며, 회전 수준 간의 차이는 더 작습니다. 그러나 중복될 수 있습니다.번역 에너지 수준은 실질적으로 연속적이며 고전 역학을 사용하여 운동 에너지로 계산할 수 있습니다.
온도가 높으면 유체 원자와 분자가 더 빠르게 움직이면서 변환 에너지가 증가하고, 분자가 더 높은 평균 진동 및 회전 모드로 열적으로 들뜨게 됩니다(분자가 더 높은 내부 에너지 수준으로 들뜨게 됩니다).이것은 온도가 상승함에 따라 분자 열 용량에 대한 변환, 진동 및 회전의 기여가 분자가 열을 흡수하고 더 많은 내부 에너지를 보유하도록 한다는 것을 의미합니다.열의 전도는 일반적으로 분자 또는 원자가 서로 열을 전달하면서 충돌할 때 발생합니다.심지어 더 높은 온도에서, 전자는 원자나 분자의 더 높은 에너지 궤도에 열적으로 흥분할 수 있습니다.낮은 에너지 레벨로 전자를 떨어뜨리면 광자가 방출되어 빛나기 쉽다.
핵에서 더 멀리 있는 전자는 핵에 더 가까이 있는 전자보다 더 높은 위치에너지를 가지며, 따라서 그 위치에너지는 음이고 [6]핵으로부터의 거리에 반비례하기 때문에 핵에 덜 결합됩니다.
결정성 물질
결정성 고형물은 에너지 수준 대신 또는 에너지 띠를 가지고 있는 것으로 밝혀졌습니다.전자는 채워지지 않은 띠 안에 있는 어떤 에너지도 차지할 수 있다.처음에 이것은 에너지 수준의 요건에 대한 예외로 보입니다.그러나 밴드 이론에서 보듯이, 에너지 대역은 실제로 분해하기에는 너무 가까운 많은 이산 에너지 레벨로 구성되어 있습니다.밴드 내에서 레벨의 수는 결정의 원자 수의 순서이기 때문에, 전자는 실제로 이러한 에너지로 제한되지만, 그들은 값의 연속을 취할 수 있는 것으로 보입니다.결정의 중요한 에너지 레벨은 원자가 밴드의 상단, 전도 밴드의 하단, 페르미 레벨, 진공 레벨 및 결정의 결함 상태의 에너지 레벨입니다.
「 」를 참조해 주세요.
레퍼런스
- ^ 참조: 전자껍질은 왜 한계를 설정합니까?madsci.org, 1999년 3월 17일, Dan Berger, Bluffton College, 교수 화학/과학
- ^ 전자 서브셸부식원2011년 12월 1일에 취득.
- ^ Tipler, Paul A.; Mosca, Gene (2004). Physics for Scientists and Engineers, 5th Ed. Vol. 2. W. H. Freeman and Co. p. 1129. ISBN 0716708108.
- ^ a b c d 자외선 가시 흡수 스펙트럼
- ^ 자외선 가시(UV-Visible) 분광학 이론
- ^ "Archived copy". Archived from the original on 2010-07-18. Retrieved 2010-10-07.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크)