분자 궤도 본딩
Bonding molecular orbital본딩 궤도(bonding arbit)는 분자 내 두 개 이상의 원자의 원자 궤도 사이의 매력적인 상호작용을 설명하기 위해 분자 궤도(MO) 이론에 사용된다. MO 이론에서 전자는 파동을 일으키기 위해 묘사된다.[1] 이러한 파동 중 하나 이상이 서로 가까이 다가오면 이들 파동의 위상 결합은 크게 안정되는 종으로 이어지는 상호작용을 일으킨다. 파장의 건설적인 간섭의 결과는 결합 영역 내에서 전자의 밀도를 발견하게 하여 두 종 사이에 안정된 결합을 만들어 낸다.[2]
이원자 분자
고전적인2 H MO의 예에서, 두 개의 분리된 H 원자는 동일한 원자 궤도를 가지고 있다. 분자 이수소(dihydrogen)를 만들 때, 개별 발란스 궤도 1s: 원자의 핵 사이에 전자 밀도가 있는 결합 궤도를 얻기 위해 위상에서 병합하거나, 두 개의 핵 사이의 공간을 제외한 원자 주위의 모든 곳에 전자 밀도가 있는 항균 궤도를 얻기 위해 위상에서 병합한다. 원자.[3] 궤도를 결합하는 것은 두 개의 수력체가 단원자일 때보다 더 안정적인 종으로 이끈다. 궤도를 반연하는 것은 중간에 전자 밀도가 거의 없거나 거의 없는 두 개의 핵(동일한 전하를 유지함)이 서로를 억제하기 때문에 안정성이 떨어진다. 따라서 항응궤도를 통해 두 원자를 함께 고정시키는 데는 더 많은 에너지가 필요할 것이다. 수소의 발란스 1s 껍질 안에 있는 각각의 전자는 안정화된 본딩 궤도 안을 채우기 위해 모인다. 그래서 수소는 단원자 분자가 아닌 이원자 분자로 존재하는 것을 선호한다.[4]
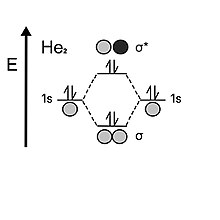
헬륨을 볼 때 원자는 각각의 발란스 1s 껍질에 두 개의 전자를 가지고 있다. 두 개의 원자 궤도가 모이면 먼저 본딩 궤도 궤도(bonding arbit)를 두 개의 전자로 채우지만, 수소와 달리 두 개의 전자가 남아 있는데, 이 전자는 그 다음 항균 궤도(antiboning arbit)로 가야 한다. 항균 궤도 불안정성은 본딩 궤도(bonding optival)에 의해 제공되는 안정화 효과를 상쇄하므로, 디엘리듬의 본딩 순서는 0이다. 이것이 헬륨이 이산화질소보다 단원자성을 선호하는 이유다.[5]
다원자 분자
파이 본드의 본딩 MO
파이 결합은 궤도의 "측면" 상호작용에 의해 만들어진다.[3] 다시 한번 분자궤도에서는 두 π 원자궤도의 교호작용이 위상에 있을 때 파이( () 전자를 접합하는 일이 일어난다. 이 경우 본딩 상호작용을 만들기 위해서는 π 궤도상의 전자 밀도가 거울 평면을 따라 대칭이어야 한다. 거울 평면을 따라 비대칭이 발생하면 해당 평면의 노드가 생성되며 항균 궤도인 **[3]에 설명된다.
단순 결합 π 시스템의 MO의 예는 부타디엔이다. 부타디엔에 대한 MO를 생성하기 위해, 앞에서 설명한 시스템의 resulting과 π* 궤도들은 서로 상호작용한다. 이 혼합은 4개의 그룹 궤도(모든 다이엔의 π MO를 설명하는 데도 사용될 수 있음)를 생성하게 된다.[3] π은1 수직 노드를 포함하지 않고, π은2 1개를 포함하며, both은 2개의 수직 노드를 포함하고, π은34 3개를 포함하며, 둘 다 항균 궤도로 간주된다.[3]
국부적 분자 궤도
s궤도의 구형 3D 모양은 우주에서 방향성이 없고 px, py, p 궤도z 모두 90이다o. 따라서 화학반응을 기술하기 위해 화학적 결합에 해당하는 궤도를 얻기 위해 에드미스턴과 루덴버그는 국산화 절차의 개발을 개척했다.[6][7] 예를 들어, CH에서는4 수소 원자의 1s 궤도상에서 나온 4개의 전자와 탄소 원자에서 나온 발란스 전자(p 2 in s, 2 in p)가 결합 분자 궤도인 σ과 π을 차지하고 있다.[6] 메탄 분자 내 탄소 원자의 분해된 MO는 4개의 sp3 하이브리드 궤도를 제공하도록 국부화될 수 있다.
적용들
분자 궤도 그리고 보다 구체적으로 말하면 본딩 궤도(bonding arbital)는 광범위하게 적용되기 때문에 유기체에서 물리적 그리고 심지어 분석적인 것까지 화학의 모든 다른 영역에서 가르쳐지는 이론이다. 유기화학자들은 반응에 대한 생각 근거에 분자 궤도 이론을 사용한다;[8][9] 분석 화학자들은 분자 궤도 이론을 다른 분광학 방법으로 사용한다;[10][11] 물리 화학자들은 그것을 계산에 사용한다;[8][12] 그것은 심지어 분자 궤도 이론의 확장인 밴드 이론을 통한 재료 화학에서 보여진다.[13]
참조
- ^ Mulliken, Robert S. (1932). "Electronic Structures of Polyatomic Molecules and Valence. II. General Considerations". Physical Review. 41 (1): 49–71. Bibcode:1932PhRv...41...49M. doi:10.1103/physrev.41.49.
- ^ Sannigrahi, A. B.; Kar, Tapas (1988-08-01). "Molecular orbital theory of bond order and valency". Journal of Chemical Education. 65 (8): 674. Bibcode:1988JChEd..65..674S. doi:10.1021/ed065p674. ISSN 0021-9584.
- ^ a b c d e Anslyn, Eric V. (2006). Modern physical organic chemistry. Dougherty, Dennis A., 1952-. Sausalito, CA: University Science. ISBN 978-1891389313. OCLC 55600610.
- ^ Lennard-Jones, J. E. (1929-01-01). "The electronic structure of some diatomic molecules". Transactions of the Faraday Society. 25: 668. Bibcode:1929FaTr...25..668L. doi:10.1039/tf9292500668. ISSN 0014-7672.
- ^ Housecroft, Catherine E. (2012). Inorganic chemistry. Sharpe, A. G. (4th ed.). Harlow, England: Pearson. ISBN 9780273742753. OCLC 775664094.
- ^ a b Cohen, Irwin; Del Bene, Janet (1969-08-01). "Hybrid orbitals in molecular orbital theory". Journal of Chemical Education. 46 (8): 487. Bibcode:1969JChEd..46..487C. doi:10.1021/ed046p487. ISSN 0021-9584.
- ^ Edmiston, Clyde (1963). "Localized Atomic and Molecular Orbitals". Reviews of Modern Physics. 35 (3): 457–464. Bibcode:1963RvMP...35..457E. doi:10.1103/revmodphys.35.457.
- ^ a b Dannenberg, J. J. (1999-05-12). "Using Perturbation and Frontier Molecular Orbital Theory To Predict Diastereofacial Selectivity". Chemical Reviews. 99 (5): 1225–1242. doi:10.1021/cr980382f. ISSN 0009-2665. PMID 11749445.
- ^ Li, Yongjun; Jia, Zhiyu; Xiao, Shengqiang; Liu, Huibiao; Li, Yuliang (2016-05-16). "A method for controlling the synthesis of stable twisted two-dimensional conjugated molecules". Nature Communications. 7: 11637. Bibcode:2016NatCo...711637L. doi:10.1038/ncomms11637. PMC 4873669. PMID 27181692.
- ^ Smith, Wendell F. (1963). "Application of molecular orbital theory to the electronic absorption spectra of schiff bases". Tetrahedron. 19 (3): 445–454. doi:10.1016/s0040-4020(01)99192-6.
- ^ Mulliken, Robert S. (1967-07-07). "Spectroscopy, Molecular Orbitals, and Chemical Bonding". Science. 157 (3784): 13–24. Bibcode:1967Sci...157...13M. doi:10.1126/science.157.3784.13. ISSN 0036-8075. PMID 5338306.
- ^ Gimarc, Benjamin M. (1974). "Applications of qualitative molecular orbital theory". Accounts of Chemical Research. 7 (11): 384–392. doi:10.1021/ar50083a004.
- ^ Brédas, J. L.; Calbert, J. P.; da Silva Filho, D. A.; Cornil, J. (2002-04-30). "Organic semiconductors: A theoretical characterization of the basic parameters governing charge transport". Proceedings of the National Academy of Sciences. 99 (9): 5804–5809. Bibcode:2002PNAS...99.5804B. doi:10.1073/pnas.092143399. PMC 122857. PMID 11972059.