황색포도상구균
Staphylococcus aureus| 황색포도상구균 | |
|---|---|
 | |
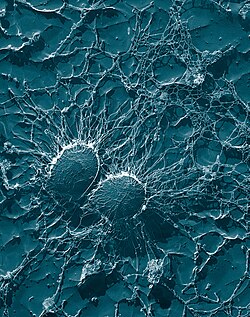
| S. aureus의 전자 마이크로그래프 스캐닝; 잘못된 색 추가 | |
| 과학적 분류 | |
| 도메인: | 박테리아 |
| Phylum: | "Firmicutes" |
| 등급: | 바킬리 |
| 순서: | 바킬라목 |
| 패밀리: | 포도상구균과 |
| 속: | 포도상구균 |
| 종: | S. 아우레우스 |
| 이항식 이름 | |
| 황색포도상구균 로젠바흐 1884년 | |
| 황색포도상구균 | |
|---|---|
| 기타 이름 | 스타프 아우레우스, S. 아우레우스 |
| 전문 | 전염병 |
| 종류들 | 메티실린-감각 포도상구균 아우레우스, 메티실린 내성 포도상구균 아우레우스 |
| 원인들 | 황색포도상구균 |
| 차등진단 | 다른 박테리아, 바이러스, 곰팡이 감염이 있고 |
| 예방 | 손 씻기, 표면 닦기 |
| 약물 | 항생제 |
| 빈도 | 인구의 20-30%가 증상이 없는 경우가 많다. |
황색포도상구균은 그람 양성 원형 모양의 박테리아로, 프러디쿠테스의 일원으로 상기와 피부에서 자주 발견되는 신체의 미생물(microbiota)에 속한다. 카탈라아제와 질산염 감소에 양성인 경우가 많으며 산소 없이도 성장할 수 있는 기능성 혐기증이다.[1] S. aureus는 보통 인간 마이크로바이오타에 준하는 역할을 하지만 또한 기회주의적 병원체가 되어 종기, 축농증 같은 호흡기 감염, 식중독을 포함한 피부 감염의 흔한 원인이 될 수 있다. 병원성 균주는 종종 강력한 단백질 독소와 같은 독성인자를 생성하여 감염을 촉진하고, 항체를 결합하고 불활성화하는 세포표면 단백질의 발현을 촉진한다. 메티실린 내성 S. 아우레우스(MRSA)와 같은 S. 아우레우스(S. aureus)의 항생제 내성 균주의 출현은 임상 의학에서 세계적인 문제다. 많은 연구 개발에도 불구하고 S. aureus용 백신은 승인되지 않았다.
인구의 약 20-30%가 S. aureus의[2][3] 장기 보균자로, 정상 피부 동식물의 일부로서, 콧구멍에서,[2][4] 그리고 여성의 하부 생식기관의 정상적인 거주자로서 발견될 수 있다.[5][6] S. aureus는 여드름,[7] 임피고, 종기, 섬유염, 모낭염, 카르분클, 골수염, 심내막염, 독성 쇼크 증후군, 균열, 패혈증과 같은 경미한 피부 감염에서부터 폐렴, 뇌막염, 골수염, 종기 등의 생명을 위협하는 질병에 이르기까지 다양한 질병을 일으킬 수 있다. 그것은 여전히 병원에서 얻은 감염의 5가지 가장 흔한 원인 중 하나이며 종종 수술 후 상처 감염의 원인이다. 매년 미국의 병원에서 약 50만 명의 환자들이 주로 S. aureus에 의해 포도상구균 감염에 걸린다.[8] 미국에서 매년 최대 5만 명의 사망자가 S. aureus 감염과 연관되어 있다.[9]
역사
디스커버리
1880년, 스코틀랜드의 외과의사인 알렉산더 오그스턴은 자신이 시술하는 동안 수술용 종기에서 고름이 나온 박테리아 집단을 발견한 후 포도상구균이 상처 감염을 일으킬 수 있다는 것을 발견했다. 그는 현미경 아래 있는 그것의 군집화된 모습을 보고 그것을 포도상구균이라고 이름 지었다. 그 후 1884년 독일의 과학자 프리드리히 율리우스 로젠바흐는 포도상구균 아우레우르스를 식별하여 관련 박테리아인 포도상구균 알버스와 구별하고 분리하였다. 1930년대 초, 의사들은 세균에 의해 생성된 효소의 탐지를 가능하게 하는 코굴라제 검사를 통해 S. aureus 감염의 존재를 감지하기 위해 보다 능률적인 검사를 사용하기 시작했다. 1940년대 이전에는, S. aureus 감염은 대다수의 환자들에게 치명적이었다. 하지만 의사들은 페니실린의 사용이 S. aureus 감염을 치료할 수 있다는 것을 발견했다. 불행하게도 1940년대 말에 페니실린 저항은 이 박테리아 집단 사이에 널리 퍼졌고 저항성 변종의 발병이 일어나기 시작했다.[10]
진화
황색포도상구균은 10개의 지배적인 인간 계열로 분류될 수 있다. 수많은 작은 줄들도 있지만, 이러한 줄들은 종종 인구에서 볼 수 없다. 같은 혈통 내 박테리아의 게놈은 이동 유전원소를 제외하고 대부분 보존된다. S. aureus에서 흔히 볼 수 있는 이동 유전 원소로는 박테리오파지, 병원성 섬, 플라스미드, 트랜스폰스, 포도상구균 카세트 염색체 등이 있다. 이러한 요소들은 S. aureus가 지속적으로 진화하고 새로운 특성을 얻을 수 있게 했다. S. aureus 종에는 유전적 변화가 매우 많다. 피츠제럴드 외 연구진 (2001) S. aureus 게놈의 약 22%가 비코딩 상태여서 박테리아마다 다를 수 있다고 밝혔다. 이 차이의 예는 그 종의 강인함에서 볼 수 있다. 오직 소수의 S. aureus 변종만이 인간 내 감염과 연관되어 있다. 이것은 그 종 내에 광범위한 감염 능력이 있다는 것을 보여준다.[11]
종 내에서 이질성이 크게 나타나는 한 가지 가능한 이유는 이질감염에 대한 의존 때문일 수 있다고 제안되었다. 이것은 여러 가지 다른 종류의 S. aureus가 호스트 내에 감염을 일으킬 때 발생한다. 서로 다른 균주는 서로 다른 효소를 분비하거나 다른 항생제 저항을 그룹에 가져와서 병원성 능력을 높일 수 있다.[12] 따라서 이동 유전 원소의 대량 돌연변이와 획득이 필요하다.
S. aureus 종 내에서 또 다른 주목할 만한 진화 과정은 그것의 인간 숙주와 그것의 공동 진화다. 시간이 지남에 따라 이러한 기생관계는 박테리아가 증상이나 감염을 일으키지 않고 인간의 비인두 속에 옮겨지는 능력을 가져왔다. 이것은 그것이 인류 전체로 전달되도록 하여 종으로서의 체력을 증가시킨다.[13] 그러나 인구의 약 50%만이 S. aureus의 운반자로, 20%는 연속 운반자로, 30%는 간헐적으로 운반된다. 이것은 과학자들이 S. aureus가 인간에게 무증상적으로 운반되는지 여부를 결정하는 많은 요소들이 있다고 믿게 한다. 여기에는 개인에게 특정한 요소들이 포함된다. 호프만 외 연구소의 1995년 연구에 따르면, 이러한 요인에는 나이, 성별, 당뇨병, 흡연 등이 포함될 수 있다. 그들은 또한 S. aureus가 더 큰 코르티코스테로이드 생산을 야기하는 글루코코르티코이드 수용체 유전자의 다형성 증대로 이어지는 인간의 유전적 변화를 결정했다. 결론적으로, 이 박테리아의 어떤 변종도 침습적이 될 수 있다는 증거가 있는데, 이는 인간의 요인에 크게 의존하기 때문이다.[14]
S. aureus는 빠른 생식력과 미세 진화율을 가지고 있지만, 종과의 진화를 막는 여러 장벽이 있다. 그러한 장벽 중 하나는 ARG이다. ARG는 박테리아 내의 전지구적 부속 유전자 조절기다. 이러한 조절기는 박테리아의 독성 수준과 연결되어 있다. 이 유전자 내의 기능 돌연변이의 상실은 그것을 포함하는 박테리아의 적합성을 증가시키는 것으로 밝혀졌다. 따라서 S. aureus는 종으로서 그들의 성공을 증가시키기 위해 절충을 마약 저항성 증가와 교환하면서 절충을 해야 한다. 진화의 또 다른 장벽은 Sau1 Type I 제한 수정(RM) 시스템이다. 이 시스템은 이 박테리아를 소화함으로써 외국 DNA로부터 보호하기 위해 존재한다. 같은 혈통 사이의 DNA 교환은 차단되지 않는데, 이는 효소가 동일하고 RM 시스템이 새로운 DNA를 외국산 DNA로 인식하지 못하기 때문이다.[12]
미생물학
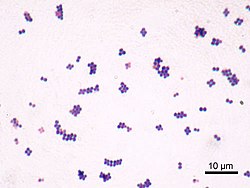
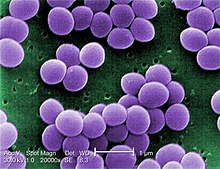
S. aureus (/ˌstæfɪləˈkɒkəs ˈɔːriəs, -loʊ-/,[15][16] Greek σταφυλόκοκκος, "grape-cluster berry", Latin aureus, "golden") is a facultative aerobic, Gram-positive coccal (round) bacterium also known as "golden staph" and "oro staphira". S. aureus는 운동성이 없고 포자를 형성하지 않는다.[17] 의학 문헌에서 박테리아는 흔히 S. aureus, Stapp aureus 또는 Stapp a라고 불린다.[18] S. aureus는 현미경을 통해 볼 때 포도상구균(강관처럼 생긴 군집)으로 나타나며, 혈액응고판 위에서 자랄 때 종종 용혈과 함께 크고 둥근 황금빛 황색 군락을 가지고 있다.[19] S. aureus는 이항 핵분열에 의해 무성으로 생식한다. 딸 세포의 완전한 분리는 S. aureus autolyshin에 의해 매개되며, 그 부재나 표적 억제에서는 딸 세포가 서로 붙어 있는 상태로 남아 군집처럼 나타난다.[20]
S. aureus는 카탈라아제 양성(catalase 효소를 생산할 수 있다는 의미)이다. 카탈라아제는 과산화수소(HO
2
2)를 물과 산소로 변환시킨다. 카탈라아제-활동 테스트는 때때로 포도상구균과 장구균을 구별하기 위해 사용된다. 기존에는 S. aureus가 coagulase 테스트에 의해 다른 포도상구균과 차별화되었다. 그러나 모든 S. aureus 변종이 cagulase[19][21] 양성인 것은 아니며 잘못된 종 식별은 효과적인 치료와 통제 조치에 영향을 미칠 수 있다.[22]
포도상구균은 유사한 명칭이 있고 의학적으로 관련이 있는 스트렙토코쿠스속과는 다르다.
자연 유전적 변환은 DNA가 매개체를 통해 박테리아에서 다른 박테리아로 전달되고, 균질 재조합에 의해 기증자 서열이 수령자 게놈으로 통합되는 것을 수반하는 생식 과정이다. S. aureus는 자연적인 유전적 변환이 가능하지만, 사용된 실험 조건 하에서는 저주파에서만 가능한 것으로 밝혀졌다.[23] 추가 연구들은 자연 유전자 변형을 위한 능력의 발달이 적절한 조건 하에서는 상당히 더 높을 수 있지만 아직 발견되지 않을 수 있음을 시사했다.[24]
건강에서의 역할
인간에게 있어 S. aureus는 정상 마이크로바이오타의 구성원으로 상부 호흡기, 장 점막, 피부 등에 존재할 수 있다.[25][26][27] 그러나 S. aureus는 특정 숙주와 환경 조건 하에서 질병을 일으킬 수 있기 때문에 '경로비온트'[25]로 특징지어진다.
질병에서의 역할
S. aureus는 보통 인간의 약 30%를 무증상적으로 식민지로 만드는 균의 역할을 하는 반면, 때때로 질병을 일으킬 수 있다.[3] 특히 S. aureus는 균혈증과 감염성 심내막염의 가장 흔한 원인 중 하나이다. 게다가, 그것은 특히 피부나 점막 장벽이 뚫렸을 때,[3] 다양한 피부와 연성 질환의 감염을 일으킬 수 있다.
S. aureus 감염은 감염된 상처에서 나온 고름과의 접촉, 감염된 사람과 피부 간 접촉, 수건, 시트, 옷, 운동기구와 같은 감염자가 사용하는 물체와 접촉함으로써 퍼질 수 있다. 관절 치환술은 특히 패혈성 관절염, 포도상구균 내막염(심장판막염), 폐렴의 위험을 초래한다.[28]
예방책으로는 비누로 손을 자주 씻고 매일 목욕이나 샤워를 하는 것이 있다.
S. aureus는 의료용 임플란트에서의 만성 바이오필름 감염의 중요한 원인이며, 독소 억제기는 감염 경로의 일부분이다.[29]
S. aureus는 발견되지 않은 채 몇 년 동안 몸 속에 잠재울 수 있다. 일단 증상이 나타나기 시작하면 숙주는 다시 2주 동안 전염이 되고, 전반적인 병은 몇 주 동안 지속된다. 그러나 치료하지 않으면 그 병은 치명적일 수 있다.[30] 깊이 침투하는 S. aureus 감염은 심각할 수 있다.
피부 감염
피부 감염은 S. aureus 감염의 가장 흔한 형태다. 이것은 작은 양성 종기, 모낭염, 임피고, 섬유염, 그리고 더 심하고 침습적인 소프트티슈 감염을 포함한 다양한 방법으로 나타날 수 있다.[7][3]
S. aureus는 아토피성 피부염을 가진 사람들에게 매우 널리 퍼져 있는데, 흔히 습진이라고 알려져 있다. 주로 겨드랑이, 머리카락, 두피 등 비옥하고 활동적인 곳에서 발견된다. 그 부위에 나타나는 큰 여드름은 열상을 입으면 감염을 악화시킬 수 있다. 이것은 신생아들에게서 볼 수 있는 심각한 형태의 포도상구균 메스드 피부 증후군으로 이어질 수 있다.[31]
아토피성 피부염을 앓고 있는 사람에게 S. aureus가 있다는 것은 구강 항생제로 치료할 수 있는 징후가 아니며, 증거가 이를 보여주지 않았기 때문이다.[32][33] 그러나 코르티코스테로이드와 결합된 국소 항생제는 이 상태를 호전시키는 것으로 밝혀졌다.[34] S. aureus의 식민지화는 아토피 피부염의 염증을 유발하고,[35] S. aureus는 아토피 피부염을 가진 사람의 피부 장벽의 결함을 악용하여 사이토카인 발현을 유발하여 증상을 악화시킨다고 여겨진다.[36]
식중독
S. aureus도 식중독의 원인이다. 인체에 식중독을 일으키는 독소를 발생시킬 수 있다.[37] 잠복기는 1~6시간이며,[38] 병 자체도 30분에서 3일 정도 지속된다.[39] 질병의 확산을 막기 위해 취할 수 있는 예방 조치에는 음식을 준비하기 전에 비누와 물로 손을 철저히 씻는 것이 포함된다. 아프면 음식을 멀리하고, 음식을 준비하는 동안 손이나 손목에 벌어진 상처가 있으면 장갑을 낀다. 식품을 2시간 이상 보관할 경우, 식품을 40°F(4.4°C 또는 60°C) 이하로 보관하십시오.[40]
뼈 및 관절염
S. aureus는 모든 주요 뼈와 관절 감염에 공통적으로 책임이 있는 박테리아다. 이것은 골수염, 패혈성 관절염, 대체 관절 수술로 인한 감염의 세 가지 형태 중 하나로 나타난다.[41][3][42]
박테레미아
S. aureus는 산업화된 세계의 많은 지역에서 혈류 감염의 주요 원인이다.[41] 감염은 일반적으로 카테터, 혈액투석기 또는 약물주입과 같은 혈관내 장치의 수술, 부상 또는 사용으로 인한 피부나 점막의 파손과 관련이 있다.[3][41] 일단 이 박테리아가 혈류로 들어가면 여러 장기를 감염시켜 감염성 심내막염, 패혈성 관절염, 골수염 등을 일으킬 수 있다.[41] 이 병은 특히 아주 젊고 아주 노쇠한 사람에게 만연하고 심하다.[3]
항생제 치료를 받지 않으면, S. aureus 균사체는 케이스 치사율이 80%[3] 정도 된다. 항생제 치료의 경우 환자의 연령과 건강, S. aureus 변종의 항생제 내성 등에 따라 케이스 치사율이 15%~50%에 이른다.[3]
의료용 임플란트 감염증
S. aureus는 종종 신체나 인체 조직에서 이식된 의료기기에 형성된 생체필름에서 발견된다. 그것은 다종 생물필름을 형성하는 또 다른 병원체, 칸디다 알비칸과 함께 흔히 발견된다. 후자는 S. aureus가 인체 조직을 관통하는 것을 돕는다는 의심을 받고 있다.[9] 높은 사망률은 다종 생물필름과 연관되어 있다.[43]
S. aureus 바이오 필름은 정형외과적 임플란트 관련 감염의 주요 원인이지만 심장 이식, 혈관 이식, 다양한 카테터, 성형외과적 임플란트에서도 발견된다.[44][45] 이식 후 이들 장치의 표면은 숙주 단백질로 코팅되어 세균 부착과 바이오필름 형성을 위한 풍부한 표면을 제공한다. S. aureus 바이오 필름은 항생제 치료로 파괴될 수 없기 때문에 일단 장치가 감염되면 완전히 제거해야 한다.[45]
현재 S. aureus 바이오필름 매개 감염에 대한 치료법은 감염된 장치를 수술로 제거한 후 항생제 치료를 하는 것이다. 기존 항생제 치료만으로는 이런 감염을 근절하는 데 효과적이지 않다.[44] 수술 후 항생제 치료의 대안으로 항생제를 탑재한 용해 가능한 황산칼슘 비드를 사용하는 것이 있는데, 이 비드는 의료기기와 함께 이식된다. 이 구슬들은 초기 감염을 막기 위해 원하는 부위에 많은 양의 항생제를 방출할 수 있다.[45]
나노 실버 입자, 박테리오파지, 식물 유래 항생제 등이 포함된 S. aureus 바이오필름의 새로운 치료법이 연구되고 있다. 이러한 작용제는 바이오필름에 내장된 S. aureus에 대한 억제 효과를 보여 왔다.[46] 효소의 종류는 바이오필름 매트릭스 분해 능력이 있는 것으로 밝혀져 항생제와 결합해 바이오필름 분산제로 사용될 수 있다.[47]
동물감염
S. aureus는 개,[48] 고양이,[49] 말에서 살아남을 수 있고 [50]닭에서 발을 구르는 원인이 될 수 있다.[51] 일부 사람들은 건강관리 종사자들의 개가 특히 발병 시기에 항생제에 내성이 있는 S. aureus의 중요한 공급원으로 여겨져야 한다고 생각한다.[48] 부스트, 오도노후, 제임스의 2008년 연구에서 애완견에서 서식하는 S. aureus의 약 90%만이 적어도 하나의 항생제에 내성이 있는 것으로 나타났다. 비강 부위는 개와 사람 사이의 가장 중요한 이동 장소로 연루되어 왔다.[52]
S. aureus는 젖소의 유방염의 원인물질 중 하나이다. 그것의 큰 다당류 캡슐은 소의 면역 방어에 의한 인식으로부터 유기체를 보호한다.[53]
맹독성 인자
효소
S. aureus는 혈장을 응고하고 박테리아 세포를 코팅하는 코글라아제(결합 및 자유 코글라제)와 같은 다양한 효소를 생산하는데, 아마도 포자세포증을 예방하기 위해서일 것이다. 히알루로니다아제(확산인자로도 알려져 있다)는 히알루론산을 분해하여 확산시키는 데 도움을 준다. DNA를 분해하는 디옥시리보누클리스는 중성미자 세포외 함정에 의한 살상으로부터 S. aureus를 보호한다.[54][55] S. aureus는 또한 지질을 소화하기 위한 리파아제, 피브린과 스프레드를 돕기 위한 스테이필로키나제, 약물 내성을 위한 베타 락타마제를 생산한다.[56]
독소
스트레인에 따라 S. aureus는 여러 개의 엑소톡신을 분비할 수 있는데, 이 엑소톡신은 세 그룹으로 분류할 수 있다. 이러한 독소들 중 많은 것들이 특정 질병과 연관되어 있다.[57]
- 수페란티겐스
- 슈퍼안티겐으로 알려진 항원은 독성 쇼크 증후군을 유발할 수 있다. 이 소분류는 현재까지 식별되고 알파벳(SEA - SEZ)으로 명명된 25개의 스타필로코칼 엔토톡신(SE - SEZ)[58]과 탐폰 사용과 관련된 TSS를 유발하는 독성 쇼크 증후군 TSS-1로 구성된다. 독성 쇼크 증후군은 발열, 홍반 발진, 저혈압, 쇼크, 다발성 장기부전, 피부 껍질 벗겨짐 등이 특징이다. TSST-1에 대한 항체 결핍은 TSS의 병원체 생성에 한 몫을 한다. S. aureus의 다른 변종은 위장염의 일종인 원인 물질인 장내톡신을 생산할 수 있다. 이러한 형태의 위장염은 자가제한으로 독소 섭취 후 1~6시간 후에 구토와 설사를 하며 8~24시간 만에 회복되는 것이 특징이다. 증상으로는 메스꺼움, 구토, 설사, 큰 복통 등이 있다.[59][60]
- 각질 독소
- 각질성 독소는 포도상구균 화상피부 증후군(SSSSS)에 관여하는 엑소톡신(exotoxins)으로 영유아에게 가장 많이 발생한다. 그것은 또한 병원 탁아소에서 전염병으로 발생할 수 있다. 각질 독소의 프로테아제 활성은 SSSS로 관찰된 피부가 벗겨지는 원인이 된다.[60]
- 기타독소
- 세포막에 작용하는 포도상구균 독소에는 알파독소, 베타독소, 델타독소, 그리고 몇몇 바이코메인 독소가 있다. S. aureus 변종은 PVL(Panton-Valentine Raekocidin, PVL)을 생성하는 prophage Ⅱ-PVL과 같은 phages를 진행시켜 활성을 증가시킬 수 있다. 이산화독소 PVL은 어린이들의 심한 괴사성 폐렴과 관련이 있다.[61][62] PVL의 성분을 인코딩하는 유전자는 지역사회 관련 MRSA 변종에서 발견되는 박테리오파지에 암호화되어 있다.[citation needed]
소형 RNA
S. aureus의 박테리아 독성 조절에 관여하는 작은 RNA의 목록이 증가하고 있다. 이는 그러한 작은 RNA의 증가된 레벨이 존재하는 상황에서 바이오필름 형성의 증가와 같은 요인에 의해 촉진될 수 있다.[63] 예를 들어 RNAIII,[64] SprD,[65] SprC,[66][67] RsaE,[68] SprA1, [69]SSR42,[70] ArtR,[71] SprX, Teg49 등이 있다.[72]
IMT2000 3GPP - 3 ; 번역 후 규제전략
S. aureus의 많은 mRNA는 100 nucleotides보다 긴 세 개의 주요 비번역 영역(3'UTR)을 운반하며, 이는 잠재적으로 규제 기능을 가질 수 있다.[73]
icaR mRNA(세균 바이오필름 매트릭스의 주성분 화합물 억제기에 대한 mRNA 부호화)에 대한 추가 조사 결과, 3가 나왔다.5' UTR에 대한 UTR 바인딩은 변환 개시 콤플렉스를 방해할 수 있으며 RNase III를 위한 이중 좌초 기질을 생성할 수 있다. 상호작용은 3'의 UCCUG 모티브 사이에 있다.UTR과 샤인달라가르노 지역은 5층이다.UTR. 모티브를 삭제한 결과 IcaR 억제기 누적 및 바이오필름 개발 억제가 발생하였다.[73] 바이오필름 형성은 포도상구균 이식 감염의 주요 원인이다.[74]
바이오필름
생물필름은 박테리아와 같은 미생물의 집단으로 서로 붙어 젖은 표면에서 자란다.[75] S. aureus 바이오 필름은 글리코칼립스 슬라임 층에 내장되어 있으며, 티초산, 숙주 단백질, 세포외 DNA(eDNA), 다당질간 항원(PIA)으로 구성될 수 있다. 모든 S. aureus 바이오필름이 PIA를 포함하는 것은 아니다. S. aureus 바이오필름은 항생제 내성과 면역체계 탈피에 기여할 수 있기 때문에 질병 병원생식에 중요하다.[45] S. aureus 바이오필름은 항생제 치료와 숙주 면역 반응에 대한 내성이 높다.[75] 이를 설명하기 위한 한 가지 가설은 바이오필름 매트릭스가 항생제 침투 방지를 위한 장벽 역할을 함으로써 내장 세포를 보호한다는 것이다. 그러나 바이오필름 매트릭스는 많은 물 채널로 구성되어 있어 이 가설은 점점 가능성이 낮아지고 있지만, 바이오필름 매트릭스는 항생제 침투를 막을 수 있는 β-락타마제 같은 항생제 분해 효소를 포함하고 있을 가능성이 있다.[76] 또 다른 가설은 바이오필름 매트릭스의 조건들이 항생제 내성, 휴면성 박테리아 세포인 퍼시스터 세포의 형성을 선호한다는 것이다.[45] S. aureus biofilms 또한 숙주 면역 반응에 대한 저항성이 높다. 정확한 저항의 메커니즘은 알려지지 않았지만, S. aureus 바이오필름은 숙주 면역 반응에 의해 생성된 사이토카인의 존재 아래 성장을 증가시켰다.[77] 숙주항체는 이질적인 항원분포 때문에 S. aureus 바이오필름에 덜 효과적이며, 이질적인 항원은 바이오필름의 일부 영역에 존재할 수 있지만 다른 영역에서는 완전히 존재하지 않는다.[45]
바이오필름 개발에 관한 연구는 유전자 발현 변화와 관련이 있는 것으로 나타났다. 서로 다른 바이오필름 성장단계에서 결정적인 것으로 밝혀진 특정 유전자가 있다. 이 유전자 중 2개에는 효소의 오르니틴-옥소-산소-아산화 트랜스아미나제를 인코딩하는 rocD와 gudB, 아미노산 대사에 중요한 글루탐산탈수소효소가 있다. 연구는 적절한 대사 기능을 위해 바이오필름 개발이 아미노산 글루타민과 글루탐산염에 의존한다는 것을 보여주었다.[78]
기타 면역억제적 전략
- 단백질 A
단백질 A는 트랜스펩티다아제 분류효소 A에 의해 포도상구균 펩티도글리칸 펜타글리신교(글리신잔류 5개 체인)에 고정되어 있다.[79] IgG 결합 단백질인 단백질 A는 항체의 Fc 영역에 결합한다. 실제로 단백질 A에 대한 유전자 코딩 돌연변이와 관련된 연구에서는 혈액 내 생존에 의해 측정된 S. aureus의 바이러스성이 낮아져 단백질 A가 함유된 바이럴은 항체 Fc 부위의 결합을 필요로 한다는 추측이 나오고 있다.[80]
다양한 재조합 형태의 단백질 A는 면역선호도 크로마토그래피에 의해 광범위한 항체를 결합하고 정화하기 위해 수십 년 동안 사용되어 왔다. 포도상구균 펩티도글리칸에 단백질 A와 같은 고정인자를 담당하는 분류법 같은 트랜스펩타아제는 MRSA 감염을 목표로 하는 새로운 항생제를 개발하고자 하는 희망으로 연구되고 있다.[81]
- 포도상구균 색소
S. aureus의 일부 변종은 황금의 색소인 포도상구균을 생산할 수 있다. 이 색소는 주로 박테리아 항산화 작용으로 병원균을 죽이기 위해 숙주 면역체계가 사용하는 활성산소 종을 미생물들이 피하도록 돕는다.[82][83]
포도상구균이 부족하도록 변형된 S. aureus의 돌연변이 변종은 착색된 변종보다 과산화수소 같은 산화화학물질로 부화해도 살아남을 가능성이 적다. 돌연변이 군락은 인간의 중성미자에 노출되면 빠르게 죽지만, 색소화된 군락 중 많은 수가 살아남는다.[82] 생쥐의 경우 색소성 균주는 상처에 접종하면 종기가 남는 반면, 비염색성 균주에 감염된 상처는 빠르게 치유된다.
이 테스트들은 포도상구균 균주가 정상적인 인간의 면역체계에 대한 방어 수단으로 포도상구균을 사용한다는 것을 시사한다. 포도상구균의 생산을 억제하기 위해 고안된 약물은 박테리아를 약화시키고 항생제에 대한 민감성을 갱신할 수 있다.[83] 실제로 포도상구균과 사람콜레스테롤의 생합성 경로상 유사성 때문에 콜레스테롤 저하요법의 맥락에서 개발된 약물이 쥐 감염 모델에서 S. aureus 색소 침착과 질병 진행을 차단하는 것으로 나타났다.[84]
고전 진단
존재하는 감염의 종류에 따라 그에 따라 적절한 시료를 얻어 생화학적 또는 효소 기반 테스트를 이용하여 최종 식별을 위해 실험실로 보내진다. 그램 얼룩은 먼저 그램 양성 박테리아인 cocci를 군집화하여 보여야 하는 길을 안내하기 위해 행해진다. 둘째, 고립은 S. aureus가 자랄 수 있는 선택적 매체인 Mannitol salt agar에서 배양되며, 이는 S. aureus가 자랄 수 있는 7.5% NaCl로, mannitol 발효와 그에 따른 medium pH 감소의 결과로 노란 색상의 군락을 생성한다.[85][86]
나아가 종 수준의 분화를 위해 카탈라아제(모든 포도상구균 종에 양성), 코아굴라제(피브린 응고 형성, S. aureus에 양성), DNA세(DNase agar에 대한 간극 영역), 리파아제(노란색, 황색, 황색, 황색 냄새), 인산아제(핑크색) 검사가 모두 이루어진다. 포도상구균 식중독의 경우 해당 식품에서 회수된 포도상구균이 감염원인지 여부를 판별하기 위해 페이징 타이핑을 할 수 있다.[87]
신속한 진단 및 입력
최근 환자가 섭취한 활동과 음식 등은 의사가 문의하고, 신체검사를 실시해 증상이 있는지 여부를 점검한다. 증상이 심해지면 혈액검사와 대변 배양도 순서가 잡힐 수 있다.[88] 진단 미생물학 연구소와 참고 실험실은 S. aureus의 발생과 새로운 변종을 식별하기 위한 핵심이다. 최근의 유전적 발전은 실시간으로 S. aureus의 임상격리체를 식별하고 특성화하는 신뢰할 수 있고 빠른 기법을 가능하게 했다. 이러한 도구는 세균 확산을 제한하고 항생제의 적절한 사용을 보장하기 위한 감염 통제 전략을 지원한다. 감염의 발생을 확인하기 위해 정량적 PCR이 점점 더 많이 사용되고 있다.[89][90]
S. aureus의 진화와 각각의 변형된 항생제에 적응하는 능력을 관찰할 때, "밴드 기반" 또는 "시퀀스 기반"으로 알려진 두 가지 기본적인 방법을 사용한다.[91] 이 두 가지 방법을 유념하면 다엽서 시퀀스 타이핑(MLST), 펄스장 겔 전기영동(PFGE), 박테리오파지 타이핑, 스파 로커스 타이핑, SCCmec 타이핑 등 다른 방법이 다른 방법보다 더 많이 수행되는 경우가 많다.[92] 이러한 방법으로, MRSA의 균주가 어디에서 발생했는지와 현재 어디에 있는지를 파악할 수 있다.[93]
이 타이핑 기술은 MLST와 함께 aroE, glpF, gmk, pta, tip, yqiL로 알려진 여러 하우스키핑 유전자의 파편을 사용한다. 그런 다음 이 시퀀스에는 알레르기의 프로필 역할을 하는 여러 숫자의 문자열에 부여되는 번호가 할당된다. 이 방법이 일반적인 방법이지만, 이 방법의 한계는 새로 발생하는 프로파일을 감지하는 마이크로 어레이의 유지보수로 비용이 많이 들고 시간이 많이 소요되는 실험이 된다.[91]
PFGE는 1980년대 첫 성공으로 거슬러 올라가도 여전히 많이 사용되고 있으며, MRSA의 차별화를 도울 수 있다.[93] 이를 위해 이 기법은 분자의 명확한 분해능을 보여주기 위해 전압 구배와 함께 복수의 젤 전기영향을 사용한다. 그리고 나서 S. aureus 파편들은 겔을 타고 내려가면서, 관련 변종을 식별하고자 다른 것과 나중에 비교되는 특정한 밴드 패턴을 생성한다. 이 방법의 한계에는 균일한 밴드 패턴과 PFGE 감도를 전체적으로 가진 실제적인 어려움이 있다.
스파 로커스 타이핑은 또한 S. aureus의 다형성 영역에서 단일 로커스 영역을 사용하여 어떤 형태의 돌연변이를 구별하는 인기 있는 기술로 간주된다.[93] 비록 이 기술은 종종 비용이 적게 들고 시간이 덜 소요되지만, 차별적 힘을 상실하여 MLST clonal clonal clonal clonal complex를 구별하기 어려울 가능성이 중요한 한계를 예시한다.
치료
예민한 균주의 경우 S. aureus 감염에 대한 선택 치료는 페니실린이다. 일부 페니실리움 진균종에서 유래한 항생제인 페니실린은 박테리아 세포벽에서 강성과 강도를 제공하는 펩티도글리칸 교차연결을 억제한다. 페니실린의 네 엠베드 β-락탐 링은 효소 DD-트랜스펙티다아제와 결합되는데, 이 효소는 기능할 때 박테리아 세포벽을 형성하는 펩티도글리칸 체인을 교차 연결하는 효소다. DD-트랜스펩티아제에 대한 β-락탐의 결합은 효소의 기능을 억제하고 더 이상 교차 링크 형성을 촉진할 수 없다. 그 결과 세포벽 형성 및 분해의 균형이 맞지 않아 세포사멸을 초래한다. 그러나 대부분의 나라에서는 페니실린 저항성이 극히 일반적이며(>90%) 1차 치료는 국소 저항 패턴에 따라 가장 일반적으로 페니실린제 내성 β-락탐 항생제(예: 옥사실린 또는 플루클로사실린) 또는 반코마이신이다. 겐타미닌과의 결합요법은 심내막염 등 중증 감염 치료에 쓰일 수 있지만 신장에 손상을 줄 위험이 높아 사용법이 논란이 되고 있다.[94][95][96] 치료 기간은 감염 부위 및 중증도에 따라 달라진다. 부가성 리프암피신은 역사적으로 S aureus 박테라빈혈증 관리에 사용되어 왔으나 무작위 제어 시행 증거는 이것이 표준 항생제 치료보다 전반적인 효익이 없음을 보여주었다.[97]
S. aureus의 항생제 내성은 페니실린이 1943년에 처음 도입되었을 때 흔치 않았다. 실제로 임페리얼 칼리지 런던의 알렉산더 플레밍이 페니실리움 균의 항균 활동을 관찰한 원래의 페트리 요리는 S. aureus의 문화를 키우고 있었다. 1950년까지 S. aureus 격리된 병원의 40%는 페니실린 내성이었고 1960년에는 80%[98]까지 증가했다.
메티실린 내성 포도상구균 aureus(MRSA, 종종 / pronouncedmɜːrsə/ 또는 /ɛm ɑːr ɛs eɪ/)는 대부분의 β-락탐 항생제에 내성이 생긴 S. aureus의 여러 크게 우려되는 변종 중 하나이다. 이 때문에 글리코펩타이드 항생제인 반코마이신은 MRSA와 싸우는 데 흔히 사용된다.반코마이신은 펩티도글리칸의 합성을 억제하지만 β-락탐 항생제와 달리 글리코프타이드 항생제 표적을 억제하고 세포벽의 아미노산과 결합해 펩티도글리칸 교차 연계가 형성되는 것을 막는다. MRSA 변종은 대부분 병원과 같은 기관과 연관되어 발견되지만, 지역사회에서 획득한 감염에서 점점 더 보편화되고 있다.
경미한 피부염은 삼중 항생제 연고로 치료할 수 있다.[99] 처방되는 한 가지 국소제로는 단백질 합성억제제 무피로신(Mupirocin)이 있는데, 이는 녹농균 형광체에 의해 자연적으로 생성되어 S. aureus 비강 마개 치료의 성공을 거두었다.[45]
항생제 내성
페니실린에 대한 포도상구균 저항성은 페니실린 분자의 β-락탐 링을 갈라 항생제를 비효과적으로 만드는 효소인 페니실린아제(베타카마제) 생성에 의해 매개된다. 메티실린, 나프실린, 옥사실린, 클로사실린, 디클로사실린, 플루클로사실린 등 페니실린제 내성 β-락탐 항생제는 포도상구균 페니실린제로 분해에 저항할 수 있다.
메티실린에 대한 저항은 포도상구균 카세트 염색체 메카(SCCMEC)의 일부인 메카 피연산자를 통해 매개된다. SCCmec은 S. aureus 진화의 주요 원동력인 이동 유전적 원소 계열이다.[91] 저항성은 β-락탐(페니실린, 세팔로스포린, 카바베넴) 결합 친화력이 낮은 변형 페니실린 결합 단백질(PBP2a 또는 PBP2')을 코딩하는 메카 유전자에 의해 부여된다. 이는 모든 β-락탐 항생제에 대한 내성을 허용하며, MRSA 감염 시 임상 사용을 방지한다. 연구는 이 이동 유전 원소가 별도의 유전자 전달 사건에서 서로 다른 선에 의해 획득되었다고 설명했는데, 이는 다른 MRSA 변종의 공통 조상이 없다는 것을 보여준다.[100] 흥미롭게도, 한 연구는 MRSA가 생물필름의[101] 생존과 창조를 위해 독소 생산과 침입과 같은 맹독성을 희생시킨다고 제안한다.
카나미신, 젠타마민, 스트렙토마이신 같은 아미노글리코사이드 항생제는 균주가 30S 리보솜 하위 유닛의 리보솜 RNA와/또는 히드록실 상호작용을 통해 발생하는 아미노글리코사이드의 작용을 억제하는 메커니즘을 진화시킬 때까지 포도상구균 감염에 한때 효과적이었다.[102] 아미노글리코사이드 저항성 메커니즘의 세 가지 주요 메커니즘은 현재 그리고 널리 받아들여지고 있다: 아미노글리코사이드 수정 효소, 리보솜 돌연변이, 박테리아에서 약물의 활성 유출이다.
아미노글리코사이드 수정 효소는 항생제의 아민이나 알코올 키 기능 그룹(또는 두 그룹 모두)에 인산염, 뉴클레오티드 또는 아세틸 모이티 중 하나를 공동으로 부착함으로써 아미노글리코사드를 비활성화시킨다. 이것은 전하를 변화시키거나 항생제를 강직하게 방해하여 항생제의 리보솜 결합 친화력을 감소시킨다. S. aureus에서 가장 잘 특징지어지는 아미노글리코사이드수정효소는 아미노글리코사이드 아데닐트랜스퍼레이제4' IA(ANT(4')이다.이 효소는 X선 결정학에 의해 해결되었다.[103] 이 효소는 카마마이신과 겐타미신을 포함한 많은 아미노글리코사이드의 4' 히드록실 그룹에 아데닐 모이티를 부착할 수 있다.
글리코펩타이드 저항은 바나 유전자의 획득에 의해 매개되는데, 이 유전자는 장내occi의 플라스미드에서 발견된 Tn1546 트랜스포존과 반코마이신이 결합하지 않는 대체 펩티도글리칸을 생성하는 효소의 코드에서 유래한다.[104]
오늘날, S. aureus는 일반적으로 사용되는 많은 항생제에 내성을 갖게 되었다. 영국에서는, S. aureus 고립된 전체 S. aureus의 2%만이 페니실린에 민감하며, 나머지 세계에서도 비슷한 그림을 가지고 있다. β-락타마제 내성 페니실린(메티실린, 옥사실린, 클로사실린, 플루클로사실린)은 페니실린 내성 S. 아우레우스 치료용으로 개발돼 지금도 1선 치료제로 사용되고 있다. 메티실린은 이 반에서 가장 먼저 사용된 항생제였으나(1959년 도입) 2년 만에 영국에서 메티실린 내성 포도상구균(MRSA) 환자가 처음 보고됐다.[105]
그럼에도 불구하고, MRSA는 병원 내 MRSA 유행이 폭발적으로 증가했던 1990년대까지 병원 환경에서도 일반적으로 흔치 않은 발견으로 남아 있었고, 현재는 풍토병이다.[106]
병원과 지역사회 환경 모두에서 MRSA 감염은 클린다마이신(린코사민)과 공동 트리모사졸(일반적으로 트리메토프림/술파메트호사졸로도 알려져 있음)과 같은 비β-락탐 항생제로 치료된다. 이러한 항생제에 대한 내성은 경구용 약물로 사용할 수 있기 때문에 라인졸리드 같은 새롭고 광범위한 그램 양성 항생제를 사용하게 되었다. MRSA에 의한 심각한 침습성 감염에 대한 1차 치료는 현재 글리코펩타이드 항생제(반코마이신, 티코플라닌)이다. 이러한 항생제에는 정맥 투여의 필요성(구강 준비는 제공되지 않음), 독성, 혈액 검사에 의한 약물 수치를 정기적으로 감시할 필요성 등 여러 가지 문제가 발생한다. 또한 글리코펩타이드 항생제는 감염된 조직에 잘 침투하지 않는다(뇌와 뇌막염의 감염과 심내막염의 특별한 우려 사항이다). 글리코펩타이드제는 메티실린에 민감한 S. aureus(MSSA)를 치료하는데 사용되어서는 안 된다. 결과가 열등하기 때문이다.[107]
페니실린에 대한 내성이 높고 판코마이신에 대한 내성이 MRSA의 잠재력 때문에 미국 질병통제예방센터는 밴코마이신의 적절한 사용에 대한 지침을 발표했다. MRSA 감염 발생률이 높은 것으로 알려진 상황에서 주치의는 감염 유기체의 정체가 알려질 때까지 글리코펩타이드 항생제를 사용할 수 있다. 메티실린에 의한 S. aureus의 감지된 변형률로 감염이 확인되면 치료법을 플루클로사실린이나 페니실린으로 적절하게 변경할 수 있다.
반코마이신 내성 S. 아우레우스(VRSA)는 글리코펩타이드에 내성이 생긴 S. 아우레우스 변종이다. 반코마이신 중간재 S. aureus (VISA)의 첫 사례는 1996년에 일본에서 보고되었지만,[108] S. aureus의 첫 번째 경우는 글리코펩타이드 항생제에 진정으로 저항하는 것으로 2002년에야 보고되었다.[109] 2005년 현재 미국에서 세 건의 VRSA 감염 사례가 보고되었다.[110] 적어도 부분적으로는 S. aureus의 항균 저항은 적응력으로 설명할 수 있다. 여러 가지 두 가지 성분 신호 전달 경로는 S. aureus가 항균 스트레스 하에서 생존하기 위해 필요한 유전자를 표현하는데 도움이 된다.[111]
마차
미국 인구의 약 33%가 S. aureus의 운송업자이고 약 2%가 MRSA를 소유하고 있다.[112] 심지어 의료 제공업체도 MRSA 식민지배자가[113][114] 될 수 있다.
S. aureus의 운반은 병원에서 얻은 감염의 중요한 원천이다(일명 무소코메탈이라고도 함)과 지역사회에서 획득한 MRSA. S. aureus는 숙주의 피부에 존재할 수 있지만, 그것의 마차의 상당 부분은 코의[2] 앞쪽 광맥을 통해 있고 더 나아가 귀에 존재할 수 있다.[115] S. aureus 항구에 대한 비강의 능력은 약해지거나 결함이 있는 숙주 면역력과 숙주 선천적 면역력을 회피하는 박테리아의 능력 조합에서 비롯된다.[116] 비강 마차는 또한 포도상구균 감염의 발생과 관련이 있다.[117]
감염관리
S. aureus (MRSA 포함)의 확산은 일반적으로 사람과 사람간의 접촉을 통해 이루어지지만,[118] 최근 일부 수의사들은 환경오염이 상대적으로 덜 중요한 역할을 한다고 생각하면서 감염이 애완동물을 통해 확산될 수 있다는 것을 발견했다.[119] 따라서 기본적인 손 씻기 기술을 강조하면 손 씻기의 전달을 막는 데 효과적이다. 직원이 일회용 에이프런과 장갑을 사용하면 피부 간 접촉이 줄어들기 때문에 전염 위험을 더욱 줄일 수 있다.
최근 미국 전역의 병원에서 수많은 S. aureus 사례가 보고되고 있다. 의료 종사자 위생이 부족한 의료 환경에서는 병원체 전달이 촉진된다. S. aureus는 폴리에스테르에서 겨우 3개월 동안 생존한 연구에서 보여지듯이 믿을 수 없을 정도로 강한 박테리아다;[120] 폴리에스테르는 병원 프라이버시 커튼에 사용되는 주요 물질이다.
이 박테리아는 건강관리 종사자들의 손으로 옮겨지는데, 이들은 건강해 보이는 환자로부터 S. aureus의 양성 또는 균등 변종을 운반한 후 치료를 받고 있는 다음 환자에게 옮길 수 있다. 이 박테리아가 혈류로 유입되면 심내막염, 뇌막염, 패혈증 등 다양한 합병증을 유발할 수 있다.
에탄올은 MRSA에 대항하는 효과적인 국소 살균제라는 것이 입증되었다. 4차 암모늄은 소독 작용의 지속시간을 증가시키기 위해 에탄올과 함께 사용될 수 있다. 병원균 감염의 예방은 정기적인 세척과 터미널 청소를 포함한다. CO
2 NAV-CO2 시스템의 불연성 알코올 증기는 의료 환경에서 사용되는 금속이나 플라스틱을 공격하지 않으며 항균 저항에도 기여하지 않는다는 장점이 있다.
지역사회와 연관된 MRSA의 식민지화 및 전염을 위한 중요하고 이전에 인식되지 않았던 수단은 성적인 접촉 중에 있다.[121]
S. aureus는 78°C에서 1분, 64°C에서 10분 이내에 죽지만 결빙에 강하다.[122][123]
S. aureus의 특정 변종은 염소 소독에[124][125] 내성이 있다고 설명되어 왔다.
무피로신 연고를 사용하면 S. 아우레우루스 비강 마비로 인한 감염률을 줄일 수 있다.[126] 항생제나 항균제를 사용하는 S. aureus의 비강 제독이 수술부위 감염률을 낮출 수 있다는 제한적인 증거가 있다.[127]
| 각 산업에서 가장 많이 사용되는 박테리아 | |
|---|---|
| 급식산업 | 비브리오 파라하임폴리티쿠스, S. 아우레우스, 바실러스 세레우스 |
| 의료산업 | 대장균, S. 아우레우스, 녹농균[128] |
리서치
2021년 현재 S. aureus에 대한 승인된 백신은 존재하지 않는다. 초기 임상시험은 나비의 스타프박스와 펜타스태프, 인터셀 / 머크의 V710, VRi의 SA75 등 여러 백신 후보자들을 대상으로 실시됐다.[129]
후보자들이 면역 반응을 보인 반면, 다른 후보자들은 S. aureus에 의한 감염을 악화시켰다. 현재까지 이 후보자들 중 어느 누구도 S. aureus 감염에 대한 보호를 제공하지 않는다. 나비의 스타프박스의 개발은 3단계 실험이 실패한 후 2005년에 중단되었다.[130] 인터셀의 첫 번째 V710 백신 변종은 S. aureus 감염에 걸린 환자들 사이에서 높은 사망률과 질병성이 관찰된 후 II/III 단계에서 종료되었다.[131]
나비의 강화된 S. aureus 백신 후보 PentaStapp은 2011년 GlaxoSmithKline Biologicals S.A.에 팔렸다.[132] 펜타스태프의 현재 상태는 불명확하다. WHO 문서는 PentaStapp이 3단계 시험 단계에서 실패했음을 나타낸다.[133]
2010년 GlaxoSmithKline은 GSK2392103A 백신을 평가하기 위해 1단계 블라인드 연구를 시작했다.[134] 2016년 현재 이 백신은 더 이상 개발이 활발하지 않다.[135]
화이저의 S. aureus 4 항원형 백신 SA4Ag는 2014년 2월 미국 식품의약국(FDA)으로부터 패스트트랙 지정을 받았다.[136] 2015년 화이저는 SA4Ag 백신과 관련한 2b 단계 시험을 시작했다.[137] 2017년 2월에 발표된 1단계 결과는 SA4Ag의 매우 강력하고 안전한 면역유전성을 보여주었다.[138] 백신은 2019년 6월까지 임상시험을 거쳤으며, 수술 후 혈류감염의 현저한 감소를 보여주지 못한 결과가 2020년 9월에 발표되었다.[139]
노바티스의 전 부서로 지금은 글락소스미스클라인에 속해 있는 노바티스 백신과 진단은 2015년 4가지 성분인 포도상구균 백신인 4C-stap의 임상 전 결과를 발표했다.[140]
2020년에는 미리아 필로사 잎에서 수력분해로 추출한 에센셜 오일이 다항성 포도상구균 아우레우스 변종에 의한 감염을 억제하는 항균제로서 잠재력이 있는 것으로 밝혀졌다.[141]
표준균주
S. aureus ("유형 배양"이라고 불리는)의 많은 표준 변종은 연구와 실험실 테스트에 사용된다.
| 이름 | NCTC | ATCC | 예치년 | 댓글 |
|---|---|---|---|---|
| 옥스퍼드 H | 6571 | 9144 | 1943 | 페니실린 효력 테스트에 사용된 표준 변형률로, 페니실린 단위가 원래 정의되었다.[142][143] |
| 로젠바흐 | 12973 | 29213 | 1884 | EUCAST 항균 저항성 테스트를 위한 표준 변형률.[144] |
참조
- ^ Masalha M, Borovok I, Schreiber R, Aharonowitz Y, Cohen G (December 2001). "Analysis of transcription of the Staphylococcus aureus aerobic class Ib and anaerobic class III ribonucleotide reductase genes in response to oxygen". Journal of Bacteriology. 183 (24): 7260–72. doi:10.1128/JB.183.24.7260-7272.2001. PMC 95576. PMID 11717286.
- ^ a b c Kluytmans J, van Belkum A, Verbrugh H (July 1997). "Nasal carriage of Staphylococcus aureus: epidemiology, underlying mechanisms, and associated risks". Clinical Microbiology Reviews. 10 (3): 505–20. doi:10.1128/CMR.10.3.505. PMC 172932. PMID 9227864.
- ^ a b c d e f g h i Tong SY, Davis JS, Eichenberger E, Holland TL, Fowler VG (July 2015). "Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management". Clinical Microbiology Reviews. 28 (3): 603–61. doi:10.1128/CMR.00134-14. PMC 4451395. PMID 26016486.
- ^ Cole AM, Tahk S, Oren A, Yoshioka D, Kim YH, Park A, Ganz T (November 2001). "Determinants of Staphylococcus aureus nasal carriage". Clinical and Diagnostic Laboratory Immunology. 8 (6): 1064–9. doi:10.1128/CDLI.8.6.1064-1069.2001. PMC 96227. PMID 11687441.
- ^ Senok AC, Verstraelen H, Temmerman M, Botta GA (October 2009). "Probiotics for the treatment of bacterial vaginosis". The Cochrane Database of Systematic Reviews (4): CD006289. doi:10.1002/14651858.CD006289.pub2. PMID 19821358.
- ^ Hoffman B (2012). Williams gynecology (2nd ed.). New York: McGraw-Hill Medical. p. 65. ISBN 978-0071716727.
- ^ a b "Staphylococcal Infections". MedlinePlus [Internet]. Bethesda, MD: National Library of Medicine, USA.
Skin infections are the most common. They can look like pimples or boils.
- ^ Bowersox J (27 May 1999). "Experimental Staph Vaccine Broadly Protective in Animal Studies". NIH. Archived from the original on 5 May 2007. Retrieved 28 July 2007.
- ^ a b Schlecht LM, Peters BM, Krom BP, Freiberg JA, Hänsch GM, Filler SG, Jabra-Rizk MA, Shirtliff ME (January 2015). "Systemic Staphylococcus aureus infection mediated by Candida albicans hyphal invasion of mucosal tissue". Microbiology. 161 (Pt 1): 168–181. doi:10.1099/mic.0.083485-0. PMC 4274785. PMID 25332378.
- ^ Orent W (2006). "A Brief History of Staph". Proto Magazine.
- ^ Fitzgerald JR, Sturdevant DE, Mackie SM, Gill SR, Musser JM (2001). "Evolutionary genomics of Staphylococcus aureus: insights into the origin of methicillin resistant strains and the toxic shock syndrome epidemic". Proceedings of the National Academy of Sciences. 98 (15): 8821–8826. Bibcode:2001PNAS...98.8821F. doi:10.1073/pnas.161098098. PMC 37519. PMID 11447287.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ a b Lindsay JA (2010). "Genomic variation and evolution of Staphylococcus aureus". International Journal of Medical Microbiology. 300 (2–3): 98–103. doi:10.1016/j.ijmm.2009.08.013. PMID 19811948.
- ^ Fitzgerald JR (2014). "Evolution of Staphylococcus aureus during human colonization and infection". Infection, Genetics and Evolution. 21: 542–547. doi:10.1016/j.meegid.2013.04.020. PMID 23624187.
- ^ Van B, Melles D, Nouwen J, Van L, Van W, Vos M, Verbrugh H (2009). "Co-evolutionary aspects of human colonisation and infection by Staphylococcus aureus". Infection, Genetics and Evolution. 9 (1): 32–47. doi:10.1016/j.meegid.2008.09.012. PMID 19000784.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ "Staphylococcus". Dictionary.com Unabridged. Random House. "aureus". Dictionary.com Unabridged. Random House.
- ^ "staphylococcus – definition of staphylococcus in English from the Oxford dictionary". OxfordDictionaries.com. Retrieved 20 January 2016. "aureus – definition of aureus in English from the Oxford dictionary". OxfordDictionaries.com. Retrieved 20 January 2016.
- ^ "병원성 안전 데이터 시트 - 감염 물질." 포도상구균 세포의 직경은 0.7–1.2 um이다. 포도상구균 아우레우스 캐나다 보건국, 2011. 웹
- ^ "Canadian Centre for Occupational Health and Safety". Retrieved 8 April 2016.
- ^ a b Ryan KJ, Ray CG, eds. (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. ISBN 978-0-8385-8529-0.
- ^ Varrone JJ, de Mesy Bentley KL, Bello-Irizarry SN, Nishitani K, Mack S, Hunter JG, Kates SL, Daiss JL, Schwarz EM (October 2014). "Passive immunization with anti-glucosaminidase monoclonal antibodies protects mice from implant-associated osteomyelitis by mediating opsonophagocytosis of Staphylococcus aureus megaclusters". Journal of Orthopaedic Research. 32 (10): 1389–96. doi:10.1002/jor.22672. PMC 4234088. PMID 24992290.
- ^ 프리테스트, 외과, 12번지, 페이지 88
- ^ Matthews KR, Roberson J, Gillespie BE, Luther DA, Oliver SP (1997). "Identification and Differentiation of Coagulase-Negative Staphylococcus aureus by Polymerase Chain Reaction". Journal of Food Protection. 60 (6): 686–8. doi:10.4315/0362-028X-60.6.686. PMID 31195568.
- ^ Morikawa K, Takemura AJ, Inose Y, Tsai M, Nguyen T, Ohta T, Msadek T (2012). "Expression of a cryptic secondary sigma factor gene unveils natural competence for DNA transformation in Staphylococcus aureus". PLOS Pathogens. 8 (11): e1003003. doi:10.1371/journal.ppat.1003003. PMC 3486894. PMID 23133387.
- ^ Fagerlund A, Granum PE, Håvarstein LS (November 2014). "Staphylococcus aureus competence genes: mapping of the SigH, ComK1 and ComK2 regulons by transcriptome sequencing". Molecular Microbiology. 94 (3): 557–79. doi:10.1111/mmi.12767. PMID 25155269. S2CID 1568023.
- ^ a b Schenck LP, Surette MG, Bowdish DM (November 2016). "Composition and immunological significance of the upper respiratory tract microbiota". FEBS Letters. 590 (21): 3705–3720. doi:10.1002/1873-3468.12455. PMC 7164007. PMID 27730630.
- ^ Wollina U (2017). "Microbiome in atopic dermatitis". Clinical, Cosmetic and Investigational Dermatology. 10: 51–56. doi:10.2147/CCID.S130013. PMC 5327846. PMID 28260936.
- ^ Otto M (April 2010). "Staphylococcus colonization of the skin and antimicrobial peptides". Expert Review of Dermatology. 5 (2): 183–195. doi:10.1586/edm.10.6. PMC 2867359. PMID 20473345.
- ^ Kuehnert MJ, Hill HA, Kupronis BA, Tokars JI, Solomon SL, Jernigan DB (June 2005). "Methicillin-resistant-Staphylococcus aureus hospitalizations, United States". Emerging Infectious Diseases. 11 (6): 868–72. doi:10.3201/eid1106.040831. PMC 3367609. PMID 15963281.
- ^ Kavanaugh JS, Horswill AR (June 2016). "Impact of Environmental Cues on Staphylococcal Quorum Sensing and Biofilm Development". The Journal of Biological Chemistry (Review). 291 (24): 12556–64. doi:10.1074/jbc.R116.722710. PMC 4933443. PMID 27129223.
- ^ "Staphylococcus aureus in Healthcare Settings HAI CDC". www.cdc.gov. Retrieved 19 April 2017.
- ^ Curran JP, Al-Salihi FL (August 1980). "Neonatal staphylococcal scalded skin syndrome: massive outbreak due to an unusual phage type". Pediatrics. 66 (2): 285–90. PMID 6447271.
- ^ American Academy of Dermatology (February 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American Academy of Dermatology, retrieved 5 December 2013
- ^ George SM, Karanovic S, Harrison DA, Rani A, Birnie AJ, Bath-Hextall FJ, et al. (October 2019). "Interventions to reduce Staphylococcus aureus in the management of eczema". The Cochrane Database of Systematic Reviews. 2019 (10). doi:10.1002/14651858.CD003871.pub3. PMC 6818407. PMID 31684694.
- ^ Hon KL, Wang SS, Lee KK, Lee VW, Leung TF, Ip M (July 2012). "Combined antibiotic/corticosteroid cream in the empirical treatment of moderate to severe eczema: friend or foe?". Journal of Drugs in Dermatology. 11 (7): 861–4. PMID 22777230.
- ^ Kobayashi T, Glatz M, Horiuchi K, Kawasaki H, Akiyama H, Kaplan DH, et al. (April 2015). "Dysbiosis and Staphylococcus aureus Colonization Drives Inflammation in Atopic Dermatitis". Immunity. 42 (4): 756–66. doi:10.1016/j.immuni.2015.03.014. PMC 4407815. PMID 25902485.
- ^ Nakatsuji T, Chen TH, Two AM, Chun KA, Narala S, Geha RS, et al. (November 2016). "Staphylococcus aureus Exploits Epidermal Barrier Defects in Atopic Dermatitis to Trigger Cytokine Expression". The Journal of Investigative Dermatology. 136 (11): 2192–2200. doi:10.1016/j.jid.2016.05.127. PMC 5103312. PMID 27381887.
- ^ "Staphylococcal Food Poisoning". cdc.gov. hhs.gov. 4 October 2016. Retrieved 23 October 2016.
- ^ "스타필로코쿠스." Foodsafety.gov, 미국 보건 및 휴먼 서비스 부서, https://www.foodsafety.gov/poisoning/causes/bacteriaviruses/staphylococcus/.
- ^ "스타필로코칼 식중독." 2016년 10월 4일 질병관리본부 식품안전센터 https://www.cdc.gov/foodsafety/diseases/staphylococcal.html
- ^ Woodson J. "Centers for disease control and prevention". Food Safety. Archived from the original on 8 February 2016. Retrieved 24 October 2017.
- ^ a b c d Rasmussen RV, Fowler VG, Skov R, Bruun NE (January 2011). "Future challenges and treatment of Staphylococcus aureus bacteremia with emphasis on MRSA". Future Microbiology. 6 (1): 43–56. doi:10.2217/fmb.10.155. PMC 3031962. PMID 21162635.
- ^ Latha T, Anil B, Manjunatha H, Chiranjay M, Elsa D, Baby N, Anice G. MRSA: 남인도 3차 진료 병원의 정형외과적 감염의 선도적인 병원체. 아프리카 보건 과학. 2019년 4월 16일;19(1):1393-401.
- ^ Zago CE, Silva S, Sanitá PV, Barbugli PA, Dias CM, Lordello VB, Vergani CE (2015). "Dynamics of biofilm formation and the interaction between Candida albicans and methicillin-susceptible (MSSA) and -resistant Staphylococcus aureus (MRSA)". PLOS ONE. 10 (4): e0123206. Bibcode:2015PLoSO..1023206Z. doi:10.1371/journal.pone.0123206. PMC 4395328. PMID 25875834.
- ^ a b Nandakumar V, Chittaranjan S, Kurian VM, Doble M (2013). "Characteristics of bacterial biofilm associated with implant material in clinical practice". Polymer Journal. 45 (2): 137–152. doi:10.1038/pj.2012.130.
- ^ a b c d e f g Archer NK, Mazaitis MJ, Costerton JW, Leid JG, Powers ME, Shirtliff ME (1 September 2011). "Staphylococcus aureus biofilms: properties, regulation, and roles in human disease". Virulence. 2 (5): 445–59. doi:10.4161/viru.2.5.17724. PMC 3322633. PMID 21921685.
- ^ Chung PY, Toh YS (April 2014). "Anti-biofilm agents: recent breakthrough against multi-drug resistant Staphylococcus aureus". Pathogens and Disease. 70 (3): 231–9. doi:10.1111/2049-632x.12141. PMID 24453168.
- ^ Hogan S, Zapotoczna M, Stevens NT, Humphreys H, O'Gara JP, O'Neill E (June 2017). "Potential use of targeted enzymatic agents in the treatment of Staphylococcus aureus biofilm-related infections". The Journal of Hospital Infection. 96 (2): 177–182. doi:10.1016/j.jhin.2017.02.008. PMID 28351512.
- ^ a b Boost MV, O'Donoghue MM, James A (July 2008). "Prevalence of Staphylococcus aureus carriage among dogs and their owners". Epidemiology and Infection. 136 (7): 953–64. doi:10.1017/S0950268807009326. PMC 2870875. PMID 17678561.
- ^ Hanselman BA, Kruth SA, Rousseau J, Weese JS (September 2009). "Coagulase positive staphylococcal colonization of humans and their household pets". The Canadian Veterinary Journal. 50 (9): 954–8. PMC 2726022. PMID 19949556.
- ^ Burton S, Reid-Smith R, McClure JT, Weese JS (August 2008). "Staphylococcus aureus colonization in healthy horses in Atlantic Canada". The Canadian Veterinary Journal. 49 (8): 797–9. PMC 2465786. PMID 18978975.
- ^ "Staphylococcosis, Staphylococcal Arthritis, Bumble Foot". The Poultry Site. Retrieved 22 October 2013.
- ^ Boost MV, O'Donoghue MM, James A (2008). "Prevalence of Staphylococcus aureus carriage among dogs and their owners". Epidemiology and Infection. 136 (7): 953–64. doi:10.1017/s0950268807009326. hdl:10397/7558. PMC 2870875. PMID 17678561.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Cenci-Goga BT, Karama M, Rossitto PV, Morgante RA, Cullor JS (September 2003). "Enterotoxin production by Staphylococcus aureus isolated from mastitic cows". Journal of Food Protection. 66 (9): 1693–6. doi:10.4315/0362-028X-66.9.1693. PMID 14503727.
- ^ Berends, Evelien T. M.; Horswill, Alexander R.; Haste, Nina M.; Monestier, Marc; Nizet, Victor; Köckritz-Blickwede, Maren von (2010). "Nuclease Expression by Staphylococcus aureus Facilitates Escape from Neutrophil Extracellular Traps". Journal of Innate Immunity. 2 (6): 576–586. doi:10.1159/000319909. ISSN 1662-811X. PMC 2982853. PMID 20829609.
- ^ Monteith, Andrew J.; Miller, Jeanette M.; Maxwell, C. Noel; Chazin, Walter J.; Skaar, Eric P. (September 2021). "Neutrophil extracellular traps enhance macrophage killing of bacterial pathogens". Science Advances. 7 (37): eabj2101. doi:10.1126/sciadv.abj2101. PMID 34516771.
- ^ 열대국가 의료실험실 매뉴얼 제2권
- ^ Dinges MM, Orwin PM, Schlievert PM (January 2000). "Exotoxins of Staphylococcus aureus". Clinical Microbiology Reviews. 13 (1): 16–34, table of contents. doi:10.1128/cmr.13.1.16. PMC 88931. PMID 10627489.
- ^ Etter, Danai; Schelin, Jenny; Schuppler, Markus; Johler, Sophia (10 September 2020). "Staphylococcal Enterotoxin C—An Update on SEC Variants, Their Structure and Properties, and Their Role in Foodborne Intoxications". Toxins. 12 (9): 584. doi:10.3390/toxins12090584. PMC 7551944. PMID 32927913.
- ^ Jarraud S, Peyrat MA, Lim A, Tristan A, Bes M, Mougel C, Etienne J, Vandenesch F, Bonneville M, Lina G (January 2001). "egc, a highly prevalent operon of enterotoxin gene, forms a putative nursery of superantigens in Staphylococcus aureus". Journal of Immunology. 166 (1): 669–77. doi:10.4049/jimmunol.166.1.669. PMID 11123352.
- ^ a b Becker K, Friedrich AW, Lubritz G, Weilert M, Peters G, Von Eiff C (April 2003). "Prevalence of genes encoding pyrogenic toxin superantigens and exfoliative toxins among strains of Staphylococcus aureus isolated from blood and nasal specimens". Journal of Clinical Microbiology. 41 (4): 1434–9. doi:10.1128/jcm.41.4.1434-1439.2003. PMC 153929. PMID 12682126.
- ^ Lina G, Piémont Y, Godail-Gamot F, Bes M, Peter MO, Gauduchon V, Vandenesch F, Etienne J (November 1999). "Involvement of Panton-Valentine leukocidin-producing Staphylococcus aureus in primary skin infections and pneumonia". Clinical Infectious Diseases. 29 (5): 1128–32. doi:10.1086/313461. PMID 10524952.
- ^ Gillet YIssartel B, Vanhems P, Fournet JC, 리나 G, 꼬리가 있고 M, Vandenesch F, 피에몽, Y, 브후쓰 N, Floret D, 에티엔 J(2002년 3월)."협회 황색 포도알균 변종들 사이의 젊은 면역 능력이 있는. 환자들에Panton-Valentine 백혈구 파괴소고 매우 치명적인necrotising 폐렴의 유전자를 가지고 있는".Lancet.359(9308):753–9. doi:10.1016(02)07877-7. PMID 11888586.S2CID 20400336.PDFArchived 14로 7월 2014년은 승객을 머신에.
- ^ Kim S, Reyes D, Beaume M, Francois P, Cheung A (2014). "Contribution of teg49 small RNA in the 5' upstream transcriptional region of sarA to virulence in Staphylococcus aureus". Infection and Immunity. 82 (10): 4369–4379. doi:10.1128/iai.02002-14. PMC 4187880. PMID 25092913.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Chevalier C, Boisset S, Romilly C, Masquida B, Fechter P, Geissmann T, Vandenesch F, Romby P (March 2010). "Staphylococcus aureus RNAIII binds to two distant regions of coa mRNA to arrest translation and promote mRNA degradation". PLOS Pathogens. 6 (3): e1000809. doi:10.1371/journal.ppat.1000809. PMC 2837412. PMID 20300607.
- ^ Chabelskaya S, Gaillot O, Felden B (June 2010). "A Staphylococcus aureus small RNA is required for bacterial virulence and regulates the expression of an immune-evasion molecule". PLOS Pathogens. 6 (6): e1000927. doi:10.1371/journal.ppat.1000927. PMC 2880579. PMID 20532214.
- ^ Le Pabic H, Germain-Amiot N, Bordeau V, Felden B (October 2015). "A bacterial regulatory RNA attenuates virulence, spread and human host cell phagocytosis". Nucleic Acids Research. 43 (19): 9232–48. doi:10.1093/nar/gkv783. PMC 4627067. PMID 26240382.
- ^ Mauro T, Rouillon A, Felden B (December 2016). "Insights into the regulation of small RNA expression: SarA represses the expression of two sRNAs in Staphylococcus aureus". Nucleic Acids Research. 44 (21): 10186–10200. doi:10.1093/nar/gkw777. PMC 5137438. PMID 27596601.
- ^ Bohn C, Rigoulay C, Chabelskaya S, Sharma CM, Marchais A, Skorski P, Borezée-Durant E, Barbet R, Jacquet E, Jacq A, Gautheret D, Felden B, Vogel J, Bouloc P (October 2010). "Experimental discovery of small RNAs in Staphylococcus aureus reveals a riboregulator of central metabolism". Nucleic Acids Research. 38 (19): 6620–36. doi:10.1093/nar/gkq462. PMC 2965222. PMID 20511587.
- ^ Sayed N, Jousselin A, Felden B (December 2011). "A cis-antisense RNA acts in trans in Staphylococcus aureus to control translation of a human cytolytic peptide" (PDF). Nature Structural & Molecular Biology. 19 (1): 105–12. doi:10.1038/nsmb.2193. PMID 22198463. S2CID 8217681.
- ^ Morrison JM, Miller EW, Benson MA, Alonzo F, Yoong P, Torres VJ, Hinrichs SH, Dunman PM (June 2012). "Characterization of SSR42, a novel virulence factor regulatory RNA that contributes to the pathogenesis of a Staphylococcus aureus USA300 representative". Journal of Bacteriology. 194 (11): 2924–38. doi:10.1128/JB.06708-11. PMC 3370614. PMID 22493015.
- ^ Xue T, Zhang X, Sun H, Sun B (February 2014). "ArtR, a novel sRNA of Staphylococcus aureus, regulates α-toxin expression by targeting the 5' UTR of sarT mRNA". Medical Microbiology and Immunology. 203 (1): 1–12. doi:10.1007/s00430-013-0307-0. PMID 23955428. S2CID 18371872.
- ^ Kim S, Reyes D, Beaume M, Francois P, Cheung A (October 2014). "Contribution of teg49 small RNA in the 5' upstream transcriptional region of sarA to virulence in Staphylococcus aureus". Infection and Immunity. 82 (10): 4369–79. doi:10.1128/IAI.02002-14. PMC 4187880. PMID 25092913.
- ^ a b Ruiz de los Mozos I, Vergara-Irigaray M, Segura V, Villanueva M, Bitarte N, Saramago M, Domingues S, Arraiano CM, Fechter P, Romby P, Valle J, Solano C, Lasa I, Toledo-Arana A (2013). "Base pairing interaction between 5'- and 3'-UTRs controls icaR mRNA translation in Staphylococcus aureus". PLOS Genetics. 9 (12): e1004001. doi:10.1371/journal.pgen.1004001. PMC 3868564. PMID 24367275.
- ^ Arciola CR, Campoccia D, Speziale P, Montanaro L, Costerton JW (September 2012). "Biofilm formation in Staphylococcus implant infections. A review of molecular mechanisms and implications for biofilm-resistant materials". Biomaterials. 33 (26): 5967–82. doi:10.1016/j.biomaterials.2012.05.031. PMID 22695065.
- ^ a b 비드야사가르, A. (2016) 바이오필름이란 무엇인가? 라이브 사이언스.
- ^ de la Fuente-Núñez C, Reffuveille F, Fernández L, Hancock RE (October 2013). "Bacterial biofilm development as a multicellular adaptation: antibiotic resistance and new therapeutic strategies". Current Opinion in Microbiology. 16 (5): 580–9. doi:10.1016/j.mib.2013.06.013. PMID 23880136.
- ^ McLaughlin RA, Hoogewerf AJ (August 2006). "Interleukin-1beta-induced growth enhancement of Staphylococcus aureus occurs in biofilm but not planktonic cultures". Microbial Pathogenesis. 41 (2–3): 67–79. doi:10.1016/j.micpath.2006.04.005. PMID 16769197.
- ^ Nassar, Rania; Hachim, Mahmood; Nassar, Mohannad; Kaklamanos, Eleftherios G.; Jamal, Mohamed; Williams, David; Senok, Abiola (2021). "Microbial Metabolic Genes Crucial for S. aureus Biofilms: An Insight From Re-analysis of Publicly Available Microarray Datasets". Frontiers in Microbiology. 11: 607002. doi:10.3389/fmicb.2020.607002. ISSN 1664-302X. PMC 7876462. PMID 33584569.
- ^ Schneewind O, Fowler A, Faull KF (April 1995). "Structure of the cell wall anchor of surface proteins in Staphylococcus aureus". Science. 268 (5207): 103–6. Bibcode:1995Sci...268..103S. doi:10.1126/science.7701329. PMID 7701329.
- ^ Patel AH, Nowlan P, Weavers ED, Foster T (December 1987). "Virulence of protein A-deficient and alpha-toxin-deficient mutants of Staphylococcus aureus isolated by allele replacement". Infection and Immunity. 55 (12): 3103–10. doi:10.1128/IAI.55.12.3103-3110.1987. PMC 260034. PMID 3679545.
- ^ Zhu J, Lu C, Standland M, Lai E, Moreno GN, Umeda A, Jia X, Zhang Z (February 2008). "Single mutation on the surface of Staphylococcus aureus Sortase A can disrupt its dimerization". Biochemistry. 47 (6): 1667–74. doi:10.1021/bi7014597. PMID 18193895.
- ^ a b Clauditz A, Resch A, Wieland KP, Peschel A, Götz F (August 2006). "Staphyloxanthin plays a role in the fitness of Staphylococcus aureus and its ability to cope with oxidative stress". Infection and Immunity. 74 (8): 4950–3. doi:10.1128/IAI.00204-06. PMC 1539600. PMID 16861688.
- ^ a b Liu GY, Essex A, Buchanan JT, Datta V, Hoffman HM, Bastian JF, Fierer J, Nizet V (July 2005). "Staphylococcus aureus golden pigment impairs neutrophil killing and promotes virulence through its antioxidant activity". The Journal of Experimental Medicine. 202 (2): 209–15. doi:10.1084/jem.20050846. PMC 2213009. PMID 16009720.
- ^ Liu CI, Liu GY, Song Y, Yin F, Hensler ME, Jeng WY, Nizet V, Wang AH, Oldfield E (March 2008). "A cholesterol biosynthesis inhibitor blocks Staphylococcus aureus virulence". Science. 319 (5868): 1391–4. Bibcode:2008Sci...319.1391L. doi:10.1126/science.1153018. PMC 2747771. PMID 18276850.
- ^ Shields, Patricia; Tsang, Anne Y. (9 October 2006). "Mannitol Salt Agar Plates Protocols". www.asmscience.org. Retrieved 31 December 2020.
- ^ "Mannitol Salt Agar (MSA) Culture Media". Microbe Notes. 14 January 2020. Retrieved 31 December 2020.
- ^ SAINT-MARTIN, M.; CHAREST, G.; DESRANLEAU, J. M. (1951). "Bacteriophage Typing in Investigations of Staphylococcal Food-Poisoning Outbreaks". Canadian Journal of Public Health. 42 (9): 351–358. ISSN 0008-4263. JSTOR 41980177. PMID 14879282.
- ^ Krause L (8 July 2017). "Staphylococcus Aureus food poisoning". healthline. Retrieved 24 October 2017.
- ^ Francois P, Schrenzel J (2008). "Rapid Diagnosis and Typing of Staphylococcus aureus". Staphylococcus: Molecular Genetics. Caister Academic Press. ISBN 978-1-904455-29-5.
- ^ Mackay IM, ed. (2007). Real-Time PCR in Microbiology: From Diagnosis to Characterization. Caister Academic Press. ISBN 978-1-904455-18-9.
- ^ a b c Deurenberg RH, Stobberingh EE (December 2008). "The evolution of Staphylococcus aureus". Infection, Genetics and Evolution. 8 (6): 747–63. doi:10.1016/j.meegid.2008.07.007. PMID 18718557.
- ^ Aires de Sousa M, Conceição T, Simas C, de Lencastre H (October 2005). "Comparison of genetic backgrounds of methicillin-resistant and -susceptible Staphylococcus aureus isolates from Portuguese hospitals and the community". Journal of Clinical Microbiology. 43 (10): 5150–7. doi:10.1128/JCM.43.10.5150-5157.2005. PMC 1248511. PMID 16207977.
- ^ a b c Kim J (2009). "Understanding the Evolution of Methicillin-Resistant Staphylococcus aureus". Clinical Microbiology Newsletter. 31 (3): 17–23. doi:10.1016/j.clinmicnews.2009.01.002.
- ^ Korzeniowski O, Sande MA (October 1982). "Combination antimicrobial therapy for Staphylococcus aureus endocarditis in patients addicted to parenteral drugs and in nonaddicts: A prospective study". Annals of Internal Medicine. 97 (4): 496–503. doi:10.7326/0003-4819-97-4-496. PMID 6751182.
- ^ Bayer AS, Bolger AF, Taubert KA, Wilson W, Steckelberg J, Karchmer AW, Levison M, Chambers HF, Dajani AS, Gewitz MH, Newburger JW, Gerber MA, Shulman ST, Pallasch TJ, Gage TW, Ferrieri P (1998). "Diagnosis and management of infective endocarditis and its complications". Circulation. 98 (25): 2936–48. doi:10.1161/01.CIR.98.25.2936. PMID 9860802.
- ^ Cosgrove SE, Vigliani GA, Fowler VG, Abrutyn E, Corey GR, Levine DP, Rupp ME, Chambers HF, Karchmer AW, Boucher HW (March 2009). "Initial low-dose gentamicin for Staphylococcus aureus bacteremia and endocarditis is nephrotoxic". Clinical Infectious Diseases. 48 (6): 713–21. doi:10.1086/597031. PMID 19207079.
- ^ Thwaites GE, Scarborough M, Szubert A, Nsutebu E, Tilley R, Greig J, Wyllie SA, Wilson P, Auckland C, Cairns J, Ward D, Lal P, Guleri A, Jenkins N, Sutton J, Wiselka M, Armando GR, Graham C, Chadwick PR, Barlow G, Gordon NC, Young B, Meisner S, McWhinney P, Price DA, Harvey D, Nayar D, Jeyaratnam D, Planche T, Minton J, Hudson F, Hopkins S, Williams J, Török ME, Llewelyn MJ, Edgeworth JD, Walker AS (February 2018). "Adjunctive rifampicin for Staphylococcus aureus bacteraemia (ARREST): a multicentre, randomised, double-blind, placebo-controlled trial". Lancet. 391 (10121): 668–678. doi:10.1016/S0140-6736(17)32456-X. PMC 5820409. PMID 29249276.
- ^ Chambers HF (2001). "The changing epidemiology of Staphylococcus aureus?". Emerging Infectious Diseases. 7 (2): 178–82. doi:10.3201/eid0702.010204. PMC 2631711. PMID 11294701.
- ^ Bonomo RA, Van Zile PS, Li Q, Shermock KM, McCormick WG, Kohut B (October 2007). "Topical triple-antibiotic ointment as a novel therapeutic choice in wound management and infection prevention: a practical perspective". Expert Review of Anti-Infective Therapy. 5 (5): 773–82. doi:10.1586/14787210.5.5.773. PMID 17914912. S2CID 31594289.
- ^ Jamrozy D, Coll F, Mather AE, Harris SR, Harrison EM, MacGowan A, et al. (September 2017). "Evolution of mobile genetic element composition in an epidemic methicillin-resistant Staphylococcus aureus: temporal changes correlated with frequent loss and gain events". BMC Genomics. 18 (1): 684. doi:10.1186/s12864-017-4065-z. PMC 5584012. PMID 28870171.
- ^ Pozzi C, Waters EM, Rudkin JK, Schaeffer CR, Lohan AJ, Tong P, et al. (5 April 2012). Sullam PM (ed.). "Methicillin resistance alters the biofilm phenotype and attenuates virulence in Staphylococcus aureus device-associated infections". PLOS Pathogens. 8 (4): e1002626. doi:10.1371/journal.ppat.1002626. PMC 3320603. PMID 22496652.
- ^ Carter AP, Clemons WM, Brodersen DE, Morgan-Warren RJ, Wimberly BT, Ramakrishnan V (September 2000). "Functional insights from the structure of the 30S ribosomal subunit and its interactions with antibiotics". Nature. 407 (6802): 340–8. Bibcode:2000Natur.407..340C. doi:10.1038/35030019. PMID 11014183. S2CID 4408938.
- ^ Sakon J, Liao HH, Kanikula AM, Benning MM, Rayment I, Holden HM (November 1993). "Molecular structure of kanamycin nucleotidyltransferase determined to 3.0-A resolution". Biochemistry. 32 (45): 11977–84. doi:10.1021/bi00096a006. PMID 8218273.
- ^ Arthur M, Courvalin P (August 1993). "Genetics and mechanisms of glycopeptide resistance in enterococci". Antimicrobial Agents and Chemotherapy. ASM. 37 (8): 1563–71. doi:10.1128/AAC.37.8.1563. PMC 188020. PMID 8215264.
- ^ Jevons MP (1961). "Celbenin-resistant staphylococci". BMJ. 1 (5219): 124–5. doi:10.1136/bmj.1.5219.124-a. PMC 1952878.
- ^ Johnson AP, Aucken HM, Cavendish S, Ganner M, Wale MC, Warner M, Livermore DM, Cookson BD (July 2001). "Dominance of EMRSA-15 and −16 among MRSA causing nosocomial bacteraemia in the UK: analysis of isolates from the European Antimicrobial Resistance Surveillance System (EARSS)". The Journal of Antimicrobial Chemotherapy. 48 (1): 143–4. doi:10.1093/jac/48.1.143. PMID 11418528.
- ^ [필요하다]Blot SI, Vandewoude KH, Hoste EA, Colardyn FA (October 2002). "Outcome and attributable mortality in critically Ill patients with bacteremia involving methicillin-susceptible and methicillin-resistant Staphylococcus aureus". Archives of Internal Medicine. 162 (19): 2229–35. doi:10.1001/archinte.162.19.2229. PMID 12390067.
- ^ Hiramatsu K, Hanaki H, Ino T, Yabuta K, Oguri T, Tenover FC (July 1997). "Methicillin-resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility". The Journal of Antimicrobial Chemotherapy. 40 (1): 135–6. doi:10.1093/jac/40.1.135. PMID 9249217.
- ^ Chang S, Sievert DM, Hageman JC, Boulton ML, Tenover FC, Downes FP, Shah S, Rudrik JT, Pupp GR, Brown WJ, Cardo D, Fridkin SK (April 2003). "Infection with vancomycin-resistant Staphylococcus aureus containing the vanA resistance gene". The New England Journal of Medicine. 348 (14): 1342–7. doi:10.1056/NEJMoa025025. PMID 12672861.
- ^ Menichetti F (May 2005). "Current and emerging serious Gram-positive infections". Clinical Microbiology and Infection. 11 Suppl 3 (Suppl 3): 22–8. doi:10.1111/j.1469-0691.2005.01138.x. PMID 15811021.
- ^ Sengupta M, Jain V, Wilkinson BJ, Jayaswal RK (June 2012). "Chromatin immunoprecipitation identifies genes under direct VraSR regulation in Staphylococcus aureus". Canadian Journal of Microbiology. 58 (6): 703–8. doi:10.1139/w2012-043. PMID 22571705.
- ^ "General Information: Community acquired MRSA". CDC. 25 March 2016.
- ^ 라타 T, 아니일 바트, 만주나타 한데, 시란제이 무코파디데이, 엘사 사나톰비 데비, 베이비 나약. 3차 진료 병원의 건강 관리 전문가들 사이에서 메티실린 내성 포도상구균이 운반된다. Asian J Pharmetic Crinal Res. 2018;11(3):346-9.
- ^ Mello DD, Latha T, Alva J, Barnini Barnarjee VK. 메티실린 내성 포도상구균 아우레우스(MRSA) 감염: 의료전문 의료진의 지식, 예방 관행 및 식민지화. 인도 공중 보건 연구 개발 저널. 2019년 12월 10일(12):587-91.
- ^ Campos A, Arias A, Betancor L, Rodríguez C, Hernández AM, López Aguado D, Sierra A (July 1998). "Study of common aerobic flora of human cerumen". The Journal of Laryngology and Otology. 112 (7): 613–6. doi:10.1017/s002221510014126x. PMID 9775288.
- ^ Quinn GA, Cole AM (September 2007). "Suppression of innate immunity by a nasal carriage strain of Staphylococcus aureus increases its colonization on nasal epithelium". Immunology. 122 (1): 80–9. doi:10.1111/j.1365-2567.2007.02615.x. PMC 2265977. PMID 17472720.
- ^ Wertheim HF, Melles DC, Vos MC, van Leeuwen W, van Belkum A, Verbrugh HA, Nouwen JL (December 2005). "The role of nasal carriage in Staphylococcus aureus infections". The Lancet. Infectious Diseases. 5 (12): 751–62. doi:10.1016/S1473-3099(05)70295-4. PMID 16310147.
- ^ Sing A, Tuschak C, Hörmansdorfer S (March 2008). "Methicillin-resistant Staphylococcus aureus in a family and its pet cat". The New England Journal of Medicine. 358 (11): 1200–1. doi:10.1056/NEJMc0706805. PMID 18337614.
- ^ Munir MT, Pailhories H, Eveillard M, Irle M, Aviat F, Federighi M, Belloncle C (August 2020). "Quercus petraea)". Antibiotics. 9 (9): 535. doi:10.3390/antibiotics9090535. PMC 7558063. PMID 32847132.
- ^ Neely AN, Maley MP (February 2000). "Survival of enterococci and staphylococci on hospital fabrics and plastic". Journal of Clinical Microbiology. 38 (2): 724–6. doi:10.1128/JCM.38.2.724-726.2000. PMC 86187. PMID 10655374.
- ^ Cook HA, Furuya EY, Larson E, Vasquez G, Lowy FD (February 2007). "Heterosexual transmission of community-associated methicillin-resistant Staphylococcus aureus". Clinical Infectious Diseases. 44 (3): 410–3. doi:10.1086/510681. PMID 17205449.
- ^ Shafiei Y, Razavilar V, Javadi A (2011). "Thermal Death Time of Staphylococcus Aureus (PTCC=29213) and Staphylococcus Epidermidis (PTCC=1435) in Distilled Water" (PDF). Australian Journal of Basic and Applied Sciences. 5 (11): 1551–4.
- ^ Wu X, Su YC (August 2014). "Effects of frozen storage on survival of Staphylococcus aureus and enterotoxin production in precooked tuna meat". Journal of Food Science. 79 (8): M1554-9. doi:10.1111/1750-3841.12530. PMID 25039601.
- ^ Bolton KJ, Dodd CE, Mead GC, Waites WM (1988). "Chlorine resistance of strains of Staphylococcus aureus isolated from poultry processing plants". Letters in Applied Microbiology. 6 (2): 31–34. doi:10.1111/j.1472-765X.1988.tb01208.x. S2CID 84137649.
- ^ Mead GC, Adams BW (1986). "Chlorine resistance of Staphylococcus aureus isolated from turkeys and turkey products". Letters in Applied Microbiology. 3 (6): 131–133. doi:10.1111/j.1472-765X.1986.tb01566.x. S2CID 86676949.
- ^ van Rijen M, Bonten M, Wenzel R, Kluytmans J, et al. (Cochrane Wounds Group) (October 2008). "Mupirocin ointment for preventing Staphylococcus aureus infections in nasal carriers". The Cochrane Database of Systematic Reviews (4): CD006216. doi:10.1002/14651858.CD006216.pub2. PMID 18843708.
- ^ Liu Z, Norman G, Iheozor-Ejiofor Z, Wong JK, Crosbie EJ, Wilson P, et al. (Cochrane Wounds Group) (May 2017). "Nasal decontamination for the prevention of surgical site infection in Staphylococcus aureus carriers". The Cochrane Database of Systematic Reviews. 5 (8): CD012462. doi:10.1002/14651858.CD012462.pub2. PMC 6481881. PMID 28516472.
- ^ "Food standard agency".
- ^ "A Shot Against MRSA?" (PDF). Resources for the Future. 20 April 2009. Retrieved 7 October 2015.
- ^ "Strengthening the immune system as an antimicrobial strategy against Staphylococcus aureus infections" (PDF). FORMATEX RESEARCH CENTER. 11 December 2013. Retrieved 7 October 2015.
- ^ "Intercell, Merck terminate V710 Phase II/III trial against S. aureus infection". Merck & Co. 8 June 2011. Retrieved 7 October 2015.
- ^ "Nabi Biopharmaceuticals Completes Final PentaStaph(TM) Milestone". GLOBE NEWSWIRE. 27 April 2011. Retrieved 7 October 2015.
- ^ "Vaccines to prevent antibiotic‐resistant Staphylococcus aureus (MRSA)infections" (PDF). University of Chicago. Retrieved 11 May 2017.
- ^ "A Study to Evaluate the Safety, Reactogenicity and Immunogenicity of GSK Biologicals' Staphylococcal Investigational Vaccine in Healthy Adults". ClinicalTrials.gov. 1 July 2010. Retrieved 7 October 2015.
- ^ "Status of vaccine research and development of vaccines for Staphylococcus aureus" (PDF). ELSEVIER. 19 April 2016. Retrieved 10 October 2016.
- ^ "Pfizer Begins Phase 2b Study of Its Investigational Multi-antigen Staphylococcus aureus Vaccine in Adults Undergoing Elective Spinal Fusion Surgery". Pfizer Inc. 7 July 2015. Retrieved 24 February 2016.
- ^ "Safety and Efficacy of SA4Ag Vaccine in Adults Having Elective Posterior Instrumented Lumbar Spinal Fusion Procedure (STRIVE)". ClinicalTrials.gov. 9 March 2015. Retrieved 7 October 2015.
- ^ Begier E, Seiden DJ, Patton M, Zito E, Severs J, Cooper D, Eiden J, Gruber WC, Jansen KU, Anderson AS, Gurtman A (February 2017). "SA4Ag, a 4-antigen Staphylococcus aureus vaccine, rapidly induces high levels of bacteria-killing antibodies". Vaccine. 35 (8): 1132–1139. doi:10.1016/j.vaccine.2017.01.024. PMID 28143674.
- ^ "Safety and Efficacy of SA4Ag Vaccine in Adults Having Elective Open Posterior Spinal Fusion Procedures With Multilevel Instrumentation (STRIVE)". ClinicalTrials.gov. 9 March 2015. Retrieved 1 September 2021. Cite 저널은 필요로 한다.
journal=(도움말) - ^ Torre A, Bacconi M, Sammicheli C, Galletti B, Laera D, Fontana MR, Grandi G, De Gregorio E, Bagnoli F, Nuti S, Bertholet S, Bensi G (August 2015). "Four-component Staphylococcus aureus vaccine 4C-staph enhances Fcγ receptor expression in neutrophils and monocytes and mitigates S. aureus infection in neutropenic mice". Infection and Immunity. 83 (8): 3157–63. doi:10.1128/IAI.00258-15. PMC 4496606. PMID 26015481.
- ^ Kennedy Costa, Wêndeo; Ohana da Costa Gomes, Nandara; Souza Dos Santos, Bruno; Macêdo Bezerra Filho, Clóvis; Macário de Oliveira, Alisson; Cláudia da Silva, Graziela; Oliveira de Veras, Bruno; Granja da Silva Oliveira, Fernanda; César Ribeiro de Oliveira Farias de Aguiar, Júlio; Maria do Amaral Ferraz Navarro, Daniela; Tereza Dos Santos Correia, Maria; Vanusa da Silva, Márcia (27 October 2020). "First report on the chemical composition of leaf essential oil of Myrciaria pilosa Sobral & Couto and its antimicrobial and antivirulence activities against Staphylococcus aureus". Nat Prod Res: 1–5. doi:10.1080/14786419.2020.1837805. PMID 33107338. S2CID 225081539.
- ^ Mayr-Hartin A (1953). "The acquisition of Penicillin resistance by Staphylococcus aureus, strain Oxford". J Gen Microbiol. 13 (1): 9–21. doi:10.1099/00221287-13-1-9. PMID 13252206.
- ^ Kearns AM, Ganner M, Holmes A (2006). "The 'Oxford Staphylococcus': a note of caution". J Antimicrob Chemother. 58 (2): 480–1. doi:10.1093/jac/dkl230. PMID 16735421.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ EUCAST (1 January 2020). Routine and extended internal quality control for MIC determination and disk diffusion as recommended by EUCAST: version 10.0. Växjö, Sweden: European Society of Clinical Microbiology and Infectious Diseases. p. 9.
추가 읽기
- Loskill P, Pereira PM, Jung P, Bischoff M, Herrmann M, Pinho MG, Jacobs K (September 2014). "Reduction of the peptidoglycan crosslinking causes a decrease in stiffness of the Staphylococcus aureus cell envelope". Biophysical Journal. 107 (5): 1082–1089. Bibcode:2014BpJ...107.1082L. doi:10.1016/j.bpj.2014.07.029. PMC 4156677. PMID 25185544.
- Benson MA, Ohneck EA, Ryan C, Alonzo F, Smith H, Narechania A, Kolokotronis SO, Satola SW, Uhlemann AC, Sebra R, Deikus G, Shopsin B, Planet PJ, Torres VJ (August 2014). "Evolution of hypervirulence by a MRSA clone through acquisition of a transposable element". Molecular Microbiology. 93 (4): 664–81. doi:10.1111/mmi.12682. PMC 4127135. PMID 24962815.
외부 링크
| 분류 |
|---|
| 위키미디어 커먼스는 포도상구균 아우레우스와 관련된 미디어를 보유하고 있다. |
| 위키피아는 포도상구균과 관련된 정보를 가지고 있다. |
- StopMRSANow.org — MRSA 확산 방지 방법 논의
- TheMRSA.com — MRSA 감염의 모든 것을 이해하십시오.
- "Staphylococcus aureus". NCBI Taxonomy Browser. 1280.
- Packham C (16 March 2015). "Successful in vivo test of breakthrough Staphylococcus aureus vaccine". Medical Press. Archived from the original on 19 September 2012. Retrieved 18 March 2015.
- BacDive의 포도상구균 종류 변종 – 박테리아 다양성 메타다타바아제