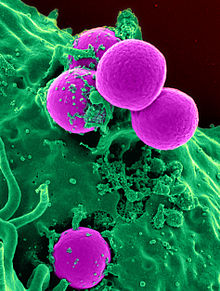
메티실린 내성 황색포도상구균
Methicillin-resistant Staphylococcus aureus메티실린 내성 황색포도상구균(MRSA)은 다른 황색포도상구균과 유전적으로 구별되는 그램 양성균군이다.MRSA는 사람에게서 치료하기 어려운 감염의 원인이다.2019년 항균성 때문에 10만 명 이상이 사망했다.
MRSA는 (자연선택을 통해) β-락탐 항생제에 대한 다제내성을 개발하거나 (수평 유전자 전달을 통해) 획득하는 황색포도상구균의 모든 변종이다.베타-락탐(β-락탐) 항생제는 페남(메티실린과 옥사실린과 같은 페니실린 유도체)과 세팔로스포린과 [1]같은 세펨을 포함하는 광범위한 스펙트럼 그룹입니다.이러한 항생제에 저항할 수 없는 균주는 메티실린 수용성 황색소(MSSA)로 분류된다.
MRSA는 열린 상처, 카테터와 같은 침습적 장치 및 약화된 면역 시스템을 가진 사람들이 의료 관련 감염의 위험이 더 큰 병원, 교도소 및 요양원에서 흔하다.MRSA는 병원 감염으로 시작됐지만 가축뿐만 아니라 지역사회 감염으로 발전했다.HA-MRSA(헬스케어 관련 또는 병원 취득 MRSA), CA-MRSA(커뮤니티 관련 MRSA), LA-MRSA(리베스토크 관련 MRSA)라는 용어는 이를 반영한다.
징후 및 증상
사람에게 황색포도상구균은 상기도,[2] 피부 및 내장 [3]점막에 존재하는 정상적인 미생물군의 일부입니다.하지만, 공생적으로 서식하고 행동할 수 있는 유사한 박테리아 종들과 함께, 그들은 만약 그들이 식민화한 조직을 차지하기 시작하거나 다른 조직으로 침입하기 시작하면 질병을 일으킬 수 있습니다; 그 결과로 생긴 감염은 "파토비온트"[2]라고 불립니다.
72시간 후, MRSA는 인간의 조직을 장악할 수 있고 결국 치료에 내성을 갖게 된다.MRSA의 첫 번째 증상은 여드름, 거미에 물린 상처 또는 종기를 닮은 작은 붉은 돌기로, 발열과 때로는 발진이 동반될 수 있습니다.며칠 안에, 돌기는 더 커지고 더 아프다; 그것들은 결국 깊고 고름이 가득 찬 종기로 열린다.CA-MRSA 감염의 약 75%는 피부와 연조직에 국한되어 있으며 대개 효과적으로 [4]치료될 수 있다.
위험요소
위험에 처한 일부 모집단에는 다음이 포함된다.
- 유치용 임플란트, 보철물, 배수구 및 카테터[1][5] 보유자
- 사람이 많은 장소, 특히 공유 장비 및 피부[6] 접촉이 잦은 사용자
- 면역력이 약한 사람(HIV/AIDS, 루푸스, 암 환자, 이식 환자, 중증 천식 환자 등)
- 당뇨병 환자[1][7]
- 정맥 내 약물[8][9] 사용자
- 작년에[10] 약물을 주입한 사람과의 정기적인 접촉
- 퀴놀론 항생제[5][11] 사용자
- 고령자[5][12]
- 스포츠 및 기타 장비를 공유하는 학생
- 기숙사에[6] 사는 대학생들
- 의료시설에 장기[5][6] 체류하거나 근무하는 사람
- 플로리다와 미국 서부[13][14] 해안 등 MRSA가 있는 연안 해역에서 시간을 보내는 사람들
- 노숙자 쉼터 입주자, 교도소 재소자, 기초훈련[15][16] 중인 신병 등 다른 사람과 함께 밀폐된 공간에서 시간을 보내는 사람
- 수의사, 가축 사육사, 애완동물[17] 주인
- 살균되지[18] 않은 우유를 섭취하는 사람
- 면역력이 약해지고 식민지화[19]: 249 된 사람들
- 만성폐쇄성폐질환자[5]
- 흉부[5] 수술을 받은 사람
MRSA에 감염된 사람들 중 22%가 눈에 띄는 위험 [20]: 637 요소를 가지고 있지 않다.
입원자
노인을 포함하여 입원한 사람들은 종종 면역력이 약해지고 MRSA를 포함한 모든 종류의 감염에 취약하다. MRSA에 의한 감염은 의료 관련 또는 병원 획득 메티실린 내성 황색병(HA-MRSA)[1][5][21][22]이라고 불린다.일반적으로 MRSA에 감염된 사람은 의사의 치료를 받으면 10일 이내에 감염이 유지되지만 사람에 [23]따라 효과는 다를 수 있다.
수술과 비수술의 상처는 모두 HA-MRSA에 [1][5][21]감염될 수 있습니다. 수술 부위의 감염은 피부 표면에서 발생하지만 내부 [1]장기와 혈액으로 전이되어 패혈증을 일으킬 수 있습니다.일부 의료 제공자가 [11][24]검사 사이에 예방적 손 씻기를 수행하지 않을 수 있기 때문에 의료 제공자와 환자 간에 전염될 수 있습니다.
요양원에 있는 사람들은 위의 모든 이유로 위험에 처해 있으며, 그들의 일반적으로 약한 면역 [12][25]체계로 인해 더욱 복잡하다.
수감자 및 군인
교도소나 군[18] 막사는 붐비고 갇힐 수 있으며, 열악한 위생관행이 확산되어 주민들이 [17]MRSA에 걸릴 위험이 높아질 수 있다.이러한 집단에서의 MRSA 사례는 미국에서 처음 보고되었고, 이후 캐나다에서 보고되었다.최초의 보고서는 미국 주 교도소에 있는 질병통제예방센터에 의해 작성되었다.뉴스 매체에는 2000년과 2008년 사이에 교도소에서 발생한 MRSA에 대한 수백 건의 보고서가 실렸다.예를 들어, 2008년 2월 오클라호마의 Tulsa County 교도소는 한 [26]달에 평균 12건의 S. Aureus 환자를 치료하기 시작했습니다.
동물
가축에 항생제를 사용하면 가축 사이에서 MRSA가 발생할 위험이 높아집니다. MRSA ST 398과 CC398 변종은 사람에게 [18][27]전염됩니다.일반적으로 동물은 증상이 [1]없다.
가축 애완동물은 주인의 전염에 의해 MRSA에 감염되기 쉽고, 반대로 MRSA에 감염된 애완동물은 [28]사람에게도 MRSA를 전염시킬 수 있다.
선수들
라커룸, 체육관 및 관련 운동 시설은 MRSA 오염 및 [29]감염 가능성이 있는 장소를 제공합니다.운동선수들은 고위험군으로 [18]밝혀졌다.한 연구는 MRSA를 [30]인조잔디에 의한 찰과상과 연관시켰다.텍사스 주 보건부의 세 가지 연구에 따르면 미식축구 선수들의 감염률은 전국 평균의 16배였다.2006년 10월, 고등학교 미식축구 선수가 MRSA에 감염된 잔디 화상으로 일시적으로 마비되었다.그는 2007년 1월 다시 감염돼 감염된 조직을 제거하기 위해 3번의 수술과 3주간의 [31]입원치료를 받았다.
2013년, Tampa Bay Buccaneers의 Lawrence Tynes, Carl Nicks 및 Johnthan Banks가 MRSA 진단을 받았습니다.타인스와 닉스는 서로 감염되지 않았지만 뱅크스가 어느 개인에게서 감염됐는지는 알려지지 않았다.[32]2015년 LA 다저스 내야수 저스틴 터너는 뉴욕 [33]메츠를 방문하던 중 감염됐다.2015년 10월, 뉴욕 자이언츠의 타이트 엔드 Daniel Fels는 심각한 MRSA [34]감염으로 입원했다.
아이들.
MRSA는 [35]어린이에게 있어서 중대한 문제가 되고 있습니다.연구 결과에 따르면 (아마도)[36] 병원 탁아소를 포함한 미국 의료 시설의 환자 중 4.6%가 MRSA에 [37]감염되었거나 MRSA에 의해 식민지화되었습니다.누가 보육 시설 centers,[18]놀이터, 라커 룸, 캠프, 기숙사, 교실과 다른 학교 설정 및 체육관, 운동 시설에 닿아 어린이들과 어른들은 항생제 내성 세균 감염에 걸릴 위험이 높은 부모 특히 발과 같은 스포츠 장비를 공유하는 활동에 참여하는 아이들의 주의해야 한다.bal나는 헬멧과 유니폼.[38]
정맥 내 약물 사용자
주사제 사용(IDU)이 테네시 병원 퇴원 시스템의 24.1%(1,839명)를 차지하면서 바늘이 필요한 약물은 [39]MRSA의 증가를 초래했다.비위생적인 주입방법에 의해 MRSA의 액세스포인트가 혈류에 들어가 호스트의 감염을 시작합니다.게다가, MRSA의 [10]높은 전염률로 인해, 일반적인 위험 요소는 작년에 약물을 주입한 사람과 지속적으로 접촉하는 사람들이다.
메커니즘
항균제 내성은 유전자에 기반을 두고 있다; 내성은 특정 항생제에 내성을 부여하는 유전자를 포함하는 염색체 외 유전 요소의 획득에 의해 매개된다.이러한 요소의 예로는 플라스미드, 전이성 유전 요소, 수평 유전자 [40]이식을 통해 박테리아 간에 전달될 수 있는 게놈 섬 등이 있다.MRSA의 명확한 특징은 페니실린과 같은 항생제의 존재 하에서 번성하는 능력이다.이 항생제는 보통 세포벽 물질의 합성을 억제함으로써 세균의 성장을 막는다.이것은 세포벽 [41]합성에 중요한 효소(트랜스펩티드가수분해효소)의 불활성화를 막는 내성 유전자, mecA 때문이다.
SCMec
포도상구균 카세트 염색체 메크(SCCMec)는 항생제 내성 유전자 메카([42][43]mecA)를 포함한 출처를 알 수 없는 게놈 섬이다.SCCMec은 시톨리신 유전자 psm-mec을 포함한 mecA 이상의 추가 유전자를 포함하고 있으며, 이는 HA 취득 MRSA [44]균주의 독성을 억제할 수 있다.또한 이 궤적은 psm-mecRNA로 [45]알려진 변형 의존성 유전자 조절 RNA를 코드한다.SCcmec은 또한 ccrA와 ccrB를 포함한다.두 유전자 모두 S.Oureus [42][43]염색체로부터의 SCCMec 요소의 부위 특이적 통합과 절제를 매개하는 재조합 효소를 코드한다.현재 21~67kb 크기의 6가지 고유한 SCCMEC 유형이 [42]식별되었다. 이들은 I-VI 유형으로 지정되며 mec 및 ccr 유전자 [40]복합체의 변동으로 구별된다.SCCMec 요소의 크기와 수평 유전자 전달의 제약으로 인해, 최소 5개의 클론이 MRSA 감염의 확산에 책임이 있다고 생각되며, 클론 복합체(CC) 8이 가장 [42][46]널리 퍼져 있다.SCCMec은 근연종인 포도상구균 sciuri 종에서 유래하여 황색포도상구균으로 [47]수평으로 전이된 것으로 생각된다.
SCCMec 유전자형이 다르면 항균 내성 [48]비율과 같은 미생물학적 특성이 다르다.다른 유전자형은 또한 다른 종류의 감염과 연관되어 있다.타입 I~III SCCMec은 일반적으로 추가적인 저항 유전자를 포함하는 대형 원소로 HA-MRSA [43][48]균주로부터 특징적으로 격리됩니다.반대로 CA-MRSA는 mecA [43][48]이외의 내성 유전자가 부족한 IV형 및 V형과 관련된다.
이러한 구별은 2001년 콜린스 등에 의해 철저히 조사되었으며, 크고 작은 SCCMec 플라스미드의 운반과 관련된 적합성 차이로 설명될 수 있다.SCCMecI와 같은 대형 플라스미드의 운반 -III는 박테리아에 비용이 많이 들어 독성 [49]발현을 보상적으로 감소시킨다.MRSA는 항생제 내성이 증가하지만 독성은 감소하는 병원 환경에서 번성할 수 있습니다. HA-MRSA는 면역력이 저하된 입원 숙주를 대상으로 하므로 독성의 감소는 [49]부적응성이 아닙니다.이와는 대조적으로 CA-MRSA는 건강한 [49]숙주를 감염시키는 데 필요한 증가된 독성 및 독성 발현을 상쇄하기 위해 적합도 비용이 낮은 SCCMec 요소를 운반하는 경향이 있습니다.
메카
mecA는 메티실린과 다른 β-락탐 항생제에 대한 내성을 담당하는 바이오마커 유전자이다.mecA를 획득한 후, 그 유전자는 S. aureus [42]염색체에 통합되고 국소화되어야 한다.mecA는 페니실린 결합 단백질 2a(PBP2a)를 코드하며, 활성 부위는 메티실린이나 다른 β-락탐 [42]항생제와 결합하지 않기 때문에 다른 페니실린 결합 단백질과는 다르다.이와 같이 PBP2a는 펩티도글리칸 가교에서 필요한 트랜스펩티드화 반응을 계속 촉매할 수 있어 항생제가 존재해도 세포벽 합성이 가능하다.PBP2a가 β-락탐 부분과 상호작용할 수 없기 때문에 mecA의 [42][50]취득은 메티실린 외에 모든 β-락탐 항생제에 대한 내성을 부여한다.
mecA는 두 개의 조절 유전자, 즉 mecI와 mecR1의 통제를 받는다.MecI는 보통 MecA 프로모터에 결합되어 억제제 [40][43]역할을 합니다.β-락탐 항생제의 존재 하에서 MecR1은 mecA의 [40][43]전사 활성화로 이어지는 신호 전달 캐스케이드를 개시한다.이는 MecI의 MecR1 매개분할에 의해 달성되며, 이는 MecI [40]억제를 완화한다.MecA는 2개의 공동억제제 blaI 및 blaR1에 의해 더욱 제어된다.blaI와 blaR1은 각각 MeCI와 상동성이며, 통상의 조절제로서 기능한다.mecI와 blaI에 의해 결합된 DNA 배열은 [42]동일하기 때문에 blaI는 또한 mecA의 [51]전사를 억제하기 위해 mecA 연산자와 결합할 수 있다.
아르기닌 이화 이동체
아르기닌 이화 이동 요소(ACME)는 많은 MRSA 균주에 존재하는 독성 인자이지만 [52]MSSA에는 널리 분포하지 않습니다.SpG 양성 ACME는 황색포도상구균의 폴리아민 과민증을 보상하고 안정적인 피부 정착, 상처 감염, 사람 대 사람 [53]전염을 촉진합니다.
변종
메티실린 감수성 황색포도상구균(MSSA)에서 SCCMec을 획득하면 유전적으로 다른 MRSA 계열이 다수 발생한다.서로 다른 MRSA 균주 내의 이러한 유전적 변이는 독성 및 관련 MRSA 감염의 [54]변이를 설명할 수 있다.첫 번째 MRSA 스트레인 ST250 MRSA-1은 SCCMec 및 ST250-MSSA 통합에서 [54]비롯되었습니다.과거에는 주요 MRSA 클론 ST2470-MRSA-I, ST239-MRSA-II, ST5-MRSA-II 및 ST5-MRSA-IV가 병원 획득 MRSA([54]HA-MRSA) 감염의 원인이었다.브라질 클론으로 알려진 ST239-MRSA-II는 다른 복제품들에 비해 전염성이 높았고 아르헨티나, 체코, 포르투갈에 [54]분포했다.
영국에서 MRSA의 가장 일반적인 변종은 EMRSA15 및 EMRSA16입니다.[55] EMRSA16은 ST36과 동일한 것으로 확인되었습니다.미국에서 유통되는 USA200 변종, SCCMEC 타입 II,[56] 엔테로톡신 A 및 독성 쇼크 증후군 독소 1 유전자를 운반하기 위해.새로운 국제 타이핑 시스템 하에서, 이 변종은 현재 MRSA252라고 불리고 있습니다.EMRSA 15도 아시아에서 일반적인 MRSA 변종 중 하나입니다.기타 일반적인 변종으로는 ST5가 있습니다.USA100 및 EMRSA [57]1이 변종들은 HA-MRSA의 [58]유전적 특성이다.
지역사회에서 획득한 MRSA(CA-MRSA) 변종이 1990년 후반에서 2000년에 출현하여 의료 [58]시설과 접촉하지 않았던 건강한 사람들을 감염시켰다.연구자들은 CA-MRSA가 HA-MRSA에서 [58]진화하지 않았다고 주장한다.이는 CA-MRSA[59] 균주의 분자 유형과 CA-MRSA와 HA-MRSA 간의 게놈 비교에 의해 더욱 입증되며, 이는 새로운 MRSA 균주가 [58]MSSA에 개별적으로 통합되었음을 나타낸다.2000년 중반에는 CA-MRSA가 의료 시스템에 도입되었고 CA-MRSA와 HA-MRSA를 구별하는 것은 어려운 [58]과정이 되었다.지역사회에서 취득한 MRSA는 병원에서 취득한 MRSA(HA-MRSA)[58]보다 더 쉽게 치료되고 더 치명적입니다.CA-MRSA의 강화된 독성을 위한 유전적 메커니즘은 여전히 활발한 연구 분야로 남아 있다.판톤-발렌틴 류코시딘(PVL) 유전자는 CA-MRSA의 [54]독특한 특징이기 때문에 특히 관심을 끈다.
미국에서는 대부분의 CA-MRSA가 ST8로 지정된 CC8 균주에 의해 발생합니다.USA300(SCCMec 타입 IV, Panton-Valentine Leukocidin, PSM-alpha 및 Enterotoxin Q와 K,[56] ST1을 운반하는 경우):USA400.[60] ST8:USA300 균주는 피부 감염, 괴사성 근막염 및 독성 쇼크 증후군을 일으키는 반면, ST1:USA400 균주는 괴사성 폐렴과 폐패혈증을 [54]일으킨다.MRSA의 기타 커뮤니티 취득 균주는 ST8입니다.USA500 및 ST59:USA1000.세계의 많은 나라에서, 다른 유전적 배경을 가진 MRSA 변종이 CA-MRSA 변종 중에서 우세하게 되었다; USA300은 미국에서 쉽게 1위를 차지했고 2004년에 캐나다에 처음 등장한 이후 더 흔해지고 있다.예를 들어 호주에서는 ST93 균주가 일반적이지만, 유럽 대륙에서는 SCCMec 타입 IV를 가진 ST80 균주가 우세합니다.[61][62]대만에서는 ST59 균주가 발생했으며, 그 중 일부는 많은 비 베타 락탐 항생제에 내성이 있으며, 지역사회의 피부 및 연조직 감염의 일반적인 원인으로 나타났다.미국 대륙의 대부분과 달리 알래스카의 외딴 지역에서는 USA300이 2004년부터 [63]2006년까지의 감시뿐만 아니라 1996년과 2000년에 발생한 MRSA 변종 연구에서도 거의 발견되지 않았다.
MRSA 변종 CC398은 집중적으로 사육되는 생산동물(주로 돼지, 소 및 가금류)에서 발견되며, LA-MRSA(Livestock-associated MRSA)[57][64][65]로서 사람에게 전염될 수 있다.
진단.
MRSA의 발생을 특정하기 위해서는 진단미생물학연구소 및 참조연구소가 중요합니다.일반적으로 혈액, 소변, 가래, 기타 체액 샘플에서 세균을 배양하고 초기에 확인검사를 할 수 있는 충분한 양을 배양해야 합니다.그러나 MRSA를 진단하기 위한 빠르고 쉬운 방법이 존재하지 않기 때문에 감염의 초기 치료는 종종 치료의사의 "강력한 의심"과 기술에 기초한다. 여기에는 MRSA 균주를 [66][67]신속하게 검출하고 식별하기 위해 임상 실험실에서 사용되는 정량적 PCR 절차가 포함된다.
또 다른 일반적인 실험실 테스트는 PBP2a 단백질을 검출하는 신속한 라텍스 응집 테스트입니다.PBP2a는 변종 페니실린 결합 단백질로 옥사실린에 [68]대한 S. Aureus의 내성 능력을 부여합니다.
미생물학
모든 황색포도상구균(때로는 SA라고도 함)과 마찬가지로 메티실린 내성 황색포상구균은 그램 양성균으로 지름이 약 1미크론이다.그것은 포자를 형성하지 않고 운동성이 없다.포도와 비슷한 송이 [69]: 390 또는 사슬에서 자주 발견됩니다.메티실린 수용성 황색포도상구균(MSSA)과는 달리 MRSA는 다양한 배지에서 천천히 성장하며 MSSA의 혼합 콜로니에 존재하는 것으로 밝혀졌다.다수의 항생제에 대한 내성을 부여하는 mecA 유전자는 항상 MRSA에 존재하며 보통 MSSA에는 존재하지 않는다. 그러나 어떤 경우에는 mecA 유전자가 MSSA에 존재하지만 발현되지 않는다.중합효소 연쇄반응(PCR) 테스트는 MRSA 균주를 식별하는 가장 정확한 방법입니다.특수 배지는 MSSA와 MRSA를 더 잘 구별하기 위해 개발되었으며, 경우에 따라 이러한 배지는 다른 항생제에 [69]: 402 내성이 있는 특정 변종을 식별하기 위해 사용될 수 있다.
옥사실린, 클린다마이신, 테이코플라닌, 에리트로마이신 등에 내성이 있는 황색포도상구균의 다른 변종도 나타났다.이러한 내성 균주는 mecA 유전자를 가질 수도 있고 가지지 않을 수도 있다.황색포도상구균은 또한 반코마이신(VRSA)에 대한 내성을 발달시켰다.한 변종은 반코마이신에 부분적으로만 민감하며 반코마이신-중간 S. 아우레우스(VISA)라고 불린다.내성 황색포도상구균의 일종인 GISA는 글리코펩타이드 중간 황색포상구균이며 반코마이신과 티코플라닌에 덜 감염된다.황색포도상구균의 항생제 내성은 성장을 억제하기 위해 사용해야 하는 항생제의 양을 결정함으로써 정량화할 수 있다.4μg/ml 이하의 반코마이신 농도로 S. 아우레스를 억제하면 감수성이 있다고 한다.성장을 억제하기 위해 32μg/ml 이상의 농도가 필요한 경우에는 [20]: 637 내성이 있다고 한다.
예방
스크리닝
의료 환경에서 MRSA를 가진 사람들을 감염되지 않은 사람들로부터 격리하는 것은 전염을 막는 한 가지 방법입니다.신속한 배양 및 민감도 테스트와 분자 테스트를 통해 보균자를 식별하고 감염률을 [70]낮춥니다.2%의 사람들이 MRSA의 보균자이기 때문에 이러한 환경에서 환자를 검사하는 것이 특히 중요하다. 이러한 경우들 중 많은 경우 박테리아가 콧구멍에 상주하고 환자는 어떠한 [71]증상도 보이지 않는다.
MRSA는 콧구멍을 채취하고 그곳에서 발견된 박테리아를 분리함으로써 확인할 수 있다.감염자와 접촉한 사람에 대한 추가 위생 조치와 함께, 병원에 입원한 사람들의 면봉 검사는 미국, 덴마크, 핀란드, 네덜란드의 [72]병원들에서 MRSA의 확산을 최소화하는 데 효과가 있는 것으로 밝혀졌다.
손빨래
질병관리본부는 수감자, 어린이집 직원, 운동선수 등 지역사회 환경에 적합한 MRSA 감염의 수축 및 확산을 방지하기 위한 제안을 제공한다.MRSA의 확산을 막기 위해 비누와 물 또는 알코올성 세정제를 사용하여 손을 깨끗이 정기적으로 씻는 것이 좋습니다.추가적인 권장 사항은 상처를 깨끗하고 덮는 것을 유지하고, 다른 사람의 상처와의 접촉을 피하고, 면도기나 수건과 같은 개인 용품을 공유하는 것을 피하고, 운동 시설에서 운동한 후 샤워하고, 수영장이나 [73]월풀을 사용하기 전에 샤워를 하는 것입니다.
격리
의료시설을 제외하고, 현재 미국의 지침은 MRSA 감염 근로자를 일반 작업장에서 [74]일상적으로 제외하도록 요구하지 않는다.국립 보건 연구원 사람들은 상처 배수를 포함된 깨끗하고 건조한 붕대로 덮여 있으면 안 될 수 있는 자와 좋은 위생 습관과 환자들 상처 배액 간담 reassigned,[74]을 유지할 수 없다는 자동으로"연락처와 아들"에 관계 없이 아무거나 잘 알려 진 가지고 있는 것을 넣어야만 하는 것이 좋습니다.fec감염이 활발한 근로자는 피부 대 피부 접촉이 발생할 [76]수 있는 활동에서 제외됩니다.[75]직장 내 포도상구균이나 MRSA의 확산을 방지하기 위해, 고용주들은 좋은 위생을 지원하는 적절한 시설을 마련하도록 권장된다.또한 표면 및 장비 소독은 환경보호청이 등록한 소독제를 [74]준수해야 합니다.병원 환경에서는 1~3개 문화가 [77]음성으로 돌아온 후 접촉 격리를 중단할 수 있습니다.환자가 격리 상태를 해제하기 전에 해당 특정 환자를 위한 전용 환자 관리 또는 일회용 장비가 있어야 합니다.이렇게 할 수 없는 [78]경우 장비를 다른 환자에게 사용하기 전에 올바르게 소독해야 합니다.
가정 내 MRSA의 확산을 막기 위해 보건부는 감염자와 별도로 접촉한 물질과 희석 표백제를 사용하여 세척하고, 코와 피부에 세균의 부하를 줄이고, 싱크대, 욕조, 키치 등 정기적으로 만지는 것을 세척 및 소독할 것을 권장합니다.카운터, 휴대전화, 전등 스위치, 문 손잡이, 전화기, 화장실,[79] 컴퓨터 키보드.
항생제 사용 제한
글리코펩타이드, 세팔로스포린, 특히 퀴놀론은 MRSA의 콜로니제이션 위험 증가와 관련이 있다.[11][24]현재 가이드라인에서는 MRSA 콜로니제화를 촉진하는 항생제 클래스, 특히 플루오로퀴놀론의 사용을 줄이는 것이 권장된다.
공중 위생에 관한 고려 사항
수학적 모델은 영국에서 발생한 것과 같이 선별 및 격리 조치가 수년간 효과적이었던 것으로 보이는 후 감염 제어의 상실이 발생할 수 있는 한 가지 방법을 설명한다.1990년대 중반까지 모든 영국 병원에서 채용된 '수색 및 파괴' 전략에서는 MRSA에 걸린 입원자 전원이 즉시 격리되고 모든 직원이 MRSA 검사를 받아 효과가 입증된 퇴치 치료 과정을 마칠 때까지 일할 수 없게 되었다.통제력의 상실은 식민지화된 사람들이 다시 지역사회로 배출되고 다시 수용되기 때문에 발생한다; 지역사회의 식민지화된 사람들의 수가 일정한 문턱에 도달하면, "검색과 파괴" 전략은 [80]압도된다.MRSA에 압도당하지 않은 몇 안 되는 나라 중 하나는 네덜란드입니다.네덜란드 전략의 성공의 중요한 부분은 퇴원 [81]시 운반을 근절하는 것이었을지도 모릅니다.
탈식민지화
2013년의, 한가지 임상 실험 어떻게, MRSA,[21]과 불충분한 공부를 하지만 감염되지 않식민지화해 왔다 비수술 상처를 치료하기 위해 이해하기 어떻게 2013년 현재, 전략 항생제 내성 세균 colonizatio을 근절하기 위해 MRSA.[1]과 식민지화해 왔다 수술 상처를 치료하기 위해 이해하기에 성공했다고 행해졌다.pe의 n양로원의 ople 감소된 감염률은 알려지지 않았다.[25]
주변 조직이 교란되어 혈류 [82]감염을 포함한 더 큰 감염으로 이어질 수 있으므로 종기를 배출할 때 주의해야 합니다.무피로신 2% 연고는 병변의 크기를 줄이는 데 효과적입니다.의류의 2차 피복이 바람직하다.[79]당뇨병 생쥐를 대상으로 한 동물 연구에서 나타난 바와 같이 당(70%)과 3% 포비돈-요오드 페이스트의 혼합물은 MRSA [83]감염 당뇨병 궤양 치료에 효과적인 약제이다.
커뮤니티 설정
이 섹션의 예와 관점은 주로 영국을 다루며, 주제에 대한 전 세계적인 관점을 나타내지 않습니다.(2020년 8월 (이 및 ) |
손 씻기 시설이 있는 공중 화장실과 같은 시설에 접근하지 못하면 필요한 청결을 유지하는 것이 어려울 수 있습니다.영국의 1992년 직장(보건, 안전 및 복지) 규정에서는[84] 기업이 비누 또는 기타 적절한 청소 수단을 포함한 세척 시설과 함께 종업원을 위한 화장실을 제공하도록 요구하고 있습니다.화장실 수 및 화장실과 함께 제공해야 하는 세면시설 종류에 대한 지침은 보건안전이그제큐티브북스에서 구할 수 있는 작업장(보건, 안전 및 복지) 승인실천규범 및 지침 L24에 제시되어 있지만 영국 지방당국에 공공장소를 제공해야 할 법적 의무는 없다.c 화장실, 그리고 2008년에 하원 커뮤니티와 지방 정부 위원회는 공공 화장실 [85]전략을 개발하기 위해 지방 당국에 의무를 요구했지만,[86] 정부에 의해 거부되었습니다.
농업
세계보건기구(WHO)는 동물 사료에 항생제를 사용하는 것을 규제해 MRSA의 [27]약제 내성 균주가 출현하는 것을 막고 있다.MRSA는 동물과 [18]조류에 확립되어 있다.
치료
항생제
MRSA 감염의 치료는 긴급하며 지연은 [19]: 328 치명적일 수 있다.감염과 관련된 위치와 병력에 따라 치료가 결정된다.항생제의 투여 경로는 다양하다.MRSA에 효과적인 항생제는 IV, 경구 또는 둘 다 조합하여 투여할 수 있으며, 특정 상황과 환자의 [4]특성에 따라 달라집니다.반코마이신 또는 다른 베타락탐 약물과 동시에 치료제를 사용하면 상승 [20]: 637 효과가 있을 수 있다.
CA-MRSA와 HA-MRSA는 모두 세팔렉신과 같은 전통적인 항포도상구균 베타-락탐 항생제에 내성이 있다.CA-MRSA는 술파 약물(코트리목사졸/술파메톡사졸), 테트라사이클린(독시사이클린 및 미니사이클린) 및 클린다마이신(골수염용)[4]에 대한 항균 감수성의 스펙트럼이 더 크다.MRSA는 치료 프로토콜이 다르고 항생제의 혈청 수준이 사람마다 다양하며 [88]결과에 영향을 미칠 수 있지만 라인졸리드 [87]요법으로 근절될 수 있다.Linezolid에 의한 MRSA의 효과적인 치료는 87%의 사람들에게서[87] 성공적이었다.리네졸리드는 반코마이신보다 [89][1]연조직 감염에 더 효과적이다.이것은 반코마이신으로 처리된 MRSA를 가진 사람들의 감염을 근절하는 것과 비교된다.반코마이신에 의한 치료는 약 49%[1]의 사람들에게서 성공적이다.Linezolid는 CA-MRSA와 HA-MRSA에 모두 효과가 있는 것으로 밝혀진 새로운 항생제 옥사졸리디논 클래스에 속합니다.미국 전염병 학회는 MRSA 폐렴 [4]환자 치료에 반코마이신, 리네졸리드 또는 클린다마이신(감염될 경우)을 권장하고 있습니다.5세대 세팔로스포린인 세프타롤린은 피부와 연조직의 MRSA 감염이나 지역사회 감염성 [90]폐렴을 치료하기 위해 미국에서 승인된 최초의 베타-락탐 항생제이다.
반코마이신과 테이코플라닌은 MRSA [91]감염 치료에 사용되는 글리코펩티드 항생제이다.타이코플라닌은 유사한 활동 스펙트럼을 가지지만 반감기가 [92]긴 반코마이신의 구조적 집합체이다.반코마이신과 테이코플라닌의 경구 흡수가 매우 낮기 때문에 이러한 약물은 전신 [93]감염을 통제하기 위해 정맥에 투여될 수 있다.반코마이신에 의한 MRSA 감염의 치료는 투여 경로가 불편하기 때문에 복잡할 수 있다.또한 MRSA에 대한 반코마이신의 효능은 메티실린 수용성 황색포도상구균(MSSA)[94][95]에 대한 항포도상구균 베타락탐 항생제보다 낮다.
새롭게 발견된 여러 종류의 MRSA는 반코마이신과 테이코플라닌에도 항생제 내성을 보인다.글리코펩타이드-중간 S. 아우레우스(GISA) 또는 반코마이신-중간 S. 아우레우스(VISA)[96][97]로 불리는 중간 수준의 내성(4~8μg/ml) 균주가 1990년대 후반에 나타나기 시작했다.첫 번째 확인된 사례는 1996년 일본에서 발생했으며, 이후 영국, 프랑스, 미국의 병원에서 변종이 발견되었다.반코마이신에 대한 완전한 내성(>16μg/ml)을 가진 최초의 문서화된 변종인 반코마이신 내성 S. 아우레우스(VRSA)는 [98]2002년 미국에서 나타났다.2011년에는 젖산염 변이에 결합하고 원래 표적에도 잘 결합하는 반코마이신 변종이 시험되어 강력한 항균 [99]활성이 회복되었다.리네졸리드, 퀴누프리스틴/달포프리스틴, 답토마이신,[100] 세프타롤린 및 티게사이클린은 반코마이신과 같은 글리코펩타이드에 반응하지 않는 보다 심각한 감염 치료에 사용된다.현행 가이드라인은 VISA 혈류감염과 [4]심내막염에 답토마이신을 권장하고 있다.
리네졸리드와 같은 옥사졸리디논은 1990년대에 사용 가능해졌으며 MRSA에 대한 효과 면에서 반코마이신에 필적한다.[101] 황색포도상구균의 리네졸리드 내성은 2001년에 보고되었지만, 감염률은 일관되게 낮은 수준이었다.영국과 아일랜드에서는 2001년과 [102]2006년 사이에 균혈증 사례에서 채취한 포도상구균에서 라인졸리드 내성이 발견되지 않았다.
피부 및 연조직 감염
피부농양 시 권장되는 1차 치료법은 각질 조직 제거, 절개, 배수입니다.수술 부위 감염(SSI)[4]에서 특정 항생제 치료의 효과를 판단하려면 더 많은 정보가 필요합니다.MRSA에 의한 연조직 감염의 예로는 궤양, 침소, 농양,[89] SSI 등이 있다.외과적 상처에서는 라인졸리드가 MRSA SSI를 [1]근절하는 데 반코마이신보다 나을 수 있다는 증거가 약하다(편향의 위험이 높다).
MRSA 콜로니화는 외상, 화상 및 만성 궤양(예: 당뇨병 궤양, 욕창, 동맥부전 궤양, 정맥 궤양)과 같은 비수술적 상처에서도 발견된다.MRSA 식민지화를 [21]치료하기 위한 최선의 항생제 요법에 대한 결정적인 증거는 발견되지 않았다.
아이들.
피부 감염 및 2차 감염 부위에서는 국소 무피로신을 성공적으로 사용한다.박테레미아 및 심내막염의 경우 반코마이신 또는 답토마이신 등이 고려됩니다.MRSA에 감염된 뼈나 관절을 가진 어린이의 경우 개별적이고 장기적인 치료가 이루어집니다.MRSA에 [4]의한 국소 감염의 결과로 신생아 농포증이 발생할 수 있다. Clindamycin은 MRSA 감염의 치료에는 승인되지 않았지만, 여전히 연조직 [4]감염에 어린이에게 사용된다.
심내막염과 균혈증
인공판막 교체 평가를 고려한다.적절한 항생제 치료는 최대 6주 동안 투여될 수 있다.종종 4주에서 6주의 항생제 치료가 권장되며 MRSA [4]감염 정도에 따라 달라집니다.
호흡기 감염
입원환자의 폐렴 치료에서 CA-MRSA는 배양 결과가 나오기 전에 시작한다.항생제에 대한 감수성이 수행된 후 감염은 최대 21일 동안 반코마이신 또는 라인졸리드로 처리될 수 있다.폐 주위의 흉강 내에 고름이 축적되어 폐렴이 복잡해지면 항생제 [4]치료와 함께 배수할 수 있다.낭포성 섬유증이 있는 사람들은 MRSA 감염과 관련된 호흡기 합병증이 생길 수 있다.낭포성 섬유증 환자의 MRSA 발생률은 2000년부터 2015년까지 5배 증가했다.이러한 감염의 대부분은 HA-MRSA였다. MRSA는 낭포성 섬유증 [103]환자의 폐 감염의 26%를 차지한다.
비강 또는 비강외 MRSA [104]감염에 국소적 또는 체계적인 항생제 사용을 뒷받침하는 증거는 불충분하다.
뼈 및 관절 감염
죽은 조직의 상처를 세척하고 농양을 빼내는 것이 MRSA 감염을 치료하기 위한 첫 번째 행동이다.항생제 투여는 표준화되지 않았으며 사례별로 조정된다.항생제 치료는 3개월까지 지속될 수 있으며 때로는 [4]더 오래 지속될 수도 있다.
감염된 삽입물
MRSA 감염은 임플란트 및 관절 치환과 관련하여 발생할 수 있습니다.시술에 대한 권장 사항은 임플란트가 제자리에 있는 기간을 기준으로 합니다.최근 수술용 임플란트 또는 인공관절을 배치한 경우에는 항생제 치료를 계속하는 동안 장치를 유지할 수 있다.3주 이상 전에 디바이스를 배치한 경우 디바이스를 분리할 수 있습니다.항생제 치료는 각각의 경우에 때때로 장기간에 [4]걸쳐 사용된다.
중추신경계
MRSA는 중추신경계를 감염시키고 뇌농양, 경막하농양, 척추경막외농양을 형성할 수 있다.항생제 치료와 함께 절제 및 배수가 가능합니다.구강정맥동이나 경막정맥동의 [4]패혈혈전증은 때때로 합병증이 될 수 있다.
기타 감염
광범위한 조직에서 MRSA 감염의 다른 예에 대한 치료는 표준화되어 있지 않다.치료법은 골막하 농양, 괴사성 폐렴, 셀룰라염, 근막염, 괴사성 근막염, 종격막염, 심근염, 골막, 간 및 비장성 농양, 패혈성 혈전성 정맥염 [4]및 안구내막염을 포함한 심각한 안구 감염과 관련된 MRSA 감염에 대해 다양하다.애완동물은 저수지가 되어 사람들에게 MRSA를 전달할 수 있다.어떤 경우에는 감염이 증상일 수 있고 애완동물이 MRSA 감염을 일으킬 수 있다.보건부에서는 [79]만약 MRSA 감염이 애완동물과 접촉한 사람들에게서 계속 발생한다면, 애완동물을 수의사에게 데려갈 것을 권고한다.
역학
전 세계적으로 약 20억 명의 사람들이 어떤 형태로든 황색포도상구균을 가지고 있다. 이 중 최대 5300만 명(보균자의 2.7%)이 [105]MRSA를 가지고 있는 것으로 생각된다. 황색포도상구균은 2019년 내성과 관련된 사망의 6대 병원체 중 하나로 확인되었고, MRSA로 인한 사망자는 10만 명에 달했다.[106]
HA-MRSA
건강한 어린이 1,300명을 대상으로 한 미국 코호트 연구에서 2.4%가 [107]코에 MRSA를 가지고 있었다.세균성 패혈증은 대부분의 침습성 MRSA [4]감염 사례에서 발생한다.2009년에는 MRSA로 인해 약 463,017명이 입원했으며,[108] 이는 1,000명당 11.74명의 비율이다.이러한 감염의 대부분은 덜 심각하지만,[109] 질병통제예방센터(CDC)는 매년 80,461건의 침습성 MRSA 감염과 11,285건의 MRSA로 인한 사망이 있을 것으로 추정하고 있다.2003년 MRSA 감염으로 인한 입원 비용은 미화 92,363달러,[89] MSSA 입원 비용은 52,791달러였다.
수술 후 감염은 비교적 드물지만 특정 유형의 수술에서 33%나 발생한다.수술 부위의 감염률은 1%에서 33%에 이른다.외과적 감염 후 30일 이내에 발생하는 MRSA 패혈증은 사망률이 15-38%이며, 1년 이내에 발생하는 MRSA 패혈증은 사망률이 약 55%이다.심장 수술과 관련된 사망률이 증가할 수 있다.MRSA에 감염된 사람은 12.9%의 비율이 있는 반면 다른 유기체에 감염된 사람은 3%에 불과하다.MRSA에 감염된 SSI는 그렇지 [1]않은 SSI보다 입원 기간이 더 길었다.
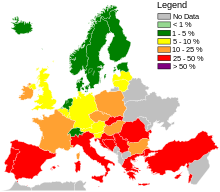
전 세계적으로 MRSA 감염률은 동적이고 [110]매년 다릅니다.2006년 SENTRY 항균 감시 프로그램 보고서에 따르면 MRSA 혈류 감염률은 북미에서 35.9%였다.라틴 아메리카의 MRSA 혈액 감염률은 29%였다.유럽 발병률은 22.8%였다.유럽의 모든 MRSA 감염률은 포르투갈에서 50%에서 스웨덴에서 0.8%까지 다양했다.전체 MRSA 감염률은 중남미에서 다양했다.콜롬비아와 베네수엘라를 합치면 3%, 멕시코는 50%, 칠레는 38%, 브라질은 29%, 아르헨티나는 28%[89]였다.
질병통제예방센터(CDC)는 2002년 미국에서 약 170만 건의 병원내 감염이 발생했으며 관련 [111]사망자는 99,000명이라고 추정했다.추정 발병률은 100명 입원당 4.5명의 병원 내 감염이며, 직접 비용(2004년 가격으로)은 환자당 10,500달러(2006년 비율에서 €5300, €8000)에서 항생제 내성 i 감염에 대해 환자당 111,000달러(57,000,000,000유로)에 이른다.이식 환자 수 n명.이 수치로 병원내 감염의 총 직접 비용에 대한 보수적인 추정치는 170억 달러 이상이다.이러한 감염의 감소는 의료 안전을 개선하기 위한 노력의 중요한 요소를 형성한다. (BMJ 2007)[citation needed] MRSA만 해도 2006년 1월부터 2007년 [112]10월까지 CDC National Healthcare Safety Network에 보고된 병원 내 감염의 8%와 관련이 있다.
영국 국립감사국은 유럽의 병원내 감염률이 전체 입원자의 4%에서 10%에 이르는 것으로 추정했다.2005년 초 현재, MRSA로 인한 영국의 사망자 수는 다양한 소식통에 의해 [113]연간 3,000명 정도로 추정되고 있다.
미국에서는 약 95명이 코에, 이 250만(통신사의 2.6%)가 소지한 인구 검토 세명의 미국 지역 사회에서 실시한 MRSA.[114]2001–2002가 되18–25.7/100,000 동안;대부분의 CA-MRSA 소이 임상적으로 관련된 감염과 관련이 있CA-MRSA의 연간 발생률을 보였다 S. 악성을 운반합니다.s,d 23%의 사람들이 [115]입원을 요구했다.
CA-MRSA
건강한 어린이 1,300명을 대상으로 한 미국 코호트 연구에서 2.4%가 [107]코에 MRSA를 가지고 있었다.환경에 MRSA가 존재하면 내성이 페이지를 통해 다른 박테리아로 전달될 수 있다는 우려가 있다.MRSA의 원천은 병원 폐기물, 농장 하수 또는 다른 [4]폐수에서 나올 수 있습니다.
LA-MRSA
2004년 MRSA는 네덜란드 양돈장에서 처음 분리돼 가축 관련 MRSA(LA-MRSA)[116]에 대한 추가 조사가 이뤄졌다.가축 관련 MRSA(LA-MRSA)는 한국,[18] 브라질, 스위스, 말레이시아, 인도, 영국, 덴마크, 중국에서 관찰되었습니다.
역사
1961년, 최초의 알려진 MRSA 격리체가 영국의 연구에서 보고되었고, 1961년부터 1967년까지 서유럽과 [16]호주에서 드물게 병원 발병이 발생했으며, 메티실린은 내성 감염을 치료하기 위해 영국에서 허가되었다.MRSA에 대한 다른 보고서는 1970년대에 [1]기술되기 시작했다.다른 항생제에 대한 내성은 황색포도상구균의 일부 변종에서 입증되었다.1996년 일본에서 [20]: 637 반코마이신 내성이 보고되었다.많은 나라에서,[69]: 402 MRSA 감염의 발생은 병원들 간에 전염되는 것으로 보고되었다.이 비율은 1995년까지 22%로 증가했으며 1997년에는 MRSA로 인한 병원 황색포도상구균 감염률이 50%에 달했다.
지역사회 관련 MRSA(CA-MRSA)의 첫 번째 보고는 1981년에 발생했으며,[16] 1982년에는 미시간주 디트로이트의 정맥 내 약물 사용자들 사이에서 CA-MRSA의 대규모 발생이 일어났다.1980년대와 1990년대에는 병원에 한 번도 피폭된 적이 없는 호주 원주민 인구 사이의 감염을 포함하여 CA-MRSA의 추가 발생이 보고되었다.1990년대 중반에는 미국 어린이들 사이에서 CA-MRSA 발생에 대한 산발적인 보고가 이루어졌다.1998년과 2008년 사이에 HA-MRSA 금리가 안정되었지만 CA-MRSA 금리는 계속 상승했다.시카고 대학 소아병원이 두 기간(1993-1995년과 1995-1997)을 비교한 보고서에 따르면 미국 [117]어린이들 사이에서 MRSA로 인한 입원률이 25배 증가했다.1999년, 시카고 대학교는 미국에서 [16]건강한 어린이들 사이에서 침습성 MRSA로 인한 첫 사망자를 보고했다.2004년까지, 다양한 종류의 MRSA의 게놈이 [118]기술되었다.
MRSA에 감염된 사람들 사이에서 관찰된 사망률 증가는 분명 이러한 사람들의 증가하는 근본적인 질병률의 결과일 수 있다.그러나 Blot과 동료들의 연구를 포함하여 기초 질환에 적응한 몇몇 연구에서는 MRSA 균혈증이 메티실린 수용성 S. Aureus([119]MSSA) 균혈증보다 더 높은 귀인 사망률을 보였다.
2004-05년 샌프란시스코의 MRSA 감염 발생률에 대한 인구 기반 연구에 따르면 300명 중 1명꼴로 1년 동안 이러한 감염이 발생했으며 이러한 감염의 85% 이상이 의료 [120]환경 밖에서 발생했다고 한다.2004년 연구에 따르면 미국 황색포도상구균 감염자는 병원 체류 기간의 평균 3배(14.3일 대비 4.5일)이며,[121] 총 비용(48,824달러 대비 14,141달러)의 3배가 발생했으며, 병원 내 사망 위험(11.2%, 2.3%)은 감염되지 않은 사람에 비해 5배 높았다.코스그로브 외 연구진은 31개 연구에 대한 메타 분석에서 MRSA 박테레미아(MRSA 박테레미아)가 MSSA 박테레미아에 비해 사망률 증가와 관련이 있다고 결론지었다(비율 = 1.93, CI 95% = 1.93 ± 0.39).[122][123]또한 Wyllie 등은 MRSA 감염자의 30일 이내 사망률이 34%로 MSSA [124]감염자의 사망률 27%와 비슷하다고 보고했다.
미국에서는 CDC가 2006년 10월 19일에 추가 연구의 필요성을 이유로 가이드라인을 발표했지만, 그러한 심사 [125]권고는 거부했다.CDC에 따르면, 미국에서 MRSA에 기인하는 의료 관련 감염 발생률의 가장 최근의 추정치는 그러한 감염률의 감소를 나타낸다.수백 개의 중환자실에서 보고된 바와 같이 MRSA 중심 라인 관련 혈류 감염의 발생률은 2001년부터 [126]2007년까지 50-70% 감소했다.모든 병원 MRSA 혈류 감염을 추적하는 별도의 시스템에서는 2005년과 2008년 사이에 [126]총 34%가 감소했습니다.2010년,[4] 반코마이신은 최고의 약이었다.
유럽 전역에서 대부분 2013년부터 데이터,(아이슬란드, 노르웨이, 스웨덴, 네덜란드, 덴마크, 핀란드, 에스토니아, 가장 낮은 가장 높은 수준으로에서)병원에서 항생제 내성 세균 감염은 others,[127]에 비해 낮은 수준:92–93과 수치가 높은 국가 중에서 중대한 발전 불가리아, 폴만에서 만들어졌다고 일곱 나라에 근거한다.그리고,브리티시 [127]: 40 제도
가장 초기의 의학 교과서 중 하나인 영국 도서관에 있는 중세 대머리 리치북에서 발견된 1,000년 된 안약 레시피가 MRSA 체외 및 [128]쥐의 피부 상처에서 MRSA에 대한 작용을 하는 것으로 밝혀졌다.
미디어에서
MRSA는 특히 유명 인사들이 [129][130][131]감염됐거나 감염된 적이 있다고 발표한 경우 언론의 화제가 되는 경우가 많습니다.감염 발생 소식은 신문과 텔레비전 뉴스 프로그램에 정기적으로 등장한다.2004-05년 시카고 쿡 카운티 교도소의 피부 및 연조직 감염에 대한 보고서는 MRSA가 [132]수감자들 사이에서 이러한 감염의 가장 일반적인 원인이었음을 보여주었다.MRSA에 감염된 혐의로 기소된 사람들을 상대로 한 소송도 [133][134]언론에서 인기 있는 이야기다.
MRSA는 라디오 프로그램,[135] 텔레비전 쇼,[136][137][138] 책,[139] 그리고 [140]영화의 주제이다.
조사.
그sweetgum 나무(로사 리퀴담바)의 다양한 생물 종의 다양한 항균성 화학 추출물 그들의 활동을 위한 항생제 내성 세균 억제에. 조사를 받아 왔다 특히, 이것들은:계피산, 신나밀 cinnamate, ethyl cinnamate, 벤질 cinnamate, 스티렌, 바닐린, 신나밀 알코올, 2-phenylpropyl한 알콜 복용, 3-phenylpropyl cinnamate.[141]
MRSA를 치료하기 위한 체계적인 투여와 함께 흡입 항생제의 전달이 개발되고 있다.이것은 낭포성 섬유증 및 기타 호흡기 [103]감염을 가진 사람들의 결과를 개선할 수 있다.파지 요법은 동부 국가에서는 MRSA에서 수년간 사용되어 왔으며, [142][143]서방 국가에서는 연구가 진행 중이다.
2015년 코크란 체계적 검토는 병원에서 MRSA 확산을 막기 위해 장갑, 가운 및 마스크 착용의 효과를 평가하는 것을 목표로 했으나, 포함 대상으로 하는 적합한 연구는 확인되지 않았다.검토 저자는 장갑, 가운 및 마스크의 사용이 [144]병원에서 MRSA의 전염을 감소시키는지 여부를 결정하는 데 도움이 되도록 무작위 대조 시험을 실시할 필요가 있다고 결론지었다.
레퍼런스
- ^ a b c d e f g h i j k l m Gurusamy KS, Koti R, Toon CD, Wilson P, Davidson BR (August 2013). "Antibiotic therapy for the treatment of methicillin-resistant Staphylococcus aureus (MRSA) infections in surgical wounds". The Cochrane Database of Systematic Reviews (8): CD009726. doi:10.1002/14651858.CD009726.pub2. PMID 23963687.
- ^ a b Schenck LP, Surette MG, Bowdish DM (November 2016). "Composition and immunological significance of the upper respiratory tract microbiota". FEBS Letters. 590 (21): 3705–3720. doi:10.1002/1873-3468.12455. PMC 7164007. PMID 27730630.
- ^ Wollina U (2017). "Microbiome in atopic dermatitis". Clinical, Cosmetic and Investigational Dermatology. 10: 51–56. doi:10.2147/CCID.S130013. PMC 5327846. PMID 28260936.
- ^ a b c d e f g h i j k l m n o p q Liu C, Bayer A, Cosgrove SE, Daum RS, Fridkin SK, Gorwitz RJ, et al. (February 2011). "Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children". Clinical Infectious Diseases. 52 (3): e18-55. doi:10.1093/cid/ciq146. PMID 21208910.
- ^ a b c d e f g h Sganga G, Tascini C, Sozio E, Carlini M, Chirletti P, Cortese F, et al. (2016). "Focus on the prophylaxis, epidemiology and therapy of methicillin-resistant Staphylococcus aureus surgical site infections and a position paper on associated risk factors: the perspective of an Italian group of surgeons". World Journal of Emergency Surgery. 11 (1): 26. doi:10.1186/s13017-016-0086-1. PMC 4908758. PMID 27307786.
- ^ a b c "General Information About MRSA in the Community". Centers for Disease Control and Prevention. 10 September 2013. Retrieved 9 October 2014.
- ^ Lipsky BA, Tabak YP, Johannes RS, Vo L, Hyde L, Weigelt JA (May 2010). "Skin and soft tissue infections in hospitalised patients with diabetes: culture isolates and risk factors associated with mortality, length of stay and cost". Diabetologia. 53 (5): 914–23. doi:10.1007/s00125-010-1672-5. PMID 20146051. S2CID 5660826.
- ^ Otter JA, French GL (November 2011). "Community-associated meticillin-resistant Staphylococcus aureus strains as a cause of healthcare-associated infection". The Journal of Hospital Infection. 79 (3): 189–93. doi:10.1016/j.jhin.2011.04.028. PMID 21741111.
- ^ Golding GR, Quinn B, Bergstrom K, Stockdale D, Woods S, Nsungu M, et al. (January 2012). "Community-based educational intervention to limit the dissemination of community-associated methicillin-resistant Staphylococcus aureus in Northern Saskatchewan, Canada". BMC Public Health. 12 (1): 15. doi:10.1186/1471-2458-12-15. PMC 3287965. PMID 22225643.
- ^ a b Loewen, Kassandra; Schreiber, Yoko; Kirlew, Mike; Bocking, Natalie; Kelly, Len (July 2017). "Community-associated methicillin-resistant Staphylococcus aureus infection". Canadian Family Physician. 63 (7): 512–520. ISSN 0008-350X. PMC 5507223. PMID 28701438.
- ^ a b c Tacconelli E, De Angelis G, Cataldo MA, Pozzi E, Cauda R (January 2008). "Does antibiotic exposure increase the risk of methicillin-resistant Staphylococcus aureus (MRSA) isolation? A systematic review and meta-analysis". The Journal of Antimicrobial Chemotherapy. 61 (1): 26–38. doi:10.1093/jac/dkm416. PMID 17986491.
- ^ a b Dumyati G, Stone ND, Nace DA, Crnich CJ, Jump RL (April 2017). "Challenges and Strategies for Prevention of Multidrug-Resistant Organism Transmission in Nursing Homes". Current Infectious Disease Reports. 19 (4): 18. doi:10.1007/s11908-017-0576-7. PMC 5382184. PMID 28382547.
- ^ "Study: Beachgoers More Likely to Catch MRSA". FoxNews.com. Reuters. 2009-02-16.
- ^ Marilynn Marchione (2009-09-12). "Dangerous staph germs found at West Coast beaches". Associated Press.
- ^ Zinderman CE, Conner B, Malakooti MA, LaMar JE, Armstrong A, Bohnker BK (May 2004). "Community-acquired methicillin-resistant Staphylococcus aureus among military recruits". Emerging Infectious Diseases. 10 (5): 941–4. doi:10.3201/eid1005.030604. PMC 3323224. PMID 15200838.
- ^ a b c d "MRSA History Timeline: The First Half-Century, 1959–2009". The University of Chicago Medical Center. 2010.
- ^ a b David MZ, Daum RS (July 2010). "Community-associated methicillin-resistant Staphylococcus aureus: epidemiology and clinical consequences of an emerging epidemic". Clinical Microbiology Reviews. 23 (3): 616–87. doi:10.1128/CMR.00081-09. PMC 2901661. PMID 20610826.
- ^ a b c d e f g Gopal S, Divya KC (March 2017). "Staphylococcus aureus prevalence from dairy cows in India act as potential risk for community-associated infections?: A review". Veterinary World. 10 (3): 311–318. doi:10.14202/vetworld.2017.311-318. PMC 5387658. PMID 28435193.
- ^ a b Ficalora R (2013). Mayo Clinic internal medicine board review. Oxford: Oxford University Press. ISBN 978-0-19-994894-9.
- ^ a b c d Winn W (2006). Koneman's color atlas and textbook of diagnostic microbiology. Philadelphia: Lippincott Williams & Wilkins. ISBN 978-0-7817-3014-3.
- ^ a b c d Gurusamy KS, Koti R, Toon CD, Wilson P, Davidson BR (November 2013). Gurusamy KS (ed.). "Antibiotic therapy for the treatment of methicillin-resistant Staphylococcus aureus (MRSA) in non surgical wounds". The Cochrane Database of Systematic Reviews (11): CD010427. doi:10.1002/14651858.CD010427.pub2. PMID 24242704.
- ^ Jacobs A (2014). "Hospital-acquired methicillin-resistant Staphylococcus aureus: status and trends". Radiologic Technology. 85 (6): 623–48, quiz 649–52. PMID 25002642.
- ^ Davis C. "Is MRSA Contagious?". Medicinenet.com. Retrieved 24 October 2017.
- ^ a b Muto CA, Jernigan JA, Ostrowsky BE, Richet HM, Jarvis WR, Boyce JM, Farr BM (May 2003). "SHEA guideline for preventing nosocomial transmission of multidrug-resistant strains of Staphylococcus aureus and enterococcus". Infection Control and Hospital Epidemiology. 24 (5): 362–86. CiteSeerX 10.1.1.575.8929. doi:10.1086/502213. PMID 12785411. S2CID 19544705.
- ^ a b Hughes C, Tunney M, Bradley MC (November 2013). "Infection control strategies for preventing the transmission of meticillin-resistant Staphylococcus aureus (MRSA) in nursing homes for older people". The Cochrane Database of Systematic Reviews. 2013 (11): CD006354. doi:10.1002/14651858.CD006354.pub4. PMC 7000924. PMID 24254890.
- ^ "PURE Bioscience". purebio.com. Archived from the original on 2009-02-24.
- ^ a b Mehndiratta PL, Bhalla P (September 2014). "Use of antibiotics in animal agriculture & emergence of methicillin-resistant Staphylococcus aureus (MRSA) clones: need to assess the impact on public health". The Indian Journal of Medical Research. 140 (3): 339–44. PMC 4248379. PMID 25366200.
- ^ Vitale CB, Gross TL, Weese JS (December 2006). "Methicillin-resistant Staphylococcus aureus in cat and owner". Emerging Infectious Diseases. 12 (12): 1998–2000. doi:10.3201/eid1212.060725. PMC 3291366. PMID 17354344.
 이 문서에는 질병통제예방센터의 웹사이트 또는 문서에 있는 퍼블릭 도메인 자료가 포함되어 있습니다.
이 문서에는 질병통제예방센터의 웹사이트 또는 문서에 있는 퍼블릭 도메인 자료가 포함되어 있습니다. - ^ Salgado CD, Farr BM, Calfee DP (January 2003). "Community-acquired methicillin-resistant Staphylococcus aureus: a meta-analysis of prevalence and risk factors". Clinical Infectious Diseases. 36 (2): 131–9. doi:10.1086/345436. PMID 12522744.
- ^ Kazakova SV, Hageman JC, Matava M, Srinivasan A, Phelan L, Garfinkel B, et al. (February 2005). "A clone of methicillin-resistant Staphylococcus aureus among professional football players". The New England Journal of Medicine. 352 (5): 468–75. doi:10.1056/NEJMoa042859. PMID 15689585.
- ^ Epstein V (21 December 2007). "Texas Football Succumbs to Virulent Staph Infection From Turf". Bloomberg. Retrieved 10 June 2010.
- ^ Yasinskas, Pat (11 October 2013). "Third Tampa Bay Buccaneers player tests positive for MRSA staph infection". ESPN. ESPN Internet Ventures. Retrieved 11 October 2013.
- ^ Hernandez D (August 12, 2015). "Dodgers' Justin Turner nears return from MRSA infection". Los Angeles Times. Retrieved August 13, 2015.
- ^ Rappoport I (October 11, 2015). "MRSA infection leaves Giants' Daniel Fells in dire situation". NFL.com. Retrieved October 12, 2015.
- ^ Gray JW (April 2004). "MRSA: the problem reaches paediatrics". Archives of Disease in Childhood. 89 (4): 297–8. doi:10.1136/adc.2003.045534. PMC 1719885. PMID 15033832.
- ^ Bratu S, Eramo A, Kopec R, Coughlin E, Ghitan M, Yost R, et al. (June 2005). "Community-associated methicillin-resistant Staphylococcus aureus in hospital nursery and maternity units". Emerging Infectious Diseases. 11 (6): 808–13. doi:10.3201/eid1106.040885. PMC 3367583. PMID 15963273.
- ^ "National Prevalence Study of Methicillin-Resistant Staphylococcus aureus (MRSA) in U.S. Healthcare Facilities". Association for Professionals in Infection Control & Epidemiology. June 25, 2007. Archived from the original on September 7, 2007. Retrieved 2007-07-14.
- ^ "Staph Infections and MRSA in Children: Prevention, Symptoms, and Treatment". webmd.com.
- ^ Parikh, Meghana P.; Octaria, Rany; Kainer, Marion A. (2020). "Methicillin-Resistant Staphylococcus aureus Bloodstream Infections and Injection Drug Use, Tennessee, USA, 2015–2017 – Volume 26, Number 3—March 2020 – Emerging Infectious Diseases journal – CDC". Emerging Infectious Diseases. 26 (3). doi:10.3201/eid2603.191408. PMC 7045815. PMID 32091385. S2CID 211098414.
- ^ a b c d e Jensen SO, Lyon BR (June 2009). "Genetics of antimicrobial resistance in Staphylococcus aureus". Future Microbiology. 4 (5): 565–82. doi:10.2217/fmb.09.30. PMID 19492967.
- ^ Chambers HF (February 2001). "Methicillin-resistant Staphylococcus aureus. Mechanisms of resistance and implications for treatment". Postgraduate Medicine. 109 (2 Suppl): 43–50. doi:10.3810/pgm.02.2001.suppl12.65 (inactive 28 February 2022). PMID 19667557.
{{cite journal}}: CS1 유지 : 2022년 2월 현재 DOI 비활성화 (링크) - ^ a b c d e f g h i Lowy FD (May 2003). "Antimicrobial resistance: the example of Staphylococcus aureus". The Journal of Clinical Investigation. 111 (9): 1265–73. doi:10.1172/JCI18535. PMC 154455. PMID 12727914.
- ^ a b c d e f Pantosti A, Sanchini A, Monaco M (June 2007). "Mechanisms of antibiotic resistance in Staphylococcus aureus". Future Microbiology. 2 (3): 323–34. doi:10.2217/17460913.2.3.323. PMID 17661706.
- ^ Kaito C, Saito Y, Nagano G, Ikuo M, Omae Y, Hanada Y, et al. (February 2011). Cheung A (ed.). "Transcription and translation products of the cytolysin gene psm-mec on the mobile genetic element SCCmec regulate Staphylococcus aureus virulence". PLOS Pathogens. 7 (2): e1001267. doi:10.1371/journal.ppat.1001267. PMC 3033363. PMID 21304931.
- ^ Cheung GY, Villaruz AE, Joo HS, Duong AC, Yeh AJ, Nguyen TH, et al. (July 2014). "Genome-wide analysis of the regulatory function mediated by the small regulatory psm-mec RNA of methicillin-resistant Staphylococcus aureus". International Journal of Medical Microbiology. 304 (5–6): 637–44. doi:10.1016/j.ijmm.2014.04.008. PMC 4087065. PMID 24877726.
- ^ Enright MC, Robinson DA, Randle G, Feil EJ, Grundmann H, Spratt BG (May 2002). "The evolutionary history of methicillin-resistant Staphylococcus aureus (MRSA)". Proceedings of the National Academy of Sciences of the United States of America. 99 (11): 7687–92. Bibcode:2002PNAS...99.7687E. doi:10.1073/pnas.122108599. PMC 124322. PMID 12032344.
- ^ Wu SW, de Lencastre H, Tomasz A (April 2001). "Recruitment of the mecA gene homologue of Staphylococcus sciuri into a resistance determinant and expression of the resistant phenotype in Staphylococcus aureus". Journal of Bacteriology. 183 (8): 2417–24. doi:10.1128/JB.183.8.2417-2424.2001. PMC 95156. PMID 11274099.
- ^ a b c Kuo SC, Chiang MC, Lee WS, Chen LY, Wu HS, Yu KW, et al. (January 2012). "Comparison of microbiological and clinical characteristics based on SCCmec typing in patients with community-onset meticillin-resistant Staphylococcus aureus (MRSA) bacteraemia" (PDF). International Journal of Antimicrobial Agents. 39 (1): 22–6. doi:10.1016/j.ijantimicag.2011.08.014. PMID 21982834.
- ^ a b c Collins J, Rudkin J, Recker M, Pozzi C, O'Gara JP, Massey RC (April 2010). "Offsetting virulence and antibiotic resistance costs by MRSA". The ISME Journal. 4 (4): 577–84. doi:10.1038/ismej.2009.151. PMID 20072161. S2CID 38231565.
- ^ Sahebnasagh R, Saderi H, Owlia P.테헤란의 임상 샘플에서 메티실린 내성 황색포도상구균주를 검출하는 방법.제1회 이란 국제 의료 세균학 회의; 9월 4-7일; 이란 타브리즈. 2011.195 페이지.
- ^ a b Berger-Bächi B (November 1999). "Genetic basis of methicillin resistance in Staphylococcus aureus". Cellular and Molecular Life Sciences. 56 (9–10): 764–70. doi:10.1007/s000180050023. PMID 11212336. S2CID 40019841. Archived from the original on 2013-02-12.
- ^ Goering RV, McDougal LK, Fosheim GE, Bonnstetter KK, Wolter DJ, Tenover FC (June 2007). "Epidemiologic distribution of the arginine catabolic mobile element among selected methicillin-resistant and methicillin-susceptible Staphylococcus aureus isolates". Journal of Clinical Microbiology. 45 (6): 1981–4. doi:10.1128/JCM.00273-07. PMC 1933090. PMID 17409207.
- ^ Joshi, Gauri S.; Spontak, Jeffrey S.; Klapper, David G.; Richardson, Anthony R. (2011-09-08). "Arginine catabolic mobile element encoded speG abrogates the unique hypersensitivity of Staphylococcus aureus to exogenous polyamines". Molecular Microbiology. Wiley. 82 (1): 9–20. doi:10.1111/j.1365-2958.2011.07809.x. ISSN 0950-382X. PMC 3183340. PMID 21902734.
- ^ a b c d e f Gordon RJ, Lowy FD (June 2008). "Pathogenesis of methicillin-resistant Staphylococcus aureus infection". Clinical Infectious Diseases. 46 Suppl 5 (Suppl 5): S350–9. doi:10.1086/533591. PMC 2474459. PMID 18462090.
- ^ Johnson AP, Aucken HM, Cavendish S, Ganner M, Wale MC, Warner M, et al. (July 2001). "Dominance of EMRSA-15 and -16 among MRSA causing nosocomial bacteraemia in the UK: analysis of isolates from the European Antimicrobial Resistance Surveillance System (EARSS)". The Journal of Antimicrobial Chemotherapy. 48 (1): 143–4. doi:10.1093/jac/48.1.143. PMID 11418528.
- ^ a b Diep BA, Carleton HA, Chang RF, Sensabaugh GF, Perdreau-Remington F (June 2006). "Roles of 34 virulence genes in the evolution of hospital- and community-associated strains of methicillin-resistant Staphylococcus aureus". The Journal of Infectious Diseases. 193 (11): 1495–503. doi:10.1086/503777. PMID 16652276.
- ^ a b Stefani S, Chung DR, Lindsay JA, Friedrich AW, Kearns AM, Westh H, Mackenzie FM (April 2012). "Meticillin-resistant Staphylococcus aureus (MRSA): global epidemiology and harmonisation of typing methods". International Journal of Antimicrobial Agents. 39 (4): 273–82. doi:10.1016/j.ijantimicag.2011.09.030. PMID 22230333.
- ^ a b c d e f Calfee DP (2011). "The epidemiology, treatment, and prevention of transmission of methicillin-resistant Staphylococcus aureus". Journal of Infusion Nursing. 34 (6): 359–64. doi:10.1097/NAN.0b013e31823061d6. PMID 22101629. S2CID 11490852.
- ^ Daum RS (July 2007). "Clinical practice. Skin and soft-tissue infections caused by methicillin-resistant Staphylococcus aureus". The New England Journal of Medicine. 357 (4): 380–90. doi:10.1056/NEJMcp070747. PMID 17652653.
- ^ Wang R, Braughton KR, Kretschmer D, Bach TH, Queck SY, Li M, et al. (December 2007). "Identification of novel cytolytic peptides as key virulence determinants for community-associated MRSA". Nature Medicine. 13 (12): 1510–4. doi:10.1038/nm1656. PMID 17994102. S2CID 8465052.
- ^ Tristan A, Bes M, Meugnier H, Lina G, Bozdogan B, Courvalin P, et al. (April 2007). "Global distribution of Panton-Valentine leukocidin--positive methicillin-resistant Staphylococcus aureus, 2006". Emerging Infectious Diseases. 13 (4): 594–600. doi:10.3201/eid1304.061316. PMC 2725977. PMID 17553275.
- ^ Gould IM, David MZ, Esposito S, Garau J, Lina G, Mazzei T, Peters G (February 2012). "New insights into meticillin-resistant Staphylococcus aureus (MRSA) pathogenesis, treatment and resistance". International Journal of Antimicrobial Agents. 39 (2): 96–104. doi:10.1016/j.ijantimicag.2011.09.028. PMID 22196394.
- ^ David MZ, Rudolph KM, Hennessy TW, Boyle-Vavra S, Daum RS (November 2008). "Molecular epidemiology of methicillin-resistant Staphylococcus aureus, rural southwestern Alaska". Emerging Infectious Diseases. 14 (11): 1693–9. doi:10.3201/eid1411.080381. PMC 2630737. PMID 18976551.
- ^ Panel on Biological Hazards (16 June 2009). "Joint scientific report of ECDC, EFSA and EMEA on meticillin resistant Staphylococcus aureus (MRSA) in livestock, companion animals and food". EFSA Journal. 7 (6). doi:10.2903/j.efsa.2009.301r.
- ^ Graveland H, Duim B, van Duijkeren E, Heederik D, Wagenaar JA (December 2011). "Livestock-associated methicillin-resistant Staphylococcus aureus in animals and humans". International Journal of Medical Microbiology. 301 (8): 630–4. doi:10.1016/j.ijmm.2011.09.004. hdl:1874/407042. PMID 21983338.
- ^ Francois P, Schrenzel J (2008). "Rapid Diagnosis and Typing of Staphylococcus aureus". Staphylococcus: Molecular Genetics. Caister Academic Press. ISBN 978-1-904455-29-5.
- ^ Mackay IM, ed. (2007). Real-Time PCR in Microbiology: From Diagnosis to Characterization. Caister Academic Press. ISBN 978-1-904455-18-9.
- ^ Seiken D. "MRSA latex test for PBP2".
- ^ a b c Murray P (2007). Manual of clinical microbiology. Washington, D.C: ASM Press. ISBN 978-1-55581-371-0.
- ^ Tacconelli E, De Angelis G, de Waure C, Cataldo MA, La Torre G, Cauda R (September 2009). "Rapid screening tests for meticillin-resistant Staphylococcus aureus at hospital admission: systematic review and meta-analysis". The Lancet. Infectious Diseases. 9 (9): 546–54. doi:10.1016/S1473-3099(09)70150-1. PMID 19695491.
- ^ 헬스케어 설정(2019년 2월 28일).2021년 3월 19일 https://www.cdc.gov/mrsa/healthcare/index.html에서 취득
- ^ McCaughey B. "Unnecessary Deaths: The Human and Financial Costs of Hospital Infections" (PDF) (2nd ed.). Archived from the original (PDF) on July 11, 2007. Retrieved 2007-08-05.
- ^ "Personal Prevention of MRSA Skin Infections". CDC. 9 August 2010. Retrieved 25 May 2017.
 이 문서에는 질병통제예방센터의 웹사이트 또는 문서에 있는 퍼블릭 도메인 자료가 포함되어 있습니다.
이 문서에는 질병통제예방센터의 웹사이트 또는 문서에 있는 퍼블릭 도메인 자료가 포함되어 있습니다. - ^ a b c "NIOSH MRSA and the Workplace". United States National Institute for Occupational Safety and Health. Retrieved 2017-05-25.
- ^ 급성치료시설에서 병원 내 황색포도상구균 혈류감염 예방전략(2019년 12월 16일).2021년 3월 19일 https://www.cdc.gov/hai/prevent/staph-prevention-strategies.html#anchor_1565005744에서 취득
- ^ CDC (1998). "Guidelines for Infection Control in Health Care Personnel, 1998". Centers for Disease Control and Prevention. Retrieved December 18, 2007.
- ^ Banach DB, Bearman G, Barnden M, Hanrahan JA, Leekha S, Morgan DJ, et al. (February 2018). "Duration of Contact Precautions for Acute-Care Settings". Infection Control and Hospital Epidemiology. 39 (2): 127–144. doi:10.1017/ice.2017.245. PMID 29321078.
- ^ 급성치료시설에서 병원 내 황색포도상구균 혈류감염 예방전략(2019년 12월 16일).2021년 3월 19일 https://www.cdc.gov/hai/prevent/staph-prevention-strategies.html#anchor_1565005744에서 취득
- ^ a b c "Living With MRSA" (PDF). Group Health Cooperative/Tacoma-Pierce County Health Dept./Washington State Dept. of Health. Retrieved 20 November 2011.
- ^ Cooper BS, Medley GF, Stone SP, Kibbler CC, Cookson BD, Roberts JA, et al. (July 2004). "Methicillin-resistant Staphylococcus aureus in hospitals and the community: stealth dynamics and control catastrophes". Proceedings of the National Academy of Sciences of the United States of America. 101 (27): 10223–8. Bibcode:2004PNAS..10110223C. doi:10.1073/pnas.0401324101. PMC 454191. PMID 15220470.
- ^ Bootsma MC, Diekmann O, Bonten MJ (April 2006). "Controlling methicillin-resistant Staphylococcus aureus: quantifying the effects of interventions and rapid diagnostic testing". Proceedings of the National Academy of Sciences of the United States of America. 103 (14): 5620–5. Bibcode:2006PNAS..103.5620B. doi:10.1073/pnas.0510077103. PMC 1459403. PMID 16565219.
- ^ "MRSA (Methicillin-Resistant Staphylococcus aureus)". National Library of Medicine – PubMed Health. US National Institutes of Health. Retrieved 20 November 2011.
- ^ Shi CM, Nakao H, Yamazaki M, Tsuboi R, Ogawa H (November 2007). "Mixture of sugar and povidone-iodine stimulates healing of MRSA-infected skin ulcers on db/db mice". Archives of Dermatological Research. 299 (9): 449–56. doi:10.1007/s00403-007-0776-3. PMID 17680256. S2CID 28807435.
- ^ "The Workplace (Health, Safety and Welfare) Regulations 1992". UK legislation. The National Archives/Her Majesty's Stationery Office. Retrieved January 12, 2018.
- ^ Foundation, Internet Memory. "[ARCHIVED CONTENT] UK Government Web Archive – The National Archives". Archived from the original on 2012-09-19.
{{cite web}}: CS1 maint: bot: 원래 URL 상태를 알 수 없습니다(링크). - ^ "Government Response to the Communities and Local Government Committee Report on the Provision of Public Toilets". Archived from the original on 2012-09-19.
- ^ a b Gurusamy KS, Koti R, Toon CD, Wilson P, Davidson BR (November 2013). Gurusamy KS (ed.). "Antibiotic therapy for the treatment of methicillin-resistant Staphylococcus aureus (MRSA) in non surgical wounds". The Cochrane Database of Systematic Reviews (11): CD010427. doi:10.1002/14651858.CD010427. PMID 24242704.
- ^ Choo EJ, Chambers HF (December 2016). "Treatment of Methicillin-Resistant Staphylococcus aureus Bacteremia". Infection & Chemotherapy. 48 (4): 267–273. doi:10.3947/ic.2016.48.4.267. PMC 5204005. PMID 28032484.
- ^ a b c d Yue J, Dong BR, Yang M, Chen X, Wu T, Liu GJ (January 2016). "Linezolid versus vancomycin for skin and soft tissue infections". The Cochrane Database of Systematic Reviews (1): CD008056. doi:10.1002/14651858.CD008056.pub3. PMID 26758498.
- ^ "FDA Approves Teflaro for Bacterial Infections". Food and Drug Administration.
- ^ Schentag JJ, Hyatt JM, Carr JR, Paladino JA, Birmingham MC, Zimmer GS, Cumbo TJ (May 1998). "Genesis of methicillin-resistant Staphylococcus aureus (MRSA), how treatment of MRSA infections has selected for vancomycin-resistant Enterococcus faecium, and the importance of antibiotic management and infection control". Clinical Infectious Diseases. 26 (5): 1204–14. doi:10.1086/520287. PMID 9597254.
- ^ Rybak MJ, Lerner SA, Levine DP, Albrecht LM, McNeil PL, Thompson GA, et al. (April 1991). "Teicoplanin pharmacokinetics in intravenous drug abusers being treated for bacterial endocarditis". Antimicrobial Agents and Chemotherapy. 35 (4): 696–700. doi:10.1128/AAC.35.4.696. PMC 245081. PMID 1829880.
- ^ Janknegt R (June 1997). "The treatment of staphylococcal infections with special reference to pharmacokinetic, pharmacodynamic and pharmacoeconomic considerations". Pharmacy World & Science. 19 (3): 133–41. doi:10.1023/A:1008609718457. PMID 9259029. S2CID 10413339.
- ^ Chang FY, Peacock JE, Musher DM, Triplett P, MacDonald BB, Mylotte JM, et al. (September 2003). "Staphylococcus aureus bacteremia: recurrence and the impact of antibiotic treatment in a prospective multicenter study". Medicine. 82 (5): 333–9. doi:10.1097/01.md.0000091184.93122.09. PMID 14530782. S2CID 15917805.
- ^ Siegman-Igra Y, Reich P, Orni-Wasserlauf R, Schwartz D, Giladi M (2005). "The role of vancomycin in the persistence or recurrence of Staphylococcus aureus bacteraemia". Scandinavian Journal of Infectious Diseases. 37 (8): 572–578. doi:10.1080/00365540510038488. PMID 16138425. S2CID 24390948.
- ^ Sieradzki K, Tomasz A (April 1997). "Inhibition of cell wall turnover and autolysis by vancomycin in a highly vancomycin-resistant mutant of Staphylococcus aureus". Journal of Bacteriology. 179 (8): 2557–66. doi:10.1128/jb.179.8.2557-2566.1997. PMC 179004. PMID 9098053.
- ^ Schito GC (March 2006). "The importance of the development of antibiotic resistance in Staphylococcus aureus". Clinical Microbiology and Infection. 12 Suppl 1 (Suppl 1): 3–8. doi:10.1111/j.1469-0691.2006.01343.x. PMID 16445718.
- ^ Bozdogan B, Esel D, Whitener C, Browne FA, Appelbaum PC (November 2003). "Antibacterial susceptibility of a vancomycin-resistant Staphylococcus aureus strain isolated at the Hershey Medical Center". The Journal of Antimicrobial Chemotherapy. 52 (5): 864–8. doi:10.1093/jac/dkg457. PMID 14563898.
- ^ Xie J, Pierce JG, James RC, Okano A, Boger DL (September 2011). "A redesigned vancomycin engineered for dual D-Ala-D-ala And D-Ala-D-Lac binding exhibits potent antimicrobial activity against vancomycin-resistant bacteria". Journal of the American Chemical Society. 133 (35): 13946–9. doi:10.1021/ja207142h. PMC 3164945. PMID 21823662.
- ^ Mongkolrattanothai K, Boyle S, Kahana MD, Daum RS (October 2003). "Severe Staphylococcus aureus infections caused by clonally related community-acquired methicillin-susceptible and methicillin-resistant isolates". Clinical Infectious Diseases. 37 (8): 1050–8. doi:10.1086/378277. PMID 14523769.
- ^ Tsiodras S, Gold HS, Sakoulas G, Eliopoulos GM, Wennersten C, Venkataraman L, et al. (July 2001). "Linezolid resistance in a clinical isolate of Staphylococcus aureus". Lancet. 358 (9277): 207–8. doi:10.1016/S0140-6736(01)05410-1. PMID 11476839. S2CID 27426801.
- ^ Hope R, Livermore DM, Brick G, Lillie M, Reynolds R (November 2008). "Non-susceptibility trends among staphylococci from bacteraemias in the UK and Ireland, 2001-06" (PDF). The Journal of Antimicrobial Chemotherapy. 62 Suppl 2: ii65-74. doi:10.1093/jac/dkn353. PMID 18819981.
- ^ a b Maselli DJ, Keyt H, Restrepo MI (May 2017). "Inhaled Antibiotic Therapy in Chronic Respiratory Diseases". International Journal of Molecular Sciences. 18 (5): 1062. doi:10.3390/ijms18051062. PMC 5454974. PMID 28509852.
- ^ Loeb MB, Main C, Eady A, Walker-Dilks C, et al. (Cochrane Wounds Group) (2003-10-20). "Antimicrobial drugs for treating methicillin-resistant Staphylococcus aureus colonization". The Cochrane Database of Systematic Reviews (4): CD003340. doi:10.1002/14651858.CD003340. PMID 14583969.
- ^ "MRSA Infections". Keep Kids Healthy. Archived from the original on December 9, 2007.
- ^ Murray, Christopher JL; Ikuta, Kevin Shunji; Sharara, Fablina; Swetschinski, Lucien; Aguilar, Gisela Robles; Gray, Authia; Han, Chieh; Bisignano, Catherine; Rao, Puja; Wool, Eve; Johnson, Sarah C. (2022-01-19). "Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis". The Lancet. 399 (10325): 629–655. doi:10.1016/S0140-6736(21)02724-0. ISSN 0140-6736. PMC 8841637. PMID 35065702.
- ^ a b Fritz SA, Garbutt J, Elward A, Shannon W, Storch GA (June 2008). "Prevalence of and risk factors for community-acquired methicillin-resistant and methicillin-sensitive staphylococcus aureus colonization in children seen in a practice-based research network". Pediatrics. 121 (6): 1090–8. doi:10.1542/peds.2007-2104. PMID 18519477. S2CID 23112235.
- ^ Klein EY, Sun L, Smith DL, Laxminarayan R (April 2013). "The changing epidemiology of methicillin-resistant Staphylococcus aureus in the United States: a national observational study". American Journal of Epidemiology. 177 (7): 666–74. doi:10.1093/aje/kws273. PMID 23449778.
- ^ "Antibiotic Resistance Threats in the United States, 2013 – Antibiotic/Antimicrobial Resistance – CDC". 2019-05-07.
 이 문서에는 질병통제예방센터의 웹사이트 또는 문서에 있는 퍼블릭 도메인 자료가 포함되어 있습니다.
이 문서에는 질병통제예방센터의 웹사이트 또는 문서에 있는 퍼블릭 도메인 자료가 포함되어 있습니다. - ^ "ResistanceMap – Antibiotic Resistance". resistancemap.cddep.org. Center for Disease Dynamics, Economics & Policy. 2017. Retrieved 27 May 2017. 참고: 검색은 웹사이트에서 수행해야 합니다. 검색은 대화식으로 수행되며 통계는 최신 정보를 기반으로 합니다.
- ^ Klevens RM, Edwards JR, Richards CL, Horan TC, Gaynes RP, Pollock DA, Cardo DM (2007). "Estimating health care-associated infections and deaths in U.S. hospitals, 2002". Public Health Reports. 122 (2): 160–6. doi:10.1177/003335490712200205. PMC 1820440. PMID 17357358.
- ^ Hidron AI, Edwards JR, Patel J, Horan TC, Sievert DM, Pollock DA, Fridkin SK (November 2008). "NHSN annual update: antimicrobial-resistant pathogens associated with healthcare-associated infections: annual summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006–2007". Infection Control and Hospital Epidemiology. 29 (11): 996–1011. doi:10.1086/591861. PMID 18947320. S2CID 205988392.
- ^ Johnson AP, Pearson A, Duckworth G (September 2005). "Surveillance and epidemiology of MRSA bacteraemia in the UK". The Journal of Antimicrobial Chemotherapy. 56 (3): 455–62. doi:10.1093/jac/dki266. PMID 16046464.
- ^ Graham PL, Lin SX, Larson EL (March 2006). "A U.S. population-based survey of Staphylococcus aureus colonization". Annals of Internal Medicine. 144 (5): 318–25. doi:10.7326/0003-4819-144-5-200603070-00006. PMID 16520472. S2CID 38816447.
- ^ Jernigan JA, Arnold K, Heilpern K, Kainer M, Woods C, Hughes JM (2006-05-12). "Methicillin-resistant Staphylococcus aureus as community pathogen". Symposium on Community-Associated Methicillin-resistant Staphylococcus aureus (Atlanta, Georgia, U.S.). Cited in Emerg Infect Dis. Centers for Disease Control and Prevention. Retrieved 2007-01-27.
- ^ Voss, Andreas; Loeffen, Frans; Bakker, Judith; Klaassen, Corne; Wulf, Mireille (2005). "Methicillin-resistant Staphylococcus aureus in Pig Farming – Volume 11, Number 12—December 2005 – Emerging Infectious Diseases journal – CDC". Emerging Infectious Diseases. 11 (12): 1965–1966. doi:10.3201/eid1112.050428. PMC 3367632. PMID 16485492.
- ^ "Community-acquired MRSA in Children with no predisposing risk" (PDF).
- ^ Holden MT, Feil EJ, Lindsay JA, Peacock SJ, Day NP, Enright MC, et al. (June 2004). "Complete genomes of two clinical Staphylococcus aureus strains: evidence for the rapid evolution of virulence and drug resistance". Proceedings of the National Academy of Sciences of the United States of America. 101 (26): 9786–91. Bibcode:2004PNAS..101.9786H. doi:10.1073/pnas.0402521101. PMC 470752. PMID 15213324.
- ^ Blot SI, Vandewoude KH, Hoste EA, Colardyn FA (October 2002). "Outcome and attributable mortality in critically Ill patients with bacteremia involving methicillin-susceptible and methicillin-resistant Staphylococcus aureus". Archives of Internal Medicine. 162 (19): 2229–35. doi:10.1001/archinte.162.19.2229. PMID 12390067.
- ^ Liu C, Graber CJ, Karr M, Diep BA, Basuino L, Schwartz BS, et al. (June 2008). "A population-based study of the incidence and molecular epidemiology of methicillin-resistant Staphylococcus aureus disease in San Francisco, 2004–2005". Clinical Infectious Diseases. 46 (11): 1637–46. doi:10.1086/587893. PMID 18433335.
- ^ Noskin GA, Rubin RJ, Schentag JJ, Kluytmans J, Hedblom EC, Smulders M, et al. (2005). "The burden of Staphylococcus aureus infections on hospitals in the United States: an analysis of the 2000 and 2001 Nationwide Inpatient Sample Database". Archives of Internal Medicine. 165 (15): 1756–61. doi:10.1001/archinte.165.15.1756. PMID 16087824.
- ^ Cosgrove SE, Qi Y, Kaye KS, Harbarth S, Karchmer AW, Carmeli Y (February 2005). "The impact of methicillin resistance in Staphylococcus aureus bacteremia on patient outcomes: mortality, length of stay, and hospital charges". Infection Control and Hospital Epidemiology. 26 (2): 166–74. doi:10.1086/502522. PMID 15756888. S2CID 22553908.
- ^ Hardy KJ, Hawkey PM, Gao F, Oppenheim BA (January 2004). "Methicillin resistant Staphylococcus aureus in the critically ill". British Journal of Anaesthesia. 92 (1): 121–30. doi:10.1093/bja/aeh008. PMID 14665563.
- ^ Wyllie DH, Crook DW, Peto TE (August 2006). "Mortality after Staphylococcus aureus bacteraemia in two hospitals in Oxfordshire, 1997–2003: cohort study". BMJ. 333 (7562): 281. doi:10.1136/bmj.38834.421713.2F. PMC 1526943. PMID 16798756.
- ^ "Healthcare-associated infections—HAI—CDC" (PDF). cdc.gov. 2019-06-03.
- ^ a b "MRSA Surveillance". Centers for Disease Control and Prevention. April 8, 2011.
- ^ a b "Outcomes in EHCI 2015" (PDF). Health Consumer Powerhouse. 26 January 2016. Archived from the original (PDF) on 6 June 2017. Retrieved 27 January 2016.
- ^ Thompson N, Smith-Spark L. "Thousand-year-old Anglo-Saxon potion kills MRSA superbug". CNN News. CNN/Time Warner. Retrieved 1 April 2015.
- ^ "Bucs' Nicks, Tynes have MRSA infections". Tampa Bay Times. Retrieved 3 June 2017.
- ^ Correspondent, Elizabeth Cohen, Senior Medical (12 October 2015). "MRSA: The tiny bacteria that can tackle giants". CNN. Retrieved 3 June 2017.
- ^ Biddle S, Cush A. "This Australian Says He and His Dead Friend Invented Bitcoin". Gizmodo. Retrieved 3 June 2017.
- ^ Singh J, Johnson RC, Schlett CD, Elassal EM, Crawford KB, Mor D, et al. (2016-10-26). "Multi-Body-Site Microbiome and Culture Profiling of Military Trainees Suffering from Skin and Soft Tissue Infections at Fort Benning, Georgia". mSphere. 1 (5): e00232–16. doi:10.1128/mSphere.00232-16. PMC 5064451. PMID 27747300.
- ^ "Hospital Infection Lawsuits are on the Rise – AboutLawsuits.com". www.aboutlawsuits.com. 2 December 2008. Retrieved 3 June 2017.
- ^ "Doc who treated superbug vic was sued before". New York Daily News. Retrieved 3 June 2017.
- ^ "MRSA: The Drug-Resistant 'Superbug' That Won't Die". NPR.org. Retrieved 3 June 2017.
- ^ ""Should I Worry About...?" MRSA (TV Episode 2004)". IMDb. 23 September 2004. Retrieved 3 June 2017.
- ^ McKenna M. "Resistance: The Movie That Will Make You Care About Antibiotic Misuse". Wired. Retrieved 3 June 2017.
- ^ "Line of Duty series 4: Everything you need to know". Digital Spy. 24 April 2017. Retrieved 3 June 2017.
- ^ results, search (1 February 2011). Superbug: The Fatal Menace of MRSA. Free Press. ISBN 978-1-4165-5728-9.
- ^ "Facing the Future of Antibiotic Resistance – The Change Starts Here". HuffPost UK. 18 July 2016. Retrieved 3 June 2017.
- ^ Lingbeck JM, O'Bryan CA, Martin EM, Adams JP, Crandall PG (2015). "Sweetgum: An ancient source of beneficial compounds with modern benefits". Pharmacognosy Reviews. 9 (17): 1–11. doi:10.4103/0973-7847.156307. PMC 4441155. PMID 26009686.
- ^ Reardon S (June 2014). "Phage therapy gets revitalized". Nature. 510 (7503): 15–6. Bibcode:2014Natur.510...15R. doi:10.1038/510015a. PMID 24899282. S2CID 205081324.
- ^ Robson D. "The viruses that may save humanity". Retrieved 2018-09-25.
- ^ López-Alcalde J, Mateos-Mazón M, Guevara M, Conterno LO, Solà I, Cabir Nunes S, Bonfill Cosp X (July 2015). "Gloves, gowns and masks for reducing the transmission of meticillin-resistant Staphylococcus aureus (MRSA) in the hospital setting". The Cochrane Database of Systematic Reviews. 2015 (7): CD007087. doi:10.1002/14651858.cd007087.pub2. PMC 7026606. PMID 26184396.
추가 정보
- 질병통제예방센터 정보, 예방, 통계, 위험 그룹, 원인, 교육 자원 및 환경 요인.
- 국립산업안전보건연구원은 세균, 작업장 내 피폭 및 감염 위험 감소에 대한 정보를 제공한다.