비금속
Nonmetal
각 원소를 비금속 상태로 분류하는 빈도를 나타내는 주기율표 추출물:
사실상 항상 14[n 1]
자주 3개[n 2]
6 때때로 (모노이드)[n 3]
부근의 금속은 회색 글꼴로 표시되어 있다.[n 4]
비금속에는 정확한 정의가 없다. 어떤 요소가 그러한 변화로 간주되는가.
수소는 보통 그룹 1(아래 전체 표에 해당)에 있지만 그룹 17(위의 추출물에 해당)에 포함될 수 있다.[n 5]
| ▉▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ |
| ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ ▉ |
화학에서 비금속은 일반적으로 금속 성질의 우위성이 결여된 화학 원소로, 무색의 기체에서 광택과 굴절(고융점) 고형분에 이르기까지 다양하다.비금속에서의 전자는 금속의 전자와 다르게 작용한다.일부 예외를 제외하고 비금속은 제자리에 고정되어 있어 비금속은 대개 열과 전기의 전도체가 불량하고 고체일 때 부서지거나 부서진다.금속의 전자는 일반적으로 자유롭게 움직이며, 이것이 금속이 좋은 전도체이고 대부분이 시트로 납작하게 되어 전선으로 끌어당기는 이유다.비금속 원자는 적당히 전기적인 원자에 적합하다; 그것들은 화학 반응에서 전자를 끌어들이고 산성 화합물을 형성하는 경향이 있다.
두 개의 비금속인 수소와 헬륨은 질량으로 관측 가능한 우주에서 보통 물질의 약 99%를 차지한다.수소, 탄소, 질소, 산소, 실리콘 등 5가지 비금속 원소는 지구의 지각, 대기, 해양, 생물권을 주로 구성하고 있다.
대부분의 비금속은 생물학적, 기술적 또는 국내적 역할이나 용도를 가지고 있다.살아있는 유기체는 거의 전적으로 비금속 수소, 산소, 탄소, 질소로 구성되어 있다.거의 모든 비금속은 의약품, 레이저, 조명, 가정용품을 개별적으로 사용한다.
비금속 용어는 적어도 1566년부터 시작되었지만, 널리 합의된 비금속 정의는 없다.일부 원소에는 금속성 및 비금속성 성질이 현저하게 혼합되어 있다. 이러한 경계선 사례 중 어느 것이 분류 기준에 따라 비금속성으로 계산될 수 있는가?14개 원소는 항상 비금속 상태로 인식되며, 수반되는 주기율표 추출물에서 볼 수 있듯이 최대 9개까지 추가되는 경우가 많다.
정의 및 적용 요소
비금속(nonmetal)은 다른 특성들 중에서도 상대적으로 밀도가 낮고 중간에서 높은 전기성을 갖는 화학원소다.대체로 광택, 변형성, 우수한 열 및 전기 전도성, 낮은 전기율과 같은 보다 금속적인 속성의 우위성이 부족하다.[12]비금속 정의에 대한 엄격한 정의가 없기 때문에 비금속 요소로 분류되는 소스에서 일부 변동이 발생할 수 있다.[11][13][14]그러한 결정은 어떤 속성이나 속성을 비금속적 또는 금속적 특성을 가장 잘 나타내는 것으로 간주하는지에 따라 달라진다.[15]
비록 Steudel이 [16]2020년에 23개의 요소를 비메탈로 인식하였지만, 그러한 목록은 도전할 여지가 있다.[1]효과적으로 항상 인식되는 14는 수소, 산소, 질소, 황, 부식성 할로겐 불소, 염소, 브롬, 요오드, 그리고 헬륨, 네온, 아르곤, 크립톤, 크립톤, 제논, 라돈 등이다. 예:라라냐 [1]등같은 저자들이 탄소, 인, 셀레늄을 비금속이라고 인식한 반면, 버논은[3] 이 세 원소가 대신 메탈로이드로 계산되는 경우도 있다고 일찍이 보고했다.그 요소 일반적으로 metalloids로 모두 주고, 안티몬, 텔루르 비소 때때로 중간 클래스로 금속과 기준 금속과 nonmetals을 구별하는 데 사용하 결론을 내릴 수 있는 nonmetals 사이의 간주된다; 다른 때에는[17]그들은 nonmetals로 의 빛으로 간주된다 즉 붕소, 실리콘과 게르마늄을 인정했었죠.ir비금속 [5]화학
알려진 118개의 원소 중 비금속이라고 간주될 수 있는 23개는 여러 차례 금속의 수적으로 우세하다.[18][19]다섯 번째 할로겐인 아스타틴은 희귀성과 강렬한 방사능 때문에 종종 무시된다;[20] 간접적인 이론적, 실험적인 증거는 그것이 금속이라는 것을 강하게 암시한다.[21]초중량 원소 코페르니슘(Z = 112)과 오가네손(118)은 비금속 원소로 판명될 수 있으며, 아직 실제 상태는 확인되지 않았다.[22]
일반 속성
물리적인
겉으로 보기에는 비금속 원소의 약 절반은 유색 가스 또는 유색 가스이며, 나머지는 대부분 빛나는 고체 물질이다.유일한 액체인 브롬은 휘발성이 매우 강하여 보통 연기의 층에 의해 위로 올라간다; 유황은 유일하게 색이 있는 고체 비금속이다.유체 비금속은 밀도가 매우 낮고 용해점과 비등점이 있으며 열과 전기의 전도체가 불량하다.[23]고체 비금속 원소는 밀도가 낮으며, 부서지기 쉬우거나 부스러져 기계 및 구조 강도가 낮으며,[24] 전도체가 양호하지 못하다.[n 8]
내부적으로는 비금속들의 구조와 결합배열이 형태상 차이를 설명한다.분리된 원자(예: 제논) 또는 분자(예: 산소, 유황, 브로민)로 존재하는 그러한 원자들은 원자나 분자 사이에 작용하는 약한 런던 분산력에 의해 함께 고정될 때 용융점과 끓는점이 낮은 경향이 있다.[28]많은 가스들은 실온에 있는 가스들이다.최대 1,000개의 원자 체인(예: 셀레늄),[29] 시트(탄소) 또는 3D 격자(실리콘)와 같은 거대한 구조를 형성하는 구조들은 더 높은 용융점과 비등점을 보이며, 이는 더 강한 공밸런스 결합을 극복하는 데 더 많은 에너지가 필요하기 때문이다. 그것들은 모두 고체다.주기율표의 왼쪽에 가깝거나 기둥 아래쪽에 있는 사람들은 종종 분자, 체인 또는 층들 사이에 약간의 약한 금속 상호작용을 가지고 있는데, 이는 금속들에 대한 그들의 근접성과 일치한다; 이것은 붕소,[30] 탄소,[31] 인,[32] 비소,[33] 셀레늄,[34] 안티몬,[35] 텔루륨,[36] 요오드 등에서 발생한다.[37]
비메탈의 전도성과 고체의 부서지기 쉬운 성질은 마찬가지로 내부 배치와 관련이 있다.좋은 열전도와 전기 전도성, 그리고 가소성(말성, 연성)은 일반적으로 금속에서 자유 이동 및 균일하게 분포된 전자의 존재와 연관된다.[38] 일부 예외를 제외하고, 비금속에서의 전자는 일반적으로 그러한 이동성이 결여되어 있다.[39]비금속 요소 중:
- 양호한 열 및 전기 전도성은 탄소, 비소 및 안티몬에 대해서만 볼 수 있다.[n 9]
- 금속과 유사한 열전도율 값은 붕소, 실리콘, 인 및 게르마늄에 대해서만 분명하게 나타난다.[25] 이러한 전도율은 이러한 원소의 결정 격자의 진동을 통해 전달된다.[40]
- 붕소, 실리콘, 인, 게르마늄, 셀레늄, 텔루륨 및 요오드에 적당한 전기 전도성이 발생한다.[n 10]
- 가소성은 탄소, 인, 황, 셀레늄, 금속 비금속에서만 제한된 환경에서 발생한다.[n 11]
금속과 비금속 사이의 물리적 차이는 내부와 외부의 원자력에 의해 발생한다.내부적으로는 원자의 양의 핵 전하가 작용하여 외부 전자를 제자리에 고정시킨다.외부적으로는 동일한 전자가 인근 원자의 핵 전하로부터 매력적인 힘에 노출된다.외부 힘이 내부 힘보다 크거나 같을 때, 외부 전자는 떠돌이(원자들 사이에서 자유롭게 이동할 수 있음)가 되고 금속 성질이 예측된다.그렇지 않으면 비금속 특성이 예상된다.[47]
케미컬
| 측면 | 금속 | 비금속 |
|---|---|---|
| 전기성 | 비금속보다 낮음, 다소[49] 예외로. | 중간에서 높음 |
| 케미컬 유대감 | ||
| 좀처럼 형성되지 않다. 공밸런스 | 자주 서식 공밸런스 | |
| 금속 결합(알로이) 금속 사이에 | 공밸런트채권 비금속 사이에 | |
| 비금속과 금속 사이의 이온 결합 | ||
| 산화 미국. | 긍정적인 | 부정 또는 양수 |
| 산화제 | 하부 산화물의 기본. 점점 더 산성화되어 가는 더 높은 산소로 | 산성; 결코[50] 기본이 아닌 |
| 수용액으로 [51] | 계정으로 존재 | 음이온으로 존재하다 또는 옥사니언 |
비금속은 중간에서 높은 전기적[52] 가치를 가지며 화학 반응에서 산성 화합물을 형성하는 경향이 있다.예를 들어 고체 비금속(금속성 포함)은 질산과 반응하여 산성을 형성하거나 산성이거나 산성이 앞서 있는 산성을 갖는 산화물을 형성한다.[n 12]
그들은 전자를 기증하는 금속과 달리 반응할 때 전자를 얻거나 공유하는 경향이 있다.구체적으로는, 그리고 고귀한 기체(외피 채움)의 전자 구성의 안정성에 비추어 볼 때, 비금속은 일반적으로 다음과 같은 고귀한 기체의 전자 구성을 제공하기에 충분한 수의 전자를 얻는 반면, 금속은 전자의 전자 구성으로 그것들을 남겨두기에 충분한 전자를 잃는 경향이 있다.고귀한 가스를 주입하다비금속 원소의 경우 이러한 경향은 두중과 엄지손가락의 8진법(그리고 금속의 경우 18전자의 법칙을 덜 엄격하게 따른다)에 의해 캡슐화된다.[55]
정량적으로 비금속은 금속보다 대부분 더 높은 이온화 에너지, 더 높은 전자 친화력, 더 높은 전기적 집적도 값, 더 높은 표준 감소 전위를 가지고 있다.일반적으로 이러한 값이 높을수록 해당 요소가 비금속적이다.[56]
금속과 비금속 사이의 화학적 차이는 대개 개별 원자의 양의 핵 전하와 음의 전자의 외부 전자 사이의 매력적인 힘에서 발생한다.주기율표의 각 기간에 걸쳐 왼쪽에서 오른쪽으로 핵전하가 증가하고 핵의 양성자의 수가 증가함에 따라 증가한다.[57]핵 전하 증가가 외부 전자를 핵에 가깝게 끌어당기면서 원자 반경의[58] 관련 감소가 있다.[59]금속의 경우, 핵전하의 영향은 일반적으로 비금속 원소에 비해 약하다.따라서 화학적 결합에서 금속은 전자를 잃고, 양전하 또는 편극화된 원자나 이온을 형성하는 반면, 비금속은 더 강한 핵전하로 같은 전자를 얻는 경향이 있고, 음전하 이온이나 편극화된 원자를 형성한다.[60]
비금속들에 의해 형성되는 화합물의 수는 어마어마하다.[61]2021년 11월 2일 화학 추상화 서비스 등록부에 기재된 895,501,834개의 화합물에서 가장 많이 접하는 "상위 20"의 원소 표의 첫 10개 자리는 비금속들이 차지했다.수소, 탄소, 산소, 질소는 화합물의 대다수(80%)에서 발견되었다.메탈로이드인 실리콘이 11위를 차지했다.발생빈도가 0.14%로 가장 높은 등급의 금속은 철로 12위였다.[62]비메탈 화합물의 예로는 세라믹 글레이즈에 사용되는 붕산(HBO
3
3), 생명의 21번째 아미노산인 셀레노시스테인([63]CHNOSe
3
7
2), 어느 곳에서나 타격할 수 있는 인세술황화(PS43), 테플론(CF
2
4)n[64] 등이 있다.
합병증
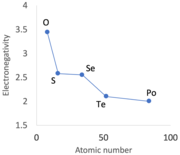
비금속들의 화학작용을 복잡하게 만드는 것은 각 주기율표 블록의 첫 번째 행에서 볼 수 있는 이상이다.이러한 이상 징후는 수소, 붕소(비금속 또는 야금성), 탄소, 질소, 산소 및 불소 등에서 두드러지며, p-블록 그룹의 대부분을 감소시키는 이차 주기성 또는 불균일한 주기적 경향으로 확장되며,[65] 중량이 많은 비금속에서의 비정상적인 산화 상태로 확장된다.
첫 번째 행 이상 징후
수소로 시작하는 첫 번째 행 이상 현상은 크게 관련 원소의 전자 구성에서 발생한다.수소는 결합을 형성하는 다양한 방법으로 유명하다.그것은 가장 흔하게 공밸런스 결합을 형성한다.엄청난 편광력을 가진 맨 양성자를 남기고 수용액에서 하나의 전자를 잃을 수 있다.[66]이것은 결과적으로 물 분자 안에 있는 산소 원자의 외로운 전자쌍에 달라붙어 산-기초 화학의 기초를 형성한다.[67]분자의 수소 원자는 다른 분자의 원자 또는 원자 그룹과 두 번째, 더 약한 결합을 형성할 수 있다.이러한 결합, "도움쇠는 눈송이에 육각대칭을 부여하고 DNA를 이중나선으로 묶고, 단백질의 3차원 형태를 형성하며, 심지어 물의 비등점을 차 한 잔을 만들 정도로 높이 올린다"[68]는 것이다.
수소와 헬륨, 붕소부터 네온까지 1s와 2p 서브쉘은 내부 유사성이 없고(즉, 제로스 쉘이 없고 1p 서브쉘이 없기 때문에 전자 반발 효과를 경험하지 않기 때문에 무거운 원소의 3p, 4p, 5p 서브셸과 달리 비교적 작은 반경을 가지고 있다.[69]이러한 요소들 사이의 이온화 에너지와 전기적 중요도는 결과적으로 정기적인 추세를 고려하여 예상한 것보다 더 높다.탄소, 질소, 산소의 작은 원자 반경은 이중 또는 삼중 결합의 형성을 용이하게 한다.[70]
일반적으로 전자 구성 기반에서 수소와 헬륨이 강력한 금속성의 s-블록 원소의 맨 위에 위치할 것으로 예상되지만, 이 두 원소의 첫 번째 열 이상은 대체 배치를 보장하기에 충분할 정도로 강하다.수소는 때때로 그룹 1의 리튬보다 그룹 17의 플루오린 위에 위치한다.헬륨은 정기적으로 베릴륨보다 그룹 18의 네온 위에 위치한다.[71]
2차 주기성
전환 금속의 첫 번째 행 직후, 즉 갈륨(금속)에서 게르마늄, 비소, 셀레늄, 브롬의 네 번째 줄에 있는 3d 전자는 증가된 양의 핵전하를 차폐하는 데 효과적이지 않다.비슷한 효과는 바륨과 루테튬 사이에 14개의 f-블록 금속의 출현과 함께 나타나며, 궁극적으로는 하프늄(Hf) 이후 원소에 대해 예상된 원자 반지름보다 작은 결과를 초래한다.[72]특히 그룹 13-15 요소의 순 결과는 그룹 13~17의 일부 주기적 추세가 번갈아 나타난다는 것이다.[73]
비정상적인 산화 상태
더 무거운 그룹 15–18 비메탈의 더 큰 원자 반경은 더 높은 대량 조정 숫자를 가능하게 하고, 더 높은 양의 전하를 더 잘 견디는 낮은 전기율을 초래한다.따라서 관련 원소는 인 펜타클로라이드(PCL5), 육불화황(SF),6 요오드 헵타플루오라이드(IF7), 제논 이플루오라이드(XeF2) 등에서 가장 낮은 그룹(3, 2, 1 또는 0) 이외의 산화 상태를 나타낼 수 있다.[74]
서브클래스
비금속 분류에 대한 접근방식은 2개 이하의 하위 분류에서 최대 6개 또는 7개까지 포함될 수 있다.예를 들어, 브리태니커 백과 사전 정기 및 요소가 일반적으로" 다른 금속"과" 다른 nonmetals"사이에 metalloids로 인식되는데,[86]반면에 왕립 협회 화학 주기율 표의, 그리고 nonmetals 수 있는 각 8개의 그룹의 다른 색을 사용하여 귀족, 가스들 halogens, 그리고 다른 nonmetals다. 있다이것들 중 7개에서 발견된다.[87]
주기적인 표 용어로 오른쪽에서 왼쪽으로 서너 종류의 비금속은 다소 흔히 발견된다.다음은 다음과 같다.
- 상대적으로 불활성 고귀한 기체
- 화학적으로 강한 할로겐 원소 세트(산화질소, 염소, 브롬 및 요오드)는 비금속 할로겐[88](여기서 사용되는 용어) 또는 안정적인 할로겐으로 언급되기도 한다.[89]
- 널리 인정된 집단 이름이 없는 수소, 탄소, 질소, 산소 등의 원소를 포함한 미분류 비금속 세트
- 화학적으로 약한 비금속 금속성, 때로는 [90]비금속성, 때로는 그렇지 않은 것으로 간주된다.[n 16]
메탈로이드는 금속이 비금속과 만나는 프런티어 영역을 차지하고 있기 때문에, 그 처리방법은 저자에 따라 다르다.어떤 사람들은 그것들을 금속과 비금속 모두로부터 분리한다고 생각한다. 어떤 사람들은 그것들을 비금속[92] 또는 비금속 하위 등급으로 간주한다.[93]다른 이들은 중금속과 유사하기 때문에 비소와 안티몬과 같은 일부 금속을 금속으로 간주하기도 한다.[94][n 17]메탈로이드는 화학적 행동에 비추어 비교 목적으로 비금속 물질로 취급된다.
메탈로이드 외에도, (일반적으로 분류 체계에서 발생하는) 일부 경계 솜털과 중첩은 다른 비금속 하위 분류들 사이에서 식별될 수 있다.탄소, 인, 셀레늄, 요오드는 야금류와 경계를 이루며 수소처럼 금속성을 나타낸다.고귀한 가스 중에서 라돈은 가장 금속성이 높고 약간의 양이온 작용을 보이기 시작하는데, 이는 비금속으로는 이례적인 일이다.[96]
노블 가스

6개의 비금속은 헬륨, 네온, 아르곤, 크립톤, 제논, 방사성 라돈 등 고귀한 가스로 분류된다.전통적인 주기율표에서 그들은 가장 오른쪽 열을 차지한다.그들은 특성적으로 매우 낮은 화학 반응성에 비추어 고귀한 가스라고 불린다.[97]
그들은 모두 무색, 무취, 불연성으로 매우 유사한 성질을 가지고 있다.닫힌 외부 전자 껍질로 고귀한 가스는 원자간 끌어당김의 약한 힘을 가지고 있어 용융점과 비등점이 매우 낮다.[98]그렇기 때문에 원자 질량이 보통 많은 고체 원소보다 큰 것들도 모두 표준 조건 하의 기체다.[99]
화학적으로, 고귀한 가스는 상대적으로 높은 이온화 에너지, 영 또는 음의 전자 친화력, 그리고 상대적으로 높은 전기성을 가지고 있다.고귀한 가스의 화합물은 비록 계속 증가하지만 수백 개에 달한다.[100] 이들 대부분은 산소와 불소를 통해 크립톤, 제논 또는 라돈과 결합하여 발생한다.[101]
주기적인 표 용어로, 백금이나 금과 같은 고귀한 가스와 고귀한 금속 사이에서 유추할 수 있는데, 후자는 비슷하게 화학적 결합에 들어가는 것을 꺼린다.[102]또 다른 예로, +8 산화 상태에서 제논은 옅은 노란색의 폭발성 산화물인 XeO를4 형성하고, 또 다른 고귀한 금속인 오스뮴은 노란색의 강한 산화산화물인 OsO를4 형성한다.옥시플루오리드 공식에도 유사성이 있다: XeOF와24 OsOF24, XeOF와32 OsOF32.[103]
약 10톤의15 고귀한 가스가 지구 대기 중에 존재한다.[104]헬륨은 천연가스에서 7%[105]까지 추가로 발견된다.라돈은 암석 밖으로 더 확산되는데, 여기서 라돈은 우라늄과 토륨의 자연 붕괴 과정에서 형성된다.[106]2014년에는 지구의 핵에 안정적인 XeFe와3 XeNi3 간 금속성 화합물의 형태로 ca. 10톤의13 제논이 함유되어 있을 수 있다고 보고되었다.이것이 왜 "지구 대기의 연구 결과 Xe 예상량의 90% 이상이 고갈된 것으로 나타났다"[107]는 이유를 설명할 수 있을 것이다.
비메탈 할로겐
비금속 할로겐은 부식성이 있고 현저하게 반응하는 원소인 반면, 그것들은 일반 식탁용 소금(NaCl)과 같은 무해한 화합물에서 발견될 수 있다.비금속으로서의 그들의 주목할 만한 화학적 활동은 나트륨과 칼륨과 같은 알칼리 금속의 똑같이 주목할 만한 화학적 활동과 대조될 수 있다.[108]
물리적으로 불소와 염소는 옅은 노랗고 노란 녹색 기체, 브롬은 적갈색의 액체(보통 연기 층이 위에 있다), 요오드는 흰 빛 아래 금속처럼 보이는[75] 고체다.전기적으로는 처음 3개는 절연체, 요오드는 반도체(평면에 따라)이다.[109]
화학적으로 이온화 에너지, 전자 친화력, 전기자극도 값이 높고 대부분 상대적으로 강한 산화제다.[110]이러한 상태의 징후는 본질적으로 부식되는 성질을 포함한다.[111]이 네 가지 모두 금속과[112] 이온화합물을 주로 형성하는 경향을 보이는 반면, 나머지 비금속인 바 산소는 주로 금속과 공밸류화합물을 형성하는 경향이 있다.[n 18]비금속 할로겐의 반응성 및 강한 전기적 특성은 비금속성의 전형이다.[116]
주기적인 표 용어에서 그룹 17의 고도로 비금속 할로겐의 상대방은 그룹 1의 나트륨과 칼륨과 같은 고반응 금속이다.신기하게도 대부분의 알칼리 금속은 비메탈 할로겐을 모방한 것처럼 –1 음이온(비메탈 사이에서 거의 발생하지 않는 것)을 형성하는 것으로 알려져 있다.[117]
비금속 할로겐은 소금과 관련된 미네랄에서 발견된다.불소는 플루오르산염에서 발생하는데, 이것은 널리 퍼진 광물이다.염소, 브롬, 요오드는 브라인에서 발견된다.예외적으로, 2012년의 한 연구는 앙토조나이트에서 무게별로 0.04%의 고유 불소(F
2)가 존재한다고 보고했는데, 이러한 포함은 소량의 우라늄이 존재하는 데서 오는 방사선에 기인한다.[118]
미분류 비금속
비금속 원소를 고귀한 가스, 할로겐 또는 야금류(추후)로 분류한 후 나머지 7개 비금속은 수소, 탄소, 질소, 산소, 인, 황, 셀레늄이다.가장 안정적인 할당량에서 3개는 무색의 기체(H, N, O), 3개는 금속과 같은 외관(C, P, Se), 1개는 노란색(S)이다.전기적으로, 그래피티 탄소는 평면을[120] 따라 있는 반메탈이고 평면에 수직인 방향의 반도체를 말한다.[121] 인과 셀레늄은 반도체다.[122] 그리고 수소, 질소, 산소, 황은 절연체다.[n 19]
그것들은 일반적으로 너무 다양해서 집합적인 검사를 받을 가치가 없다고 여겨져 왔고,[124][125] 다른 비금속 또는 메탈로이드와 할로겐 사이에 위치한 비금속이라고 더 분명히 언급되어 왔다.[126]결과적으로, 그들의 화학 유사점이 없이. 예를 들어 4명의 각각의 주기율 표 groups,[127]에 따른 수소 그룹 1에서>14탄소 nonmetals(탄소, 아마도 실리콘과 게르마늄)그룹;15pnictogen nonmetals(질소, 인, 치료하고 비소 안티몬)그룹;그리고 그룹 16chalco 가르쳐 지는 경향이 있다.정보비금속(금속, 황, 셀레늄 및 텔루륨)그 밖의 세분화는 작가 개인의 선호도에 따라 가능하다.[n 20]
특히 수소는 어떤 면에서는 금속처럼, 어떤 면에서는 비금속처럼 작용한다.[129]금속처럼 그것은 (첫 번째) 하나의 전자를 잃을 수 있고,[130] 전형적인 알칼리 금속 구조에서 알칼리 금속을 지지할 수 있으며,[131] 금속 접합이 특징인 합금 같은 하이드라이드를 일부 전이 금속으로 형성할 수 있다.[132]한편, 전형적인 비금속과 같은 단열성 이원자 기체로서, 보다 일반적으로 화학 반응에서는 헬륨의 전자 구성을 달성하는 경향이 있다.[133]이것은 공밸런트나 이온 결합을[132] 형성하는 방법으로, 또는 만약 전자를 잃어버렸다면, 한 쌍의 전자에 자신을 붙인다.[134]
그럼에도 불구하고 이러한 비금속 중 일부 또는 전부는 여러 공유 속성을 가지고 있다.대부분 할로겐보다[135] 반응성이 떨어지는 것은 자연적으로 환경에서 발생할 수 있다.[136]그들은 생물학적[137][138], 지질학적 역할이 두드러진다.[124]그들의 물리적, 화학적 특성은 "엄청나게 비금속적"이지만, 순위에 따르면,[124] 그들 모두는 부식적인 측면을 가지고 있다.수소는 금속을 부식시킬 수 있다.탄소 부식은 연료 전지에서 발생할 수 있다.[139]산성비는 용해된 질소나 황에 의해 발생한다.산소는 녹을 통해 철을 부식시킨다.가장 불안정한 형태인 백인은 공기 중에 발화하여 인산 잔류물을 발생시킨다.[140]토양에서 처리되지 않은 셀레늄은 부식성 수소 셀레니드 가스를 발생시킬 수 있다.[141]금속과 결합하면 상대적으로 작은 원자 반경과 충분히 낮은 이온화 에너지 값 때문에 [142]미분류 비금속은 단단한 (간격 또는 내화성) 화합물을 형성할 수 있다.[124]그들은 특히 고체 상태의 화합물에서 자신들과 결합하는 경향을 보인다.[143][124]이러한 비금속들 사이의 대각선 주기율표 관계는 야금류들 사이의 유사한 관계를 반영한다.[144][145]
주기적인 표 용어로, 지리적 비유는 미분류 비금속과 전이 금속 사이에서 나타난다.분류되지 않은 비금속은 오른쪽의 강력한 비금속 할로겐과 왼쪽의 약한 비금속 메탈로이드 사이의 영역을 차지한다.전이 금속은 "주기율표 왼쪽의 독성 금속과 강력 금속 사이, 그리고 고요하고 만족한 금속 사이의 영역을 차지하고 있다...[그리고]...두 [146]사람 사이에 과도기적인 다리를 놓다
미분류 비금속은 일반적으로 원소 형태(산소, 황)에서 발생하거나 다음 두 원소 중 하나와 연관되어 발견된다.[147]
- 수소는 물의 성분으로 세계 해양에서 발생하며, 메탄과 황화수소의 성분으로 천연가스에서 발생한다.[148]
- 탄소는 석회석, 돌로마이트, 대리석 등에서 탄산수로 발생한다.[149]잘 알려지지 않은 것은 흑연으로서 탄소인데, 주로 퇴적 탄소 화합물의 압축과 가열의 결과로서 변성 규산염[150] 암석에서 발생한다.[151]
- 산소는 대기에 있고, 해양은 물의 구성 요소로서, 지각은 산화 미네랄로서 발견된다.
- 인 광물은 널리 퍼져 있으며, 보통 인-산소 인산염으로 되어 있다.[152]
- 원소 유황은 세계 많은 지역의 온천과 화산 지역에서 발견될 수 있다.황 광물은 일반적으로 황화물이나 산소-황산염으로 널리 퍼져 있다.[153]
- 셀레늄은 황화 금속 광석에서 발생하는데, 여기서 부분적으로 황을 대체한다; 원소 셀레늄은 때때로 발견된다.[154]
메탈로이드

메탈로이드로 더 일반적으로 인식되는 6가지 원소는 붕소, 실리콘, 게르마늄, 비소, 안티몬, 텔루륨으로 각각 금속성 외관을 가지고 있다.표준 주기율표에서, 그들은 일부 주기율표에 나타난 금속과 비금속 사이의 구분선을 따라 왼쪽 상단의 붕소에서 텔루륨까지 확장되는 p-블록의 대각선 영역을 점유한다.[3]
그들은 열과 전기의 좋은 전도체에게는 부서지기 쉽고 가난하다.붕소, 실리콘, 게르마늄, 텔루륨은 반도체다.비소와 안티몬은 반도체 할당량이 덜 안정적이긴 하지만 반모양의 전자 구조를 가지고 있다.[3]
화학적으로 야금류는 일반적으로 비금속처럼 행동한다.비금속 원소들 중에서 그들은 가장 낮은 이온화 에너지, 전자 친화도 및 전기유도 값을 가지는 경향이 있으며 상대적으로 약한 산화제들이다.그들은 또한 금속으로 합금을 형성하는 경향을 보여준다.[3]
주기율표 용어로, 약하게 비금속 금속성의 왼쪽에는 약하게 금속성 금속(주석, 납, 비스무트 등)[155]의 불확실한 집합이 있으며, 때로는 변환 후 금속으로 일컬어지기도 한다.[156]딩글은 상황을 이렇게 설명한다.
- ... 테이블의 맨 왼쪽에는 '노-노-노-노-노-노-노-노-노-노-노-노-노-노-노-노-노-노-노-노-노-노-노양 극단의 간극은 우선 가난한 (후반-후반) 금속들에 의해 연결되고, 그 다음에는 메탈로이드에 의해, 아마도 같은 토큰에 의해서, 집합적으로 '가난한 비-비-중복'으로 이름이 바뀔지도 모른다.[157]
야금성은 산소나 유황과 결합된 형태로 발견되는 경향이 있고 텔루륨의 경우 금이나 은으로 발견된다.[147]붕소는 화산 샘물을 포함한 붕소-산소 붕산염 광물에서 발견된다.실리콘은 실리콘-산소 광물 규소(모래)에서 발생한다.게르마늄, 비소, 안티몬은 주로 황화 광석의 성분으로 발견된다.텔루륨은 금이나 은의 텔루라이드 광물에서 발생한다.비소, 안티몬, 텔루륨의 원형이 보고되었다.[158]
코로프스
대부분의 비금속 원소는 균등성 형태로 존재한다.예를 들어, 탄소는 흑연과 다이아몬드로 발생한다.그러한 할당량은 더 금속성이거나 덜 비금속적인 물리적 특성을 나타낼 수 있다.[159]
비금속 할로겐과 미분류 비금속 중:
- 요오드는 반도체성 비정형으로 알려져 있다.[160]
- 탄소의 표준 상태인 흑연은 꽤 좋은 전기 전도체다.탄소의 다이아몬드 할당 로프는 반투명하고 절연체로서 매우 빈약한 전기 전도체로서 분명히 비금속적이다.[161]탄소는 반도체 버크민스터풀레렌과 [162]아모르퍼스탈린[163](혼합된 아모르퍼스와 결정체)[164] 품종을 포함한 몇 가지 다른 균등성 형태로 더 잘 알려져 있다.
- 질소는 약 1마이크로초의 수명을 가진 불안정한 다원자 분자인 기체 테트라니트로겐(N4)을 형성할 수 있다.[165]
- 산소는 표준 상태의 이원자 분자로, 20 °C에서 대기 중 약 3일 동안 "내인" 반감기를 가진 불안정한 비금속 할당로프인 오존(O3)으로도 존재한다.[166]
- 인은 고유하게 몇 가지 할당성 형태로 존재하며, 백인(P4)으로서 표준 상태의 그것보다 더 안정적이다.흰색, 빨간색, 검은색의 할당체는 아마도 가장 잘 알려져 있을 것이다; 첫 번째는 절연체; 두 번째는 반도체다.[167]인은 불안정한 이원자 할당로프인 이중인산소(P2)로도 존재한다.[168]
- 유황은 다른 어떤 원소보다 더 많은 할당량을 가지고 있다.[169]이러한 할당량의 측정 가능한 혼합물인 아모르퍼스 황은 탄성으로 유명하다.[170]
- 셀레늄에는 몇 개의 비금속성 할당체가 있는데, 모두 표준 상태의 회색 "금속성" 셀레늄보다 전기 전도율이 훨씬 낮다.[171]
가장 일반적으로 메탈로이드로 인식되는 모든 원소는 할당제를 형성한다.
- 보론은 몇 가지 결정체와 무정형 형태로 알려져 있다.[172]
- 실리콘은 결정체(다이아몬드 유사)와 비정형 형태에서만 가장 최근에 알려져 있었는데, 2014년에 정형화된 할당로프인 Si의24 합성이 보고되었다.[173]
- 게르마늄은 ca. 10–11 GPA의 압력에서 주석과 같은 4각형 구조를 가진 금속 단계로 변환한다.압축을 풀 때, 그리고 압력 방출 속도에 따라, 금속 게르마늄은 주변 조건에서 전이 가능한 일련의 할당량을 형성한다.[174]
- 비소와 안티몬은 여러 개의 잘 알려진 할당체(노란색, 회색, 검은색)를 형성한다.[175]
- 텔루륨은 결정성과 무정형 형태로 알려져 있다.[176]
비금속 원소의 다른 균등성 형태는 압력 또는 단량형 중 하나로 알려져 있다.충분히 높은 압력 하에서, 1.7 GPA에서 인을 시작으로 반도체나 절연체인 비금속 원소의 적어도 절반이 금속성 할당체를 형성하는 것이 관찰되었다.[n 21][178][n 22]비메탈의 단층 2차원 형태로는 보로페네(보론), 그래핀(탄소), 실리콘(실리콘), 인산(인산), 게르마늄(게르마늄), 비소네(아르세닌), 안티모넨(안티몬), 텔루레오렌(텔루륨) 등이 있는데, 이를 합쳐서 Xenes라고 부른다.[180]
보급률 및 접근성
풍요
| 도메인 | 주성분 | 다음으로 가장 많이 풍성한 |
|---|---|---|
| 크러스트 | O 61%, Si 20% | H 2.9% |
| 대기 | N 78%, O 21% | 아르 0.5% |
| 하이드로스피어 | O 66.2% H 33.2% | Cl 0.3% |
| 바이오매스 | O 63%, C 20%, H 10% | N 3.0% |
수소와 헬륨은 우주의 모든 보통 물질의 약 99%와 원자의 99.9% 이상을 구성하는 것으로 추정된다.[182]산소는 ca. 0.[183]1%로 다음으로 가장 풍부한 원소로 여겨진다.우주의 5% 미만이 별, 행성, 생명체로 대표되는 평범한 물질로 만들어졌다고 믿어진다.그 균형은 암흑 에너지와 암흑 물질로 이루어져 있는데, 두 가지 모두 현재 잘 이해되지 않고 있다.[184]
수소와 탄소, 질소, 산소, 실리콘 등 5개의 비금속은 표에 나타난 양으로 지구 지각, 대기, 하이드로스피어, 바이오매스의 대부분을 차지한다.
추출
비금속 및 메탈로이드는 다음에서 원시 형태로 추출된다.[136]
- 브라인—메뉴, 브롬, 요오드;
- 액체 공기—액체, 산소, 네온, 아르곤, 크립톤, 제논;
- 미네랄—보레이트(보레이트 광물), 탄소(석탄, 다이아몬드, 흑연), 불소(불화석), 실리콘(실리카), 인(황산염), 안티몬(스티브나이트, 사방헤드라이트), 요오드(요오드산나트륨, 요오드산나트륨);
- 천연 가스 - 가스, 헬륨, 유황 및
- 처리 부산물로서 광석은 게르마늄(게르마늄 광석), 비소(탄소 및 납 광석), 셀레늄, 텔루륨(탄소 광석), 라돈(탄소 함유 광석)이다.
비용
2022년 1월처럼 비방사성 비금속은 상대적으로 저렴하지만[n 23] 일부 예외는 있다.붕소, 게르마늄, 비소, 브롬의 가격은 그램 당 미화 3달러에서 11달러(cf. silver는 그램 당 약 0.75달러)까지 할 수 있다.대량으로 관련되면 가격이 급격히 하락할 수 있다.[186]가장 안정된 흑색 형태의 인은 "그램 당 1000달러까지 할 수 있다"([187]가명 금의 15배)는 일반 백인은 100g당 30달러에 구입할 수 있다.[186]연구원들은 흑인의 비용을 그램 당 1달러까지 낮출 수 있기를 바라고 있다.[187]2013년까지 국가표준기술원에서 발행 단위 0.2ml당 ca에 해당하는 1636달러에 라돈이 공급됐다.그램 당 8,600,000,000달러, 대량 수량에 대한 할인 표시 없음.[188]
거의 모든 비금속은 레이저, 조명, 의약품 등 생활용품의 용도가 다양하다.예를 들어, 질소는 몇몇 정원 치료법, 레이저, 그리고 당뇨병 약품에서 발견된다.게르마늄, 비소, 라돈은 각각 이 들판들 중 하나 또는 두 곳에서 사용하지만 세 가지 모두 사용되지는 않는다.[136]고귀한 가스를 제외하고 나머지 비금속 물질은 대부분 농화학 물질과 다이어스터프(dyestuff)에 사용되었거나 사용되어 왔다.[136]메탈로이드는 금속성을 보일 정도로 산화 유리(예를 들어)와 합금 부품, 반도체까지 확장된 특수 용도를 갖고 있다.[189]
비금속 하위 집합의 서로 다른 하위 집합의 추가 공유는 공기 대체, 극저온 및 냉매, 비료, 난연제 또는 소화기, 미네랄산, 플러그인 하이브리드 차량, 용접 가스 및 스마트폰의 존재 또는 특정 용도를 포함한다.[136]
역사, 배경 및 분류법
디스커버리
대부분의 비금속은 18세기와 19세기에 발견되었다.그 이전까지 탄소, 유황, 안티몬은 고대로 알려져 있었고, 비소는 중세 (알베르투스 마그누스에 의해) 발견되었으며, 헤니그 브랜드는 1669년에 소변에서 인을 분리했다.헬륨(1868년)은 지구에서 발견되지 않은 최초의 원소(그리고 지금까지만)라는 구별을 가지고 있다.[n 24]라돈은 19세기 말에야 발견된 비금속 중 가장 최근에 발견된 것이다.[136]
격리 노력에 사용된 화학 또는 물리 기반 기법은 분광학, 분수 증류, 방사선 검출, 전기분해, 광석 산성화, 연소, 변위 반응 및 가열이었다. 몇 가지 비금속은 자유 원소로 자연 발생하였다.
이 고귀한 가스들 중 헬륨은 태양의 관상 스펙트럼에서 노란선을 통해 검출되었고, 이후 산성 용해된 천왕성 UO에서2 빠져나온 기포를 관찰함으로써 검출되었다.네온 스루 제논은 공기의 부분 증류를 통해 얻어졌다.라돈은 1896년 앙리 베크렐이 방사능을 발견한 지 3년 만에 토륨 화합물에서 방출되는 것으로 처음 관찰됐다.[191]
비금속 할로겐은 전기분해, 산성 또는 변위를 통해 할로겐의 할로겐으로부터 얻어졌다.일부 화학자들은 불소를 분리하려는 실험의 결과로 죽었다.[192]
공개된 nonmetals 중 탄소, 매연, 흑연과 다이아몬드 숯, 많은 것은 질소 대기에서 산소를 제거했어;산소 제1수은의 산화 가열에 의해 입수됐다 관찰되었다; 인로 소변에서 발견된 암모늄 수소 나트륨 인산염(나지완(NH4)HPO4 가열에 의해 해방되었다;[193]유황 자연스럽게 일어났다(또는) 알려져 있었다.는 f로리 원소[n 25]; 그리고 셀레늄은 황산의 잔류물로 검출되었다.[195]
일반적으로 메탈로이드로 인식되는 원소의 대부분은 산화물(보론, 실리콘, 비소, 텔루륨)이나 황화(게르마늄)을 가열하여 격리되었다.[136]안티몬은 황화물을 가열하여 분리할 수 있을 뿐만 아니라 원래 형태로도 알려져 있었다.[196]
개념의 기원
금속과 비금속 사이의 구별은 순수한 물질, 혼합물, 화합물, 원소 등 자연 물질의 종류에 대한 조잡한 인식으로부터 복잡한 방식으로 일어났다.따라서 물질은 순수한 물질(염, 소다의 바이카브, 또는 유황과 같은)과 혼합물(예를 들어 아쿠아 레지아, 화약, 청동)으로 나눌 수 있었고, 순수 물질은 결국 화합물과 원소로 구별될 수 있었다.[197]그 후 "금속" 원소는 열을 전도하는 능력이나 퀵라임(CaO)과 같이 물에서 기본적인 용액을 형성하는 "지구"(산화물)와 같이 다른 원소들이 하지 못한 광범위하게 구별할 수 있는 속성을 가지고 있는 것처럼 보였다.[198]
용어 사용
비금속 용어는 1566년으로 거슬러 올라간다.그해 발간된 의학 논문에서 로이스 드 로나이(프랑스 의사)는 금속과 "비금속" 땅에서 나오는 식물 물질의 성질을 언급했다.[199]
초기 화학에서 빌헬름 홈버그(독일 자연철학자)[200]는 데 에사이 드 치미에(1708)에서 '비금속' 유황을 언급했다.그는 모든 물질을 황, 수은, 소금, 물, 흙으로 5배 분할하는 것에 대해 의문을 품었는데, 에티엔느 드 클레이브 (1641)가 <진정한 원리와 자연의 원소의 새로운 철학적 빛>에서 가정하였다.[201]Homberg의 접근방식은 "요소의 현대적 개념을 향한 중요한 움직임"[202]을 나타냈다.
라부아지에르는 그의 "혁명적인"[203] 1789년 작품에서 가스, 금속, 비금속, 지구(난방성 산화물)를 구별하는 최초의 현대 화학 원소 목록을 발표했다.[204]첫 17년 동안, 라부아지에의 작품은 6개 국어로 23판에 재출판되었고, "캐리어드...유럽과 미국 전역에서 그의 새로운 화학작품이 소개되었다.[205]
제안된 구분 기준
| |
1809년 험프리 데이비가 발견한 나트륨과 칼륨은 금속과 비금속 사이의 경계선을 "갈등시키지 않은"[226] 것이다.그 이전에는 금속이 묵직함이나 비교적 높은 밀도에 기초하여 구별되었었다.[227]반면에 나트륨과 칼륨은 물 위에 떠있었지만 화학적 행동에 근거하여 분명히 금속이었다.[228]
1811년부터는 금속과 비금속 사이의 구분을 개선하기 위한 시도에 물리, 화학, 전자와 관련된 다른 성질이 사용되어 왔다.동봉된 표에는 유형 및 날짜 순서별로 22개의 그러한 속성이 설명되어 있다.
아마도 가장 잘 알려진 성질은 온도가 하락할 때 금속의 전기 전도도가 증가하는 반면 비금속은 상승한다는 것이다.[218]그러나 이 계획은 플루토늄, 탄소, 비소, 안티몬에는 효과가 없다.금속인 플루토늄은 -175~+125°C의 온도 범위에서 가열하면 전기 전도도가 높아진다.[229]탄소는 비금속이라고 널리 여겨지지만, 마찬가지로 열을 가할 때 전도성을 증가시킨다.[230]비소와 안티몬은 때때로 비메탈로 분류되지만 탄소와 유사하게 작용한다.[231]
Emsley이,"어떤 단일 속성...양쪽 금속이거나 nonmetals 모든 요소들을 분류하는데 사용될 수도 있다고 밝혔다."[232]Kneen(알. 한번 금속성에 대한[단일]기준 선정된 것처럼 nonmetals,를 알아볼 수 있다고 제안하였다,"many 임의의 분류, 만약 합리적으로 선택한, 대부분, b와 유사할 것이다 가능하다반면 존스는 "클래스는 보통 세 가지 이상의 속성으로 정의된다"[233]고 말했다.[15]
존슨은 물리적 특성이 요소의 금속성 또는 비금속성을 가장 잘 나타낼 수 있으며, 모호한 경우 다른 특성이 필요할 것이라는 단서가 제시되었다.좀 더 구체적으로, 그는 모든 기체 또는 비전도성 원소는 비금속이고, 고체 비금속 금속은 단단하고 부서지기 쉬우며 부드러우며, 반면에 금속은 대개 유연하고 연성이며, 비금속 산화물들은 산성이라는 것을 관찰했다.[234]
일단 "두 가지 훌륭한 등급의 원소"[235]를 구별할 수 있는 근거가 마련되면, 비금속은 금속의 [236]성질이 부족하여 어느 정도 크거나 낮은 것으로 밝혀진다.[237]어떤 저자들은 더 나아가 금속, 금속, 금속, 비금속 등으로 분화한다.[238] 비록 금속이 아닌 것은 분류 근거상으로는 비금속이지만.
서브클래스 개발
비메탈의 기본 분류법은 1844년 프랑스의 의사, 약사, 화학자 알퐁스 뒤파스키어에 의해 시작되었다.[239]비금속 연구를 용이하게 하기 위해 그는 다음과 같이 썼다.[240]
- 다음과 같이 4개 그룹 또는 섹션으로 나뉜다.
- 유기체 O, N, H, C
- 설푸로이드 S, 세, P
- 클로로이데스 F, Cl, Br, I
- 보로이드 B, Si.
뒤파스키에의 4배 분류의 메아리는 현대의 하위 분류에서 볼 수 있다.유기체와 유황은 분류되지 않은 비금속 세트를 나타낸다.이러한 7개의 비금속,[241] 생물체, 중앙 비금속,[242][243] CHNOPS,[244] 필수요소,[245] "비금속",[246][n 27] 고아 비금속,[247] 또는 redox 비금속 등의 다양한 구성을 가리켜왔다.[248]클로로이드 비금속은 독립적으로 할로겐이라고 불리게 되었다.[249]붕소이드 비금속은 1864년경부터 메탈로이드로 확장되었다.[250]이 고귀한 가스들은, 별개의 그룹으로서, 일찍이 1900년부터 비금속들 사이에서 계수되었다.[251]
비교
금속의 일부 특성, 메탈로이드, 미분류 비금속, 비금속 할로겐, 고귀한 가스가 표에 요약되어 있다.[n 28]물리적 특성은 주변 조건에서 가장 안정된 형태의 원소에 적용되며, 결정 용이성의 느슨한 순서로 나열된다.화학적 성질은 일반에서 서술에 이르기까지, 그리고 그 다음에 구체적으로 열거된다.메탈로이드 주위의 점선은, 저자에 따라, 관련 원소가 원소의 구별되는 분류나 하위 분류로 인식될 수도 있고, 그렇지 않을 수도 있다는 것을 나타낸다.금속은 기준점으로 포함되어 있다.
대부분의 속성은 금속에서 비금속 문자 또는 평균값으로 좌우 진보를 나타낸다.따라서 주기율표는 금속과 비금속로 구분할 수 있으며 비금속들 사이에서 다소 구별되는 등급이 보인다.[252]
| 일부 교차 하위 클래스 속성 | |||||
| 물성 | 금속 | 메탈로이드 | 미분류 비금속 | 비메탈 할로겐 | 노블 가스 |
|---|---|---|---|---|---|
| 알칼리, 알칼리성 접지, 란타니드, 액티나이드, 전이 후 금속 | 붕소, 실리콘, 게르마늄, 비소, 안티몬(Sb), 텔루륨 | 수소, 탄소, 질소, 인, 산소, 황, 셀레늄 | 불소, 염소, 브로민, 요오드 | 헬륨, 네온, 아르곤, 크립톤, 제논, 라돈 | |
| 형태와 허프[253] |
|
|
|
| |
| 외관 | 광채가[23] 나는 | 광채가[254] 나는 | 무색의[259] | ||
| 탄력성 | 대부분 유동성 및 연성[23](Hg는 액체) | 깨지기[254] 쉬운 | 요오드는 깨지기[266] 쉽다. | 해당되지 않는 | |
| 전기 전도도 | 좋은[n 30] |
|
|
| 가난하다[n 34] |
| 전자 구조[177] | 금속(Bi는 반메탈) | 세미메탈(As, Sb) 또는 반도체 |
| 반도체(I) 또는 절연체 | 절연체 |
| 화학적 특성 | 금속 | 메탈로이드 | 미분류 비금속 | 비메탈 할로겐 | 노블 가스 |
| 알칼리, 알칼리성 접지, 란타니드, 액티나이드, 전이 후 금속 | 붕소, 실리콘, 게르마늄, 비소, 안티몬(Sb), 텔루륨 | 수소, 탄소, 질소, 인, 산소, 황, 셀레늄 | 불소, 염소, 브로민, 요오드 | 헬륨, 네온, 아르곤, 크립톤, 제논, 라돈 | |
| 일반 화학 작용 | 약하게 금속이[n 35] 아닌 | 적당히 비금속적인[272]. | 비금속성의[273] | ||
| 산화제 | |||||
| 금속성 화합물 | 합금[23] 또는 금속간 화합물[291] | 합금이나 금속간 화합물을[292] 형성하는 경향이 있다. | 주로 이온성의[112] | 알려지지[n 38] 않은 주변 조건에서의 단순 화합물 | |
| 이온화 에너지(kJ mol−1)† (데이터 페이지) |
|
|
|
|
|
| 전기수집율([n 39]폴링 스케일)† (데이터 페이지) |
|
|
|
|
|
| † 표에 기재된 값 범위 기준으로 하한, 중간, 높음, 매우 높음 라벨이 임의로 하여 임의로 함 ‡ 수소도 합금 형태의 하이드라이드를 형성할 수 있음[296] | |||||
참고 항목
- COUN(탄소, 수소, 산소, 질소)
- 비금속 단자 목록
- 금속화 압력
- 1주기 원소(수소, 헬륨)
- 그룹별 비금속(및 메탈로이드) 특성
메모들
- ^ H; N; O, S; F, Cl, Br, I; He, N, N, Ar, Kr, Xe, Rn[1]
- ^ C; P; Se.[2]한편, 이 세 원소는 각각 16, 10, 46회, 194개의 메탈로이드 리스트를 조사한 결과, 메탈로이드로이드로 계산되었다.[3]
- ^ B; Si, Ge; As, Sb; Te[4][5]
- ^ Al, Ga, In, Tl, Sn, Pb, Bi, Po, At
- ^ 수소는 역사적으로 하나 이상의 리튬, 붕소,[6] 탄소 또는 불소 위에 놓이거나,[7] 전혀 집단이 없거나, 또는 모든 주요 집단에 동시에 놓였으며, 따라서 다른 비금속과 인접하거나 인접하지 않을 수 있다.[8]
- ^ 극단적 방사능 원소 At(원소 85), Fr(87) 및 원자 번호가 Es(99)보다 높은 원소의 가중치가 준비되지 않았다.[10] At와 Fr에 사용되는 밀도 값은 이론적 추정치다.
- ^ 이 두 가지 출처 중 첫 번째 출처는 화학자들이 더 이상 메탈로이드라는 용어를 사용하지 않으며 관련된 원소들은 비금속이라고 말한다.두 번째 출처는 주기율표의 원소가 "항상" 금속, 야금, 비금속 등으로 나뉜다고 말한다.
- ^ 고체 nonmetals 2000원으로 탄소 비교하라.에서 각각 0.27Wm–1 K–1의 유황에 열 전도율 값을 가지고 있는 6.3에 429년에[25]전기 전도율 값 10−18 S•cm−1에서 sulfur[25]에 graphite[26]에 arsenic[27]비교하라 모델은 은색이고, 금속에 대한 망간 63x104에 3×104또는 3.9×104호입니다. 0.69×104까지 은, 금속 모두, 넵투늄.both.[25]
- ^ 금속의 열전도도 값은 넵투늄의 경우 6.3 Wm–1 K에서–1 은의 경우 429까지, cf. 안티몬 24.3, 비소 50 및 탄소 2000까지,[25] 금속의 전기전도도 값은 망간의 경우 0.69 S•cm−1 × 10에서4 은의 경우 63 × 10까지4, cf. 탄소 3 × 104,[26] 비소 3.9 × 104 및 안티몬 2.3 × 10이다4[25].
- ^ 이 요소들은 반도체다.
- ^ 예를 들어, 각질 제거(확장) 흑연으로 C,[42] 그리고 미터 길이의 탄소 나노튜브 와이어로,[43] 백인으로서 P, (왁스처럼 부드럽고 유연하며 상온에서 칼로 자를 수 있음),[44] 플라스틱 유황으로 S,[45] 그리고 녹은 형태에서[46] 뽑아낸 셀레늄 와이어로 SE.
- ^ 산은 붕소, 인, 셀레늄, 비소, 요오드로 형성되며, 산화물은 탄소, 실리콘, 게르마늄, 황, 안티몬, 텔루륨에 의해 형성된다.[53][54]
- ^ 이 원소들은 s-블록의 수소와 헬륨, p-블록의 붕소와 네온, d-블록의 아연과 스칸듐, f-블록의 란타넘과 이테르비움 사이이다.
- ^ 고귀한 가스:He, Ne, Ar, Kr, Xe, Rn; 비금속 할로겐: F, Cl, Br, I; 미분류 비금속: H, C, N, P, O, S, S, 메탈로이드: B, Si, Ge, As, Sb, Te.근처 금속은 알, 가, 인, Tl, Sn, Pb, Bi, Po, At이다.
- ^ 단검이나 이중검으로 표시된 7개의 비금속은 각각 부진한 외관과 이산형 분자구조를 가지고 있지만, 흰 빛 아래 금속성 외관을 가진 I의 경우.[75]나머지 반응성 비금속 원소들은 거대한 공밸런트 구조를 가지고 있지만, 이원자 가스인 H의 경우.[76]
단검 비금속 N, S, 요오드는 다소 "강력한" 비금속이라고 절뚝거린다.
N은 전기성이 높은 반면, O나 F와 같이 보다 활동적인 비금속과 결합하지 않는 한 마지못해 음이온 전, [77]보행자 산화제다.[78]
S는 알칼리성 금속과 변환 후 금속, Cu, Ag 및 Hg와 함께 냉기에 반응하지만,[79] 다른 금속의 평균에 비해 이온화 에너지, 전자 친화성 및 전기가중성의 값이 낮으며, 특히 좋은 산화제로 간주되지 않는다.[80]
요오드는 적절한 보호 없이 취급할 경우 열화상을 닮은 병변을 일으킬 정도로 부식성이 충분하며, 요오드의 틱큐어는 Au를 부드럽게 용해시킨다.[81][82]그렇긴 하지만, "F, Cl, Br은 모두 Fe2+ (aq)를3+ Fe (aq)로 산화시킬 것이다... 요오드...Fe(II) 이온에서 전자를 제거하여 Fe(II) 이온을 형성할 수 없을 정도로 [상대적으로] 약한 산화제다."[83]따라서 반응 X2 + 2e− → 2X−(aq)의 경우 감소 전위는 F +2.87 V; Cl +1.36; Br +1.09; I +0.54이다.여기 Fe3+ + e− → Fe3+ +0.77.[84]따라서 F2, Cl2, Br은2 Fe를2+ Fe로3+ 산화시키지만 Fe는3+ I로−2 산화시킨다.요오드는 이전에 적당히 강한 산화제라고 일컬어 왔다.[85] - ^ 티쇼얀 외 연구진(2019년)은 1922~2018년 사이 1,000여 개의 학술지에 게재된 330만 건의 추상화를 바탕으로 원소 명칭의 근접성을 기계에 기반해 분석했다.결과 지도는 "화학적으로 유사한 원소들이 함께 군집화되고 전체 분포는 주기율표 자체를 연상시키는 위상"을 나타낸다는 것을 보여준다.[91]
- ^ 존스는 이러한 질문들에 대해 철학적이거나 실용적인 견해를 가지고 있다.그는 다음과 같이 쓰고 있다: "분류란 모든 과학 분야의 필수적인 특징이지만, 경계에는 항상 어려운 경우가 있다.수업의 경계가 거의 뚜렷하지 않다...과학자들은 이 힘든 사건들에 대해 잠을 자서는 안 된다.분류 체계가 서술의 경제, 지식의 구조화 및 우리의 이해에 이로운 한, 그리고 어려운 경우가 소수를 구성하는 한, 그 다음 그것을 유지하라.시스템이 유용하지 않게 되면 폐기하고 다른 공유 특성을 바탕으로 한 시스템으로 대체하십시오."[95]
- ^ 금속 산화물들은 보통 이온성이다.[113]반면에 산화 상태가 높은 금속의 산화물은 대개 고분자 또는 공동 발효성이다.[114]중합체 산화물은 복수의 반복 단위로 구성된 연계 구조를 가지고 있다.[115]
- ^ 절연체인 황과 반도체인 셀레늄은 각각 복사기로서 빛에 노출되면 전기 전도도가 최대 6배까지 증가한다.[123]
- ^ 예를 들어, Wulfsberg는 B, Si, Ge, As, Sb, Te, Xe를 포함한 비메탈을 매우 전기적인 비메탈(2.8에 대한 폴링 전기 가타성)과 전기 비메탈(1.9 ~ 2.8)으로 나눈다.이로 인해 N과 O는 할로겐과 함께 매우 전기적 비금속이며, H, C, P, S, S는 전기적 비금속이다.세는 반도체 금속으로 더욱 인정받고 있다.[128]
- ^ B; Si, Ge; N, P; O, S, Se, T; 비금속 할로겐; 그리고 고귀한 가스[177]
- ^ 2020년과 마찬가지로 고압 연구와 실험은 "매우 활발하고 활발한 연구 분야"[179]를 나타낸다고 한다.
- ^ 대부분의 비금속 가격은 벌크산소의 경우 그램 당 미화 0.0002달러에서 벌크불소의 경우 그램 당 1.90달러까지 다양했다.[186]
- ^ 헬륨이 -ium 접미사를 획득한 방법은 발견자인 William Lockyer에 의해 다음 구절에서 설명된다: "나는 헬륨이라는 단어를 결합하는 책임을 맡았다...나는 그 물질이 칼슘과 같은 금속인지 수소 같은 기체인지는 몰랐지만, 나는 그것이 [태양에서 발견되는] 수소처럼 행동하고, 두마가 말한 것처럼 수소가 금속처럼 행동한다는 것을 알고 있었다."[190]
- ^ 셀레늄을 발견한 베르젤리우스는 셀레늄이 유황과 결합된 금속의 성질을 지니고 있다고 생각했다.[194]
- ^ 골드해머-헤르츠펠트 비율은 대략 원자 반경의 입방체를 어금니 부피로 나눈 것과 같다.[209]구체적으로는 고형 또는 액체 원소의 원자 사이의 상호작용에 의한 동일한 전자에 작용하는 힘과 개별 원자의 외부 전자를 제자리에 고정시키는 힘의 비율이다.원자간 힘이 원자력보다 크거나 같을 때, 외부 전자 이동성이 표시되고 금속의 거동이 예측된다.그렇지 않으면 비금속적 행동이 예상된다.[210]
- ^ 인용 부호는 출처에서 찾을 수 없다; 출처가 일반적으로 비메탈에 적용하기 보다는 문제의 화학 원소의 하위 집합에 대한 공식 용어로 비메탈이라는 단어를 사용한다는 것을 명확히 하기 위해 여기에서 사용된다.
- ^ 참고 항목: 메탈로이드, 메탈로이드 및 비메탈의 특성: 메탈로이드를 자체 분류로 취급하는 속성
- ^ 각질 제거(확장) 흑연으로서의 탄소,[261] 미터 길이의 탄소 나노튜브 와이어,[262] 백인으로서의 인(왁스처럼 부드럽고 유연하며 상온에서 [263]칼로 자를 수 있음), 플라스틱 유황과 같은 유황[265], 셀레늄 와이어로서의 셀레늄.[264]
- ^ 금속은 망간의 경우 6.9×103 S•cm에서−1 은의 경우 6.3×10까지의5 전기전도도 값을 가진다.[267]
- ^ 메탈로이드의 전기전도율은 붕소의 경우−6 1.5×10−1 S•cm에서 비소의 경우 3.9×10까지이다4.[268]
- ^ 미분류 비금속은 원소 기체의 경우 ca. 1×10−18 S•cm부터−1 흑연에서 3±4까지의 전기전도도 값을 가진다.[269]
- ^ 비금속 할로겐은 전기 전도도 값이 F의 경우 ca. 1×10−18 S•cm부터−1 요오드의 경우 1.7×10−1 S−8•cm이다.[269][109]
- ^ 원소 기체는 전기 전도도 값이 ca. 1×10−18 S•cm이다−1.[269]
- ^ 그들은 항상 "일반적인 비메탈의 해당 화합물보다 덜 산성적인 특성"을 부여한다.[254]
- ^ 삼산화 비소는 삼산화황과 반응하여 비소 "황산" AS(Solfate4)를2 형성한다.3[280]
- ^ CO와 NO는2 "각각 CO + HO2 → HCO22 (HCOOOH, Formic acid), NO2 + HO2 → HNO222 (Hyponitol acid)"의 무수체다.[285]
- ^ 이소듐헬라이드(NaHe2)는 헬륨과 나트륨의 화합물로 113 GPA 이상의 고압에서 안정적이다.아르곤은 140 GPA에서 1500K에 가까운 니켈로 합금을 형성하지만 이 압력에서 아르곤은 더 이상 고귀한 가스가 아니다.[294]
- ^ 고귀한 가스에 대한 가치는 알렌과 후히이로부터 온다.[295]
참조
인용구
- ^ a b c d 라라가, 루이스 & 루이스 2016, 페이지 988
- ^ 라라가, 루이스 & 루이스 2016, 페이지 988
- ^ a b c d e f 버논 2013
- ^ 2006년 에롤드, 페이지 149-50
- ^ a b c 버논 2020, 페이지 220
- ^ 루친스키 & 트리포노프 1981, 페이지 200–220
- ^ Jolly 1966, 안쪽 커버
- ^ 레이너-캐넘 2020, 212페이지
- ^ Aylward & Findlay 2008, 페이지 6–13; 126: 밀도와 전기율 값
- ^ 에델슈타인 & 모르스 2009, 페이지 123
- ^ a b 고도비코프 & 네나셰바 2020, 페이지 4
- ^ 글린카 1959, 페이지 77;옥스토비, 길리스 & 버틀러 2015, 페이지 I.23
- ^ a b 샌더슨 1957, 페이지 229
- ^ 몰리 & 뮤어 1892년, 페이지 241
- ^ a b 크웬, 로저스 & 심슨 1972년 페이지 218–219
- ^ Steudel 2020, 페이지 43
- ^ a b Hill, Holman & Hulme 2017, 페이지 182: 원자 전도성은 물질의 한 몰의 전기 전도성이다.전기전도도를 어금니 부피로 나눈 것과 같다.
- ^ IUPAC 원소 주기율표
- ^ 존슨 2007, 페이지 13
- ^ 보드너 & 파듀 1993, 페이지 354, 체림 1971, 페이지 98
- ^ 레스트레포 외 2006, 페이지 411; 쏜튼 & 버데트 2010, 페이지 86; 헤르만, 호프만 & 애쉬크로프트 2013, 페이지 11604‒1‒11604‒5
- ^ Mewes et al. 2019; Smits et al. 2020
- ^ a b c d 크웬, 로저스 & 심슨 1972년, 페이지 261–264
- ^ 필립스 1973, 페이지 7
- ^ a b c d e f Aylward & Findlay 2008, 페이지 6-12
- ^ a b 젠킨스 & 카와무라 1976, 페이지 88
- ^ 카라펠라 1968, 페이지 30
- ^ Zumdahl & DeCoste 2010, 페이지 455, 456, 469, A40
- ^ 여전히 2016년 페이지 120
- ^ 지키에스키 & 버지스 2002 페이지 86
- ^ 샤를리, 곤제 & 미쉐노 1994
- ^ 타니구치 외 1984년, 페이지 867: "...검은 인...[is]는 다소 탈색된 성질을 가진 넓은 발랑스 밴드가 특징이다."; 모리타 1986, 페이지 230, 카말트 & 노먼 1998, 페이지 7: "인포루스...따라서 일부 야금성을 가질 것으로 예상되어야 한다."; Du et al. 2010.반데르 바알-케솜의 힘에 기인하는 흑색 인의 층간 상호작용은 단일 층의 더 큰 대역 간격(계산된 ~0.75 eV)과는 반대로 벌크 물질의 더 작은 대역 간격(계산된 0.19 eV, 관측된 0.3 eV)에 기여하는 것으로 생각된다.
- ^ 위버그 2001, 742 페이지
- ^ 에반스 1966, 페이지 124-25
- ^ 위버그 2001 페이지 758
- ^ Stuke 1974, 페이지 178; 도노휴 1982, 페이지 386–87; 코튼 외 1999, 페이지 501
- ^ Steudel 1977, 페이지 240: "...분자간, 다-중앙을 형성하려면 상당한 궤도 중첩이 존재해야 한다...[sigma] 결합은 층을 통해 퍼지고 황산화 전자로 채워지며 요오드의 성질에 반사된다( (re, color, medium electrical conductivity."; Segal 1989, 페이지 481: "아이오딘은 약간의 금속성을 보인다..."
- ^ 크웬, 로저스 & 심슨 1972년, 페이지 85–86, 237
- ^ 살리나스 2019, 페이지 379
- ^ 양 2004, 페이지 9
- ^ Wiberg 2001, 페이지 416, 574, 681, 824, 895, 930; [#Siekierski Sieki & Burgess 2002, 페이지 129]
- ^ 정 1987; 고드프린&로터 1995
- ^ 케임브리지 엔터프라이즈 2013
- ^ 패러데이 1853, 페이지 42; 홀더니스 & 베리 1979, 페이지 255
- ^ 헤딩턴 1944 페이지 405
- ^ 레그놀트 1853 페이지 208
- ^ 헤르츠펠트 1927, 페이지 701–705; 에드워즈 2000, 페이지 100–103
- ^ 크네엔, 로저스 & 심슨 1972년, 페이지 26326264
- ^ 2014년 랭글리 & 핫토리 페이지 214
- ^ a b 애벗 1966, 페이지 18
- ^ 브라운 외 2014년, 페이지 237
- ^ 에빙 & 라이트온 2007 페이지 868
- ^ Lidin 1996, 22 페이지, 29 페이지, 322, 165, 381, 173–174; 12, 147; 157 [B; P; 세; As; I]; 하우스크로프트 & 샤프 2008, 페이지 472 [I]
- ^ Lidin 1996, pp. 52, 58; 386; 140; 361, 365; 372, 376; 403 [C; Si; Ge; S; Sb; Te]; Rochow 1973, p. 1338 [Si]; Sanderson 1967, p. 172 [Ge]; Shkol'nikov 2010, p. 2127 [Sb]; Wiberg 2001, pp. 592 [Te]
- ^ 맷슨 & 오르백 2013, 페이지 85
- ^ 요더, 수이담 & 스네이블리 1975, 페이지 58
- ^ 영 외 2018, 페이지 753
- ^ 브라운 외 2014, 227페이지
- ^ 지키에스키 & 버지스 2002, 페이지 21, 133, 177
- ^ Moore 2016; Burford, Passmore & Sanders 1989, 페이지 54
- ^ 킹 & 칼드웰 1954, 페이지 17; 브래디 & 세네즈 2009, 페이지 69
- ^ 화학 추상화 서비스 2021
- ^ 코첼 2019, 페이지 210
- ^ Emsley 2011, 페이지 81, 181; Scott 2016, 페이지 3
- ^ 크웬, 로저스 & 심슨 1972년, 페이지 226, 360
- ^ 1996년 페이지 240
- ^ 그린우드 & 어니쇼 2002, 페이지 43
- ^ 크레스시 2010
- ^ 지키에스키 & 버지스 2002 페이지 24–25
- ^ 지키에스키 & 버지스 2002 페이지 23
- ^ 페트루셰프스키 & 크벳코비치 2018; 그로찰라 2018
- ^ 그린우드 & 이너쇼 2002, 페이지 27, 1232, 1234
- ^ 지키에스키 & 버지스 2002, 페이지 52, 101, 111, 124, 194
- ^ 콕스 2004 페이지 146
- ^ a b 버논 2013년 페이지
- ^ Wiberg 2001, passim
- ^ 버논 2020, 페이지 222
- ^ 앳킨스 & 오버턴 2010 페이지 377, 389
- ^ 무디 1991 페이지 391
- ^ Rodgers 2010, 페이지 504; Wulfsberg 2000, 페이지 726
- ^ 스텔만 1998년 104-211장
- ^ 나카오 1992 페이지 426-427
- ^ 힐 & 홀만 2000, 페이지 196
- ^ Wiberg 2001, 페이지 1761–1762
- ^ 2006년 젊은 페이지 1285
- ^ 브리태니커 백과사전 2021
- ^ 왕립화학회 2021
- ^ 챔버스 & 홀리데이 1982, 페이지 273–274; 볼만 1992, 페이지 213; 젠츠슈 2015, 페이지 247
- ^ 바실라키스, 칼레모스 & 마브리디스 2014, 페이지 1; 한리 & 고가 2018, 페이지 24; 카이호 2017, ch. 2, 페이지 1
- ^ 베일라 외 1989, 742 페이지
- ^ 티쇼얀 외 2019년, 페이지 95-98
- ^ Hampel & Hawley 1976년, 페이지 174;
- ^ Goodrich 1844, 페이지 264, The Chemical News 1897, 페이지 189, Hampel & Hawley 1976, 페이지 191, Lewis 1993, 페이지 835, Held 2006, 페이지 149–50
- ^ 타일러 1948, 페이지 105; 레일리 2002, 페이지 5-6
- ^ 존스 2010, 페이지 169-71
- ^ 스타인 1983, 페이지 165
- ^ 맷슨 & 오르백 2013, 페이지 203
- ^ Jolly 1966, 페이지 20
- ^ Clugston & Flemming 2000, 페이지 100–101, 104–105, 302
- ^ 마오성 2020, 962 페이지
- ^ 메이즈 2020
- ^ 위버그 2001 페이지 1131
- ^ 버논 2020, 페이지 229
- ^ Cox 2000, 페이지 258–259; Möler 2003, 페이지 173; Trenberth & Smith 2005, 페이지 864
- ^ 엠슬리 2011, 페이지 220
- ^ 엠슬리 2011, 페이지 440
- ^ Ju et al. 2014, 페이지 644–648
- ^ 레이너-캐넘 2020, 92페이지, 139페이지
- ^ a b 그린우드 & 이너쇼 2002 페이지 804
- ^ 루돌프 1973, 페이지 133: "산소와 특히 할로겐은 강한 산화제 입니다."
- ^ 다니엘 & 랍 1976년, 페이지 55
- ^ a b 코튼 외 1999, 페이지 554
- ^ 우드워드 외 1999, 페이지 133–194
- ^ 필립스 & 윌리엄스 1965, 페이지 478–479
- ^ Moeller 외 2012, 페이지 314
- ^ 랜포드 1959, 페이지 176
- ^ 매시 2000, 페이지 113
- ^ 슈메트, 망스틀 & 크라우스 2012, 페이지 7847‒7849
- ^ 에슬리 2001, 페이지 382
- ^ 그린우드 & 이너쇼 2002, 페이지 277
- ^ 2006년 앳킨스 외, 페이지 320
- ^ 그린우드 & 이너쇼 2002, 페이지 482; 버거 1997, 페이지 86
- ^ 모스 1952, 페이지 180, 202
- ^ a b c d e Cao 외 2021 페이지 20-21
- ^ 챌린저 2014, 페이지 5; 2015년 캐나다 정부; Gargaud et al. 2006, 페이지 447
- ^ Crichton 2012, 페이지 6; Scerri 2013; Los Alamos 국립 연구소 2021
- ^ 버논 2020, 페이지 218
- ^ 울프스버그 2000, 페이지 273–274, 620
- ^ Seees & Daub 1985, 페이지 65
- ^ MacKay, MacKay & Henderson 2002, 페이지 209
- ^ Cousins, Davidson & Garcia-Vivo 2013, 페이지 11809–11811
- ^ a b Wiberg 2001, 페이지 255–257
- ^ 립트로 1983, 페이지 161
- ^ 1962년 스콧 & 칸다, 페이지 153
- ^ 테일러 1960, 페이지 316
- ^ a b c d e f g 엠슬리 2011, passim
- ^ 크로포드 1968, 페이지 540
- ^ 베너, 리카르도 & 캐리건 2018, 페이지 167—168: "탄소의 안정성—탄소 결합...생체 분자를 비계화할 수 있는 첫 번째 선택 요소가 생물 분자를 비계화할 수 있는 첫 번째 요소가 되었다.수소는 여러 가지 이유로 필요하다; 최소한 C-C 체인을 종단한다.이성질체질(탄소와 수소가 아닌 물질)은 탄소 분자의 반응도를 결정한다....생명체에서 이것들은 산소, 질소, 그리고 더 적은 범위에서는 유황, 인, 셀레늄, 그리고 이따금 할로겐이다."
- ^ 자오, 투 & 찬 2021년
- ^ 코산케 외 2012, 페이지 841
- ^ 와세워 2021, 페이지 322–323
- ^ 메슬러 2011, 페이지 10
- ^ 킹 외 1994, 페이지 1344; 파월 & 팀스 1974, 페이지 189–191
- ^ 버논 2020, 페이지 221–223
- ^ 레이너-캐넘 2020, 216페이지
- ^ 앳킨스 2001, 페이지 24-25
- ^ a b Cox 1997, 페이지 130–132; Emsley 2011, passim
- ^ 국립생명공학정보센터 2021
- ^ 엠슬리 2011, 페이지 113
- ^ 그린우드 & 이너쇼 2002, 페이지 270–271
- ^ 칸 2001, 페이지 59
- ^ Cox 1997, 페이지 130; Emsley 2011, 페이지 393
- ^ Cox 1997, 페이지 130; Emsley 2011, 페이지 515–516, 518
- ^ 보이드 2011, 페이지 570
- ^ 마스터턴, 헐리 & 네트 2011, 페이지 38
- ^ 맥큐 1963 페이지 264
- ^ 딩글 2017, 페이지 101
- ^ 헐버트 1961 페이지 132
- ^ 바톤 2021 페이지
- ^ 샤나브룩, 란닌 & 히사츠네 1981, 페이지 130‒133
- ^ 1992년 보그 & 디엔스 페이지 26
- ^ 위버그 2001 페이지 796
- ^ 샹 외 2021년
- ^ 탕 외 2021년
- ^ Cacace, de Petris & Troiani 2002, 페이지 480‒481
- ^ 코지엘 2002 페이지 18
- ^ 구스망, 소퍼 & 푸메라 2017, 페이지 8052–8053; 버거 1997, 페이지 84; 버논 2013, 페이지 1704‒1705.
- ^ Piro 등 2006, 페이지 1276‒1279
- ^ Steudel & Eckert 2003, 페이지 1
- ^ 그린우드 & 이너쇼 2002, 페이지 659–660
- ^ 모스 1952, 페이지 192; 그린우드 & 어니쇼 2002, 페이지 751
- ^ 도노휴 1982년 페이지 48–81
- ^ 시엘로2021번길
- ^ 자오 외 2017년
- ^ 도노휴 1982년 302-310페이지
- ^ 브로스키 외 1972년, 페이지 609–614
- ^ a b 킬러 앤 워더스 2013, 페이지 293
- ^ 유수프 1998, 페이지 425; 엘라트레쉬 & 본브 2020
- ^ 드라도네아 2020, 페이지 595
- ^ Su et al. 2020, 페이지 1649
- ^ 넬슨 1987, 페이지 732: 지각, 대기, 하이드로스피어; Fortescue 2012, 페이지 56, 65: 바이오매스
- ^ 맥케이, 맥케이 & 헨더슨 2002, 페이지 200
- ^ Cox 1997, 17페이지, 19페이지
- ^ 오스트리커 & 스타인하르트 2001, 페이지 46 4653
- ^ ö 2007
- ^ a b c d 스튜어트 N.D.
- ^ a b 보이세 주립 대학교 2020
- ^ 국립표준기술연구원 2013
- ^ 개프니 & 말리 2017, 페이지 27
- ^ 래빙거 2019, 페이지 305
- ^ Emsley 2011, 페이지 42–43, 219–220, 263–264, 341, 441–442, 596, 609
- ^ Emsley 2011, 페이지 84, 128, 180–181, 247
- ^ 요리사 1923 페이지 124
- ^ 1945년 주, 페이지 161
- ^ Emsley 2011, 페이지 113, 363, 378, 477, 514–515
- ^ 주 1945, 페이지 22; 엠슬리 2011, 페이지 40
- ^ 클라인 1994, 페이지 168
- ^ 리딘 1996, 페이지 64‒65
- ^ 라우나이 1566, 페이지 7)
- ^ 홈버그 1708, 페이지 350; 비디오 킴 2000
- ^ 드 클레이브 1641
- ^ Schlager & Lauer 2000, 페이지 370
- ^ 스트라틴 2000, 239페이지
- ^ 크리스웰 페이지 1140
- ^ 살츠베르크 1991, 페이지 204
- ^ Kendall 1811 페이지 298–303
- ^ 브란데 1821 페이지 5
- ^ Edwards & Sienko 1983, 페이지 691–96
- ^ Edwards & Sienko 1983, 페이지 693
- ^ 헤르츠펠트 1927; 에드워즈 2000, 페이지 100-03
- ^ 쿠바쉐프스키 1949 페이지 931–940
- ^ 레미 1956 페이지 9
- ^ 1962년, 페이지 106: 칠 때 울리는 소리를 낸다.
- ^ 존슨 1966, 페이지 3-4
- ^ 호바스 1973, 페이지 335-336
- ^ 라오&강굴리 1986
- ^ Smith & Dwyer 1991, 페이지 65: 용해점과 비등점의 차이.
- ^ a b 허먼 1999 페이지 702
- ^ 수레쉬 & 고가 2001, 페이지 5940–5944
- ^ 존슨 2007, 페이지 15-16
- ^ a b Edwards 2010, 페이지 941–965
- ^ 포브 앤 로신 2017, 페이지 131
- ^ 1911년 해변
- ^ Stott 1956, 페이지 100–102
- ^ 1977년 교구, 페이지 178
- ^ 하레&바첼 1836 페이지 310
- ^ 챔버스 1743: "금속과 다른 모든 신체를 구별하는 것...그들의 무거움..."
- ^ 에드워즈 2000, 85 페이지 85
- ^ 러셀 & 리 2005, 페이지 466
- ^ 앳킨스 외 2006, 페이지 320-21
- ^ 지갈스키 & 존스 2003, 페이지 66
- ^ 에슬리 1971 페이지 1
- ^ 존스 2010, 페이지 169
- ^ 존슨 1966, 페이지 3-5, 15
- ^ Leach & Ewing 1966, 페이지 47
- ^ 브래디 & 세네즈 2009년 페이지 52
- ^ 줌달 & 드코스트 2019, 페이지 90
- ^ 오더버그 2007년 페이지 97
- ^ 베르토메우 산체스, 가르시아-벨마르 & 벤사우드 빈센트 2002, 페이지 248–249
- ^ 듀파스키에 1844페이지 66-67
- ^ 윌리엄스 2007, 페이지 1550–1561
- ^ 웨히터쇼우저 2014
- ^ 헨젤드 & 페돈킨, 페이지 181–226
- ^ 와크만 1899 페이지 562
- ^ 1913년 11월
- ^ 파라메스와란 2020년, 페이지 210
- ^ 기사 2002 페이지 148
- ^ 프라우스토 다 실바 & 윌리엄스 2001, 페이지 500
- ^ 베르젤리우스 1832, 페이지 248–276
- ^ 케미컬 뉴스 1864 페이지 22
- ^ 르노우프 1901 페이지 268
- ^ 버논 2020, 페이지 217–225
- ^ 2003년 트레가르트헨, 페이지 10
- ^ a b c d 로초 1966, 페이지 4
- ^ Wiberg 2001, 페이지 780; Emsley 2011, 페이지 397; Rochow 1966, 페이지 23, 84
- ^ 크네인, 로저스 & 심슨 1972년, 321페이지, 404페이지, 436
- ^ 크네인, 로저스 & 심슨 1972, 페이지 439
- ^ 크네인, 로저스 & 심슨 1972, 페이지 465
- ^ 크네인, 로저스 & 심슨 1972, 페이지 308
- ^ Wiberg 2001, 페이지 505, 681, 781; Glinka 1965, 페이지 356
- ^ 1987, 페이지 419004198; 갓프린 & 라우터 1995, 페이지 216‒218
- ^ 케임브리지 엔터프라이즈 2013
- ^ 패러데이 1853, 페이지 42; 홀더니스 & 베리 1979, 페이지 255
- ^ 헤딩턴 1944 페이지 405
- ^ 레그놀트 1853 페이지 208
- ^ 위버그 2001 페이지 416
- ^ 데사이, 제임스 & 호 1984, 페이지 1160, 마툴라 1979, 페이지 1260
- ^ 섀퍼 1968, 페이지 76; 카라펠라 1968, 페이지 29‒32
- ^ a b c 보고로디츠키 & 파신코프 1967, 페이지 77, 젠킨스 & 카와무라 1976, 페이지 88
- ^ 크네인, 로저스 & 심슨 1972, 페이지 264
- ^ 레이너-캐넘 2018, 페이지 203
- ^ Welcher 2001, 페이지 3–32: "원소들은 ...금속에서 적당히 활동적인 비금속, 매우 활동적인 비금속, 그리고 고귀한 가스로 변화한다."
- ^ 맥킨 2014 페이지 80
- ^ 존슨 1966, 페이지 105-108
- ^ Stein 1969, 페이지 5396 ‒5397; 피트저 1975, 페이지 760 ‒761
- ^ 포터필드 1993, 페이지 336
- ^ a b 라오 2002 페이지 22
- ^ 웰스 1984, 페이지 534
- ^ 앳킨스 외 2006, 페이지 8, 122–123
- ^ 위버그 2001, 750 페이지
- ^ 시도로프 1960, 페이지 59999603
- ^ a b c d Puddephatt & Monahan 1989, 페이지 59
- ^ a b 샌더슨 1967, 페이지 172
- ^ a b 밍고스 2019, 페이지 27
- ^ 2008년 집, 페이지 441
- ^ 맥밀런 2006 페이지 823
- ^ 1995년 킹 페이지 182
- ^ 위버그 2001 페이지 399
- ^ 클레닝 & 아펠만 1988, 페이지 3760
- ^ 리터 2011, 페이지 10
- ^ 야마구치 & 시라이 1996 페이지 3
- ^ 버논 2020, 223 페이지
- ^ 우드워드 외 1999, 페이지 134
- ^ 달튼 2019
- ^ 앨런 & 후희 1980, 페이지 1523–1524
- ^ 슈틸 1977, 페이지 176
참고 문헌 목록
- 애보트 D 1966, 런던 J. M. 덴트 & 선스 주기율표 소개
- 앨런 LC & Huhey JE 1980, "전기율과 고귀한 가스의 화학의 정의", 제42권, 제10호, 도이: 10.1016/0022-1902(80)80132-1
- Atkins PA 2001, The Periody Kingdom: 런던 피닉스, 화학 원소의 땅으로의 여행 ISBN978-1-85799-449-0
- Atkins PA 등 2006, Shriver & Atkins의 무기화학, 4번째 Ed, 옥스퍼드 대학교 출판부, ISBN 978-0-7167-4878-6
- Atkins PA & Overton T 2010, Shriver & Atkins의 무기화학, 5부, 옥스퍼드 대학 출판부, ISBN 978-0-19-923617-6
- Aylward G and Findlay T 2008, SI 화학 데이터, 6번째 에드, John Wiley & Sons Australia, Milton, ISBN 978-0-470-81638-7
- 바일라 JC 외 1989, 화학, 3부, 하코트 브레이스 요바노비치, 샌디에이고, ISBN 978-0-15-506456-0
- Barton AFM 2021, States of Matter, States of Mind, CRC Press, Boca Raton, ISBN 978-0-7503-0418-4
- 비치 FC (ed.) 1911, The Americana: Vol. XIII, Mel-New, 메탈로이드, New York, Scientific American Composing Depository
- Benner SA, Ricardo A & Carrigan MA 2018, Cleland CE & Bedau MA (eds), The Nature: Classic and Codern Perspectives from Chealthology, Cambridge, ISBN 978-1-108-206
- 버거 LI 1997, 반도체 재료, CRC 프레스, 보카 라톤, ISBN 978-0-8493-8912-2
- 베르토메우-산체스 JR, 가르시아-벨마르 A&벤사우드-빈센트 B 2002 "순서를 구함:19세기 프랑스의 교과서 및 화학 분류", Ambix, 제49권, 제3권, doi:10.1179/amb. 49.3.227권
- Berzelius JJ & Bachen AD 1832, "화학 명명법에 관한 에세이, 화학 논문의 앞부분", The American Journal of Science and Arts, 제22권,
- 보드너 GM & 파듀 HL 1993, 화학, 실험과학, 존 와일리 & 선스, 뉴욕 ISBN 0-471-59386-9
- 보고로디츠키 NP & Pasynkov VV, 1967, 라디오 및 전자 재료, 일리프 북스, 런던
- 볼만 R 1992년 윈터펠트 E(ed.), 헤테로아톰 조작, 옥스포드 주 페르가몬 프레스, ISBN 978-00-08-091249-3
- 보이세 주립대학 2020, "비용 효율적인 제조방법은 흑인 연구에 새로운 활력을 불어넣는다" 마이크론 소재공학대학이 2021년 7월 9일에 접속했다.
- Borg RG & Dienes GJ 1992, The Physical Chemical of Solids, Academic Press, Boston, ISBN 978-0-12-118420-9
- 보이드 R 2011, "셀레늄 이야기", 자연 화학, 제3권, doi:10.1038/nchem.1076
- Brady JE & Senese F 2009, 화학: 물질과 그 변화에 관한 연구, 5차 연구, 존 와일리 & 선스, 뉴욕, ISBN 978-0-470-57642-7
- Brande WT 1821, A Manual of Chemistry, vol.2세, 존 머레이, 런던
- Brodsky MH, Gambino RJ, Smith JE Jr&Yacoby Y 1972, "무형 텔루륨의 라만 스펙트럼", Physica Status Solidi (b), vol. 52, doi:10.1002/pssb.2220520229
- Brown TL et al. 2014, 화학: Central Science, 3edd, Pearson Australia:시드니, ISBN 978-1-4425-5460-3
- Burford N, Passmore J & Sanders JCP 1989, "The preparation, structure, and energetics of homopolyatomic cations of groups 16 (the chalcogens) and 17 (the halogens), in Liebman JF & Greenberg A, From atoms to polymers : isoelectronic analogies, VCH: New York, ISBN 978-0-89573-711-3
- Cacace F, de Petris G & Troiani A 2002, "테트라니토겐의 실험 검출", Science, vol. 295, no. 5554, doi:10.1126/과학. 1067681
- 캠브리지 엔터프라이즈 2013, "탄소 '캔디 면사포'는 에너지 정전을 방지하는 데 도움이 될 수 있다.", 캠브리지 대학교는 2013년 8월 28일에 접속했다.
- Cao C 외 2021, "주기율표에서의 주기 및 비주기 화학의 이해", Frontiers in Chemical, vol. 8, no. 813, doi:10.3389/fchem.20.00813
- Carapella SC 1968, Hampel CA의 "Arsenic" (ed.), The Chemical Elegence of the Chemical Elements, Reinhold, New York.
- Carmalt CJ & Norman NC 1998, 'Arsenic, Antimony and Bismuth: Some General Properties and Aspects of Periodicity', in NC Norman (ed.), Chemistry of Arsenic, Antimony and Bismuth, Blackie Academic & Professional, London, pp. 1–38, ISBN 0-7514-0389-X
- 챌린저 J 2014, 요소: 칼튼 출판그룹, ISBN 978-0-233-00436-5
- 챔버스 E 1743, "메탈"의 사이클로피디아: 또는 유니버설 예술 및 과학 사전(등), 제2권 D 한겨울, 런던
- 체임버스 C&홀리데이 AK 1982, 무기화학, 버터워스 주식회사, 런던 ISBN 978-0-408-10822-5
- Charlier J-C, Gonze X, Michelnaud J-P 1994, Stacking effects on the Electronic Properties of Graphy, Carbon, vol. 32, 2, 289–99, doi:10.1016/0008-6223(94)90192-9-9
- 화학 추출 서비스 2021, CAS 레지스트리 데이터베이스(11월 2일 기준), 사례 #01271182
- Cherim SM 1971, 필라델피아 Sunders의 실험실 기술자를 위한 화학, ISBN 978-0-7216-2515-7
- Jung DD 1987, "각질 흑연 검토", Journal of Materials Science, vol. 22, doi:10.1007/BF01132008
- Clugston MJ & Flemming R 2000, Advanced Chemistry, Oxford University Press, ISBN 978-0-19-914633-8
- 코첼 C 2019, 생명의 방정식: 런던 애틀랜틱 북스, ISBN 978-1-78649-304-0
- CG 1923, 일상의 화학: 뉴욕 D 애플턴의 실험실 매뉴얼과 함께
- Cotton A 외 1999, 고급 무기 화학, 6번째 에드, 뉴욕 Wiley, ISBN 978-0-471-19957-1
- Cousins DM, Davidson MG & Garciaa-Vivo D 2013, "리튬 및 페놀레이트 나트륨의 큐바인 코어에 4코드로 구성된 수소 원자의 전례 없는 참여", Chemical Communications, vol. 49, doi:10.1039/C3CC47393G
- Cox A (ed.) 2000, 앨런의 천체물리학적 수량, 4번째 에드, AIP 프레스, 뉴욕, ISBN 978-0-387-987-46-0
- Cox PA 1997, The Elements: 옥스퍼드 대학 출판부, 옥스퍼드 대학교 출판부, ISBN 978-0-19-855298-7
- Cox T 2004, 무기화학, 2부, BOS Scientific Publishers, London, ISBN 978-1-85996-289-3
- Crawford FH 1968, 뉴욕 하코트, 브레이스 & 월드 물리학 소개
- 크라이튼 R 2012, 생물 무기 화학: 분자 구조와 기능에 대한 새로운 소개, 2차 에드, 암스테르담 엘스비에, ISBN 978-0-444-53783-6
- 크레스지 D 2010, "화학자들 수소 결합 재 정의", 네이처 뉴스블로그 2017년 8월 23일 접속
- 크리스웰 B 2007, "학생을 멘델레예프가 단 하루만 있게 한 실수", 제84권, 제7권, 제1140권—1144권, doi:10.1021/ed084p1140
- Dalton L 2019, "Argon은 압력솥 조건에서 니켈과 반응한다.", Chemical & Engineering News, 2019년 11월 6일 접속
- Daniel PL & Rapp RA 1976, "금속 할로겐 부식", 폰타나 MG & Staehle RW (eds.)에서, 스프링거, 보스턴의 부식 과학 기술 진보, doi:10.1007/978-1-4615-9062-0_2
- 2022년 2월 24일 파리 올리비에 데바렌스, 진정한 원리와 자연의 새로운 철학적 빛 드 클레이브 E 1641이 접속했다.
- de L'Aunay L 1566, Responce au discours de maistre Iacques Grevin, docteur de Paris, qu'il a escript contre le livre de maistre Loys de l'Aunay, medecin en la Rochelle, touchant la faculté de l'antimoine (Response to the Speech of Master Jacques Grévin,...로이스 드 라우나이 사부님의 책에 대항해 쓴...안티몬 교수진을 만지며, De l'Imprimerie de Barthellemi Berton, La Rochelle.
- Deming HG 1923, 일반 화학: 뉴욕 존 와일리 & 선즈 초등조사
- Desai PD, James HM & Ho CY 1984, "알루미늄 및 망간의 전기 저항성", Journal of Physical and Chemical Reference Data, vol. 13, no. 4, doi:10.1063/1.555725
- 딩글 2017, The Elements: Brighton, ISBN 978-0-85762-505-2 주기율표 백과사전 투어
- 도노휴 J 1982, 원소의 구조, 플로리다 말라바르의 로버트 크리거, ISBN 978-0-89874-230-5
- Du Y, Owang C, Si S & Lei M 2010, '흑인의 원자 및 전자 구조에 관한 Ab Initio 연구', 제107권, 제9권, 페이지 093718–1–4, doi:10.1063/1.3386509
- 듀파스키에 A 1844년, 디포메테 엘레멘테 데 치미 공업가, 샤를 사비 쥬엔, 리옹.
- Ebbing DD & Gammon SD 2007, General Chemistry, 9edd, Houghton Miffllin, 보스턴, ISBN 978-0-618-85748-7
- Edelstein NM & Morrs LR 2009, Nagy S(ed.), 방사화학 및 핵화학: 제2권, 생명유지 시스템 백과사전, EOLSS 출판사, 옥스포드, 페이지 118–176, ISBN 978-1-84826-576-576
- Edwards PP 2000, "무엇, 왜 그리고 언제 금속인가?", Hall N (ed.), The New Chemistry, Cambridge, Pp. 85–114, ISBN 978-0-521-45224-3
- Edwards PP et al. 2010, "…금속은 전도하고 비금속은 전도하지 않는다", Royal Society A, 2010, vol, 368, no. 1914, doi:10.1098/rsta.2009.0282
- Edwards PP & Sienko MJ 1983, "원소 주기율표에 금속성 성질의 발생에 대하여", 제60권, 제9권, doi:10.1021/ed060p691, PMID 25666074
- Elatresh SF & Bonev SA 2020, "고압에서의 고체산소의 안정성과 금속화", 물리화학물리학, 22권, 22권, doi:10.1039/C9CP05267D
- Emsley J 1971, 런던 메투엔 교육청 비금속 무기화학, ISBN 978-0-423-86120-4
- Emsley J 2011, Nature's Building Blocks: 옥스퍼드 대학 출판부의 A-Z 가이드, ISBN 978-0-19-850341-5
- 브리태니카 2021년 백과사전, 주기율표, 2021년 9월 21일 접속
- Draffotonea D 2020, "압력에 의한 위상 변환", 결정, vol. 10, doi:10.3390/cryst10070595
- 에반스 RC 1966, 케임브리지 케임브리지 대학교 크리스탈 화학 소개
- 패러데이 M 1853, 비금속 원소에 관한 6가지 강의의 주제 (존 스코페른이 기획) 런던 롱맨, 브라운, 그린, 롱맨스
- Fortescue JAC 2012, 환경 지질화학: 뉴욕 스프링거-베를라크, ISBN 978-1-4612-6047-9
- Fraps GS 1913, PA, Easton, The Chemical Publishing Company, 농업 화학 원리
- Frausto da Silva JJR & Williams RJP 2001, 원소의 생물 화학: 생명의 무기 화학, 2부 옥스퍼드 대학 출판부, ISBN 978-0-19-850848-9
- 개프니 J&말리 N 2017, 암스테르담 엘스비어, ISBN 978-0-12-810444-6
- Gargaud M 외 (eds.) 2006, Astrobiology 강의, 제1권, 제1부: 생명의 초기 지구와 다른 우주 서식지, 스프링거, 베를린, ISBN 978-3-540-29005-6
- Glinka N 1965, General Chemistry, Sobolev D (trans.), Gordon & Break, New York
- Godfrin H&Lauter HJ 1995, "He added on 흑연에 흡착된 그의 실험 특성" Halperin WP (ed.), 저온 물리학 진행, 14권, 암스테르담의 엘시어 사이언스 B.V, ISBN 978-0-08-05393-5
- 고도비코프 AA & 네나셰바 N 2020, 광물의 구조화학적 체계학, 3부, 스프링거, 스위스 참, ISBN 978-3-319-72877-3
- Goodrich BG 1844, Boston Soden & Co., Bradbury, Bradbury의 물리 과학 개요
- 2015년 캐나다 정부, 2015년 8월 30일에 액세스한 주기율표
- 그린우드 NN & 어닝쇼 2002, 원소의 화학, 2부, 버터워스-하이네만, ISBN 978-0-7506-3365-9
- Grochala W 2018, "원소 주기율표에서 헬륨과 네온의 위치에 대하여", 20권, 페이지 191–207, doi:10.1007/s10698-017-9302-7
- 구스망 R, 소퍼 Z&푸메라 M 2017 "검은 인이 재발견:벌크 재료에서 모놀레이어로", 안젤완트 케미 인터내셔널 에디션, 56권, 28권, doi:10.1002/anie.201610512
- Hampel CA & Hawley GG 1976, 화학 약관 용어집, Van Nosteland Reinhold, 뉴욕 ISBN 978-0-442-238-2
- 한리JJ&고가 KT 2018, '지상 및 우주 지질화학 시스템의 할로겐: 지구 및 외계 지질화학 프로세스에서의 할로겐의 역할: 압운턴스, 지질화학 행동, 분석 방법' 표면, 크러스트 및 맨틀, 할로프 DE&아라노비치 L(에드), 스프링거, 참, ISBN 978-3-19-61667-4
- 하레 RA & 바첼 F 1836, 펜실베이니아 대학 의학부 화학 교수 과정 개요, 3부, 필라델피아 JG 아우너
- Hengeveld R&Fedonkin MA 2007, "생명의 시작에서 에너지 흐름의 부트스트래핑", Acta Biotherica, vol. 55, doi:10.1007/s10441-007-9019-4
- Herman ZS 1999, ZB, Orville-Thomas WJ(eds)에서 1999년, Pauling의 레거시 "Linus Pauling에 따르면, 금속, 합금 및 금속간 화합물에서의 화학 결합의 특성"에서, 1999년, Pauling의 레거시치, ZB, Orville-Tomas WJ. 암스테르담 엘스비에르 화학본드의 현대적 모델링:10.1016/S1380-7323(99)80030-2
- 헤르만 A, 호프만 R & 애슈크로프트 NW 2013, "응축된 아스타틴:단원자성 및 금속성", 물리적 검토서, 제111권, doi:10.1103/PhysRevRevLet.1116404
- 2006년 Held A, "주기율표 내의 여러 등급의 화학원소를 공통 성질에 따라 배열함", 제9권, 제1권, doi:10.1016/j.crci.2005.10.002.
- Herzfeld K 1927, "원소를 금속으로 만드는 원자성" 물리 리뷰, 제29권, 제5호, doi:10.1103PhysRev.29.701
- Hill G, Holman J & Hulme PG 2017, 화학 인 컨텍스트, 7부, 옥스퍼드 대학 출판부, ISBN 978-0-19-839618-5
- 홀더니스 A&Berry M 1979, 고급 무기화학, 3차 개정, 하인만 교육서적, 런던, ISBN 978-0-435-65435-1
- Höll, Kling & Schroll E 2007, "게르마늄의 전이성—A 리뷰", Ore Geological Reviews, vol. 30, no. 3–4, 145–180, doi:10.1016/j.oreeorev 2005.07.034
- Homberg W 1708, "Des Essais de Chimie"의 히스토아르 드 L'Academie Royale Descience: 파리 L'Academique & de Bittle, L'Academique & de Bittle
- 호바스 AL 1973, "원소와 주기계의 임계 온도", 화학 교육 저널, 50권, 5권, doi:10.1021/ed050p335
- 하우스 JE 2008, 무기화학, 암스테르담 엘스비에, ISBN 978-0-12-356786-4
- 하우스크로프트 CE & 샤프 AG 2008, 무기 화학, 3부, 프렌티스 홀, 할로우, ISBN 978-0-13-175553-6
- 헐버트 Jr. CS 1961, Manual of Minerogy, 15번째 Edition, John Wiley & Sons, New York
- IUPAC 주기율표, 2021년 10월 11일 접속
- 젠킨스 GM & 카와무라 K 1976, 폴리머릭 카본스—카본 파이버, 글라스 및 차르, 캠브리지 대학 출판부, ISBN 978-0-521-20693-8
- Jentzsch AV & Matile S 2015, "할로겐 결합이 있는 Anion transport with halogen bonds", Metrangolo P & Resati G(eds), Halogen Bonding I: 재료 화학 및 생명 과학, Springer, Cham, ISBN 978-3-3-19-14057-5
- Johnson D (ed.) 2007, Metals and Chemical Change, RSC Publishing, Cambridge, ISBN 978-0-85404-665-2
- Johnson RC 1966, 뉴욕 WA Benjamin의 기술 화학 입문
- Jolly WL 1966, 뉴저지 주, 프렌티스-홀, 프렌티스-홀, 비금속 화학
- 존스 BW 2010, 명왕성: 케임브리지 케임브리지 대학교 외곽 태양계의 센티넬, ISBN 978-0-521-19436-5
- Jørgensen SE & Mitsch WJ (eds.) 1983, 환경 관리에서의 생태 모델링 적용, 파트 A, Escier Science Publishing, 암스테르담, ISBN 978-0-444-41948-4
- 카이호 T 2017, 요오드 제조 간편, CRC 프레스, 전자책, doi:10.1201/9781315158310
- Keeler J & Wothers P 2013, 화학 구조 및 반응도: 통합 접근법, 옥스퍼드 대학교 출판부, ISBN 978-0-19-960413-5
- Kendall EA 1811, 포켓 백과사전 2편, vol.III, Longman, Hurst, Rees, Orme, Co, London
- Khan N 2001, 개념 출판, 뉴델리, ISBN 978-81-7022-898-1
- Kim MG 2000, "화학 분석 및 현실 영역:빌헬름 홈버그의 Essais de chimie, 1702–1709", 역사 및 철학 연구 파트 A, vol. 31, 1, 페이지 37–69, doi:10.1016/S0039-3681(99)00033-3
- 킹 RB 1994, 무기화학 백과사전, 제3권, 존 와일리 & 선즈, 뉴욕 ISBN 978-0-471-93620-6
- 킹 RB 1995, 뉴욕 주 VCH 주요 그룹 요소의 무기 화학, ISBN 978-1-56081-679-9
- 킹 GB & 칼드웰 WE 1954년, 미국 도서 회사, 대학 화학의 기초
- Claing UK & Appelman EH 1988, "과산화 효소", 무기화학, 제27권, 제21호, doi:10.1021/ic00294a018
- 클라인 U 1994, "화학 화합물 개념의 기원", Science in Context, No. 7, vol. 2, 페이지 163–204, doi:10.1017/s0269889700001666
- Kneen WR, Rogers MJW & Simpson P 1972, 화학: 사실, 패턴 및 원칙, 런던 애디슨 웨슬리, ISBN 978-0-201-03779-1
- Knight J 2002, Science of Everyday Things: 실생활 화학, 게일 그룹, 디트로이트, ISBN 9780787656324
- Kosanke 외 2012, 2012, 폭약 기술 백과사전 (및 관련 주제), 파트 3 – P - Z, 폭약 참조 시리즈 5호, 폭약 기술 저널, 화이트워터, 콜로라도, ISBN 978-1-889526-21-8
- Koziel JA 2002, "실내 공기 분석을 위한 샘플링 및 샘플 준비" Pawliszyn J(ed.), 종합 분석 화학, vol. 37, Exvier Science B.V, 암스테르담, ISBN 978-0-444-50510-1
- 쿠바쉐프스키 O 1949, "용해 원소의 엔트로피, 부피, 결합 상태의 변화", 패러데이 소사이어티의 거래, 제45권, doi:10.1039/TF944500931권
- Labinger JA 2019, "The history (and pre-history) of the discovery and chemistry of the noble gases", in Giunta CJ, Mainz VV & Girolami GS (eds.), 150 Years of the Periodic Table: A Commemorative Symposium, Springer Nature, Cham, Switzerland, ISBN 978-3-030-67910-1
- Lanford OE 1959, 뉴욕 McGraw-Hill의 화학 사용
- Langley RH & Hattori H 2014, 1,001 연습 문제: 케미컬 포 더미즈, 존 와일리 & 선즈, NJ 호보켄, ISBN 978-1-118-54932-2
- 라라가 MD, 루이스 Sr RJ & Lewis RA 2016, 호울리의 응축화학사전, 16번지, 와일리, 호보켄, 뉴욕 ISBN 978-1-118-13515-0
- Leach RB & Ewing GW 1966, Chemistry, Doubleay, New York
- Lee JD 1996, 간결한 무기화학, 5번째 에디션, 블랙웰 사이언스, 옥스퍼드, ISBN 978-0-632-05293-6
- Lewis RJ 1993, Hawley's 응축화학사전, 12차 개정판 노스트랜드 라인홀드, 뉴욕 ISBN 978-0-442-01131-4
- Lidin RA 1996, 무기 물질 핸드북, 뉴욕 베겔 하우스, ISBN 978-0-8493-0485-9
- Liptrot GF 1983, Modern 무기화학, 4edd, Bell & Hyman, ISBN 978-0-7135-1357-8
- 로스앨러모스 국립연구소 2021, 주기율표: 초·중·고등학생을 위한 자료, 2021년 9월 19일 접속
- Luchinskii GP & Tiphonov DN 1981년, Uchenie o Chiichnosti에서 "화학원소 분류와 주기체계 구조의 일부 문제". 이스토리야 이 소브레멘녹트, (러시아) 나우카, 모스크바
- 맥케이 KM, 맥케이 RA & 헨더슨 W 2002, 현대 무기화학 소개, 6번째 에드, 넬슨 쏜스, 첼트넘, ISBN 978-0-7487-6420-4
- 맥킨 M 2014, 화학, 엘시어 사이언스, 세인트 루이스, ISBN 978-0-323-14652-4
- Maosung M 2020, "고형 화합물의 노블 가스는 충분한 압력으로 화학의 풍부한 표시를 보여준다.", Frontiers in Chemistry, vol. 8, doi:10.3389/fchem.2020.570492
- 매시 AG 2000, 메인 그룹 케미스트리 2부, 존 와일리 & 선즈, 치체스터 ISBN 978-0-471-49039-5
- 마스터톤 W, 헐리 C&Neth E 2011, 화학: 원리와 반응, 7번째 에드, 브룩스/콜, 캘리포니아 벨몬트, ISBN 978-1-111-42710-8
- Matson M & Orback AW 2013, 더미를 위한 무기 화학, John Wiley & Sons: Hoboken, ISBN 978-1-118-21794-8
- Matula RA 1979, "구리, 금, 팔라듐 및 은의 전기 저항성", 물리적 및 화학적 기준 데이터 저널, 제8권, 제4호, doi:10.1063/1.555614호
- Mazej Z 2020, "고귀한 가스 화합물의 첫 보고 이후 반세기 이상 노블 가스 화학" 분자, 25권, 13권, doi:10.3390/분자25133014, PMID 32630333, PMC 7412050
- McCall AS et al. 2014, Bromine은 조직 개발 및 아키텍처에서 콜라겐 IV 비계들의 조립을 위한 필수 트레이스 요소, Cell, vol. 157, no. 6, doi:10.1016/j.009, PMID 24906154, PMC 4144415.
- 맥큐 JJ 1963, 원자의 세계: 뉴욕 로널드 프레스, 물리과학 소개
- 맥밀런 P 2006, "탄소 한 잔", 네이처, 441권, doi:10.1038/441823a
- 메슬러 JR RW 2011, 엔지니어를 위한 자료의 정수, 매사추세츠 주 서드베리의 존스와 바틀렛 학습, ISBN 978-0-7637-7833-0
- Mewes et al. 2019, Copernicium:상대론적 고귀한 액체인 안젤완테 케미 인터내셔널 에디션 58, 페이지 17964–17968, doi:10.1002/anie.201906966
- 밍고스 DMP 2019, 밍고스 DMP (ed.), 밍고스 DMP (ed.), 밍고스 DMP (the Periody Table I)에 있는 "주기적 표의 원소 발견". 구조 및 본딩, 스프링거 네이처, 챔, doi:10.1007/978-3-030-40025-5
- Moeller T 외 2012, 화학: 무기질적 질적 분석으로 뉴욕 학술언론사 ISBN 978-0-12-503350-3
- 뮐러 D 2003, 루프트: 케미, 피식, 바이오로지, 라인할퉁, 레흐트, 베를린 발터 드 그루이터, ISBN 978-3-11-016431-2
- 무디스 B 1991, 비교 무기 화학, 3부, 에드워드 아놀드, 런던 ISBN 978-0-7131-3679-1
- 무어 JT 2016, 케미스트리 포 더미즈, 2부 16장, 주기율 추세 추적, 존 와일리 & 선즈: 호보켄, ISBN 978-1-119-29728-4
- 모리타 A 1986, '반도체 흑인', 응용물리학 A 저널, 39권, 4, 227–42권, doi:10.1007/BF00617267
- Morely HF & Muir MM 1892 와트의 화학사전, 제3권, Longman's Green, 그리고 Co, London.
- Moss, TS 1952, Butterworths Scientific, London의 요소에서의 복사율
- 나카오 Y 1992, "할로겐-할로겐-극성 유기용매 시스템에서의 고귀한 금속의 분해", 5호, 화학 협회, 화학 커뮤니케이션 저널, doi:10.1039/C39920000426
- 국립생명공학정보센터 2021 "CID 402, 황화수소용 PubChem 복합 요약본"은 2021년 8월 31일에 접속하였다.
- 국립표준기술원 2013, SRM 4972 – Radon-222 Emermation Standard(2021년 8월 1일 액세스)
- Nelson PG 1987, "중요한 요소", 화학 교육 저널, vol. 68, no. 9, doi:10.1021/ed068p732
- 오더버그 DS 2007, 리얼 에센셜리즘, 루트리지, 뉴욕 ISBN 978-1-134-34885-5
- 오가노프 AR 외2009, "원소 붕소의 이온성 고압 형태", 네이처, 457, doi:10.1038/nature07736, arXiv:0911.3192, PMID 19182772
- Ostriker JP & Steinhardt PJ 2001, "주요 우주", Scientific American, 284권, 1, 페이지 46–53 PMID 11132422, 도이: 10.1038/Scientifican0101-46
- Oxtoby DW, Gillis HP & Butler LJ 2015, 현대 화학 원리, 8번째 Edition, Cengage Learning, Boston ISBN 978-1-305-07911-3
- Parameswaran P 외 2020, "기계적으로 합금된 16진법 AlMgNiCrTiMn16.616.616.616.616.616.6 고엔트로피 합금의 위상 진화 및 특성화", 금속 분말 보고서, 75, 4, doi:10.1016/j.mprp.2019.08.001
- 1977년 파리지 RV, 런던 롱맨의 메탈릭 엘리먼트, ISBN 978-0-582-44278-8
- 헤딩턴 JR 1944, 런던 맥밀란 주식회사 5부 무기화학 텍스트북
- Pearson WB 1972, The Crystal Chemistry and Physics of Metals and Allows, Wiley-Interscience, New York, ISBN 978-0-471-67540-2
- 페트루셰프스키 VM&크베트코비치 J 2018, "주기율표에서 수소의 '진정한 위치'에 대하여", 화학의 기초, 20권, 페이지 251–260, doi:10.1007/s10698-018-9306-y
- Phillips CSG & Williams RJP 1965, 무기 화학, vol. 1, 원리 및 비금속, 옥스퍼드 클라렌던 프레스,
- Phillips JC 1973, Hannay NB(ed.)의 "고형물의 화학적 구조", 고체 상태 화학에 관한 고찰, 제1권, 플레넘 프레스, 뉴욕, 페이지 1-42, ISBN 978-1-4684-2663-2
- Piro NA 등 2006년, "삼인산 분자의 트리플 본드 반응도", Science, vol. 313, no. 5791, doi:10.1126/science.1129630, PMID 16946068
- 피츠 CR, 홀 MG & 렉트카 T 2018, "용액 내 [C-F-C]+ 플루오늄 이온의 스펙트럼 분석 특성", 안젤완트 Chemie International Edition, 제57권, doi:10.1002/anie.201712021.
- Pitzer K 1975, "라돈과 원소의 플루오리드 118", 화학 협회, 제18호, doi:10.1039/C3975000760B
- 포터필드 WW 1993, 무기화학, 학술언론, 샌디에이고, ISBN 978-0-12-562980-5
- Povh B & Rosina M 2017, 산란 및 구조: Essentials and Analogies in Quantum Physics, 2edd, Springer, Berlin, doi:10.1007/978-3-662-54515-7
- 파월 P&Tims P 1974, 런던 채프먼과 홀, ISBN 978-0-412-12200-2
- Puddefhatt RJ & Monahan PK 1989, The Periody Table of the Elements, 제2편, Clarendon Press, 옥스포드, ISBN 978-0-19-855516-2
- Rao KY 2002, 옥스퍼드 엘스비어 안경 구조 화학, ISBN 978-00-08-043958-7
- Rao CNR & Ganguly PA 1986, "원소의 금속성에 대한 새로운 기준", 솔리드 스테이트 통신, vol. 57, 1번, 페이지 5–6, doi:10.1016/0038-1098(86)90659-9
- Rayner-Canham G 2018, "전환 금속 구성" Scerri E&Restrepo G, Mendeleev에서 Oganesson으로: 주기율표에 대한 다원적 관점, 뉴욕 옥스포드 대학교, ISBN 978-0-190-668532
- 레이너-캐넘 2020, 주기율표: 과거, 현재, 미래, 월드 사이언티픽, 뉴저지, ISBN 978-981-121-850-7
- Regnault MV 1853, 화학의 요소들, 1, 2부, Clark & Hesser, 필라델피아
- Reilly C 2002, 옥스포드 블랙웰 사이언스, ISBN 978-0-632-05927-0
- Remy H 1956, Weatise on Merginal Chemistry, Anderson JS(trans.), Kleinberg J(ed.), vol.II, 엘스비에, 암스테르담
- Renouf E 1901, "Lehrbuch der anorgischen Chemie", Science, vol. 13, no. 320, doi:10.1126/science. 13.320.268
- 레스트레포 G, Llanos EJ & Mesa H 2006, "화학 원소와 그 성질의 위상적 공간", Journal of Mathemical Chemistry, vol. 39, doi:10.1007/s10910-005-9041-1
- 리터 SK 2011, "제논 실종 사건", 화학 & 엔지니어링 뉴스, 제89권, 제9호, ISSN 0009-2347
- 로초 EG 1966, 더 메탈로이드, DC 히스 앤 컴퍼니, 보스턴
- Rochow EG 1973, "실리콘" Bayar JC 외 (eds.)의 종합 무기 화학, 제 1권, 옥스퍼드 주 Pergamon Press, ISBN 978-00-08-015655-2
- 로초 EG 1977, 현대 기술 화학, 필라델피아 선더스, ISBN 978-0-7216-7628-9
- Rodgers GE 2012, 기술 무기체, 조정 및 솔리드 스테이트 화학, 3차 에드워드, 브룩스/콜레, 캘리포니아 벨몬트, ISBN 978-0-8400-6846-0
- 왕립화학회 2021, 주기율표: 비금속, 2021년 9월 3일 접속
- 왕립 화학 및 복합 이익 협회 2013, 요소 인포그래픽, 그룹 4 – 결정체, 2021년 9월 2일에 액세스
- 루돌프 J 1973, 뉴욕 맥밀런, 모던 마인드를 위한 화학
- 러셀 AM & Lee KL 2005, 뉴욕 윌리-인터사이언스, ISBN 0-471-64952-X
- Salinas JT 2019 콜로라도 주 Englewood의 Morton 출판사, ISBN 978-1-61731-753-8
- Salzberg HW 1991, Cavelman에서 Chemister로: 상황과 성과, 워싱턴 DC 미국화학협회 ISBN 0-8412-1786-6
- 샌더슨 RT 1957, "금속과 비금속 사이의 전자적 구별", 화학 교육 저널, 34권, 5권, doi:10.1021/ed034p229
- 샌더슨 RT 1967, 뉴욕 라인홀드 무기화학
- Scerri E (ed.) 2013, 30초 요소: 런던 아이비 프레스, ISBN 978-1-84831-616-4, 각각 30분 만에 설명되는 50가지 가장 중요한 요소
- 셰퍼 JC 1968, 뉴욕 라인홀드 화학원소 백과사전 함펠 CA의 "보론"
- 스헨크 J&프린스 J 1953, "플라스틱 유황", 자연, 172권, 도이:10.1038/172957a0
- Schlager N&Lauer J (eds.) 2000, Science and Its Times: 1700–1799, Science 4권 및 그 시간:게일그룹, ISBN 978-0-7876-3932-7
- Schmedt auf der Günne J, Mangstl M&Kraus F 2012, "자연에서 이플루오린 F의2 발생—NMR 분광법에 의한 현장 증명 및 정량화", Angelwandte Chemie International Edition, vol. 51, no. 31, doi:10.1002/anie.201203515
- Scott D 2015, Around the World in 18 Elements, Royal Society of Chemistry, e-book, ISBN 978-1-78262-509-4
- 스콧 EC & 칸다 FA 1962, 원자와 분자의 특성: 뉴욕 하퍼 앤 로의 일반 화학
- Sevorg GT 1969, "주기율표의 상당한 추가 연장을 위한 전망", Journal of Chemical Education, 46, no. 10, doi:10.1021/ed046p626
- Seese WS & Daub GH 1985, Basic Chemistry, 4edd, Fratice-Hall, Englewood Cliffs, NJ, ISBN 978-0-13-057811-2
- 시걸 BG 1989, 화학: 실험과 이론, 제2편, 뉴욕 존 와일리 & 선즈, ISBN 0-471-84929-4
- 샤카시리 BZ, 디린 E& 윌리엄스 LG 1989 "액체 산소의 파라마그니즘과 색:강의 시연"," 화학 교육 저널, 제57권, 제5호, doi:10.1021/ed057p373호
- Shanabrook BV, Lanin JS & Hisatsune IC 1981, "탄성 빛은 한 가지 방식으로 조정된 비정형 반도체에서 산란" 물리적 검토서, 제46권, 제2권, 제12호, 1월 12일, doi:10.1103/PhysRevlett.46.130.130
- 샹 외 2021, "붕괴된 풀레네로 인한 초경질 대량 아모르퍼스 탄소", 네이처, 599, 페이지 599–604, doi:10.10388/s41586-021-03882-9
- Sherwin E&Weston GJ 1966, 옥스퍼드 주 Pergamon Press, 비금속 원소의 화학
- Siell 외 2021, "측정 가능한 할당성 전환을 통한 불크 결정 4H 실리콘", 물리적 검토서, 제26권, 페이지 215701, doi:10.1103/PhysRevRevlett.125701
- 슈콜니코프 EV 2010, "산화물 MO23(M = Sb, Bi)의 암페어리즘 열역학적 특성화 및 수성 매체에서의 수산화물(Hydrough Journal of Applied Chemistry, vol. 83, 12, 페이지 2121–212727), doi:10.114/S10427210120101010101010101010101010101010101010104
- 시도로프 TA 1960, "구조적 산화물 및 유리 형성 경향의 연관성", 유리 및 세라믹스, 제17권, 제11호, doi:10.1007BF00670116
- 지키에스키 S&Burgess J 2002, 원소의 간결한 화학, 호우드 프레스, 치체스터, ISBN 978-1-898563-71-6
- 시슬러 HH 1973, 전자 구조, 특성 및 주기법, 반 노스트랜드, 뉴욕
- Smart LE & Moore EA 2012 솔리드 스테이트 화학: 서론, 4차 개정, CRC 프레스, 보카 라톤, ISBN 978-1-4398-4792-3
- Smith A & Dwyer C 1991, Key Chemistry: 현대화학의 탐구: 제1권: 자료와 일상, 멜버른 대학 출판부, 칼튼, 빅토리아, ISBN 978-0-522-84450-4
- 스미츠 외 2020, 오가네손:고귀하지도 않고 기체도 아닌 고귀한 기체 원소인 안젤완테 케미 인터내셔널 에디션 59, 페이지 23636–23640, doi:10.1002/anie.202011976
- Stein L 1969, "할로겐 플루오르 용액의 산화 라돈", 미국 화학 협회 저널, 19권, 19권, doi:10.1021/ja01047a042
- Stein L 1983, "라돈의 화학", Radiochimica Acta, vol. 32, doi:10.1524/ract.193
- Stellman JM (ed.) 1998, 산업안전 백과사전, 제4권, 제4권, 제네바 국제노동청, ISBN 978-92-2-109817-1
- Steudel R 1977, 비금속 화학: 베를린의 Walter de Gruyter, ISBN 978-3-11-004882-7의 원자구조와 화학적 결합에 대한 소개
- Steudel R&Eckert B 2003, Steudel R(ed.)의 "고형 황 할당제", Steudel R(ed)의 원소 황 및 황이 풍부한 화합물 I, Springer-Verlag, ISBN 978-3-540-40191-9
- Stewart D, Chemicool Periody Table, www.chemicool.com.2021년 7월 10일 접속
- 여전히 B 2016 주기율표, 런던 캐셀, ISBN 978-1-84403-885-5의 비밀스런 생활
- Stott RWA 1956, 물리 및 무기 화학, Longmans, Green and Co, London
- Stuke J 1974, '셀레니움의 광학 및 전기적 특성', RA Zingaro & WC Cooper (eds), 셀레니움, 반 노스트랜드 라인홀드, 뉴욕, 페이지 174
- Strathern P 2000, 멘델레예프의 꿈: 런던 해미시 해밀턴 ISBN 978-0-8412-1786-7
- Su et al. 2020, "최근 개발된 Xenes의 광전자학 조언", 나노포토닉스, 제9권, 제7권, doi:10.1515/나노프-2019-0561
- 수레쉬 CH & 고가 NA 2001, "원자 방사선에 대한 일관성 있는 접근법", 물리 화학 저널 A, vol. 105, no. doi:10.1021/jp010432b
- 탕 외 2021, "파라크리스탈린 다이아몬드의 합성", 네이처, 599, 페이지 605–610, doi:10.1038/s41586-021-04122-w
- Taniguchi M, Suga S, Seki M, Sakamoto H, Kanzaki H, Akahama Y, Endo S, Terada S & Narita S 1984, 'Core-exciton induced resonant photoemission in the covalent semiconductor black phosphorus', Solid State Communications, vo1. 49, no. 9, pp. 867–7, doi:10.1016/0038-1098(84)90441-1
- Taylor MD 1960, 프린스턴 반 노스트랜드 화학 제1원칙
- 화학뉴스 및 물리과학 저널 1864, "책의 공지: 메탈로이드의 설명서", 제9권, 페이지 22
- 1897년 WA 틸덴의 "A Manual of Chemical News and Journal of Physical Science", 제75권, 페이지 188–189호
- 손턴 BF & 버데트 SC 2010, "eka-iodine 찾기: 현대에 있어서의 발견 우선 순위", 화학사 회보, 제35권 제2호, 2021년 9월 14일 접속
- Tregarthen L 2003, 예비 화학, 맥밀런 교육:멜버른, ISBN 978-0-7329-9011-4
- Trenberth KE & Smith L 2005, "대기 질량: 지구 분석에 대한 제약", Journal of Climate, 18권, 6호, doi:10.1175/JCLI-3299.1
- 티쇼얀 외 2019년, "무감독 단어 임베딩은 물질과학 문헌에서 잠재적 지식을 포착한다", 네이처, 571권, doi:10.1038/s41586-019-019-1335-8
- Tyler PM 1948, From the Ground Up: 미국 광물산업의 사실과 수치, 뉴욕 맥그라우힐
- Van Setten 외 2007, "보론의 열역학적 안정성: 결함과 영점 운동의 역할" 미국화학학회지 제129권, 제9호, doi:10.1021/ja0631246호
- 바실라키스 AA, 칼레모스 A & 마브리디스 A 2014, "염소 불소 ClF와 그 이온 ClF에± 대한 첫 번째 원리 계산 정확", 이론 화학 계정, 133, No. 1436, doi:10.1007/s00214-013-1436-7
- 버논 R 2013, "어떤 원소가 메탈로이드인가?", 화학 교육 저널, vol. 90, no. 12, 1703‒1707, doi:10.1021/ed3008457
- 버논 R 2020, "금속 및 비금속 조직", 화학 기초, 22권, doi:10.1007/s10698-020-09356-6 (개방형 액세스)
- Weigand W 및 Schollhammer P(eds)의 Wechtershauter G 2014, "화학 침입에서 유전적 변동성에 이르기까지" Beachtershauser G, Bioinspected Catalysis: 금속 황 복합체, Wiley-VCH, Weinheim, doi:10.1002/9783527664160.ch1
- Wakeman TH 1899, "자유사상—과거, 현재, 미래", 자유사상지, 제17권
- Washwar KL 2021, "셀레늄 제거에 대한 집중 접근" 데비 외 (eds), 셀레늄 오염, 존 와일리 & 선스, 호보켄, 페이지 319–355, ISBN 978-1-1-119-69354-3
- Weeks ME 1945, Discovery of the Elements, 5번째 Edition, Journal of Chemical Education, 펜실베이니아 주 이스턴, 화학 교육 저널
- Welcher SH 2001, High markets: 등록 화학 Made Easy, 2edd, High Marks Made Easy, New York, ISBN 978-0-9714662-4-1
- 웰스 AF 1984, 구조용 무기화학, 5부, 옥스퍼드 클라렌던 프레스, ISBN 978-0-19-855370-0
- 웨스트 DC 1953, "요오드의 광전 상수", 캐나다 물리학 저널, 31권, 5권, doi:10.1139/p53-065
- White JH 1962, 무기화학: 고급 및 장학금 수준, 런던 런던 프레스 대학교
- Wiberg N 2001, 무기화학, 학술언론, 샌디에이고, ISBN 978-0-12-352651-9
- 윌리엄스 RPJ 2007, "생명, 환경과 우리의 생태계", 무기 생화학 저널, 제101, no. 11–12, doi:10.1016/j.j.jinorgbio.007.006
- Winstel G 2000, Ulmann's 산업 화학 백과사전, doi:10.1002/14356007.a09.a09_255
- Woodward 등 1999년, "금속 산화물의 전자 구조", In Fierro JLG(ed.), 금속 산화물: 화학 및 응용, CRC 프레스, 보카 라톤, ISBN 1-4200-2812-X
- 울프스버그 G 1987, 브룩스/콜, 벨몬트 CA, ISBN 978-0-534-07494-4
- Wulfsberg G 2000, 무기화학, Universal Science Books, Saucheonito, 캘리포니아주, ISBN 978-1-891389-01-6
- 야마구치 M&Sirai Y 1996, Stoloff NS & Sikka VK (eds.)의 "결함 구조", 물리 금속 및 이종금속 화합물 처리, 뉴욕 채프만 & 홀, ISBN 978-1-4613-1215-46-46
- Yang J 2004, '열전도율 이론' 트릿 TM (ed.)에서 열전도율: 이론, 속성 및 응용 프로그램, 클루워어 아카데미/플레넘 출판사, 뉴욕 페이지 1-20, ISBN 978-0-306-48327-1,
- 요더 CH, 수이담 FH & 스네이블리 FA 1975, 화학, 2부, 하코트 브레이스 요바노비치, 뉴욕 ISBN 978-0-15-15-506470-6
- Young et al. 2018, General Chemistry: Atoms First, Cengage 학습: 보스턴, ISBN 978-1-337-61229-6
- Young JA 2006, "Odine", Journal of Chemical Education, vol. 83, no. 9, doi:10.1021/ed083p1285
- 유수프 M 1998, Suski T&Paul W(eds)에서 "반도체 고압 연구에서의 디아몬드 앤빌 셀", 반도체 물리학 II, 반도체 및 세미메탈에서의 고압, 제55권, 아카데미 프레스, 샌디에이고, ISBN 978-08-08-086453-2권.
- 자오 J, Tu Z&Chan SH 2021, 양성자 교환막 연료전지(PEMFC)에서의 탄소 부식 메커니즘 및 완화 전략: 검토, 전력 공급원 저널, 488, #229434, doi:10.1016/j.j.jpowour.20.229434
- 자오Z, Zhang H, Kim D. 외 2017, "이국적인 전이성 ST12 게르마늄 할당로프의 속성", 네이처 커뮤니케이션, 제8권, 제13909조, doi:10.1038/ncomms13909, PMID 28045027, PMC 5216117
- 지갈스키 GP & 존스 BK 2003, 런던 테일러 & 프랜시스, ISBN 978-0-415-28390-8, 박금속 필름의 물리적 특성
- Ju et al. 2014, "철과 니켈을 사용한 제논의 작용은 지구의 내부 중심에서 예측된다.", 자연 화학, vol. 6, doi:10.1038/nchem.1925, PMID 24950336
- Zumdahell SS & DeCoste DJ 2010, 입문 화학: A Foundation, 7번째 Edition, Cengage Learning, Mason, OhioISBN 978-1-111-29601-8
- 줌달 SS & 드코스트 DJ 2019, 입문 화학: A Foundation, 9부, Cengage Learning, 보스턴, ISBN 978-1-337-39942-5
외부 링크
 Wikimedia Commons에서 비메탈과 관련된 미디어
Wikimedia Commons에서 비메탈과 관련된 미디어