글리옥살
Glyoxal| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 옥스알데히드[1] | |||
| 우선 IUPAC 이름 에단디알 | |||
| 기타 이름 글리옥살 글리옥시알데히드 옥살알데히드 에탄알데히드 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.003.160 | ||
| 케그 | |||
PubChem CID | |||
| 유니 | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C2H2O2 | |||
| 몰 질량 | 58.036 g/120−1 | ||
| 녹는점 | 15 °C (59 °F, 288 K) | ||
| 비등점 | 51 °C (124 °F, 324 K) | ||
| 열화학 | |||
열용량 (C) | 1.044 J/(K·g) | ||
| 위험 요소 | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | -4 °C (25 °F, 269 K) | ||
| 285 °C (545 °F, 558 K) | |||
| 관련 화합물 | |||
관련 알데히드 | 아세트알데히드 글리콜알데히드 프로판디알 메틸글리옥살 | ||
관련 화합물 | 글리옥실산 글리콜산 옥살산 피루브산 디아세틸 아세틸아세톤 | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
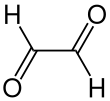
글리옥살은 화학식이 OCHCHO인 유기 화합물이다.그것은 가장 작은 디알데히드이다.결정성 고체이며, 저온에서는 흰색이고, 녹는점(15°C) 근처에서는 노란색입니다.액체는 노란색이고 수증기는 [2]녹색이다.
순수한 글리옥살은 일반적으로 40% 수용액(밀도 1.24g/mL 부근)으로 취급되기 때문에 흔치 않다.올리고머를 포함한 일련의 수화물을 형성합니다.많은 목적으로, 이러한 수화 올리고머는 글리옥살과 동등하게 작용한다.글리옥살은 많은 [3]제품의 선구자로서 산업적으로 생산된다.
생산.
글리옥살은 에탄올과 질산을 [4][5]반응시켜 독일-영국 화학자 하인리히 데부스(1824–1915)에 의해 처음 제조되고 명명되었다.
상업용 글리옥살은 은 또는 구리 촉매의 존재 하에서 에틸렌 글리콜의 기상산화(라포르테 공정) 또는 아세트알데히드와 질산의 [3]액상산화 중 하나로 제조된다.
최초의 상업적인 글리옥살 공급원은 1960년에 시작된 프랑스 라모트에서였다.단일 최대 상업 공급원은 독일 루드비히샤펜에 있는 BASF로 연간 약 6만 톤이다.다른 생산지는 미국과 중국에도 존재합니다.시판되는 부피 글리옥살은 물 중 중량[3](글리옥살 대 물의 약 1:5 몰비) 40% 용액으로 만들어 보고한다.
실험실 방법
글리옥살은 아세트알데히드를 셀렌산에[6] 의한 산화 [7]또는 벤젠의 오존 분해에 의해 실험실에서 합성될 수 있다.
고체 글리옥살 수화물을 오산화인에서 가열하여 콜드 [8]트랩으로 증기를 응축하여 무수 글리옥살로 한다.
특성.
실험적으로 결정된 글리옥살의 헨리의 법칙 상수는 다음과 같다.
생화학
고급 당화 최종 생성물(AGE)은 고당류 [10]식단의 결과로 당화되는 단백질 또는 지질입니다.그것들은 당뇨, 아테롬성 동맥경화증, 만성 신장병,[11] 알츠하이머병과 같은 많은 퇴행성 질환의 노화와 발병 또는 악화와 관련된 바이오 마커입니다.
적용들
코팅된 종이 및 섬유 마감재는 녹말 기반 제제의 가교제로 다량의 글리옥살을 사용합니다.요소에서 응축하여 4,5-디히드록시-2-이미다졸리디논을 생성하고, 포름알데히드와 추가로 반응하여 비스(히드록시메틸) 유도체 디메틸렌 요소, 즉 의류의 주름 방지 화학 처리에 사용되는 요소, 즉 영구 프레스.[3]
글리옥살은 폴리머 화학에서 가용화제 및 가교제로 사용된다.
글리옥살은 유기 합성, 특히 이미다졸과 [12]같은 헤테로사이클의 합성에 있어 귀중한 구성 요소이다.실험실에서 사용하는 시약의 편리한 형태는 에틸렌글리콜, 1,4-다이옥산-2,3-디올을 포함한 비스(헤미아세탈)이다.이 화합물은 시판되고 있다
글리옥살 용액은 또한 조직학의 고정제, 즉 현미경으로 검사하기 위한 세포를 보존하는 방법으로 사용될 수 있다.
솔루션 사양
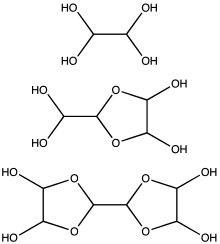
글리옥살은 일반적으로 40% [3]수용액으로 공급됩니다.다른 작은 알데히드들처럼 글리옥살은 수화물을 형성합니다.또한 하이드레이트는 응축되어 일련의 올리고머를 생성하며, 이들 중 일부는 구조가 불확실한 채로 남아 있다.대부분의 어플리케이션에서 용액에 포함된 종의 정확한 성질은 중요하지 않습니다.적어도 1종의 글리옥살 하이드레이트, 글리옥살 삼량체 이수화물: [(CHO)](23HO2)(2CAS 4405~13-4)을 시판한다.에틸렌 글리콜 헤미아세탈 1,4-다이옥산-트랜스-2,3-디올(CAS 4845-50-5, m.p. 91-95°C)과 같은 다른 글리옥살 당량을 사용할 수 있다.
1M 미만의 농도에서는 글리옥살이 주로 그 단량체 또는 수화물로서 존재하는 것으로 추정된다. 즉, OCHCHO, OCHCH(OH)22 또는 (HO)2CHCH(OH)1M 이상의 농도에서는 이합체가 우세하다.이합체들은 아마도 다이옥소란이고 공식은 [(HO)]이다.CH2]2OCHCHO이합체와 삼량체는 차가운 [13]용액에서 고체로 침전된다.
기타 사건
글리옥살은 대기 중 미량 가스, 예를 들어 [14]탄화수소의 산화 생성물로 관찰되었습니다.부피 기준 0–200ppt의 대류권 농도는 [15]부피 기준 최대 1ppb의 오염 지역에서 보고되었다.
안전.
LD(구강, 랫드)는50 3300mg/[3]kg이며, 보통50 소금의 LD는 3000mg/[16]kg이다.
레퍼런스
- ^ pubchem.ncbi.nlm.nih.gov/compound/Glyoxal#section=IUPAC-Name&fullscreen=true
- ^ 오닐, MJ (2001) :머크 인덱스, 13판, 803페이지.
- ^ a b c d e f Mattioda, Georges; Blanc, Alain. "Glyoxal". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a12_491.pub2.
- ^ 참조:
- H. Debus(1857) "일반 온도에서 알코올에 대한 질산의 작용에 대하여", Philosophical Magazine, 4번째 시리즈, 13:39-49.페이지 40부터 : "이 잔류물은 거의 전적으로 글리옥실산의 알데히드로 구성되었다; 나는 그것을 글리옥살, CHO라고243 부르자고 제안했다."
- H. Debus (1857) "On glyoxal", 철학 잡지, 네 번째 시리즈, 13:66.
- ^ 헨리 엔필드 로스코와 칼 숄레머, 화학에 관한 논문, 제3권 (뉴욕, 뉴욕:Appleton & Co, 1890), 페이지 101-102.
- ^ Ronzio, A. R.; Waugh, T. D. (1944). "Glyoxal Bisulfite". Organic Syntheses. 24: 61. doi:10.15227/orgsyn.024.0061.
- ^ US3637860A, Keaveney, William P. & Pappas, James J., "글리옥살 준비 과정", 1972-01-25 발행
- ^ Harries, C.; Temme, F. (1907). "Über monomolekulares und trimolekulares Glyoxal" [On monomoleular and trimoecular glyoxal]. Berichte. 40 (1): 165–172. doi:10.1002/cber.19070400124.
Man erhitzt nun das Glyoxal-Phosphorpentoxyd-Gemisch mit freier Flamme und beobachtet bald, dass sich unter Schwarzfärbung des Kolbeninhalte ein flüchtiges grünes Gas bildet, welches sich in der gekühlten Vorlage zu schönen Krystallen von gelber Farbe kondensiert. [One heats the mixture of (crude) glyoxal and P4O10 with an open flame and soon observes, upon blackening of the contents, a mobile green gas which condenses in the cooled flask as beautiful yellow crystals.]
- ^ Ip, H. S.; Huang, X. H.; Yu, J. Z. (2009). "Effective Henry's law constants of glyoxal, glyoxylic acid, and glycolic acid" (PDF). Geophys. Res. Lett. 36 (1): L01802. Bibcode:2009GeoRL..36.1802I. doi:10.1029/2008GL036212.
- ^ Goldin, Alison; Beckman, Joshua A.; Schmidt, Ann Marie; Creager, Mark A. (2006). "American Heart Association". Circulation. 114 (6): 597–605. doi:10.1161/CIRCULATIONAHA.106.621854. PMID 16894049.
- ^ Vistoli, G; De Maddis, D; Cipak, A; Zarkovic, N; Carini, M; Aldini, G (Aug 2013). "Advanced glycoxidation and lipoxidation end products (AGEs and ALEs): an overview of their mechanisms of formation" (PDF). Free Radic. Res. 47: Suppl 1:3–27. doi:10.3109/10715762.2013.815348. PMID 23767955. S2CID 207517855.
- ^ Snyder, H. R.; Handrick, R. G.; Brooks, L. A. (1942). "Imidazole". Organic Syntheses. 22: 65.; Collective Volume, vol. 3, p. 471
- ^ Whipple, E. B. (1970). "Structure of Glyoxal in Water". J. Am. Chem. Soc. 92 (24): 7183–7186. doi:10.1021/ja00727a027.
- ^ Vrekoussis, M.; Wittrock, F.; Richter, A.; Burrows, J. P. (2009). "Temporal and spatial variability of glyoxal as observed from space". Atmos. Chem. Phys. 9 (13): 4485–4504. Bibcode:2009ACP.....9.4485V. doi:10.5194/acp-9-4485-2009.
- ^ Volkamer, Rainer; et al. (2007). "A missing sink for gas‐phase glyoxal in Mexico City: Formation of secondary organic aerosol". Geophys. Res. Lett. 34 (19): 19. Bibcode:2007GeoRL..3419807V. doi:10.1029/2007gl030752.
- ^ "Safety (MSDS) data for sodium chloride". ox.ac.uk. Archived from the original on 2011-06-07.




![{\displaystyle K_{\text{H}}=4.19\times 10^{5}\times \exp \left[{\frac {6.22\times 10^{4}\,{\text{kJ}}\,{\text{mol}}^{-1}}{R}}\times \left({\frac {1}{T}}-{\frac {1}{298\,{\text{K}}}}\right)\right]\,{\text{M}}\,{\text{atm}}^{-1}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/889cc6b8a3cb98f718253ccab840f434f2809fd5)