이사부코나조늄
Isavuconazonium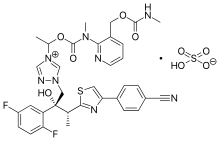 | |
| 임상자료 | |
|---|---|
| 상호 | 크레셈바 |
| AHFS/Drugs.com | 모노그래프 |
| 라이센스 데이터 |
|
| 임신 카테고리 |
|
| 경로 행정부. | 입으로, 정맥주사(IV) |
| ATC코드 |
|
| 법적지위 | |
| 법적지위 | |
| 식별자 | |
| CAS 번호 |
|
| 켐스파이더 | |
| 유니아이 |
|
| 케그 | |
| CompTox 대시보드 (EPA) | |
| 화학 및 물리 데이터 | |
| 공식 | C35H35F2N8O5S |
| 어금니 질량 | 717.77g·mol−1 |
| 3D 모델(JSMO) | |
| |
| |
| | |
 | |
 | |
| 임상자료 | |
|---|---|
| 상호 | 크레셈바 |
| 기타이름 | BAL8557 |
| 임신 카테고리 |
|
| 경로 행정부. | 입으로, 정맥주사(IV) |
| ATC코드 | |
| 법적지위 | |
| 법적지위 |
|
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 켐스파이더 | |
| 유니아이 | |
| 케그 | |
| ChEBI | |
| 쳄블 | |
| NIAID ChemDB | |
| CompTox 대시보드 (EPA) | |
| 화학 및 물리 데이터 | |
| 공식 | C22H17F2N5OS |
| 어금니 질량 | 437.47g·mol−1 |
| 3D 모델(JSMO) | |
| 융점 | 122[10]°C (252°F) |
| 물에 대한 용해도 | 14.2 ± 0.5 x−6 10 mol/L (pH 7.4) |
| |
| |
| | |
크레셈바(Cresemba)라는 상표명으로 판매되는 이사부코나조늄 설페이트(Isavconazonium sulfate)는 침습성 아스페르길루스증 및 점막근균증 [8][6][7][11]치료에 사용되는 트리아졸 부류의 전신 항진균제입니다.
가장 흔한 부작용으로는 비정상적인 간 검사, 메스꺼움, 구토, 호흡 곤란, 복통, 설사, 주사 부위 반응, 두통, 저혈량 칼륨, 피부 [9]발진 등이 있습니다.
의료용
이사부코나조늄은 18세 이상의 성인에서 침습성 아스페르길루스증과 침습성 점막근균증을 치료하는 데 사용됩니다.경구투여용 캡슐과 [8][6][7][11][13]수액투여용 분말로 사용할 수 있습니다.
금기사항
이사부코나조늄은 강한 CYP3A4 억제제, 강한 CYP3A4 유도제, 또는 적당한 CYP3A4 또는 CYP3A5 [6][7][8]유도제를 복용하는 사람들에게 금지됩니다.가족성 짧은 QT [6][7][8]증후군을 가진 사람들에게는 금물입니다.
부작용
일반적인 부작용으로는 낮은 칼륨, 식욕 감소, 섬망, 두통, 졸림, 정맥염증, 호흡곤란, 급성 호흡부전, 구토, 설사, 메스꺼움, 복통, 간기능 검사 결과 상승, 발진, 가려운 피부, 신부전, 흉통, 피로 등이 있습니다.흔하지 않은 부작용도 [6][7]몇 가지 있습니다.
전임상 연구에서, 이사부코나조늄은 동물들에게 선천적인 결함을 일으켰습니다; 그것은 임신한 [6][7][8]여성들에게 실험되지 않았습니다.
상호작용
이사부코나조늄은 체내에서 이사부코나졸로 전환되며, 이사부코나졸은 CYP3A4 또는 CYP3A5의 기질.다른 많은 약들은 이 두 효소를 억제하거나 유도하며, 이사부코나조늄은 그들과 함께 투여해서는 안됩니다.유도제는 이소부코나졸의 수준을 너무 낮게 만들어 작동하지 않으며, 억제제는 높은 수준의 이소부코나졸을 유발할 수 있으며, 이는 다시 부작용과 독성을 증가시킵니다.마찬가지로 이소나조늄은 그 [6][7]효소들의 기질인 다른 약물들의 적절한 투여를 방해할 수 있습니다.
또한, 이사부코나졸은 CYP2B6를 유도하고 효소에 의해 대사되는 약물의 양을 감소시킬 수 있습니다.이사부코나졸은 P-glycoprotein (P-gp), BCRP, SLC22A2, 그리고 우리딘 2인산-글루쿠로노실트랜스퍼레이스를 억제하는데, 이것들은 각각 순환으로부터 약물을 제거합니다; 이사부코나조늄은 그러한 단백질에 의해 영향을 받는 약물의 양을 증가시키고 그들의 [6][7]독성을 증가시킬 수 있습니다.
약리학
경구 또는 정맥(IV) 투여 후, 이소코나조늄은 혈액 또는 위장관의 에스터레이스에 의해 활성 형태인 이소코나졸로 [6][7][14]빠르게 가수분해됩니다.
이사부코나졸은 탈메틸화에 의해 라노스테롤을 에르고스테롤로 전환시키는 효소인 라노스테롤 14α-탈메틸화효소의 억제에 의해 작용합니다.에르고스테롤의 고갈과 라노스테롤의 축적은 곰팡이 세포막의 구조를 손상시킵니다.포유류의 세포는 아졸에 의한 탈메틸화 억제에 저항성을 가지는데,[6][7][14] 이것은 곰팡이 특유의 약물 효과를 만듭니다.
화학
이사부코나조늄은 이사부코나졸 [15][16][17]내의 트리아졸 질소에 에스테르 부분을 통해 연결된 N-(3-아세톡시프로필)-N-메틸아미노-카르복시메틸기를 포함합니다.신체의 수중 매체에서, 이소부코나졸 분자는 모노하이드레이트로 변환됩니다.
역사
이사부코나졸과 이사부코나조늄은 일본 카마쿠라에 [15][19]있는 로슈 연구소의 연구원들에 의해 발견되었습니다.항생제 자산 개발을 위해 로슈에서 분사된 바실리아 파마슈티카는 임상 2상을 통해 이사부코나조늄을 개발했습니다.2010년 2월, Basilea는 Astellas Pharma와 협력하여 3상 시험을 완료하고, 규제 승인을 획득하고, 의약품을 시판했습니다.2013년과 2014년, 파트너들은 침습성 아스페르길루스증, 점막근균증,[14][20][21][22] 침습성 칸디다증 치료를 위한 이사부코나조늄으로 미국에서 고아의약품 지정을 받았습니다.
2014년에 Basilea와 Astellas는 계약을 개정하여 Astellas에게 북미 지역의 유일한 마케팅 권한을 부여하고, Basilea는 나머지 [23]지역의 시장에 대한 권리를 부여했습니다.
미국 [14][24]식품의약국(FDA)은 2015년 3월 승인을, 유럽의약품청(EMA)은 2015년 [9][6][7]10월 승인을 받았습니다.
2017년 바질리아는 유럽 및 기타 [25][26][27]지역에서 화이자에 대한 시판 권한을 허가했습니다.
참고문헌
- ^ a b "Isavuconazonium (Cresemba) Use During Pregnancy". Drugs.com. 31 January 2020. Retrieved 26 August 2020.
- ^ "Cresemba isavuconazole (as isavuconazonium sulfate) 200 mg powder for injection vial". Therapeutic Goods Administration (TGA). ARTG ID 305480. Archived from the original on 19 June 2022. Retrieved 5 September 2021.
- ^ "Cresemba isavuconazole (as isavuconazonium sulfate) 100 mg capsule blister pack". Therapeutic Goods Administration (TGA). ARTG ID 305452. Archived from the original on 5 September 2021. Retrieved 5 September 2021.
- ^ "AusPAR: Isavuconazole (as sulphate)". Therapeutic Goods Administration (TGA). 22 January 2020. Retrieved 5 September 2021.
- ^ "Search Page - Drug and Health Product Register". 23 October 2014.
- ^ a b c d e f g h i j k l "Cresemba 100 mg hard capsules - Summary of Product Characteristics (SmPC)". (emc). 28 June 2021. Retrieved 5 September 2021.
- ^ a b c d e f g h i j k l "Cresemba 200mg Powder for concentrate for solution for infusion - Summary of Product Characteristics (SmPC)". (emc). 28 June 2021. Retrieved 5 September 2021.
- ^ a b c d e f "Cresemba- isavuconazonium sulfate capsule Cresemba- isavuconazonium sulfate injection, powder, lyophilized, for solution". DailyMed. 2 December 2019. Retrieved 26 August 2020.
- ^ a b c 이 출처인 © European Medicine Agency에서 텍스트를 복사했습니다.출처가 확인된 경우에는 복제가 승인됩니다.
- ^ a b 보로닌, A. P., 바실레프, N. A., 수로프, A. O., 추라코프, A. V., & Perlovich, G. L. (2021).항진균제의 고체 형태 풍경 탐색은 아부코나졸: 결정 구조 분석, 상변태 거동 및 용해 성능.CrystEng Comm, 23(48), 8513-8526. Doi:10.1039/D1CE01353J
- ^ a b Donnelley MA, Zhu ES, Thompson GR (2 June 2016). "Isavuconazole in the treatment of invasive aspergillosis and mucormycosis infections". Infection and Drug Resistance. 9: 79–86. doi:10.2147/IDR.S81416. PMC 4898026. PMID 27330318.
- ^ Wilkes, Gail M.; Barton-Burke, Margaret (2019). 2020-2021 Oncology Nursing Drug Handbook. Jones & Bartlett Learning. pp. 1874–1876. ISBN 978-1-284-17132-7.
- ^ Miceli MH, Kauffman CA (November 2015). "Isavuconazole: A New Broad-Spectrum Triazole Antifungal Agent". Clinical Infectious Diseases. 61 (10): 1558–65. doi:10.1093/cid/civ571. PMID 26179012.
- ^ a b c d Pettit NN, Carver PL (July 2015). "Isavuconazole: A New Option for the Management of Invasive Fungal Infections". The Annals of Pharmacotherapy. 49 (7): 825–42. doi:10.1177/1060028015581679. PMID 25940222. S2CID 208875031.
- ^ a b Guinea J, Bouza E (December 2008). "Isavuconazole: a new and promising antifungal triazole for the treatment of invasive fungal infections". Future Microbiology. 3 (6): 603–15. doi:10.2217/17460913.3.6.603. PMID 19072177.
- ^ "Proposed INN: List 96" (PDF). WHO Drug Information. 20 (4). 2006.
- ^ "Recommended INN: List 58" (PDF). WHO Drug Information. 21 (3). 2007.
- ^ 보로닌, A. P., 바실레프, N. A., 수로프, A. O., 추라코프, A. V., & Perlovich, G. L. (2021).항진균제의 고체 형태 풍경 탐색은 아부코나졸: 결정 구조 분석, 상변태 거동 및 용해 성능.CrystEng Comm, 23(48), 8513-8526. Doi:10.1039/D1CE01353J.
- ^ Ohwada J, Tsukazaki M, Hayase T, Oikawa N, Isshiki Y, Fukuda H, et al. (January 2003). "Design, synthesis and antifungal activity of a novel water soluble prodrug of antifungal triazole". Bioorganic & Medicinal Chemistry Letters. 13 (2): 191–6. doi:10.1016/s0960-894x(02)00892-2. PMID 12482421.
- ^ "Isavuconazonium sulfate Orphan Drug Designations and Approvals". U.S. Food and Drug Administration (FDA). 6 May 2013. Retrieved 26 August 2020.
- ^ "Isavuconazonium sulfate Orphan Drug Designations and Approvals". U.S. Food and Drug Administration (FDA). 20 October 2014. Retrieved 26 August 2020.
- ^ "Isavuconazonium sulfate Orphan Drug Designations and Approvals". U.S. Food and Drug Administration (FDA). 25 October 2013. Retrieved 26 August 2020.
- ^ "Astellas Takes Over Isavuconazole Manufacturing and Promotion in U.S., Canada". Genetic Engineering & Biotechnology News. 28 February 2014.
- ^ "Cresemba Capsules & Cresemba Powder for Injection". U.S. Food and Drug Administration (FDA). 6 March 2015. Retrieved 26 August 2020.
- 요약 표시 위치:
- ^ Elvidge S (16 June 2017). "Pfizer builds out anti-infective reach with Basilea deal". BioPharma Dive.
- ^ "Pfizer Receives Exclusive Commercialization Rights in Europe for Cresemba, a Novel Treatment for Potentially Life-Threatening Fungal Infections Among Immunocompromised Patients". Pfizer (Press release). 14 June 2017. Retrieved 5 September 2021.
- ^ "Pfizer Enters into Agreement to Develop and Commercialize Cresemba (isavuconazole) in China and Asia Pacific Region". Pfizer (Press release). 30 November 2017. Retrieved 5 September 2021.
외부 링크
- "Isavuconazonium". Drug Information Portal. U.S. National Library of Medicine.
- "Isavuconazonium sulfate". Drug Information Portal. U.S. National Library of Medicine.
- "Isavuconazole". Drug Information Portal. U.S. National Library of Medicine.


