테트라졸
Tetrazole| | |||
| 식별자 | |||
|---|---|---|---|
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.005.477 | ||
펍켐 CID | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| CH2N4 | |||
| 어금질량 | 70.05 g/190 | ||
| 밀도 | 1.477 g/mL | ||
| 녹는점 | 157 ~ 158 °C(315 ~ 316 °F, 430 ~ 431 K)[2] | ||
| 비등점 | 220 ± 23°C(428 ± 41°F, 493 ± 23K) | ||
| 산도(pKa) | 4.90[1] | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
테트라졸은 4개의 질소 원자와 1개의 탄소 원자로 이루어진 5개의 링으로 구성된 합성 유기 헤테로사이클릭 화합물의 일종이다. 테트라졸이라는 이름도 CHN24 공식을 가진 모화합물을 가리키는데, 이 중 3개의 이소머를 공식화할 수 있다.
구조 및 본딩
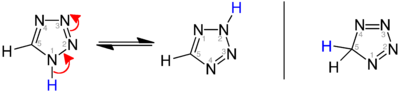
모체 테트라졸의 이소머는 이중 결합의 위치가 다른 1H-, 2H-, 5H-테트라졸의 이소머가 존재한다. 1H와 2H-Isomer는 tautomer이며, 고체상에서는 평형이 1H-테트라졸의 측면에 놓여 있다.[3][4][5] 가스 단계에서는 2H-테트라졸이 지배한다.[4][6][7] 이러한 이소머는 6 ㎥의 전자로 방향족으로 간주할 수 있는 반면, 5H 이소체는 비자동적이다.
합성
1H-테트라졸은 우선 무수 하이드라조산과 시안화수소의 압력에 의한 반응에 의해 준비되었다. 요오드나 실리카 지원 비황산나트륨이 이기종 촉매로 존재하는 상황에서 아지드화나트륨을 유기질산나트륨으로 처리하면 5H-테트라졸을 유리하게 합성할 수 있다. 또 다른 방법은 아미노구아니딘에서 상업적으로 획득하거나 차례대로 준비할 수 있는 5-아미노테트라졸의 디아미네이팅이다.[8][9]
2-아릴-2H-테트라졸은 아릴 디아조늄과 트리메틸릴디아조메탄 사이의 [3+2] 사이클로 추가 반응에 의해 합성된다.[10]
사용하다
테트라졸인 여러 제약사가 있다. 테트라졸은 유사한 pKa를 가지고 있고 생리학적 pH에서 감응되기 때문에 카르복시산 그룹의 생물 이소스테레스 역할을 할 수 있다. 안지오텐신 2 수용체 차단제 - 로사르탄이나 칸데사르탄과 같은 - 흔히 테트라졸이다. 잘 알려진 테트라졸은 디메틸 티아조엘 디페닐 테트라졸륨 브로미드(MTT)이다. 이 테트라졸은 MTT 검사에 사용되며, 이 과정에서 일반적으로 세포를 죽이지만 살아있는 세포 배양액의 호흡 활성도를 정량화하는 데 사용된다. 일부 테트라졸은 DNA 검사에도 사용될 수 있다.[11] 연구에 따르면 VT-1161과 VT-1129는 인간 효소가 아닌 곰팡이 효소 기능을 방해하기 때문에 잠재적 항응고제라고 한다.[12][13]
에너지가 높은 일부 테트라졸 유도체들은 TNT의 대체품으로 고성능 폭약으로 조사되었고 고성능 고체 로켓 추진체 제형에도 사용되었다.[14][15] 여기에는 질소 베이스의 아지도테트라졸레이트 염류가 포함된다.
다른 테트라졸은 테트라졸 자체와 5-아미노테트라졸과 같은 폭발성 또는 가연성 성질에 사용되는데, 이 성질은 자동차 에어백에서 가스 발생기의 구성 요소로 사용되기도 한다. 테트라졸 기반의 활력소재는 물과 질소가스 등 고온 무독성 반응물질을 생성하며 [16]연소율과 상대적 안정성이 높아 모두 바람직한 특성이다.[17] 테트라졸의 탈색에너지는 209 kJ/mol이다.
1H-테트라졸과 5-(벤질티오)-1H-테트라졸(BTT)은 올리고뉴클레오티드 합성 시 결합 반응의 산성 활성제로 널리 사용된다.[18]
관련 이성애자
- 3개의 질소 원자가 있는 3개의 아날로그
- 5개의 질소 원자를 가진 아날로그인 펜타졸(Pentazole), (강력하게 말하면, 이성애가 아닌 무기체 동족상)
- 옥사테트라졸
- 티아테트라졸
참조
- ^ Satchell, Jacqueline F.; Smith, Brian J. (2002). "Calculation of aqueous dissociation constants of 1,2,4-triazole and tetrazole: A comparison of solvation models". Phys. Chem. Chem. Phys. 4 (18): 4314–4318. Bibcode:2002PCCP....4.4314S. doi:10.1039/b203118c.
- ^ Mihina, Joseph S.; Herbst, Robert M. (1950). "The Reaction of Nitriles with Hydrazoic Acid: Synthesis of Monosubstituted Tetrazoles". J. Org. Chem. 15 (5): 1082–1092. doi:10.1021/jo01151a027.
- ^ Goddard, R.; Heinemann, O.; Krüger, C. (1997-05-15). "α-1H-1,2,3,4-Tetrazole". Acta Crystallographica Section C. 53 (5): 590–592. doi:10.1107/S0108270197000772. ISSN 0108-2701.
- ^ a b Kiselev, Vitaly G.; Cheblakov, Pavel B.; Gritsan, Nina P. (2011-03-10). "Tautomerism and Thermal Decomposition of Tetrazole: High-Level ab Initio Study". The Journal of Physical Chemistry A. 115 (9): 1743–1753. Bibcode:2011JPCA..115.1743K. doi:10.1021/jp112374t. ISSN 1089-5639. PMID 21322546.
- ^ 라진스카 A; Tempczyk, A., Malinski, E., Szafranek, J., Grzonka, Z.; Hermann, P.: J. Chem.에서. Soc. Perkin Trans. 2 1983, 379.
- ^ Wong, Ming Wah; Leung-Toung, Regis; Wentrup, Curt (1993-03-01). "Tautomeric equilibrium and hydrogen shifts of tetrazole in the gas phase and in solution". Journal of the American Chemical Society. 115 (6): 2465–2472. doi:10.1021/ja00059a048. ISSN 0002-7863.
- ^ Rażyńska, Anna; Tempczyk, Anna; Maliński, Edmund; Szafranek, Janusz; Grzonka, Zbigniew; Hermann, Peter (1983-01-01). "Application of mass spectrometry to the study of prototropic equilibria in 5-substituted tetrazoles in the gas phase; experimental evidence and theoretical considerations". Journal of the Chemical Society, Perkin Transactions 2 (3): 379–383. doi:10.1039/P29830000379. ISSN 1364-5471.
- ^ Henry, Ronald A.; Finnegan, William G. (1954-01-01). "An Improved Procedure for the Deamination of 5-Aminotetrazole". Journal of the American Chemical Society. 76 (1): 290–291. doi:10.1021/ja01630a086. ISSN 0002-7863.
- ^ Kurzer, F.; Godfrey, L. E. A. (1963). "Syntheses of Heterocyclic Compounds from Aminoguanidine". Angewandte Chemie International Edition in English. 2 (8): 459–476. doi:10.1002/anie.196304591. ISSN 1521-3773.
- ^ Patouret, Remi; Kamenecka, Theodore M. (2016-04-06). "Synthesis of 2-aryl-2H-tetrazoles via a regioselective [3+2] cycloaddition reaction". Tetrahedron Letters. 57 (14): 1597–1599. doi:10.1016/j.tetlet.2016.02.102. PMC 4810784. PMID 27041776.
- ^ S Berner; K Mühlegger & H Seliger (Feb 11, 1989). "Studies on the role of tetrazole in the activation of phosphoramidites". Nucleic Acids Res. 17 (3): 853–864. doi:10.1093/nar/17.3.853. PMC 331708. PMID 2922273.
- ^ Warrilow, A. G. S.; Hull, C. M.; Parker, J. E.; Garvey, E. P.; Hoekstra, W. J.; Moore, W. R.; Schotzinger, R. J.; Kelly, D. E.; Kelly, S. L. (December 2014). "The Clinical Candidate VT-1161 Is a Highly Potent Inhibitor of Candida albicans CYP51 but Fails To Bind the Human Enzyme". Antimicrobial Agents and Chemotherapy. 58 (12): 7121–7127. doi:10.1128/AAC.03707-14. PMC 4249504. PMID 25224009.
- ^ Lockhart, Shawn R.; Fothergill, Annette W.; Iqbal, Naureen; Bolden, Carol B.; Grossman, Nina T.; Garvey, Edward P.; Brand, Stephen R.; Hoekstra, William J.; Schotzinger, Robert J.; Ottinger, Elizabeth; Patterson, Thomas F.; Wiederhold, Nathan P. (April 2016). "The Investigational Fungal Cyp51 Inhibitor VT-1129 Demonstrates Potent Activity against Cryptococcus neoformans and Cryptococcus gattii". Antimicrobial Agents and Chemotherapy. 60 (4): 2528–2531. doi:10.1128/AAC.02770-15. PMC 4808209. PMID 26787697.
- ^ "Greener explosives show promise". Chemistry World. 2 October 2008.
- ^ Niko Fischer, Konstantin Karaghiosoff, Thomas M. Klapötke and Jörg Stierstorfer (April 2010). "New Energetic Materials featuring Tetrazoles and Nitramines – Synthesis, Characterization and Properties". Zeitschrift für Anorganische und Allgemeine Chemie. 636 (5): 735–749. doi:10.1002/zaac.200900521.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Tore Brinck, Thomas M. Klapötke and Jörg Stierstorfer (2014). "Energetic Tetrazole N-oxides". Energetic Tetrazole N -oxides. Green Energetic Materials. pp. 133–178. doi:10.1002/9781118676448.ch06. ISBN 9781118676448.
- ^ Nicholas Piekiel & Michael R. Zachariah (2012). "Decomposition of Aminotetrazole Based Energetic Materials under High Heating Rate Conditions". J. Phys. Chem. A. 116 (6): 1519–1526. Bibcode:2012JPCA..116.1519P. doi:10.1021/jp203957t. PMID 22214278.
- ^ Xia Wei (May 6, 2013). "Coupling activators for the oligonucleotide synthesis via phosphoramidite approach". Tetrahedron. 69 (18): 3615–3637. doi:10.1016/j.tet.2013.03.001.