에난티오선택합성
Enantioselective synthesis
키L: R = 최대 치환기, RM = 중간 치환기, RS = 최소 치환기

비대칭 [1]합성이라고도 불리는 에난티오 선택적 합성은 화학 합성의 한 형태이다.IUPAC에 의해 "기질 분자 내에서 하나 이상의 새로운 키랄리티 원소가 형성되어 동일한 [2]양의 입체 이성질체(enantiomeric 또는 diastreoisomeric) 생성물을 생성하는 화학 반응(또는 반응 시퀀스)"으로 정의된다.
좀 더 쉽게: 이것은 특정 에난티오머 또는 디아스테레오머의 형성을 선호하는 방법에 의한 화합물의 합성이다.에난티오머는 모든 키랄 중심에서 반대되는 구성을 가진 입체 이성질체입니다.디아스테레오머는 하나 이상의 키랄 중심에서 다른 입체 이성질체이다.
에난티오 선택적 합성은 현대 화학의 핵심 과정이며 분자의 다른 에난티오머 또는 디아스테레오머가 종종 다른 생물학적 활성을 가지기 때문에 의약품 분야에서 특히 중요하다.
개요

당과 아미노산과 같은 생물학적 시스템의 많은 구성 요소들은 오직 하나의 에난티오머로서만 생산된다.그 결과 생물계는 높은 수준의 화학적 키라리티를 가지며, 종종 특정 화합물의 다양한 에난티오머와 다르게 반응합니다.이 선택성의 예는 다음과 같습니다.
- 향미: 인공 감미료 아스파탐은 두 개의 에난티오머를 가지고 있다.L-aspartame은 단맛이 나는 반면 D-aspartame은 맛이 없다.[3]
- 냄새: R-(-)-카르본은 스피어민트 냄새가 나는 반면 S-(+)-카르본은 [4]캐러웨이 냄새가 난다.
- 약물 효과: 항우울제인 시탈로프람은 라세미 혼합물로 판매된다.그러나 연구에 따르면 의약품의 유익한 [5][6]효과에 대한 책임은 (S)-(+) 에난티오머에만 있는 것으로 나타났다.
- 약물 안전성:D-페니실라민은 킬레이트 요법과 류마티스 관절염 치료에 사용되는 반면, L-페니실라민은 필수 비타민 [7][8]B인 피리독신의 작용을 억제하기 때문에 독성이 있다.
따라서 에난티오 선택적 합성은 매우 중요하지만 달성하기 어려울 수도 있다.에난티오머는 엔탈피와 엔트로피가 동일하기 때문에 방향성이 없는 프로세스에 의해 동일한 양으로 생성되어 라세미 혼합물이 발생합니다.에난티오 선택적 합성은 전이 상태에서 상호작용을 통해 하나의 에난티오머 형성을 다른 에난티오머 형성에 유리한 키랄 특성을 사용함으로써 달성될 수 있다.이 바이어싱은 비대칭 유도라고 알려져 있으며 기질, 시약, 촉매 또는 환경에서[9] 키랄 특성을 포함할 수 있으며 하나의 에난티오머를 형성하는 데 필요한 활성화 에너지를 반대 [10]에난티오머보다 낮게 함으로써 작동합니다.
에난티오셀렉티비티는 보통 에난티오디파이화 단계의 상대적인 비율에 의해 결정됩니다. 즉, 한 반응물이 두 개의 에난티오머 생성물 중 하나가 될 수 있는 지점입니다.반응에 대한 속도 상수 k는 에너지 장벽이라고도 불리는 반응의 활성화 에너지의 함수이며 온도에 의존합니다.에너지 장벽의 깁스 자유 에너지 δG*는 주어진 온도 T에서 반대되는 입체 화학적 결과에 대한 상대 속도가 다음과 같은 것을 의미한다.
이 온도 의존성은 낮은 온도에서 속도 차이, 즉 에난티오셀렉티비티가 더 크다는 것을 의미합니다.그 결과, 작은 에너지 장벽의 차이도 현저한 효과를 가져올 수 있다.
δ*G* (kcal) 2731 K에서 k/k2 2981 K에서 k/k2 32312 K에서 k/k) 1.0 6
.37 5
.46 4
.78 2.0 40
.6 29
.8 22
.9 3.0 259 162 109 4.0 1650 886 524 5.0 10500 4830 2510
접근
에난티오 선택적 촉매 작용
에난티오선택적 촉매(종래 "비대칭 촉매"로 알려져 있음)는 전형적인 키랄 배위 복합체인 키랄 촉매를 사용하여 수행됩니다.촉매 작용은 에난티오 선택적 합성의 다른 어떤 방법보다 광범위한 형질전환에 효과적이다.키랄 금속 촉매는 거의 항상 키랄 배위자를 사용하여 키랄로 생성되지만, 전체적으로 아키랄 [11][12][13]배위자로 구성된 키랄-앳-메탈 복합체를 생성할 수 있다.대부분의 에난티오 선택적 촉매는 낮은 기질/[14][15]촉매비에서 효과적입니다.높은 효율성을 감안할 때, [16]고가의 촉매가 사용되더라도 산업 규모의 합성에 적합한 경우가 많습니다.에난티오 선택적 합성의 다목적 예는 다양한 기능기를 감소시키기 위해 사용되는 비대칭 수소화이다.
새로운 촉매의 설계는 새로운 등급의 배위자의 개발에 의해 지배됩니다.종종 "특권 리간드"라고 불리는 특정 리간드는 광범위한 반응에 효과적이다. 예를 들어 BINOL, Salen 및 BOX가 있다.대부분의 촉매는 한 가지 유형의 비대칭 반응에만 효과적입니다.예를 들어 BINAP/Ru에 의한 노요리 비대칭 수소화에는 β-케톤이 필요하지만, 다른 촉매인 BINAP/디아민-Ru는 범위를 α, β-알켄 및 방향족 화학 물질로 넓힌다.
키랄 보조군
키랄 보조제는 시작 물질에 결합되어 새로운 화합물을 형성하는 유기 화합물이며, 이 화합물은 분자 내 비대칭 [17][18]유도를 통해 디스테레오 선택적 반응을 일으킬 수 있다.반응이 끝나면 제품의 [19]라세미화를 일으키지 않는 조건에서 보조 장치를 제거합니다.그런 다음 일반적으로 나중에 사용하기 위해 복구됩니다.
키랄 보조제는 화학량측정학적 양으로 사용해야 하며 보조제를 추가 및 제거하기 위한 추가 합성 단계가 필요합니다.그러나 일부 경우에 유일한 사용 가능한 입체선택적 방법론은 키랄 보조제에 의존하며 이러한 반응은 다용도적이고 매우 잘 연구된 경향이 있어 에난티오머릭 순수 [18]생성물에 대한 가장 시간 효율적인 접근을 가능하게 한다.또한 보조방향반응의 산물은 디아스테레오머로 컬럼크로마토그래피 또는 결정화 등의 방법으로 이들의 활성분리를 가능하게 한다.
생체 촉매 분석
생체 촉매 작용은 화학적 변환을 수행하기 위해 분리된 효소부터 살아있는 [20][21]세포에 이르는 생물학적 화합물을 사용한다.이러한 시약의 장점은 매우 높은 예와 시약 특이성뿐만 아니라 가벼운 작동 조건과 낮은 환경 영향을 포함합니다.생물 촉매는 학술 [22]연구보다 산업계에서 더 일반적으로 사용됩니다. 예를 들어 스타틴의 [23]생산입니다.그러나 종종 효과적인 시약을 발견하기 전에 광범위한 생체 촉매 검사를 필요로 하기 때문에 높은 시약 특이성은 문제가 될 수 있습니다.
에난티오선택성 유기촉매
유기 촉매 작용은 촉매 작용의 한 형태로 탄소,[24][25] 수소, 황 및 기타 비금속 원소로 구성된 유기 화합물에 의해 화학 반응 속도가 증가됩니다.유기 촉매가 키랄일 때, 에난티오선택적 합성이 [26][27]달성될 수 있다. 예를 [28]들어, 많은 탄소-탄소 결합 형성 반응은 프롤린의 존재 하에서 에난티오선택적 반응을 일으킨다.유기 촉매 작용은 종종 천연 화합물과 2차 아민을 키랄 [29]촉매로 사용합니다; 이것들은 금속이 관여하지 않기 때문에 저렴하고 환경 친화적입니다.
키랄풀합성
키랄 풀 합성은 에난티오 선택적 합성을 위한 가장 간단하고 오래된 접근법 중 하나이다.쉽게 구할 수 있는 키랄 시작 물질은 연속적인 반응을 통해 조작되며, 종종 아키랄 시약을 사용하여 원하는 표적 분자를 얻는다.이는 S2N 반응과 같은 새로운 키랄 종이 생성될 때 에난티오선택적 합성 기준을 충족할 수 있다.
키랄 풀 합성은 당이나 아미노산 등 비교적 저렴한 자연발생 빌딩 블록과 유사한 키랄성을 가진 표적 분자에게 특히 매력적이다.그러나 분자가 겪을 수 있는 가능한 반응의 수는 제한되며, 곡선의 합성 경로가 필요할 수 있다(예: 오셀타미비르 전체 합성).이 접근방식은 또한 자연발생하지 않을 경우 비용이 많이 들 수 있는 화학측정학적 양의 특발성 시작물질을 필요로 한다.
에난티오머의 분리 및 분석
분자의 두 가지 에난티오머는 동일한 물리적 특성(예: 녹는점, 끓는점, 극성 등)을 가지므로 서로 동일하게 작용합니다.그 결과 박층 크로마토그래피에서 동일한f R로 이동하며 HPLC와 GC에서 동일한 체류시간을 갖는다.이들의 NMR과 IR 스펙트럼은 동일하다.
따라서 공정이 단일 에난티오머(및 어떤 에난티오머인지 결정적으로 어떤 에난티오머인지)를 생성했는지 확인하는 것은 매우 어려울 수 있으며 100% 에난티오머가 아닌 반응에서 에난티오머를 분리하는 것도 어려울 수 있습니다.다행히 에난티오머는 다른 키랄 소재가 있을 때 다르게 작용하며 이를 이용하여 분리 및 분석을 할 수 있습니다.
에난티오머는 석영이나 키랄로 수정된 표준 배지와 같은 키랄 크로마토그래피 배지에서 동일하게 이동하지 않습니다.이는 키랄 컬럼 크로마토그래피의 기초를 이루며, 소규모로 GC 및 HPLC를 통해 분석하거나 대규모로 키랄 불순물을 분리하는 데 사용할 수 있다.그러나 이 공정은 많은 양의 키랄 포장재를 필요로 할 수 있으며, 이는 비용이 많이 들 수 있습니다.일반적인 대안은 키랄 유도체를 사용하여 키랄 보조제와 거의 동일한 방법으로 에난티오머를 디아스테레오머로 변환하는 것이다.이것들은 서로 다른 물리적 특성을 가지고 있기 때문에 기존 방법을 사용하여 분리 및 분석할 수 있다.'키랄 분해제'로 알려진 특수 키랄 유도체 생성제는 입체 이성질체의 NMR 분광법에 사용되며, 이들은 전형적으로 Eu(fod)3 및 Eu(hfc)3와 같은 키랄 유로피움 복합체와의 배합을 포함한다.
라세미계 약물 또는 의약품 성분 에난티오머의 분리 및 분석을 키랄 [30]분석이라고 한다.또는 에난티오 선택적 분석.키랄 분석을 수행하기 위해 가장 자주 사용되는 기술은 분리 과학 절차, 특히 키랄 크로마토그래피 [31]방법을 포함합니다.
물질의 에난티오머 과잉은 특정 광학 방법을 사용하여 확인할 수도 있습니다.이를 위한 가장 오래된 방법은 편광계를 사용하여 제품의 광학 회전 수준을 알려진 구성의 '표준'과 비교하는 것입니다.코튼 효과를 이용하여 입체 이성질체의 자외선 가시 분광법도 가능하다.
화합물의 키라리티를 결정하는 가장 정확한 방법 중 하나는 X선 결정학을 통해 화합물의 절대 구성을 결정하는 것입니다.그러나 이는 적절한 단결정 재배가 필요한 노동 집약적인 프로세스입니다.
역사
도입(1815~1905)
1815년 프랑스 물리학자 장 밥티스트 비오는 특정 화학물질이 광학적 [32]활동이라고 불리는 편광 광선의 평면을 회전시킬 수 있다는 것을 보여주었다.이 성질의 본질은 1848년까지 미스터리로 남아 있었는데, 루이 파스퇴르는 그것이 비대칭성의 어떤 형태에서 유래한 분자적 기반을 가지고 있다고 제안했고, 1년 [35]후 켈빈 경에 의해 키랄리티라는 [33][34]용어가 만들어졌습니다.키랄리티의 기원은 마침내 1874년 야코부스 헨리쿠스 반트 호프와 조셉 르 벨이 독립적으로 [36][37]탄소의 사면체 기하학을 제안했을 때 설명되었습니다.이 연구 이전의 구조 모델은 2차원적이었고, 반트 호프와 르 벨은 이 4면체 주위에 그룹의 배치가 르 벨-반트 호프 법칙으로 알려진 것을 통해 결과 화합물의 광학 활동을 지시할 수 있다고 이론을 세웠다.
1894년에 헤르만 에밀 피셔는 식물에 의한 D-포도당의 선택적 형성을 엽록소 내의 광학 활성 물질의 영향 때문이라고 정확하게 설명한 비대칭 [39]유도 개념을 개략적으로 설명했습니다.피셔는 또한 킬리아니-피셔 [40]합성이 되는 과정을 통해 당을 에난티오선택적으로 신장시킴으로써 현재 에난티오선택 합성의 첫 번째 예로 간주되는 것을 성공적으로 수행했다.
최초의 에난티오 선택적 화학 합성은 [38][41]1904년에 보고된 2-에틸-2-메틸말론산의 브루신 촉매 에난티오 선택적 탈탄산화로 인해 베를린 대학의 윌리 마르크발트에게 가장 자주 기인한다.이 제품은 또한 자연적인 product—e.g로 로바 스타틴의 체인은diketide 합성 효소(LovF)에 의해 그것의 biosynthesis[42]—this 결과 때 발생하는 거울상 선택성을 처음으로 기록된 완전 합성 뿐만 아니라 다른 구성하는 반응,2-methylbutyric 산성은 제품의levorotary 형태의 가벼운 초과,., 생산되었다. 전나무sts(Koskinen이 지적한 바와 같이, 먼저 "비대칭 촉매 작용, 항생소 선택 및 유기 촉매 [38]작용의 예")이 관찰은 또한 역사적으로 중요하다. 왜냐하면 당시에는 에난티오선택적 합성이 활력주의의 관점에서만 이해될 수 있었기 때문이다.그 당시에 Jöns Jacob Berzelius와 같은 많은 저명한 화학자들은 자연 화합물과 인공 화합물은 근본적으로 다르며 키랄리티는 단지 자연 [43]화합물에만 존재할 수 있는 '활력'의 발현이라고 주장했다.피셔와는 달리, 마크왈드는 비록 키랄성 유기 촉매(현재 우리가 이 [38][44][45]화학을 이해하고 있는 것처럼)를 가지고 있지만, 아키랄성, 비자연적인 시작 물질에 대해 에난티오선택 반응을 수행했다.
초기 작업(1905~1965)
에난티오선택적 합성의 개발은 분리 및 분석에 사용할 수 있는 기술의 범위가 제한적이었기 때문에 처음에는 느렸다.디아스테레오머는 서로 다른 물리적 특성을 가지고 있어 기존의 방법으로 분리할 수 있지만, 당시에는 에난티오머가 자발 분해(결정화에 따라 에난티오머가 분리됨) 또는 운동 분해(하나의 에난티오머가 선택적으로 파괴됨)에 의해서만 분리될 수 있었다.에난티오머를 분석하기 위한 유일한 도구는 구조 데이터를 제공하지 않는 방법인 편광계를 사용한 광학 활성이었다.
1950년대에 이르러서야 큰 발전이 시작되었다.R. B. Woodward 및 Vladimir Prelog와 같은 화학자에 의해 부분적으로 추진되지만 새로운 기술의 개발에도 의해 추진됩니다.그 중 첫 번째는 [46]1951년 요하네스 비즈보트에 의해 유기 화합물의 절대적인 구성을 결정하기 위해 사용된 X선 결정학이었다.키랄 크로마토그래피는 1년 후 종이 크로마토그래피를 이용해 키랄 아미노산을 [47]분리한 달글리시에 의해 도입되었다.Dalgliesh가 이러한 분리를 처음 관찰한 것은 아니지만, 그는 에난티오머의 분리를 키랄 셀룰로오스에 의한 차이 유지로 올바르게 돌렸다.이것은 Klem과 Reed가 키랄 HPLC [48]분리에 키랄 변형 실리카 겔을 처음 사용했다고 보고한 1960년에 확대되었다.
탈리도마이드
Arthur Robertson Cushny가 [49][50]상당한 초기 작업을 수행하면서 약물의 서로 다른 에난티오머가 서로 다른 활성을 가질 수 있다고 알려져 있었지만, 초기 약 설계 및 테스트에서는 설명되지 않았다.그러나 탈리도마이드 참사 이후 의약품의 개발과 인허가도 극적으로 바뀌었다.
1953년에 처음 합성된 탈리도마이드는 1957년부터 1962년까지 입덧에 널리 처방되었지만, 곧 심각한 기형 [51]유발로 밝혀졌고, 결국 10,000명 이상의 아기들에게 선천적 결함을 야기했다.이 재앙은 많은 나라들이 케파우버-해리스 수정안(US)과 지침 65/65/EEC1(EU)과 같은 의약품의 시험과 면허를 위한 더 엄격한 규칙을 도입하도록 자극했다.
쥐를 사용한 기형성 메커니즘에 대한 초기 연구는 탈리도마이드의 한 에난티오머가 기형성인 반면 다른 한 에난티오머는 모든 치료 활성을 가지고 있다는 것을 시사했다.이 이론은 나중에 틀린 것으로 밝혀졌고 지금은 [52]연구본부로 대체되었다.그러나 약물 설계에서 키랄리티의 중요성을 제기하여 에난티오선택 합성에 대한 연구를 증가시켰다.
근대(1965년 이후)
Cahn-Ingold-Prelog 우선순위 규칙(종종 CIP 시스템으로 축약됨)은 1966년에 처음 발표되었으며, 이를 통해 에난티오머를 보다 쉽고 정확하게 설명할 수 있다.[53][54]같은 해에 가스 크로마토그래피에[55] 의한 최초의 성공적인 에난티오머 분리가 그 당시에 이 기술이 일반적으로 사용되었기 때문에 중요한 발전이었다.
금속-카탈리제 에난티오 선택적 합성은 William S. Knowles, Ryoji Noyori 및 K에 의해 개척되었다. 2001년 노벨 화학상을 받은 배리 샤프리스.놀스와 노요리는 1968년에 독립적으로 개발한 비대칭 수소화의 개발로 시작되었다.노울은 윌킨슨의 촉매에 있는 아키랄 트리페닐포스핀 배위자를 키랄포스핀 배위자로 대체했다.이 실험용 촉매는 15%의 약간의 항산화성 초과로 비대칭 수소화에 사용되었습니다.Knowles는 또한 산업 규모의 합성에 에난티오 선택적 금속 촉매를 최초로 적용한 사람이기도 합니다. Monsanto Company에서 일하는 동안 DIPAMP 배위자를 [56][57][58]사용하여 L-DOPA 생산을 위한 에난티오 선택적 수소화 공정을 개발했습니다.
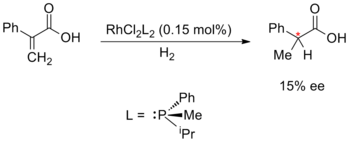 | 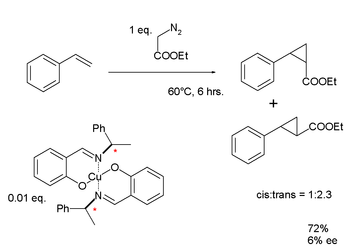 | |
| 지식:비대칭 수소화(1968년) | 노요리: 에난티오 선택적 사이클로프로판화(1968년) |
|---|
노요리는 스티렌의 [59]금속-카베노이드 사이클로프로판화에 사용된 키랄 쉬프 염기 배위자를 사용하여 구리 착체를 고안했다.놀스의 조사 결과와 마찬가지로, 노요리의 1세대 배위자 에난티오머 초과 결과는 실망스러울 정도로 낮았다: 6%.그러나 지속적인 연구는 결국 노요리 비대칭 수소화 반응으로 이어졌다.
샤프리스는 1970년대와 1980년대에 다양한 비대칭 산화(샤프리스 에폭시화,[60] 샤프리스 비대칭 디히드록실화,[61] 샤프리스 옥시아미네이션[62])를 개발함으로써 이러한 환원 반응을 보완했다.사산화 오스뮴을 이용한 비대칭 옥시아미네이션 반응이 가장 빨랐다.
같은 기간, NMR에 의한 키랄 화합물 분석을 가능하게 하는 방법이 개발되었다. 즉, Mosher's [63]acid와 같은 키랄 유도체화제 또는 Eu(DPM)3가 가장 [64]이른 유로피움 기반 시프트 시약을 사용한다.
키랄 보조 기구는 1978년 E[65].J. Corey에 의해 도입되어 다이어터 엔더의 작업에서 두드러지게 특징지어졌습니다.이와 동시에 에난티오 선택적 유기 촉매 작용이 개발되었으며, Hajos-Parish-Eder-Sauer-Wichert 반응을 포함한 선구적인 연구가 이루어졌다.효소 촉매 에난티오 선택적 반응은 1980년대,[66] 특히 [67]산업에서 돼지 간 에스테라아제에 의한 비대칭 에스테르 가수분해를 포함하여 점점 더 보편화되었다.유전공학의 새로운 기술은 효소의 특정 과정에 대한 맞춤을 허용하고, 더 많은 선택적인 변형을 가능하게 했다.예를 들어 스타틴 [23]전구체의 비대칭 수소화.
「 」를 참조해 주세요.
- 아자바일리스에난티오 선택적 합성에 키랄 이온 액체를 사용하기 위한 힐만 반응
- 켈리파이트, 비대칭 합성에 널리 사용되는 키랄 배위자
- 자발적 절대 비대칭 합성, 광학 활성 촉매 또는 보조제를 사용하지 않고 아히랄 전구체로부터 키랄 생성물을 합성하는 것.그것은 자연에서 논의되는 동질성과 관련이 있다.
- 촉각성, 에난티오 선택적 합성에 기인하는 중합체의 특성
- 키랄 분석
- 에난티오선택분석
레퍼런스
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "비대칭 합성"doi: 10.1351/goldbook.A00484
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "스테레오 선택적 합성"doi: 10.1351/goldbook.S05990
- ^ Gal, Joseph (2012). "The Discovery of Stereoselectivity at Biological Receptors: Arnaldo Piutti and the Taste of the Asparagine Enantiomers-History and Analysis on the 125th Anniversary". Chirality. 24 (12): 959–976. doi:10.1002/chir.22071. PMID 23034823.
- ^ Theodore J. Leitereg; Dante G. Guadagni; Jean Harris; Thomas R. Mon; Roy Teranishi (1971). "Chemical and sensory data supporting the difference between the odors of the enantiomeric carvones". J. Agric. Food Chem. 19 (4): 785–787. doi:10.1021/jf60176a035.
- ^ Lepola U, Wade A, Andersen HF (May 2004). "Do equivalent doses of escitalopram and citalopram have similar efficacy? A pooled analysis of two positive placebo-controlled studies in major depressive disorder". Int Clin Psychopharmacol. 19 (3): 149–55. doi:10.1097/00004850-200405000-00005. PMID 15107657. S2CID 36768144.
- ^ Hyttel, J.; Bøgesø, K. P.; Perregaard, J.; Sánchez, C. (1992). "The pharmacological effect of citalopram resides in the (S)-(+)-enantiomer". Journal of Neural Transmission. 88 (2): 157–160. doi:10.1007/BF01244820. PMID 1632943. S2CID 20110906.
- ^ JAFFE, IA; ALTMAN, K; MERRYMAN, P (October 1964). "The Antipyridoxine Effect of Penicillamine in Man". The Journal of Clinical Investigation. 43 (10): 1869–73. doi:10.1172/JCI105060. PMC 289631. PMID 14236210.
- ^ Smith, Silas W. (July 2009). "Chiral Toxicology: It's the Same Thing…Only Different". Toxicological Sciences. 110 (1): 4–30. doi:10.1093/toxsci/kfp097. PMID 19414517.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "비대칭 유도".doi:10.1351/goldbook.A00483
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. ISBN 978-0-19-850346-0.페이지 1226
- ^ Bauer, Eike B. (2012). "Chiral-at-metal complexes and their catalytic applications in organic synthesis". Chemical Society Reviews. 41 (8): 3153–67. doi:10.1039/C2CS15234G. PMID 22306968.
- ^ Zhang, Lilu; Meggers, Eric (21 February 2017). "Steering Asymmetric Lewis Acid Catalysis Exclusively with Octahedral Metal-Centered Chirality". Accounts of Chemical Research. 50 (2): 320–330. doi:10.1021/acs.accounts.6b00586. ISSN 0001-4842. PMID 28128920.
- ^ Huang, Xiaoqiang; Meggers, Eric (19 March 2019). "Asymmetric Photocatalysis with Bis-cyclometalated Rhodium Complexes". Accounts of Chemical Research. 52 (3): 833–847. doi:10.1021/acs.accounts.9b00028. ISSN 0001-4842. PMID 30840435. S2CID 73503362.
- ^ N. Jacobsen, Eric; Pfaltz, Andreas; Yamamoto, Hisashi (1999). Comprehensive asymmetric catalysis 1-3. Berlin: Springer. ISBN 978-3-540-64337-1.
- ^ M. Heitbaum; F. Glorius; I. Escher (2006). "Asymmetric Heterogeneous Catalysis". Angewandte Chemie International Edition. 45 (29): 4732–4762. doi:10.1002/anie.200504212. PMID 16802397.
- ^ 산업 규모의 비대칭 촉매 분석, (Blaser, Schmidt), Wiley-VCH, 2004.
- ^ Roos, Gregory (2002). Compendium of chiral auxiliary applications. San Diego, CA: Acad. Press. ISBN 978-0-12-595344-3.
- ^ a b Glorius, F.; Gnas, Y. (2006). "Chiral Auxiliaries – Principles and Recent Applications". Synthesis. 2006 (12): 1899–1930. doi:10.1055/s-2006-942399.
- ^ Evans, D. A.; Helmchen, G.; Rüping, M. (2007). "Chiral Auxiliaries in Asymmetric Synthesis". In Christmann, M. (ed.). Asymmetric Synthesis – The Essentials. Wiley-VCH Verlag GmbH & Co. pp. 3–9. ISBN 978-3-527-31399-0.
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "생물 촉매 분석"doi: 10.1351/goldbook.B00652
- ^ Faber, Kurt (2011). Biotransformations in organic chemistry a textbook (6th rev. and corr. ed.). Berlin: Springer-Verlag. ISBN 978-3-642-17393-6.
- ^ Schmid, A.; Dordick, J. S.; Hauer, B.; Kiener, A.; Wubbolts, M.; Witholt, B. (2001). "Industrial biocatalysis today and tomorrow". Nature. 409 (6817): 258–268. Bibcode:2001Natur.409..258S. doi:10.1038/35051736. PMID 11196655. S2CID 4340563.
- ^ a b Müller, Michael (7 January 2005). "Chemoenzymatic Synthesis of Building Blocks for Statin Side Chains". Angewandte Chemie International Edition. 44 (3): 362–365. doi:10.1002/anie.200460852. PMID 15593081.
- ^ Berkessel, A.; Groeger, H. (2005). Asymmetric Organocatalysis. Weinheim: Wiley-VCH. ISBN 3-527-30517-3.
- ^ 특별호:
- ^ Gröger, Albrecht Berkessel; Harald (2005). Asymmetric organocatalysis – from biomimetic concepts to applications in asymmetric synthesis (1. ed., 2. reprint. ed.). Weinheim: Wiley-VCH. ISBN 3-527-30517-3.
- ^ Dalko, Peter I.; Moisan, Lionel (15 October 2001). "Enantioselective Organocatalysis". Angewandte Chemie International Edition. 40 (20): 3726–3748. doi:10.1002/1521-3773(20011015)40:20<3726::AID-ANIE3726>3.0.CO;2-D. PMID 11668532.
- ^ Notz, Wolfgang; Tanaka, Fujie; Barbas, Carlos F. (1 August 2004). "Enamine-Based Organocatalysis with Proline and Diamines: The Development of Direct Catalytic Asymmetric Aldol, Mannich, Michael, and Diels−Alder Reactions". Accounts of Chemical Research. 37 (8): 580–591. doi:10.1021/ar0300468. PMID 15311957.
- ^ Bertelsen, Søren; Jørgensen, Karl Anker (2009). "Organocatalysis—after the gold rush". Chemical Society Reviews. 38 (8): 2178–89. doi:10.1039/b903816g. PMID 19623342.
- ^ Allenmark, Stig G. (1988). Chromatographic enantioseparation : methods and applications. Chichester, West Sussex, England: E. Horwood. pp. 64–66. ISBN 0-85312-988-6.
- ^ Snyder, Lloyd R.; Kirkland, Joseph J.; Glajch, Joseph L. (28 February 1997). Practical HPLC Method Development. doi:10.1002/9781118592014. ISBN 978-1-118-59201-4.
- ^ Lakhtakia, A., ed. (1990). Selected Papers on Natural Optical Activity (SPIE Milestone Volume 15). SPIE.
- ^ Gal, Joseph (January 2011). "Louis Pasteur, language, and molecular chirality. I. Background and Dissymmetry". Chirality. 23 (1): 1–16. doi:10.1002/chir.20866. PMID 20589938.
- ^ Pasteur, L. (1848). "Researches on the molecular asymmetry of natural organic products, English translation of French original, published by Alembic Club Reprints (Vol. 14, pp. 1–46) in 1905, facsimile reproduction by SPIE in a 1990 book".
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Pedro Cintas (2007). "Tracing the Origins and Evolution of Chirality and Handedness in Chemical Language". Angewandte Chemie International Edition. 46 (22): 4016–4024. doi:10.1002/anie.200603714. PMID 17328087.
- ^ Le Bel, Joseph (1874). "Sur les relations qui existent entre les formules atomiques des corps organiques et le pouvoir rotatoire de leurs dissolutions" [On the relations which exist between the atomic formulas of organic compounds and the rotatory power of their solutions]. Bull. Soc. Chim. Fr. 22: 337–347.
- ^ Van't Hoff, J.H. (1874) "Sur les formules de structure dans l'espace" (공간의 구조 공식에 대하여), Archives Néerlandaises des Sciences Exactes et Naturelles, 9: 445-454.
- ^ a b c d e Koskinen, Ari M.P. (2013). Asymmetric synthesis of natural products (Second ed.). Hoboken, N.J.: Wiley. pp. 17, 28–29. ISBN 978-1-118-34733-1.
- ^ Fischer, Emil (1 October 1894). "Synthesen in der Zuckergruppe II". Berichte der Deutschen Chemischen Gesellschaft. 27 (3): 3189–3232. doi:10.1002/cber.189402703109.
- ^ Fischer, Emil; Hirschberger, Josef (1 January 1889). "Ueber Mannose. II". Berichte der Deutschen Chemischen Gesellschaft. 22 (1): 365–376. doi:10.1002/cber.18890220183.
- ^ Marckwald, W. (1904). "Ueber asymmetrische Synthese". Berichte der Deutschen Chemischen Gesellschaft. 37: 349–354. doi:10.1002/cber.19040370165.
- ^ Campbell, Chantel D.; Vederas, John C. (23 June 2010). "Biosynthesis of lovastatin and related metabolites formed by fungal iterative PKS enzymes". Biopolymers. 93 (9): 755–763. doi:10.1002/bip.21428. PMID 20577995.
- ^ Cornish-Bawden, Athel, ed. (1997), New Beer in an Old Bottle. Eduard Buchner and the Growth of Biochemical Knowledge, Universitat de València, pp. 72–73, ISBN 978-84-370-3328-0
- ^ 이 초기 작업의 대부분은 독일어로 출판되었지만, 현대 영어 설명은 코스키넨(2012)과 같은 현대 리뷰에서 지속적인 분석과 주석과 함께 알렉산더 맥켄지의 논문에서 찾을 수 있다.
- ^ McKenzie, Alexander (1 January 1904). "CXXVII.Studies in asymmetric synthesis. I. Reduction of menthyl benzoylformate. II. Action of magnesium alkyl haloids on menthyl benzoylformate". J. Chem. Soc. Trans. 85: 1249–1262. doi:10.1039/CT9048501249.
- ^ Bijvoet, J. M.; Peerdeman, A. F.; van Bommel, A. J. (1951). "Determination of the Absolute Configuration of Optically Active Compounds by Means of X-Rays". Nature. 168 (4268): 271–272. Bibcode:1951Natur.168..271B. doi:10.1038/168271a0. S2CID 4264310.
- ^ Dalgliesh, C. E. (1952). "756. The optical resolution of aromatic amino-acids on paper chromatograms". Journal of the Chemical Society (Resumed): 3940. doi:10.1039/JR9520003940.
- ^ Klemm, L.H.; Reed, David (1960). "Optical resolution by molecular complexation chromatography". Journal of Chromatography A. 3: 364–368. doi:10.1016/S0021-9673(01)97011-6.
- ^ Cushny, AR (2 November 1903). "Atropine and the hyoscyamines-a study of the action of optical isomers". The Journal of Physiology. 30 (2): 176–94. doi:10.1113/jphysiol.1903.sp000988. PMC 1540678. PMID 16992694.
- ^ Cushny, AR; Peebles, AR (13 July 1905). "The action of optical isomers: II. Hyoscines". The Journal of Physiology. 32 (5–6): 501–10. doi:10.1113/jphysiol.1905.sp001097. PMC 1465734. PMID 16992790.
- ^ McBride, W. G. (1961). "Thalidomide and Congenital Abnormalities". The Lancet. 278 (7216): 1358. doi:10.1016/S0140-6736(61)90927-8.
- ^ Ito, Takumi; Ando, Hideki; Handa, Hiroshi (May 2011). "Teratogenic effects of thalidomide: molecular mechanisms". Cellular and Molecular Life Sciences. 68 (9): 1569–1579. doi:10.1007/s00018-010-0619-9. PMID 21207098. S2CID 12391084.
- ^ Robert Sidney Cahn; Christopher Kelk Ingold; Vladimir Prelog (1966). "Specification of Molecular Chirality". Angewandte Chemie International Edition. 5 (4): 385–415. doi:10.1002/anie.196603851.
- ^ Vladimir Prelog; Günter Helmchen (1982). "Basic Principles of the CIP-System and Proposals for a Revision". Angewandte Chemie International Edition. 21 (8): 567–583. doi:10.1002/anie.198205671.
- ^ Gil-Av, Emanuel; Feibush, Binyamin; Charles-Sigler, Rosita (1966). "Separation of enantiomers by gas liquid chromatography with an optically active stationary phase". Tetrahedron Letters. 7 (10): 1009–1015. doi:10.1016/S0040-4039(00)70231-0.
- ^ Vineyard, B. D.; Knowles, W. S.; Sabacky, M. J.; Bachman, G. L.; Weinkauff, D. J. (1977). "Asymmetric hydrogenation. Rhodium chiral bisphosphine catalyst". Journal of the American Chemical Society. 99 (18): 5946–5952. doi:10.1021/ja00460a018.
- ^ Knowles, William S. (2002). "Asymmetric Hydrogenations (Nobel Lecture)". Angewandte Chemie International Edition. 41 (12): 1999–2007. doi:10.1002/1521-3773(20020617)41:12<1998::AID-ANIE1998>3.0.CO;2-8. PMID 19746594.
- ^ Knowles, W. S. (March 1986). "Application of organometallic catalysis to the commercial production of L-DOPA". Journal of Chemical Education. 63 (3): 222. Bibcode:1986JChEd..63..222K. doi:10.1021/ed063p222.
- ^ H. Nozaki; H. Takaya; S. Moriuti; R. Noyori (1968). "Homogeneous catalysis in the decomposition of diazo compounds by copper chelates: Asymmetric carbenoid reactions". Tetrahedron. 24 (9): 3655–3669. doi:10.1016/S0040-4020(01)91998-2.
- ^ Katsuki, Tsutomu; Sharpless, K. Barry (1980). "The first practical method for asymmetric epoxidation". Journal of the American Chemical Society. 102 (18): 5974–5976. doi:10.1021/ja00538a077.
- ^ Jacobsen, Eric N.; Marko, Istvan.; Mungall, William S.; Schroeder, Georg.; Sharpless, K. Barry. (1988). "Asymmetric dihydroxylation via ligand-accelerated catalysis". Journal of the American Chemical Society. 110 (6): 1968–1970. doi:10.1021/ja00214a053.
- ^ Sharpless, K. Barry; Patrick, Donald W.; Truesdale, Larry K.; Biller, Scott A. (1975). "New reaction. Stereospecific vicinal oxyamination of olefins by alkyl imido osmium compounds". Journal of the American Chemical Society. 97 (8): 2305–2307. doi:10.1021/ja00841a071.
- ^ J. A. Dale, D. L. Dull and H. S. Mosher (1969). "α-Methoxy-α-trifluoromethylphenylacetic acid, a versatile reagent for the determination of enantiomeric composition of alcohols and amines". J. Org. Chem. 34 (9): 2543–2549. doi:10.1021/jo01261a013.
- ^ Hinckley, Conrad C. (1969). "Paramagnetic shifts in solutions of cholesterol and the dipyridine adduct of trisdipivalomethanatoeuropium(III). A shift reagent". Journal of the American Chemical Society. 91 (18): 5160–5162. doi:10.1021/ja01046a038. PMID 5798101.
- ^ Ensley, Harry E.; Parnell, Carol A.; Corey, Elias J. (1978). "Convenient synthesis of a highly efficient and recyclable chiral director for asymmetric induction". The Journal of Organic Chemistry. 43 (8): 1610–1612. doi:10.1021/jo00402a037.
- ^ Sariaslani, F.Sima; Rosazza, John P.N. (1984). "Biocatalysis in natural products chemistry". Enzyme and Microbial Technology. 6 (6): 242–253. doi:10.1016/0141-0229(84)90125-X.
- ^ Wandrey, Christian; Liese, Andreas; Kihumbu, David (2000). "Industrial Biocatalysis: Past, Present, and Future". Organic Process Research & Development. 4 (4): 286–290. doi:10.1021/op990101l.