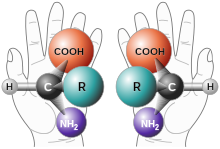
레이스메이징
Racemization화학에서 레이스메이징은 열 또는 화학 반응에 의해 광학 활성 화합물을 레이스믹(optical inactive) 형태로 변환하는 것이다.광학 활성 물질의 절반은 경합 혼합물(+)과 (-) 형태의 동일한 양을 포함하는)이라고 불리는 거울 이미지(엔안티머)가 된다.레이싱화 결과 D와 L 에나토머가 동일한 양으로 존재하는 혼합물이 발생하는 경우, 그 결과 샘플은 레이싱 혼합물 또는 레이싱메이트로 설명된다.[1][2]경주화는 여러 가지 다른 메커니즘을 통해 진행될 수 있으며, 서로 다른 항산화제가 다른 약효를 가질 수 있기 때문에 약리학에서 특히 중요한 의미를 갖는다.
입체화학
치랄 분자는 두 가지 형태(비대칭의 각 지점에서)를 가지며, 광학적 특성이 다르다.공중 부양 형태(--form)는 광선의 양극화 평면을 왼쪽으로 회전시키고, 덱스트러레이션 형태(+-form)는 광선의 양극화 평면을 오른쪽으로 회전시킨다.3차원 공간에서 회전할 때 과대포화되지 않는 두 형태는 반물질이라고 한다.이 표기법은 D-글리세알데히드 및 L-글리세알데히드와의 구조유사성을 나타내는 분자의 D및 L명칭과 혼동해서는안 된다.또한 (R)-와 (S)는 빛의 회전이 아닌 이름의 Cahn-Engold-Prelog 우선순위 규칙에 근거한 분자의 화학적 구조를 가리킨다.
인종 차별화는 한 가지 순수한 형태의 에반토머가 양쪽 에반토머의 동일한 비율로 변환되어, 인종 친구를 형성할 때 발생한다.덱스트로팅 분자와 레보로팅 분자의 수가 모두 같을 때, 경주 동료의 순 광학 회전은 0이다.[1]에나토머는 스테레오 입자 주위에 서로 다른 분자 구조를 가지고 있고 거울 이미지가 아닌 스테레오이머의 일종인 디아스테로머와도 구별되어야 한다.
물리적 성질
레이스메이트는 분자간 차이의 상호작용 때문에 순수한 항균제 중 하나와 다른 물리적 특성을 가질 수 있다(생물학적 유의성 섹션 참조).순수한 에반토머에서 레이스메이트로 변화하면 밀도, 용해점, 용해성, 융해열, 굴절률, 다양한 스펙트럼을 변화시킬 수 있다.레이스메이트의 결정화는 별도의 (+)와 (-) 형태를 만들거나 단일 레이스 화합물을 만들 수 있다.
생물학적 의의
일반적으로 대부분의 생화학적 반응은 입체적이기 때문에 한 스테레오소머만이 의도된 제품을 생산하는 반면 다른 스테레오소머는 단순히 참여하지 않거나 부작용을 일으킬 수 있다.특히 아미노산의 L형과 당류의 D형(원초 포도당)은 대개 생물학적으로 반응하는 형태다.이것은 많은 생물학적 분자들이 키랄이고 따라서 특정 에노모머들 사이의 반응은 순수 스테레오이오머를 생산하기 때문이다.[3]모든 아미노산 잔류물이 L 형태로 존재한다는 점도 눈에 띈다.그러나 박테리아는 박테리아 세포벽에서 발견될 수 있는 짧은 폴리펩타이드로 중합되는 D-아미노산 잔류물을 생성한다.이러한 폴리펩타이드들은 펩타이드에 의해 소화가 덜 되고 일반적으로 L-아미노산을 생성하는 mRNA 변환 대신 박테리아 효소에 의해 합성된다.[3]
대부분의 생화학적 반응의 입체적 성질은 화학 물질의 서로 다른 항산화제가 사람에게 다른 성질과 영향을 미칠 수 있다는 것을 의미했다.많은 향정신성 약물은 등가사이에 서로 다른 활성도나 효능을 나타낸다. 예를 들어 암페타민은 경혈성 염류로 투여되는 반면, 덱스트로암페타민은 내화성 환자나 더 심각한 징후를 위해 비축된다. 다른 예로는 메타돈(Metadone)이 있는데, 이 중 하나는 오피오이드 작용제로서 활동을 하고 다른 하나는 NMDA 길항작용제로 한다.t.[4]
제약 약물의 경주화는 체내에서 일어날 수 있다.탈리도마이드는 입덧에 효과가 있는 반면, 탈리도마이드는 기형성성이 있어 임신 첫 3개월에 복용하면 선천성 결함을 유발한다.만약 인간 피험자에게 하나의 항산화제를 투여한다면, 두 형태 모두 나중에 혈청 안에서 발견될 수 있다.[5]따라서 이 약은 아이를 낳는 나이의 여성들이 사용하기에 안전한 것으로 여겨지지 않으며, 다른 용도를 가지고 있지만, 그 사용은 엄격하게 통제된다.[6][7]탈리도마이드는 다발성 골수종 치료에 사용될 수 있다.[citation needed]
일반적으로 사용되는 또 다른 약물은 이부프로펜인데, 이부프로펜은 한 에나토머로서 항염증일 뿐 다른 약은 생물학적으로 불활성이다.마찬가지로 (S) 입체체는 세로토닌 재흡수를 억제하는 항우울제인 시탈로프람(Citalopram, Cellexa)에 있는 (R) 에난토머보다 훨씬 더 반응적이다.[2][3][8]따라서 약물의 구성적 안정성은 제약 연구에 관심 있는 영역이다.[9]제약산업에서 항산화제의 생산과 분석은 치랄 유기합성 분야에서 연구되고 있다.
경합성 혼합물 형성
경주화는 단순히 두 개의 순수한 에노머를 같은 양으로 혼합하는 것만으로 달성될 수 있다.경주화는 화학적 상호 변환에서도 발생할 수 있다.예를 들어, (R)-3-페닐-2-부타논이 NaOH 또는 HCl을 함유한 수용성 에탄올에 용해되면 레이스메이트가 형성된다.레이싱은 이전의 스테레오 입자가 평면적이 되고 따라서 아키랄이 되는 중간 에놀 형태를 통해 발생한다.[10]들어오는 그룹은 평면의 어느 한 쪽에서 접근할 수 있으므로, 치랄 케톤으로 다시 양성하는 것이 R 또는 S 형태를 생성하여 경기 동료가 될 가능성이 동등하다.
경주화는 다음과 같은 몇 가지 과정을 통해 발생할 수 있다.
- 단분자 치환반응 등 자유 탄수화물 중간을 통해 진행되는 치환반응은 경마화를 초래하는 비강력적 대체물질 추가로 이어진다.
- 단분자 제거 반응도 탄수화물을 통해 진행되지만, 치랄중추(chiral center)가 생기지는 않는다.그들은 대신, 경주 동료가 아닌 트랜스/시스(E/Z) 형태가 만들어지는 기하학적 이소머들의 집합으로 귀결된다.
- 단분자성 아열대성 대체 반응에서 카르바니온이 평면적이거나 피라미드 구조를 유지할 수 없는 경우, 항상은 아니지만 인종화가 일어나야 한다.[11]
- 자유 급진적 대체 반응에서, 만약 자유 급진파의 형성이 치랄 탄소에서 일어난다면, 인종화는 거의 항상 관찰된다.[12]
레이싱화 속도(L형식부터 L형식과 D형식의 혼합에 이르기까지)는 지질 퇴적물에서 회전 속도가 느린 조직, 법의학적 샘플, 화석의 연대를 위한 방법으로 사용되어 왔다.이 기술은 아미노산 연대 측정법으로 알려져 있다.
광학 활동 발견
1843년 루이 파스퇴르는 포도주 속에서 발견되는 파라타르타르산, 즉 인종의 광학 활동을 발견했다.그는 편광 빛을 반대 방향으로 회전시키는 두 개의 에나토머 결정체를 분리할 수 있었다.[2]
참고 항목
참조
- ^ a b 스트리트위저 & 히스콕 1985, 페이지 122–124
- ^ a b c Nelson, D. L.; Cox, M. M. (2013). Lehninger Principles of Biochemistry (6th ed.). New York: W. H. Freeman. ISBN 978-1429234146.
- ^ a b c Voet, D.; Voet, J. G.; Pratt, C. W. (2013). Fundamentals of Biochemistry: Life at the Molecular Level (4th ed.). Hoboken, NJ: John Wiley & Sons. ISBN 978-0470547847.
- ^ Arnold, L. E.; Wender, P. H.; McCloskey, K.; Snyder, S. H. (1972). "Levoamphetamine and Dextroamphetamine: Comparative Efficacy in the Hyperkinetic Syndrome: Assessment by Target Symptoms". Arch. Gen. Psychiatry. 27 (6): 816–822. doi:10.1001/archpsyc.1972.01750300078015. PMID 4564954.
- ^ Teo, S. K.; Colburn, W. A.; Tracewell, W. G.; Kook, K. A.; Stirling, D. I.; Jaworsky, M. S.; Scheffler, M. A.; Thomas S. D.; Laskin, O. L. (2004). "Clinical pharmacokinetics of thalidomide". Clin. Pharmacokinet. 43 (5): 311–327. doi:10.2165/00003088-200443050-00004. PMID 15080764. S2CID 37728304.
- ^ Stolberg, S. G. (17 July 1998). "Thalidomide Approved to Treat Leprosy, With Other Uses Seen". The New York Times. Retrieved 8 January 2012.
- ^ "Use of thalidomide in leprosy". WHO:leprosy elimination. World Health Organization. Archived from the original on November 10, 2006. Retrieved 22 April 2010.
- ^ Jacquot, C.; David, D. J.; Gardier, A. M.; Sánchez, C. (2007). "Escitalopram and citalopram: the unexpected role of the R-enantiomer". Encéphale. 33 (2): 179–187. doi:10.1016/s0013-7006(07)91548-1. PMID 17675913.
- ^ Reist, M.; Testa, B.; Carrupt, P.-A. (2003). "Drug Racemization and Its Significance in Pharmaceutical Research". In Eichelbaum, Michel F.; Testa, Bernard; Somogyi, Andrew (eds.). Stereochemical Aspects of Drug Action and Disposition. Handbook of Experimental Pharmacology. Vol. 153. pp. 91–112. doi:10.1007/978-3-642-55842-9_4. ISBN 978-3-642-62575-6.
- ^ 스트리트위저 & 히스콕 1985, 페이지 373
- ^ 1985년 3월 페이지 517-518
- ^ 1985년 3월, 페이지 610
참고 문헌 목록
- March, J. (1985). Advanced Organic Chemistry: reactions, mechanisms, and structure (3rd ed.). John Wiley & Sons. ISBN 0471854727.
- Streitwieser, A.; Heathcock, C. H. (1985). Introduction to Organic Chemistry (3rd ed.). Maxwell MacMillan. ISBN 0029467209.