치랄 보조기
Chiral auxiliary치랄 보조(chiral assistance)는 합성물의 입체화학적인 결과를 제어하기 위해 일시적으로 유기 화합물에 통합되는 입체적인 그룹이나 유닛이다.[1][2]보조에 존재하는 운율은 하나 이상의 후속 반응의 입체성을 편향시킬 수 있다.그런 다음 보조 장치는 일반적으로 나중에 사용하기 위해 회수될 수 있다.null
대부분의 생물학적 분자와 제약 목표는 가능한 두 개의 항산화제 중 하나로 존재한다. 따라서 천연물과 제약제의 화학적 합성은 항산화적으로 순수한 형태로 목표를 얻도록 자주 설계된다.[3]치랄 보조기들은 합성 화학자들이 주어진 화합물의 원하는 입체체를 선택적으로 생산하기 위해 이용할 수 있는 많은 전략들 중 하나이다.[4]null
치랄 보조기구는 1975년[5] 엘리아스 제임스 코리가 치랄 8페닐멘톨을, 1980년 배리 트로스트가 치랄 만델릭산을 도입했다.멘톨 화합물은 준비하기 어렵고 대체 트랜스-2-페닐-1-사이클로헥산올이 J. K에 의해 도입되었다.1985년 화이트셀null
비대칭합성
치랄 보조장치는 입체적인 중심부의 절대적 구성을 제어하기 위해 합성 경로에 통합된다.데이비드 A. 에반스의 고전이라고 할 수 있는 마크로라이드 시토바리신 합성은 옥사졸리디논 치랄 보조를 1개의 비대칭 알킬화 반응과 4개의 비대칭 알킬화 반응을 이용하여 9개의 입체화학의 절대 입체화학을 설정한다.[6]null
일반적인 보조 유도 입체적 변환은 세 단계를 포함한다. 첫째, 보조는 기질에 공칭적으로 결합된다. 둘째, 결과 화합물은 하나 이상의 이질회수적 변환을 거친다. 마지막으로, 보조는 원하는 제품의 레이싱화를 유발하지 않는 조건에서 제거된다.[4]계량계 보조장치를 사용하는 비용과 보조장치를 추가하고 제거하는 합성 단계를 사용할 필요성은 이 접근법을 비효율적으로 보이게 한다.그러나 많은 변환의 경우, 유일하게 이용 가능한 입체적 방법론은 키랄 보조장치에 의존한다.또한, 치랄 보조장치를 사용한 변환은 다용도적이고 매우 잘 연구되는 경향이 있어 항정신병적으로 순수한 제품에 대한 가장 시간 효율적인 접근을 가능하게 한다.[2]null
나아가 보조적 방향반응의 산물은 이질제거기로 칼럼 크로마토그래피나 결정화 등의 방법에 의해 페이셜 분리가 가능하다.[7]null
8칸소드홀
비대칭 합성에 치랄 보조 장치를 사용한 초기 예에서 E. J. 코리와 동료들은 (--8-페닐멘탈 아크릴레이트 에스테르와 5-벤질록시메틸사이클로펜타디엔 사이의 비대칭 디엘-알더 반응을 실시했다.[5]사이클로어드 추가 제품은 프로스타글란딘의 고전적인 코리 합성물의 중간인 요오드알락톤으로 운반되었다.아크릴산 뒷면은 보조에 의해 막힘으로써 알켄의 앞면에서 사이클로어드가 발생하도록 제안한다.null
(----8-148-170-170)은 풀레곤의 에나토머 중 하나에서 준비될 수 있지만,[8] 어느 경로도 매우 효율적이지 않다.8페닐멘톨 보조의 광범위한 효용성 때문에 트랜스-2페닐-1-사이클로헥산올과[9] 트랜스-2-1(1페닐-1-메틸틸)사이클로헥산올[10] 등 보다 쉽게 합성할 수 있는 대체 화합물이 탐사됐다.null
1,1'-비나프틸-2'diol(BINOL)
1,1'-비나프틸-2,2'diol, 또는 BINOL은 1983년부터 비대칭 합성의 치랄 보조로 사용되어 왔다.[11][12]null
야마모토 히사시는 먼저 (R)-BINOL을 키랄 보조로서 사이클론 모노 테르펜의 비대칭 합성에서 키랄 보조로서 활용했다. (R)-비놀 모노네릴 에테르를 키랄 보조로서 (R)-비놀의 모노실레이션과 알킬레이션으로 준비했다.오르간알루미늄 시약에 의한 감소에 따라 리모넨은 낮은 수율(수율 29%)과 중간 정도의 항산화 초과가 최대 64% ee까지 합성되었다.[12]null
다양한 항정신성 순수 비아미노산의 조제는 축방향 치라균 비놀을 보조로 하는 치랄 글리신 유도체의 알킬화를 통해 달성할 수 있다.후지 등이 묘사해 왔다.각기 다른 전기영향을 기준으로 했을 때, 이뇨제 과잉은 69%에서 86%까지 다양했다.[13]null
(R)-BINOL로 알데히드 기능에서 보호되는 아릴글리옥살은 그리그나드 시약과 함께 이질제거반응을 일으켜 보통에서 뛰어난 이질제거 과잉과 높은 수율을 가진 보호아트롤락탈알데히드를 제공했다.[14]null
비놀은 또한 비대칭 금속-분석 C-P 연결 프로세스에서 P-스테레오컨터의 형성을 제어하기 위한 키랄 보조 장치로 사용되었다.몬달 외 연구진은 반응하는 P 센터 근처에 BINOL이 존재하기 때문에 축방향 치랄 BINOL 기반 인광물질과 아릴 할리드 또는 트리플레이트 사이의 Pd-catalysed C-P 교차 결합 반응이 우수한 입체감을 가지고 진행된다는 사실을 발견했다.[15]null
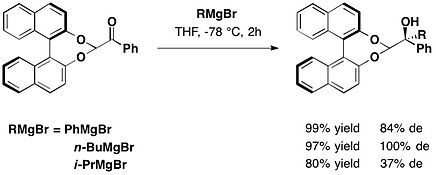
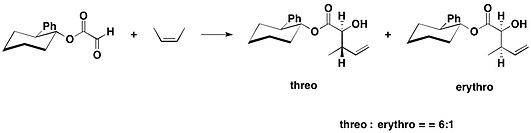
trans-2-페닐사이클로헥산올
치랄 보조의 한 종류는 제임스 K가 소개한 트랜스-2페닐사이클로헥산올 모티브에 바탕을 두고 있다.1985년 화이트셀과 동료들.이 치랄 보조는 글리옥시릴산의 파생 에스테르 반응에 사용되었다.[16]null
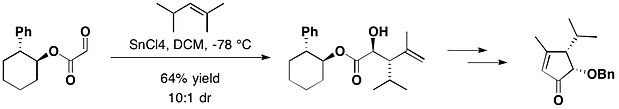
In the total synthesis of (−)-heptemerone B and (−)-guanacastepene E, attached with trans-2-phenylcyclohexanol, the glyoxylate reacted with 2,4-dimethyl-pent-2-ene, in the presence of tin(IV) chloride, yielding the desired anti adduct as the major product, together with a small amount of its syn isomer with 10:1 diastereomeric ratio.[17]null
보다 뛰어난 순응 제어를 위해 페닐에서 트리틸 그룹으로 전환하면 TTC(Trans-2-Tritylcylohexanol)가 제공된다.브라운그룹은 2015년 TTC와 함께 효율적인 치랄 과망간산염 매개 산화 사이클링을 발표했다.[18]null
옥사졸리디논
데이비드 A가 대중화한 옥사졸리디논 보조원. 에반스는 알돌 반응,[19] 알킬화 반응,[20] 디엘-알데르 반응 등 많은 입체적 변형에 적용되어 왔다.[21][22]옥사졸리디논은 4번과 5번 자세로 대체된다.대체자는 견고한 장애를 통해 다양한 집단의 대체 방향을 지시한다.보조 장치는 이후에 가수분해를 통해 제거된다.null
준비
옥사졸리디논은 아미노산이나 쉽게 구할 수 있는 아미노 알코올로부터 준비될 수 있다.아래 4개를 포함하여 많은 수의 옥사졸리디논이 상업적으로 판매되고 있다.null
옥사졸리디논의 아킬화효과는 n-부틸리튬으로 디프로톤화시키고 아킬염화효소로 쐐기를 박음으로써 달성된다.null
알킬화 반응
리튬 이소프로필아미드 등 기초가 튼튼한 옥사졸리디논 이미드의 α-탄소에서의 감압은 (Z)-에놀레이트를 선택적으로 공급하며, 이는 스테레오셀렉티브 알킬화를 진행할 수 있다.null
아군이나 벤질릭 할로겐화물과 같은 활성전극은 매우 좋은 기질이다.null
알돌반응
치랄옥사졸리디논은 입체적인 알돌 반응에 가장 널리 이용되어 왔다.null
루이스산 디부틸보론 트리플레이트 및 베이스 디이소프로필틸틸아민으로 부드러운 에놀레이션을 부여하여 알데히드 기질로 이질회수성 알돌 반응을 일으킨다.그 변환은 두 개의 연속적인 입체체를 동시에 구축하기 때문에 특히 강력하다.null
관측된 입체감에 대한 모델은 아래에서 찾을 수 있다.메틸 그룹과 새로운 2차 알코올 사이의 싱-스테레오레오레이션쉽은 6-엠베드 링 짐머만-트랙슬러 전환 상태에서 발생하며, 여기서 에놀레이트 산소와 알데이드 산소는 모두 붕소를 조정한다.알데히드는 수소가 1,3DIA 교호작용을 최소화하기 위해 사이비 축 방향으로 배치되도록 방향을 잡는다.두 스테레오센트의 절대 입체화학은 보조의 치례성에 의해 제어된다.전환 구조에서 보조 카보닐은 분자의 순 쌍극자를 최소화하기 위해 에놀레이트 산소에서 멀리 향한다. 에놀레이트 한 면은 치랄 보조의 대체물에 의해 차단된다.null
제거
서로 다른 종합적으로 유용한 기능군을 생성하기 위해 옥사졸리디논 보조의 제거를 용이하게 하기 위해 다양한 변환이 개발되었다.null
캄포르술탐
캄프호르술탐(Camphorsultam) 또는 오폴저의 술탐은 고전적인 치랄 보조물이다.null
오후네 그룹은 만자시딘 B의 총합에서 캄프호르술탐을 활용하여 코어 옥사졸린 링을 비대칭적으로 구축하였다.키랄 보조로서 옥사졸리디논과 비교했을 때, 캄프호르술탐은 상당한 (2S,3R) 선택성을 가지고 있었다.[23]null
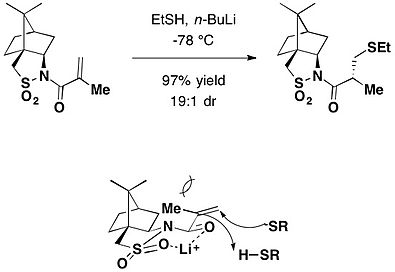
캄포르술탐은 또한 마이클 추가에서 치랄 보조의 역할을 한다.리튬 베이스는 N-mcthacryloylcamphorsultam에 티올을 첨가한 입체적인 Michael을 촉진하여 높은 이질제거율의 해당 첨가 제품을 생산하였다.[24]null
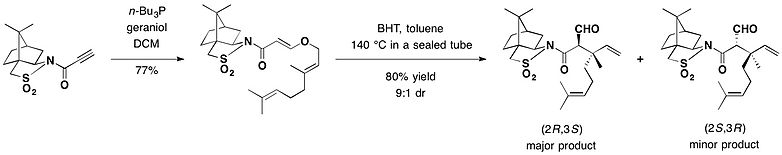
캄프호르술탐은 비대칭 클라이센 재배치의 치랄 보조로 사용되었다.In the presence of butylated hydroxytoluene (BHT) used as a radical scavenger, a toluene solution of the adduct between geraniol and camphorsultam was heated in a sealed tube at 140 °C, to provide mainly the (2R,3S)-isomer as the major rearrangement product in 72% yield, securing the two contiguous stereocenters including the quaternary carbon.[25]null
의사페드린과 의사페나민
(R,R)- 및 (S,S)-pseudoepedrine은 모두 키랄 보조제로 사용할 수 있다.[26]의사페드린은 카르복실산, 무수화물 또는 아킬염화물과 반응하여 그에 상응하는 아미드를 준다.null
카보닐 화합물의 α-프로톤은 비핵성 염기에 의해 쉽게 감압되어 에놀레이트(Enolate)를 주는데, 이것은 더 이상 반응할 수 있다.알킬 할로겐과 같은 첨가 화합물의 구성은 메틸 그룹에 의해 지시된다.따라서, 어떤 추가 제품도 메틸과 항산화효소 그룹에 동기화될 것이다.의사페드린 치랄 보조는 이후 적절한 핵소포체와 아미드 결합을 분리함으로써 제거된다.null
준비
의사페드린의 항정신병자 두 명 모두 상업적으로 이용할 수 있다.인종적 사이비페드린에는 많은 의학적 용도가 있다.의사페드린은 불법으로 필로폰을 만드는 데 사용될 수 있기 때문에 학술이나 산업 연구에 사용하기 위한 의사페드린 구입은 오히려 규제된다.대안으로 마이어스 외 연구진은 알킬화 반응에서 의사페나민 치랄 보조제의 효용성을 보고했다.[27]사이비페나민은 상업적 원천에서 쉽게 구할 수 없지만 벤질에서 비교적 쉽게 합성할 수 있고 암페타민 제조에는 사용할 수 없다.[28]null
의사페드린 아미드는 일반적으로 아틸 염화나 무수화물 아킬화물에 의해 제조된다.[29]null
알킬화
의사페드린 아미드는 해당 (Z)-엔올레이트를 주기 위해 리튬 이소프로필아미드(LDA)와 같은 강한 베이스에 의해 감응을 겪는다.이 리튬 에놀레이트의 알킬화는 높은 안면 선택성으로 진행된다.null
이질회수성은 리튬 에놀레이트 한쪽 면이 알카산화 리튬 2차 및 리튬 정화와 관련된 용제 분자에 의해 차단되는 구성에서 비롯된다고 믿어진다.이 제안에 따라 알킬화 단계의 이염화효율은 존재하는 염화 리튬의 양과 용제인 테트라하이드로푸란(THF)에 크게 의존하는 것으로 관찰되었다.일반적으로 염화 리튬의 등가물 4~6개는 반응 어금니에서 에놀레이트 용액을 THF에 포화시키기에 충분하다.null
의사페드린 아미드를 사용한 비대칭 알킬화의 한 가지 주요 장점은 아미드 에놀레이트(amide enolate)가 –78 °C ~ 0 °C의 온도에서 일차 및 이차 할로겐드와 반응할 수 있을 만큼 충분히 핵 친화적이라는 것이다.덜 반응적인 전기영향을 위해 DMPU의 추가가 필요하지만 α-브란치 아미드 에놀레이트 알키플레이션에 의한 2차 탄소 중심 건설도 가능하다.[30]null
제거
의사페드린 아미드가 항항산화 탄복실산, 알코올, 알데히드, 케톤으로 변형될 수 있는 조건이 개발되었다. 갈라진 후 보조물을 회수하여 재사용할 수 있다.null
테르트부타네술핀아미드
이 특정 설피나미드 치랄 보조 장치는 처음에 조나단 A에 의해 개발되었다.엘먼, 그리고 그 용도는 그의 그룹에 의해 광범위하게 탐구되었다.[31][32]그래서 흔히 엘먼의 보조나 엘먼의 설피나미드라고 한다.null
준비
테르트-부타네술핀아미드의 에노머 중 하나는 테르트-부틸 이황화로부터 두 단계로 도달할 수 있다: 촉매 비대칭 산화 반응은 이황화 단색화 제품을 높은 수율과 에노메릭 과잉으로 제공한다.암모니아에서 이 화합물을 리튬 아미드로 처리하면 광학적으로 순수한 반전 제품을 얻을 수 있다.null
알데히드나 케톤을 사용한 테르트-부타네술피나미드의 응축은 높은 수율에서 진행되며 해당 N-설피닐 이미인의 (E)등분체만 제공한다.null
치랄아민 합성
Tert-butanesulfinien aldimine 또는 ketimine에 Grignard 시약을 첨가하면, 비대칭으로 추가되어 갈린 설핀아미드(Sulfinamide가 된다.관측된 입체성은 황비닐 이미인의 산소와 질소가 모두 마그네슘을 조정하는 6-membed 링 전환 구조로 합리화할 수 있다.null
제거
보조 장치는 양성 용매에서 염산으로 처리하여 원하는 아민에서 제거할 수 있다.null
SAMP/램프
치랄(S)-1-아미노-2-메톡시메틸피롤리딘(SAMP)과 (R)-1-아미노-2-메톡시메틸피롤리딘(RAMP) 히드라존의 알킬화 반응은 디터엔더스와 E.J.코레이가 개발했다.[33][34]null
준비
SAMP는 (S)-프로라인에서 6단계로, RAMP는 (R)-글루탐산으로부터 6단계로 준비될 수 있다.null
알킬화 반응
알데히드 또는 케톤을 사용한 SAMP 또는 RAMP의 응축은 (E)-히드라진을 공급한다.디이소프로필아미드 리튬과 알킬 할라이드를 첨가하면 알킬화 제품이 나온다.보조 장치는 오졸리분해나 가수분해로 제거할 수 있다.null
키랄 보조산업
치랄 보조기는 일반적으로 신뢰할 수 있고 다용도적이어서 많은 수의 항항체 순수 화합물을 시간 효율적인 방법으로 합성할 수 있다.결과적으로, 키랄 보조기구는 종종 약물 개발의 초기 단계에서 선택하는 방법이다.[2]null
HIV 프로테아제 억제제 Tipranavir는 에이즈 치료용으로 시판되고 있다.Tipranavir로 가는 첫 번째 항정신성 약용 화학 루트는 치랄 Michael 수용체에 유기농 증류 시약을 첨가하는 것을 포함했다.[35]마이클 수용기의 키랄 옥사졸리디논은 분자 안에 있는 두 개의 스테레오콘 중 한 개의 스테레오케미컬을 조절했다.Tipranavir로 가는 최종 상용 노선은 치랄 보조를 특징으로 하지 않는다. 대신, 이 입체점은 비대칭 수소화 반응에 의해 설정된다.[36]null
아토르바스타틴
아토르바스타틴의 칼슘 소금은 혈중 콜레스테롤을 낮추기 위해 리피터라는 상표명으로 판매된다.아토르바스타틴에 대한 최초의 항정신성 의약 화학 루트는 치랄 에스테르와의 이질성 알돌 반응에 의존하여 두 알콜 스테레오센서 중 하나를 설정하였다.[37]아토르바스타틴에 이르는 상업적인 경로에서, 이 스테레오컨터는 쉽게 구할 수 있는 식품 첨가물 이소아스코르브산으로부터 이월된다.[38]null
참고 항목
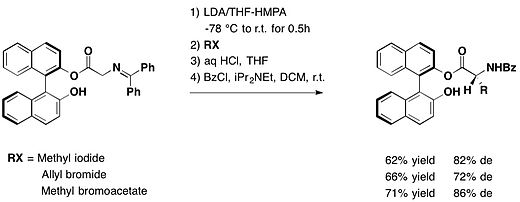
- chiral 보조로 trans-2-phenyl-1-cyclohexanol을 사용하는 예:오지마 젖탐
- 숄코프법에서 치랄 보조로서의 발레린
참조
- ^ 주요 Chiral 보조 애플리케이션(Edd.: Roos, G.)(Ed.: Roos, G.), Academic Press, Boston, 2014년 ISBN978-0-12-417034-6
- ^ a b c Glorius, F.; Gnas, Y. (2006). "Chiral Auxiliaries — Principles and Recent Applications". Synthesis. 2006 (12): 1899–1930. doi:10.1055/s-2006-942399.
- ^ Jamali, Fakhreddin (1993). "Chapter 14: Stereochemically Pure Drugs: An Overview". In Wainer, Irving W. (ed.). Drug Stereochemistry: Analytical Methods and Pharmacology. Marcel Dekker, Inc. pp. 375–382. ISBN 978-0-8247-8819-3.
- ^ a b Evans, D. A.; Helmchen, G.; Rüping, M. (2007). "Chiral Auxiliaries in Asymmetric Synthesis". In Christmann, M (ed.). Asymmetric Synthesis — The Essentials. Wiley-VCH Verlag GmbH & Co. pp. 3–9. ISBN 978-3-527-31399-0.
- ^ a b Corey, E. J.; Ensley, H. E. (1975). "Preparation of an Optically Active Prostaglandin Intermediate via Asymmetric Induction". J. Am. Chem. Soc. 97 (23): 6908–6909. doi:10.1021/ja00856a074. PMID 1184891.
- ^ Nicolau, K. C. (2008). Classics in Total Synthesis (5th ed.). New York, New York: Wiley-VCH. pp. 485–508. ISBN 978-3-527-29231-8.
- ^ Miller, J. P. (2013). "ChemInform Abstract: Recent Advances in Asymmetric Diels-Alder Reactions". ChemInform. 44 (48): no. doi:10.1002/chin.201348243.
- ^ Corey, E. J.; Ensley, H. E.; Parnell, C. A. (1978). "Convenient Synthesis of a Highly Efficient and Recyclable Chiral Director for Asymmetric Induction". J. Org. Chem. 43 (8): 1610–1611. doi:10.1021/jo00402a037.
- ^ Whitesell, J. K.; Chen, H. H.; Lawrence, R. M. (1985). "trans-2-Phenylcyclohexanol. A powerful and readily available chiral auxiliary". J. Org. Chem. 50 (23): 4663–4664. doi:10.1021/jo00223a055.
- ^ Comins, D. L.; Salvador, J. D. (1993). "Efficient Synthesis and Resolution of trans-2-(1-Aryl-1-methylethyl)cyclohexanols: Practical Alternatives to 8-P henylmenthol". J. Org. Chem. 58 (17): 4656–4661. doi:10.1021/jo00069a031.
- ^ Brunel, Jean Michel (2005). "BINOL: A Versatile Chiral Reagent". Chemical Reviews. 105 (3): 857–898. doi:10.1021/cr040079g. PMID 15755079.
- ^ a b Sakane, Soichi; Fujiwara, Junya; Maruoka, Keiji; Yamamoto, Hisashi (1983). "Chiral leaving group. Biogenetic-type asymmetric synthesis of limonene and bisabolenes". Journal of the American Chemical Society. 105 (19): 6154–6155. doi:10.1021/ja00357a033.
- ^ Tanaka, Kiyoshi; Ahn, Mija; Watanabe, Yukari; Fuji, Kaoru (1996-06-01). "Asymmetric synthesis of uncommon α-amino acids by diastereoselective alkylations of a chiral glycine equivalent". Tetrahedron: Asymmetry. 7 (6): 1771–1782. doi:10.1016/0957-4166(96)00212-1.
- ^ Maglioli, Paola; De Lucchi, Ottorino; Delogu, Giovanna; Valle, Giovanni (1992-01-01). "Highly diastereoselective reduction and addition of nucleophiles to binaphthol-protected arylglyoxals". Tetrahedron: Asymmetry. 3 (3): 365–366. doi:10.1016/S0957-4166(00)80276-1.
- ^ Mondal, Anirban; Thiel, Niklas O.; Dorel, Ruth; Feringa, Ben L. (January 2022). "P-chirogenic phosphorus compounds by stereoselective Pd-catalysed arylation of phosphoramidites". Nature Catalysis. 5 (1): 10–19. doi:10.1038/s41929-021-00697-9. S2CID 245426891.
- ^ Buchi, George; Vogel, Dennis E. (1985). "A new method for the preparation of γ,δ-unsaturated ketones via Claisen rearrangement". The Journal of Organic Chemistry. 50 (23): 4664–4665. doi:10.1021/jo00223a056.
- ^ Miller, Aubry K.; Hughes, Chambers C.; Kennedy-Smith, Joshua J.; Gradl, Stefan N.; Dirk Trauner (2006). "Total Synthesis of (−)-Heptemerone B and (−)-Guanacastepene E". Journal of the American Chemical Society. 128 (51): 17057–17062. doi:10.1021/ja0660507. PMID 17177458.
- ^ Al Hazmi, Ali M.; Sheikh, Nadeem S.; Bataille, Carole J. R.; Al-Hadedi, Azzam A. M.; Watkin, Sam V.; Luker, Tim J.; Camp, Nicholas P.; Brown, Richard C. D. (2014). "trans-2-Tritylcyclohexanol as a Chiral Auxiliary in Permanganate-Mediated Oxidative Cyclization of 2-Methylenehept-5-enoates: Application to the Synthesis of trans-(+)-Linalool Oxide". Organic Letters. 16 (19): 5104–5107. doi:10.1021/ol502454r. PMID 25225741.
- ^ Evans, D. A.; Bartroli, J.; Shih, T. L. (1981). "Enantioselective aldol condensations. 2. Erythro-selective chiral aldol condensations via boron enolates". J. Am. Chem. Soc. 103 (8): 2127–2129. doi:10.1021/ja00398a058.
- ^ Evans, D. A.; Ennis, M. D.; Mathre, D. J. (1982). "Asymmetric Alkylation Reactions of Chiral Imide Enolates. A Practical Approach to the Enantioselective Synthesis of a-Substituted Carboxylic Acid Derivatives". J. Am. Chem. Soc. 104 (6): 1737–1739. doi:10.1021/ja00370a050.
- ^ Evans, D. A.; Chapman, K. T.; Bisaha, J. (1984). "New Asymmetric Diels-Alder Cycloaddition Reactions. Chiral α,β-Unsaturated Carboximides as Practical Chiral Acrylate and Crotonate Dienophile Synthons". J. Am. Chem. Soc. 106 (15): 4261–4263. doi:10.1021/ja00327a031.
- ^ Evans, D. A.; Chapman, K. T.; Hung, D. T.; Kawaguchi, A. T. (1987). "Transition State π-Solvation by Aromatic Rings: An Electronic Contribution to Diels-Alder Reaction Diastereoselectivity". Angew. Chem. Int. Ed. 26 (11): 1184–1186. doi:10.1002/anie.198711841.
- ^ Shinada, Tetsuro; Oe, Kentaro; Ohfune, Yasufumi (2012-06-27). "Efficient total synthesis of manzacidin B". Tetrahedron Letters. 53 (26): 3250–3253. doi:10.1016/j.tetlet.2012.04.042.
- ^ Tsai, Wen-Jiuan; Lin, Yi-Tsong; Uang, Biing-Jiun (1994-07-01). "Asymmetric Michael addition of thiols to (1R,2R,4R)-(−)-2,10-N-enoylcamphorsultam". Tetrahedron: Asymmetry. 5 (7): 1195–1198. doi:10.1016/0957-4166(94)80155-X.
- ^ Takao, Ken-ichi; Sakamoto, Shu; Touati, Marianne Ayaka; Kusakawa, Yusuke; Tadano, Kin-ichi (2012-11-08). "Asymmetric Construction of All-Carbon Quaternary Stereocenters by Chiral-Auxiliary-Mediated Claisen Rearrangement and Total Synthesis of (+)-Bakuchiol". Molecules. 17 (11): 13330–13344. doi:10.3390/molecules171113330. PMC 6268616. PMID 23138536.
- ^ Myers, A. G.; et al. (1997). "Pseudoephedrine as a Practical Chiral Auxiliary for the Synthesis of Highly Enantiomerically Enriched Carboxylic Acids, Alcohols, Aldehydes, and Ketones". J. Am. Chem. Soc. 119 (28): 6496–6511. doi:10.1021/ja970402f.
- ^ Myers, A. G.; Morales, M. R.; Mellem, K. T. (2012). "Pseudoephenamine: A Practical Chiral Auxiliary for Asymmetric Synthesis" (PDF). Angew. Chem. 124 (19): 4646–4649. Bibcode:2012AngCh.124.4646M. doi:10.1002/ange.201200370. PMC 3854953. PMID 22461381.
- ^ Mellem, Kevin T.; Myers, Andrew G. (2013). "A Simple, Scalable Synthetic Route to (+)- and (−)-Pseudoephenamine". Organic Letters. 15 (21): 5594–5597. doi:10.1021/ol402815d. ISSN 1523-7060. PMC 3864801. PMID 24138164.
- ^ Myers, A. G.; Yang, B. H.; McKinstry, L.; Kopecky, D. J.; Gleason, J. L. (1997). "Pseudoephedrine as a Practical Chiral Auxiliary for the Synthesis of Highly Enantiomerically Enriched Carboxylic Acids, Alcohols, Aldehydes, and Ketones". J. Am. Chem. Soc. 119 (28): 6496–6511. doi:10.1021/ja970402f.
- ^ Kummer, D. A.; Chain, W. J.; Morales, M. R.; Quiroga, O.; Myers, A. G. (2008). "Stereocontrolled Alkylative Construction of Quaternary Carbon Centers". J. Am. Chem. Soc. 130 (40): 13231–13233. doi:10.1021/ja806021y. PMC 2666470. PMID 18788739.
- ^ Liu, Guangcheng; Cogan, Derek A.; Ellman, Jonathan A. (October 1997). "Catalytic Asymmetric Synthesis of tert -Butanesulfinamide. Application to the Asymmetric Synthesis of Amines". Journal of the American Chemical Society. 119 (41): 9913–9914. doi:10.1021/ja972012z. ISSN 0002-7863.
- ^ Ellman, J. A.; Owens, T. D.; Tang, T. P. (2002). "N-tert-Butanesulfinyl Imines: Versatile Intermediates for the Asymmetric Synthesis of Amines". Acc. Chem. Res. 35 (11): 984–995. doi:10.1021/ar020066u. PMID 12437323.
- ^ Corey, E. J.; Enders, D. (1976). "Applications of N,N-dimethylhydrazones to synthesis. Use in efficient, positionally and stereochemically selective C-C bond formation; oxidative hydrolysis to carbonyl compounds". Tetrahedron Letters. 17 (1): 3–6. doi:10.1016/s0040-4039(00)71307-4.
- ^ Kurti, L.; Czako, B. (2005). Strategic Applications of Named Reactions in Organic Synthesis. Burlington, MA: Elsevier Academic Press. pp. 150–151. ISBN 978-0-12-369483-6.
- ^ Turner, S. T.; et al. (1998). "Tipranavir (PNU-140690): A Potent, Orally Bioavailable Nonpeptidic HIV Protease Inhibitor of the 5,6-Dihydro-4-hydroxy-2-pyrone Sulfonamide Class". J. Med. Chem. 41 (18): 3467–3476. doi:10.1021/jm9802158. PMID 9719600.
- ^ Caron, Stéphane (2011). "Chapter 15: Synthetic Route Development of Selected Contemporary Pharmaceutical Drugs". In Caron, Stéphane (ed.). Practical Synthetic Organic Chemistry. John Wiley & Sons, Inc. pp. 666–670. ISBN 978-0-470-03733-1.
- ^ Roth, B. D.; et al. (1991). "Inhibitors of Cholesterol Biosynthesis. 3. Tetrahydro-4-hydroxy-6-[2-(lH-pyrrol-l-yl)ethyl]-2H-pyran-2-one Inhibitors of HMG-CoA Reductase. 2. Effects of Introducing Substituents at Positions Three and Four of the Pyrrole Nucleus". J. Med. Chem. 34 (1): 357–366. doi:10.1021/jm00105a056. PMID 1992137.
- ^ Jie Jack Li; Douglas S. Johnson; Drago R. Sliskovic; Bruce D. Roth (2004). "Chapter 9. Atorvastatin Calcium (Lipitor)". Contemporary Drug Synthesis. John Wiley & Sons, Inc. pp. 113–125. ISBN 978-0-471-21480-9.