치랄 유도체
Chiral derivatizing agent치랄 분해 시약으로도 알려진 치랄 유도제(CDA)는 혼합물 내에 존재하는 각 에노머의 양을 분석하기 위해 에노토머 혼합물을 이염제로 변환하는 데 사용되는 치랄 보조제다.분석은 분광학이나 크로마토그래피로 할 수 있다.Chiral HPLC의 대중화와 함께 chiral derivatizing agents의 사용이 감소하였다.분석 이외에도 키랄 유도체화는 키랄 분해능, 항산화제의 실제 물리적 분리에도 사용된다.null
역사
NMR 분광법을 화학자들이 이용할 수 있었기 때문에, 이 기법의 적용에 관한 수많은 연구가 있었다.이들 중 하나는 두 개의 분진제거기의 화학적 변화(즉, 봉우리 사이의 거리)의 차이를 지적했다.[1]반대로, 항산화 물질인 두 화합물은 동일한 NMR 스펙트럼 특성을 갖는다.항산화제 혼합물을 그 자체인 다른 화학 물질에 결합함으로써 이산화제 혼합물로 변환할 수 있다면, NMR을 사용하여 이 새로운 혼합물을 구별할 수 있을 것이고, 따라서 원래의 항산화제 혼합물에 대해 배울 수 있을 것이라는 이유였다.이 기술의 첫 번째 인기 있는 예는 1969년에 Harry S에 의해 출판되었다. 모셔요사용된 치랄제는 MTPA(α-메톡시-α-(트리플루오로메틸)[2]페닐아세트산)의 단일 에노머로 모셔 산으로도 알려져 있었다.해당 염화산은 모셔의 염화산이라고도 하며, 그 결과 이질화 이질화 에스테르는 모셔의 에스테르로 알려져 있다.또 다른 시스템은 1977년에 개발된 Pirkle's Alcohol이다.null
요구 사항들
CDA의 일반적인 사용과 설계는 CDA가 분석 물질의 입체화학성을 효과적으로 결정할 수 있도록 다음 규칙을 준수한다.[3]
- CDA는 반독성적으로 순수해야 하며, 또는 (만족하지 않게) 반독성 순도를 정확하게 알아야 한다.
- 두 에노머에 대한 CDA의 반응은 반응 조건 하에서 완료되어야 한다.이것은 운동 분해능에 의한 분석 물질의 한 엔노머의 농축이나 고갈을 피하기 위해 작용한다.
- CDA는 유도화 또는 분석 조건 하에서 레이싱화해서는 안 된다.부착력은 기질도 경합되지 않도록 충분히 온화해야 한다.HPLC에 의해 분석이 완료되는 경우 CDA는 검출성을 높이기 위해 색소를 포함해야 한다.
- NMR에 의해 분석이 완료된 경우 CDA에는 결과 NMR 스펙트럼에서 싱글릿을 제공하는 기능 그룹이 있어야 하며, 여기서 싱글릿은 다른 피크에서 멀리 떨어져 있어야 한다.
모셔의 방법
모셔의 산은 산성 염화물 분해를 통해 알코올과 아민에 쉽게 반응하여 각각 에스테르와 아미드를 준다.산에 알파 프로톤이 부족하면 반응 조건 하에서의 입체 화학적 충실도의 상실을 방지한다.따라서 항정신병적으로 순수한 모셔의 산을 사용하면 간단한 치랄 아민과 알코올의 구성을 결정할 수 있다.[4]예를 들어 1페닐타놀의 (R)- 및 (S) 항산화제는 NMR에서 구별할 수 있는 (R)-모셔산 염화물과 반응하여 각각 (R,S)- 및 (S,S)-정화물질과 반응한다.[5]
CFNA(모셔 산과 대체)
신형 치랄 유도체(CDA), α-시아노-α-플루오로(2-나프틸)-아세트산(2-CFNA)은 치랄 HPLC 분리에 의해 광학적으로 순수한 형태로 준비되었다.이 에스테르는 FClO3와 함께 메틸 α-시아노(2-나프틸) 아세테이트를 불소화하여 얻은 것이다. 2-CFNA는 일차 알코올의 항항성 과잉을 결정하기 위해 모셔의 에이전트보다 우수한 CDA로 밝혀졌다.[6]
CDA를 사용한 크로마토그래피
CDA가 표적 분석 물질과 반응하면 크로마토그래피를 사용하여 결과물을 분리할 수 있다.일반적으로 크로마토그래피는 어려운 결정화를 우회하기 위해 치랄 화합물을 분리하거나 용액에서 모든 이질화합물 쌍을 수집하는 데 사용될 수 있다.크로마토그래피는 또한 다양한 범주의 분자에 대한 광범위한 적용 가능성과 함께 많은 변형(예: HPLC, 가스 크로마토그래피, 플래시 크로마토그래피)을 가지고 있다.CDA가 키랄 분자를 분리하는 능력은 크로마토그래피의 두 가지 주요 메커니즘에 의존한다.[7]
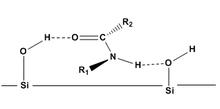
헬름헨의 가정관
Helmchen's Postmulators는[8][9] 표면에 흡착되는 (CDA로부터 형성된) 분진기의 용출 순서와 분리의 정도를 예측하는 데 사용되는 이론적 모델이다.헬름헨의 체조는 액체 크로마토그래피를 사용하는 실리카 겔에 대한 아미드 전용이지만, 체질은 다른 분자에 대한 기본적인 지침을 제공한다.헬름헨의 가설은 다음과 같다.
- 순응은 해결책과 흡착할 때 동일하다.
- 디아스트레오머는 주로 수소 결합으로 표면(정상 위상 크로마토그래피에서 실리카 겔)에 결합한다.
- 분자가 두 개의 접촉점(수소 결합 2개)을 통해 실리카에 흡착할 수 있을 때만 상당한 분진 분해능이 기대된다.이 상호작용은 대체자에 의해 동요될 수 있다.
- 알파 탄소(R2)와 질소(R1)에 부피가 큰 대체 물질을 가진 디아스트레오머는 표면과의 수소 결합을 차폐할 수 있으므로, 분자는 작은 대체 물질을 가진 유사 분자보다 먼저 용출될 것이다.
헬름첸의 체조는 카바메이트,[7] 에스테르,[10] 에폭시드와 같은 다른 기능 그룹에 적용할 수 있는 것으로 입증되었다.[11]null
치랄 정지 단계
고정 페이즈는 CDA와 반응하여 키랄 고정 페이즈를 형성하여 키랄 분자를 해결할 수 있다.[12]규산염 정지 단계에서 알코올과 반응함으로써 CDA는 치랄 분자를 분리할 수 있는 치랄 중심을 정지 단계에 추가한다.null
NMR 분광법의 CDA
CDA를 NMR 분광 분석과 함께 사용하여 항항성 과잉과 기질의 절대 구성을 결정한다.치알 차별화제는 치알화제(CSA)와 구별하기 어려운 경우가 있으며, 일부 작용제는 둘 다로 사용할 수 있다.기판과 금속 중심 사이의 교환 속도는 CDA 또는 CSA로서 화합물을 사용하는 것을 구별하기 위한 가장 중요한 결정 요인이다.일반적으로 CDA는 교환이 느린 반면, CSA는 교환이 빠르다.[13]CDA는 기판 및 보조 시약에 대한 공밸런트 본딩이 NMR 스펙트럼에 더 큰 차이를 만드는 순응 강성을 가진 종을 생성하기 때문에 절대 구성을 결정하기 위해 CSA보다 더 널리 사용된다.[14]CDA와 CSA를 함께 사용하면 흔히 있는 일은 아니지만, 키랄 인식을 개선할 수 있다.null
CDA 사용 시 주요 우려 사항
NMR 분광학에서 CDA를 사용할 때 고려해야 할 주요 관심사는 운동 분해능, 유도화 반응 중 경주화 및 시약이 100% 광학적 순도를 가져야 한다는 것이다.운동 분해능은 광학적 순도를 결정할 때 특히 중요하지만 CDA를 사용하여 광학적으로 순수한 기질의 절대적 구성을 할당하는 경우에는 다소 무시할 수 있다.[13]운동 분해능은 CDA를 초과하여 극복할 수 있다.[15]레이스메이징은 CDA나 기질에 발생할 수 있으며, 두 경우 모두 결과에 유의한 영향을 미칠 수 있다.null
NMR 분석 전략
NMR 분석의 두 가지 기본 방법은 단일화와 이중화다.이중 분해가 일반적으로 더 정확한 것으로 여겨지지만, 단일 분해가 보통은 시약을 덜 필요로 하기 때문에 비용 효율성이 더 높다.null
- 단분화 방법
- 상온에서 CDA로 기판 반응으로 형성된 제품의 NMR 스펙트럼은 다음 중 하나와 비교된다.[14]
- 낮은 온도에서 등록했을 때 동일한 파생 모델에 대한 스펙트럼
- 금속염으로 콤플렉스를 형성한 후 같은 파생물의 스펙트럼
- 유도화되지 않은 기질 스펙트럼
- 이중화 방법
- 기질의 에반토머는 CDA의 에반토머 2개로 유도되거나 기질의 에반토머 2개는 CDA의 에반토머 1개로 유도된다.두 경우에서 모두 두 개의 분진균이 형성되고 그 핵의 화학적 이동이 평가되어 기질의 구성을 할당한다.[15]
NMR 기법
Chiral 화합물을 구별할 때 사용되는 가장 일반적인 NMR 기법은 H-NMR, F-NMR, C-NMR. H-NMR이다. H-NMR은 절대 구성을 할당하는 데 사용되는 일차 기법이다.19F-NMR은 광학 순도 연구에 거의 독점적으로 적용되며, C-NMR은 비대칭 탄소 원자에 직접 접착되는 양성자가 없는 기판을 특징짓는 데 주로 사용된다.[14]null
참조
- ^ J. L. Mateos and D. J. Cram (1959). "Studies in Stereochemistry. XXXI. Conformation, Configuration and Physical Properties of Open-chain Diastereomers". J. Am. Chem. Soc. 81 (11): 2756–2762. doi:10.1021/ja01520a037.
- ^ J. A. Dale, D. L. Dull and H. S. Mosher (1969). "α-Methoxy-α-trifluoromethylphenylacetic acid, a versatile reagent for the determination of enantiomeric composition of alcohols and amines". J. Org. Chem. 34 (9): 2543–2549. doi:10.1021/jo01261a013.
- ^ Gawley, Robert E.; Aubé, Jeffrey (2012). Principles of Asymmetric Synthesis.
- ^ D. Parker (1991). "NMR determination of enantiomeric purity". Chem. Rev. 91 (7): 1441–1457. doi:10.1021/cr00007a009.
- ^ Stereochemistry and Chiral Derivatizing Agents (PDF)
- ^ New efficient derivatizing agent, alpha-cyano-alpha-fluoro(2-naphthyl)acetic acid (2-CFNA). application to the EE determination of (−)-3-acetoxy-2-fluoro-2-(hexadecyloxymethyl)propan-1-ol., Toyama, Japan: Toyama Medical & Pharmaceutical University, 2000[영구적 데드링크]
- ^ a b Pirkle, W. H.; J. R. Hauske (1977). "BROAD-SPECTRUM METHODS FOR RESOLUTION OF OPTICAL ISOMERS - DISCUSSION OF REASONS UNDERLYING CHROMATOGRAPHIC SEPARABILITY OF SOME DIASTEREOMERIC CARBAMATES". J. Org. Chem. 42 (11): 1839. doi:10.1021/jo00431a004.
- ^ Helmchen, G.; K. Sauber; R. Ott (1972). "DIRECT SEPARATION AND ABSOLUTE CONFIGURATION OF ENANTIOMERIC CARBOXYLIC-ACIDS AND AMINES". Tetrahedron Letters. 13 (37): 3873. doi:10.1016/s0040-4039(01)94184-x.
- ^ Helmchen, G.; G. Nill; D. Flockerzi; W. Schuhle; M.S.K. Youssef (1979). "DIRECTED RESOLUTION OF ENANTIOMERS VIA LIQUID-CHROMATOGRAPHY OF DIASTEREOMERIC DERIVATIVES". Angew. Chem. Int. Ed. Engl. 18 (1): 62. doi:10.1002/anie.197900651.
- ^ Pirkle, W. H.; J. R. Hauske (1977). "DESIGN OF CHIRAL DERIVATIZING AGENTS FOR CHROMATOGRAPHIC RESOLUTION OF OPTICAL ISOMERS - ASYMMETRIC SYNTHESIS OF SOME CHIRAL FLUOROALKYLATED AMINES". J. Org. Chem. 42 (14): 2436. doi:10.1021/jo00434a019.
- ^ Pirkle, W.H.; P.L. Rinaldi (1979). "SYNTHESIS AND ENANTIOMERIC PURITY DETERMINATION OF THE OPTICALLY-ACTIVE EPOXIDE DISPARLURE, SEX-PHEROMONE OF THE GYPSY-MOTH". J. Org. Chem. 44 (7): 1025. doi:10.1021/jo01321a001.
- ^ Blaschke, G. (1980). "CHROMATOGRAPHIC RESOLUTION OF RACEMATES". Angew. Chem. Int. Ed. Engl. 19 (1): 13. doi:10.1002/anie.198000131.
- ^ a b Wenzel, Thomas J. Discrimination of Chiral Compounds Using NMR Spectroscopy. John Wiley & Sons, Inc. pp. 1–7.
- ^ a b c J. M. Seco; E. Quiñoá; R. Riguera* (June 2012). "Assignment of the Absolute Configuration of Polyfunctional Compounds by NMR Using Chiral Derivatizing Agents". Chemical Reviews. 112: 4603–4641. doi:10.1021/cr2003344. PMID 22658125.
- ^ a b Katarzyna M. Błażewskaa; Tadeusz Gajda (July 2009). "Assignment of the absolute configuration of hydroxy- and aminophosphonates by NMR spectroscopy". Tetrahedron: Asymmetry. 20 (12): 1337–1361. doi:10.1016/j.tetasy.2009.05.021.