하조스-파리시-에더-사우어-위처트 반응
Hajos–Parrish–Eder–Sauer–Wiechert reaction유기화학에서의 하조스-파리쉬-에더-사우어-위처트 반응은 프롤라인 촉매 비대칭 알돌 반응이다.이 반응의 이름은 호프만-라 로슈와[1][2] 셰링 AG의 주요 조사원인 졸탄 하조스의 이름을 따서 지어졌다.[3]1970년대에 발견된 원래의 하조스-파리쉬 촉매변환술은 반응 방정식에 나타나 광학적으로 활성화된 자전거 케톨로 이어졌다. 이는 비대칭 조직분석의 길을 닦았다.Eder-Sauer-Wiechert 수정은 그림에 표시된 자전거 케톨의 수분 손실을 통해 광학적으로 활성화된 엔에디온으로 직접 이어진다.
그것은 스테로이드와 다른 반항생적으로 순수한 분자의 합성에서 도구로 광범위하게 사용되어 왔다.[4]
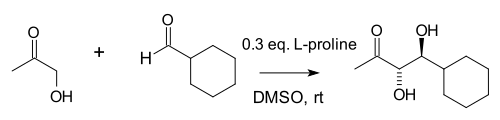
위의 그림에서 보이는 원래 반응에서 자연적으로 발생하는 치랄 프롤라인(chiral proline)은 알돌 반응의 치랄 촉매다.시작 재료는 아치랄 트리케톤이며 반응 제품을 얻으려면 3%의 프로라인만 필요하며 93%의 항항성 과잉 케톨이 필요하다.위에 나타낸 것처럼, Hajos와 Parrish는 (S)-(--)의 촉매량(3% molar ecif.)을 사용하여 주변 온도에서 dimethylformamide(DMF) 용매에서 광학적으로 활성화된 중간 자전거 케톨을 분리할 수 있도록 했다.따라서 그들은 촉매 비대칭 알돌 반응에서 프로라인의 첫 번째 사용을 설명했다.
역사
스테로이드 합성에서 중요한 매개체에 적용된 비대칭 에나민 촉매에 대한 연구는 1960년대에 효율적이고 편리한 스테로이드 총합성에 대한 관심이 높아졌기 때문이다.특히 1970년대 초의 두 산업집단은 친선분석적인 분자내 알돌반응을 보고하였다.
1971년, 에셔가 이끄는 스크링 그룹은 80 °C의 아세토나이트릴에서 (S)-프로라인(47 mol%), 1N 과염소산을 사용하여 비생물학적 조건에서 일했다.따라서 그들은 하조스-파리쉬 중간 자전거 케톨을 분리할 수 없었고 대신 물 손실을 통해 응축 제품 (S)-7a-메틸-2,3,7,7a-테트라하이드로-1H-1,5(6H)-디온을 분리할 수 없었다.[5]37년 후[6], 셰링 AG의 새로운 그룹이 초기의 셰링 작업의 계속을 발표했다.[3]앞서 언급한 비생물학적 조건 대신에 새로운 그룹은 하조스-파리쉬 촉매 절차를 사용했다.따라서 그들은 지금까지 하조스-파리쉬 출판물에만 기술된 6,5-바이시클릭 케톨을 분리할 수 있었다.[1][2]
1974년, 하조스와 패리쉬는 좋은 수율과 에노메릭 과잉의 자전거 케톨 중간체의 합성을 발표했다.[2]
그들은 위의 반응 체계에서 나타난 시스퓨즈-7a-메틸-6,5-바이사이클릭-케톨의 정확한 구성을 원형의 이분법에 의해 더 자세히 조사하였고, 이러한 결과는 단결정 X선 회절 연구로 확인되었다.무거운 원자 라벨이 없는 해당 레이싱 케톨의 중심대칭 결정체는 레이싱 프로라인을 사용하여 얻었다.그것은 X선 회절법으로 각메틸 그룹의 축방향과 6메모리 링의 의자 컨포머에 있는 히드록실 그룹의 적도방향으로 나타났다.이것은 디지탈oxigenin의 CD-링의 결정 구조와 잘 일치한다.[7]이 케톨과 에틸 호몰로뉴의 구조는 다음과 같다.
7a-에틸-호몰로그의 유사한 연구는 7a-에틸 그룹이 적도 방향이고 히드록실 그룹이 위와 같이 6-엠베드 링의 의자 형태에서 축 방향인 시스 순응에 에틸 자전거 케톨이 존재한다는 것을 보여주었다.이 순응을 선호하는 이유는 6개의 멤브레인 링에서 C-4와 C-6에서 각 에틸 그룹과 축 하이드로겐 사이의 다른 시스 컨포머에서 1,3-디아xial 교호작용을 향상시킬 수 있다.
분자간 버전
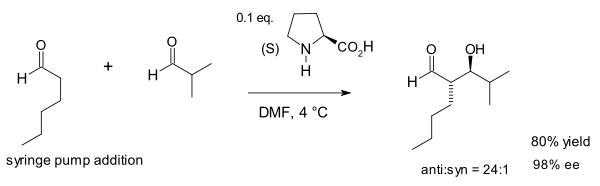
2000년 연구에서 바바스 그룹은 분자간 알돌(케톤과 알데히드 사이의 알돌) 첨가도 상당히 더 많은 프로라인을 사용하더라도 가능하다는 것을 발견했다.[8]
저자들은 자신들이 만든[9] 알돌라아제 항체와 천연알돌라아제 효소 알돌라아제 A가 모두 에나민 중간물질을 통해 작용하는 프롤라인의 유사성에 주목했다.이 반응에서 아세톤(두 반응제 중 하나)의 큰 농도는 다양한 가능한 부작용을 억제한다. 옥사졸리디논에 대한 프로라인과 아조메틴 이라이드에 대한 알데히드의 반응이다.
노츠와 리스트는 계속해서 1,2-다이올 합성에 대한 이 반응의 효용을 확장했다.[10]
In their full account of their 2000 Communication, the group revealed that proline together with the thiazolium salt 5,5-dimethyl thiazolidinium-4-carboxylate were found to be the most effective catalysts among a large group of amines, while catalysis with (S)-1-(2-pyrrolidinylmethyl)-pyrrolidine salts formed the basis for the development of diamin광범위한 다양성 또는 유기농 반응에 효과가 입증된 전자 유기 촉매.[11]
위엘란드-미셰르 케톤(1985)의 비대칭 합성은 2000년 바르바스 그룹이 탐구한 프롤라인에 기반한 또 다른 근육내 반응이다.[12]이 연구에서 바바스 그룹은 프로라인이 이미늄-에나민 촉매제를 결합하여 폭포성 미카엘알돌 반응을 촉진시킬 수 있다는 것을 처음으로 증명했다.이 연구는 30년의 역사와 산업에서의 하조스-파리시 반응의 적용에도 불구하고, 이 반응에 대한 트리케톤 기질은 항상 이산 독립 단계로 합성되어 이 반응의 화학적 메커니즘에 대한 근본적인 이해가 부족함을 증명해 주었기 때문에 중요한 의미를 갖는다.바바스 그룹은 1997년 연구에서 알돌라아제 항체가 이미늄-에나민 로빈슨 항체를 촉매작용을 했다고 발표했는데, 이 연구는 현재 장기투석이라고 불리는 분야에서 연구의 시작을 알렸다.[13]2002년에 발간된 보고서에서 카를로스 F. 바르바스 3세는 "1970년대에 합성 유기화학자 졸탄 G의 프로라인 분석 분자 내 알돌 첨가 반응에 대해 연구했다.뉴욕주 뉴틀리 호프만-라로슈 화학연구부의 하조스와 데이비드 R. 패리쉬는 우리에게 작은 분자 촉매와 효소 사이의 유사점을 좀 더 자세히 살펴보도록 영감을 주었다."[14]
2002년 맥밀란 그룹은 서로 다른 알데히드들 사이의 알돌 반응을 촉진시킨 최초의 촉매제였다.[15]일반적으로 알데히드는 자가 응결되기 때문에 이러한 반응은 이례적이다.
유기농 분자간 알돌반응은 현재 바바스-리스트 알돌반응으로 알려져 있다.[16]
반응 메커니즘
트라이케톤 반응을 위한 몇 가지 반응 메커니즘이 수년간 제안되어 왔다.하조스와 패리쉬는 그들의 논문에서 에나민 [2] 메커니즘을 제안했다.그러나, 라벨이 부착된 물의 계량계 양(HO218)에 대한 그들의 실험은 카르비놀라민 메커니즘을 지지했다.따라서 하조스는 헤미아미날 중간인 (1974)을 내세웠다.[2]아가미 메커니즘(1984)은 전환 상태에 관여하는 두 개의 프로라인 유닛을 가진 에나민 중간을 가지고 있으며(실험 반응 운동학에 기초함)[17] Houk(2001)[18][19]의 메커니즘에 따르면 단일 프로라인 유닛은 순환 전환 상태를 가지고 있고 수소 결합에 관여하는 프로라인 카복실 그룹과 함께 질식한다.
1974년 하조스가 내놓은 헤미아미날(카르비놀라민)은 tautomeric iminium hydroxide medium으로 바뀔 수 있다.사이드 체인인 메틸케톤을 에놀라게 하는 이미늄 수산화이온은 (S)-(---프롤라인)의 촉매 양에 영향을 받아 위에 표시된 광학 활성 자전거 케톨 제품(그림 1 참조)으로 링 클로징이 뒤따를 것이다.펑신 저우, 롱 장, 산중 루오, 진페이 쳉은 단순한 치랄 1차 아민(t-Bu-CH2)-CH-NET를22 이용해 우수한 성적을 얻었다.비엘란드-미셰르 케톤과 하지스-파리시 케톤과 이들의 유사성을 모두 합성하기 위한 TfOH.[20]이것은 카보닐 화합물을 가진 에나민이 아닌 1차 아민이 이미인을 형성하는 것이 교과서 화학이기 때문에 이미늄 메커니즘을 지지한다.
1974년 하조스 카르비놀라민 메커니즘은 마이클 림바흐의 보다 최근의 논문에서 자신도 모르게 지지를 받고 있다.[21]The triketone starting material 2- methyl-2-(3-oxobutyl)-1,3-cyclopentanedione gave the expected optically active bicyclic ketol (+)-(3aS,7aS)-3a,4,7,7a-tetrahydro-3a-hydroxy-7a-methyl-1,5(6H)-indanedione with (S)-(−)-proline catalyst.반면 (S)-β-호모프로라인, [(피롤리딘-(2S)-yl) 아세트산]과 같은 호몰로뉴 아미노산 촉매를 사용하면 최대 83%의 선택성으로 입체화학 결과물이 역전된다.가상 변칙은 위의 반사 대칭의 트라이케톤 시작 물질에 대한 부피가 큰 베타 아미노산의 상부 측면 접근법으로 설명할 수 있다.The top side approach results in the formation of an enantiotopic carbinolamine to give the (−)-(3aR,7aR)-3a,4,7,7a-tetrahydro-3a-hydroxy-7a-methyl-1,5(6H)-indanedione bicyclic ketol enantiomer identical to the one obtained with unnatural (R)-(+)-proline.반면에 2010년[22] 리스트는 1965년 스펜서가 아민 강직성 알돌 반응에 대한 이전의 작업에 비추어 볼 때, 하조스가 에나민 메커니즘을 거부한 것에 대해 당혹스럽고 놀랐다.[23]에더, 사우어, 위처트가 반응 메커니즘을 설명하려고 시도하지 않은 것은 흥미롭고 놀라운 일이다. [3]
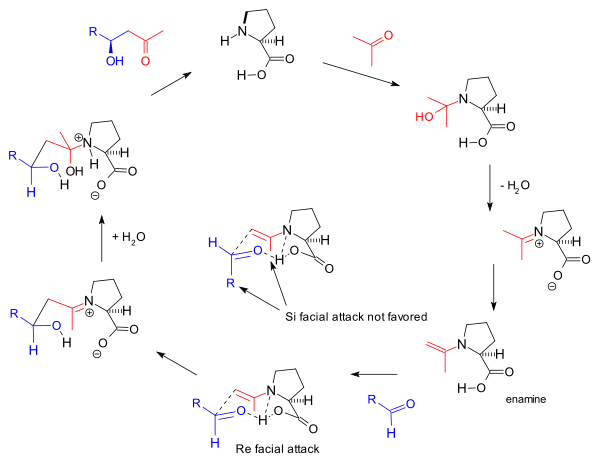
분자간 반응을[8] 위해 2000년에 Barbas 그룹이 제안한 반응 메커니즘은 Re-face 접근방식을 선호하는 Zimmerman-Taxler 모델에 기초한 에나민 형성과 관측된 입체감에 기초한다.이는 바르바스가 1995년 이 그룹이 보고한 알돌라아제 항체에 대해 제안한 것과 동일한 메커니즘이다.
이 에나민 메커니즘은 원래의 하조-파리쉬 트리케톤 반응을 일으키기도 하지만 아가미가[17] 제안한 것처럼 그 안에 있는 두 개의 프로라인 분자의 관여는 비선형 효과의[11] 결여에 근거하여 바르바스에 의해 논란이 되고 있으며, 반응 운동학에 근거한 List의 후기 연구에 의해 뒷받침된다.[24]일반 메커니즘은 라벨이 부착된 물(HO218)에서 수행되는 반응에서 산소 동위원소가 반응 제품 안으로 들어가는 것을 발견함으로써 List에 의해 더욱 뒷받침된다.[25]하조스와 패리쉬 실험은 표식수(HO218)의 스토오치메트릭 양으로 카르비놀라민 메커니즘을 지지했다.[2]
같은 연구에서 (DMSO에서) 옥사졸리디논에 대한 아세톤에 대한 프로라인의 반응을 조사했다.
이 반응에 대한 평형 상수는 0.12에 불과하며 옥사졸리디논의 관여는 기생에 불과하다고 결론을 내린다.
2004년 블랙몬드는 또한 니트로소벤젠과 프로판aline의 관련 proline-catalysed α-aminooxylation에서 옥사졸리디논을 중간자(NMR)로 발견했다.[26]
싱가포르 고성능 컴퓨팅 연구소의 Chiong Teck Wong은 키랄 프롤리놀 실릴 에테르 촉매를 사용한 부탄올과 니트로소벤젠의 유사한 옥시아민화 반응을 연구했다.[27]그의 연구는 촉매가 에놀을 생성하고, 에놀 촉매 콤플렉스를 형성한다는 것을 강하게 시사한다.니토소벤젠은 이후 에놀 촉매 콤플렉스와 반응하여 폴링의 전기성 차트와 일치하여 (S)-N-니트로소 알돌 제품을 공급한다.1차성형 알돌제품의 나트륨보루화 환원효과는 아래N 제도에서 보듯이 해당 알코올의 수확량이 양호하고 항균성이O 우수했다.Wong은 (S)-Cattle의 반응 메커니즘이 N-니트로소 알돌 반응과 니트로소벤젠과 부탄올 반응은 에나민 중간을 통해서가 아니라 에놀 중간을 통해 진행된다고 제안한다.
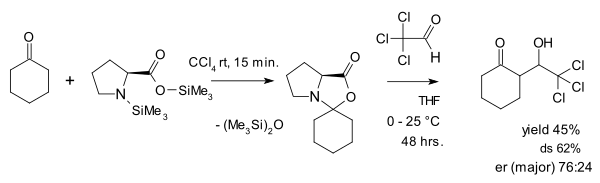
옥사졸리디논을 기생종으로 보는 견해는 시바흐와 에스첸모저에 의해 논쟁되고 있는데, 2007년에 그들은 옥사졸리디논이 사실상 프로라인 카탈루션에 중추적인 역할을 한다고 주장하는 기사를[28] 발표하였다.그들이 한 일 중 하나는 옥사졸리디논과 활성 알데히드 클로로알을 알돌에 첨가한 반응이었다.
2008년, Barbas는 에세이에서 왜 Hajos와 Parrish가 개척한 지 30년이 지난 것처럼 보이는 이 단순한 반응에 대한 관심이 재생되기 전까지 2000년까지 걸렸는지 그리고 왜 그렇게 오랫동안 프로라인 카탈루션 메커니즘이 수수께끼처럼 보였는지 그 이유를 다루었다.[29]한 가지 설명은 다른 과학 문화와 관련이 있다: 생화학자에[30] 의해 1964년에 이미 상정된 알돌라아제 촉매제의 맥락에서 프로라인 메커니즘은 유기 화학자들에 의해 무시되었다.그 설명의 또 다른 부분은 오랫동안 화학적 사고를 지배했던 알돌라아제 촉매제의 추정 복잡성이었다.마침내 1970년 11월 ZGH가 사임한 후 호프만-라로슈에서 이 분야에 대한 연구는 확대되지 않았다.
반응 이름의 기원
이 반응의 이름은 발전하는데 시간이 좀 걸렸다.1985년 아가미 교수와 동료들은 프로라인이 촉매작용을 한 로빈슨의 이름을 하조스-파리시 반응으로 지은 첫 번째 사람이었다.[31]1986년 앙리 B 교수.카간과 아가미[32] 교수는 여전히 이 논문의 '추상'에서 '하조스-파리시 반응'이라고 불렀다.2001년에 Kagan은 "비대칭 촉매에서의 비선형 효과:Synlett의 개인 계정".[33]이 논문에서 그는 새로운 제목인 하조스-파리시-위처트 반응을 소개했다.2002년에 벤자민 리스트는 두 개의 이름을 더 추가했고 하조스-파리쉬-에더-사우어-위처트 반응이라는 용어를 도입했다.[34]2008년까지 장기투석 분야에서 발표된 과학 논문은 1985년, 2001년 또는 2002년 반응의 이름을 사용한다.2014년 6월 Google Scholar가 2009-2014년으로 제한한 검색에서는 Hajos-Parrish 리액션 44회, Hajos-Parrish-Wiechert 리액션 3회, Hajos-Parish-Eder-Sauer-Wiechert 리액션 184회를 반환했다.그러나 '하조스-파리시 케톤'(등 비슷한 것)이라는 용어는 여전히 흔하다.
참조
- ^ a b Z. G. Hajos, D. R. Parrish, 독일 특허 DE 2102623 1971
- ^ a b c Hajos, Zoltan G.; Parrish, D. R. (1974). "Asymmetric synthesis of bicyclic intermediates of natural product chemistry". The Journal of Organic Chemistry. 39 (12): 1615–1621. doi:10.1021/jo00925a003.
- ^ a b Eder, Ulrich (1971). "New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures". Angewandte Chemie International Edition in English. 10 (7): 496–497. doi:10.1002/anie.197104961.
- ^ Wang, Zerong (15 September 2010). Comprehensive Organic Name Reactions and Reagents. Hoboken, NJ, USA: John Wiley & Sons, Inc. p. 1306. doi:10.1002/9780470638859. ISBN 978-0-470-63885-9.
- ^ List, Benjamin (2002). "Proline-catalyzed asymmetric reactions". Tetrahedron. 58 (28): 5573–5590. doi:10.1016/S0040-4020(02)00516-1.
- ^ Kennedy, Jason W. J.; Vietrich, Sophia; Weinmann, Hilmar; Brittain, Dominic E. A. (2008). "Synthesis of 7a-Substituted Hajos−Wiechert Ketone Analogues". The Journal of Organic Chemistry. 73 (13): 5151–5154. doi:10.1021/jo800638s. PMID 18540678.
- ^ 디지탈oxigenin, I.L. Karle과 Acta Crystalogr, J. Karle의 결정 구조. B, 25: 434–442(1969년).
- ^ a b List, Benjamin; Lerner, Richard A.; Barbas, Carlos F. (26 February 2000). "Proline-Catalyzed Direct Asymmetric Aldol Reactions". Journal of the American Chemical Society. American Chemical Society (ACS). 122 (10): 2395–2396. doi:10.1021/ja994280y. ISSN 0002-7863.
- ^ Wagner, J; Lerner, RA; Barbas, CF (December 1995). "Efficient aldolase catalytic antibodies that use the enamine mechanism of natural enzymes". Science. 270 (5243): 1797–800. Bibcode:1995Sci...270.1797W. doi:10.1126/science.270.5243.1797. PMID 8525368. S2CID 12714361.
- ^ Notz, Wolfgang; List, Benjamin (14 July 2000). "Catalytic Asymmetric Synthesis of anti-1,2-Diols". Journal of the American Chemical Society. American Chemical Society (ACS). 122 (30): 7386–7387. doi:10.1021/ja001460v. ISSN 0002-7863.
- ^ a b Sakthivel, Kandasamy (2001). "Amino Acid Catalyzed Direct Asymmetric Aldol Reactions: A Bioorganic Approach to Catalytic Asymmetric Carbon−Carbon Bond-Forming Reactions". Journal of the American Chemical Society. 123 (22): 5260–5267. doi:10.1021/ja010037z. PMID 11457388.
- ^ Bui, Tommy (2000). "A proline-catalyzed asymmetric Robinson annulation reaction". Tetrahedron Letters. 41 (36): 6951–6954. doi:10.1016/S0040-4039(00)01180-1.
- ^ Zhong, Guofu (1997). "Antibody-Catalyzed Enantioselective Robinson Annulation". Journal of the American Chemical Society. 119 (34): 8131–8132. doi:10.1021/ja970944x.
- ^ 과학기술, 2002년 2월, 제80권, 제8권, CENAR 80 08 페이지 33 ISSN 0009-2347
- ^ Northrup, Alan B. (2002). "The First Direct and Enantioselective Cross-Aldol Reaction of Aldehydes". Journal of the American Chemical Society. 124 (24): 6798–6799. doi:10.1021/ja0262378. PMID 12059180.
- ^ Ramachary, Dhevalapally B. (2009). "Direct Catalytic Asymmetric Synthesis of Highly Functionalized 2-Methylchroman-2,4-diols via Barbas-List Aldol Reaction". Chemistry - A European Journal. 15 (18): 4516–4522. doi:10.1002/chem.200900066. PMID 19308984.
- ^ a b Agami, Claude (1984). "Stereochemistry-59". Tetrahedron. 40 (6): 1031–1038. doi:10.1016/S0040-4020(01)91242-6.
- ^ Bahmanyar, S. (2001). "The Origin of Stereoselectivity in Proline-Catalyzed Intramolecular Aldol Reactions". Journal of the American Chemical Society. 123 (51): 12911–12912. doi:10.1021/ja011714s. PMID 11749554.
- ^ Bahmanyar, S. (2001). "Transition States of Amine-Catalyzed Aldol Reactions Involving Enamine Intermediates: Theoretical Studies of Mechanism, Reactivity, and Stereoselectivity". Journal of the American Chemical Society. 123 (45): 11273–11283. doi:10.1021/ja011403h. PMID 11697970.
- ^ Zhou, Pengxin; Zhang, Long; Luo, Sanzhong; Cheng, Jin-Pei (14 February 2012). "Asymmetric Synthesis of Wieland–Miescher and Hajos–Parrish Ketones Catalyzed by an Amino-Acid-Derived Chiral Primary Amine". The Journal of Organic Chemistry. American Chemical Society (ACS). 77 (5): 2526–2530. doi:10.1021/jo202433v. ISSN 0022-3263. PMID 22316216.
- ^ β-호모아미노산은 Michael Limbach, Tetrahedron Letters 47 (2006) 3843–3847에 의한 항항체 내 및 분자간 알돌 반응에 대한 촉매제로서.
- ^ List, B. (2010). "Emil Knoevenagel and the Roots of Aminocatalysis". Angewandte Chemie International Edition in English. 49 (10): 1730–1734. doi:10.1002/anie.200906900. PMID 20175175.
- ^ Spencer, T. (1965). "Observations on amine catalysis of formation and dehydration of ketols". Tetrahedron Letters. 6 (43): 3889–3897. doi:10.1016/S0040-4039(01)89143-7. PMID 5842468.
- ^ Hoang, Linh (2003). "Kinetic and Stereochemical Evidence for the Involvement of Only One Proline Molecule in the Transition States of Proline-Catalyzed Intra- and Intermolecular Aldol Reactions". Journal of the American Chemical Society. 125 (1): 16–17. doi:10.1021/ja028634o. PMID 12515489.
- ^ List, B. (2004). "Asymmetric Catalysis Special Feature Part II: New mechanistic studies on the proline-catalyzed aldol reaction". Proceedings of the National Academy of Sciences. 101 (16): 5839–5842. Bibcode:2004PNAS..101.5839L. doi:10.1073/pnas.0307979101. PMC 395996. PMID 15073330.
- ^ Iwamura, Hiroshi (2004). "Probing the Active Catalyst in Product-Accelerated Proline-Mediated Reactions". Journal of the American Chemical Society. 126 (50): 16312–16313. doi:10.1021/ja0444177. PMID 15600319.
- ^ 알파-알파-디페닐프로리놀 트리메틸릴 에테르 촉매 옥시암화 반응, 치옹 테트라헤드론 문자 50 (2009) 811–813의 메커니즘에 대한 이론적 조사.
- ^ 옥사졸리디논은 프로라인 카탈루션에서 정말 비생산적이고 기생적인 종일까? – 대안적 견해 헬베티카 치미카 액타 90권, 이슈 3, 날짜: 2007년 3월, 페이지: 425–471 디터 시바흐, 알버트 K.벡, D.마이클 바딘, 마이클 림바흐, 알버트 에스첸모저, 아디 M.프레셔왈라, 라인하르트 호비, 월터 프리코쇼비치, 베르나르 린더 도이:10.1002/hlca.200790050
- ^ 유기투석 상실: 현대 화학, 고대 화학, 그리고 보이지 않는 생합성 기구 카를로스 F. 바르바스 3세 안젤로 화학. 인트. 2008, 47, 42–47 doi:10.1002/anie.20002210 개정
- ^ Rutter, W. J. (1964). "Evolution of Aldolase". Fed. Proc. 23: 1248–57. PMID 14236133.
- ^ Agami, Claude (1985). "A new diagnostic tool for elucidating the mechanism of enantioselective reactions. Application to the Hajos–Parrish reaction". J. Chem. Soc., Chem. Commun. (8): 441–442. doi:10.1039/c39850000441.
- ^ Gilman, Henry; Jones, R. G. (1940). "Triphenylindium1". Journal of the American Chemical Society. 62 (9): 2353–2357. doi:10.1021/ja01866a025.
- ^ Synlett 2001, No. SI, 888–899
- ^ List, Benjamin (2002). "Proline-catalyzed asymmetric reactions". Tetrahedron. 58 (28): 5573–5590. doi:10.1016/s0040-4020(02)00516-1.