고성능 액체 크로마토그래피
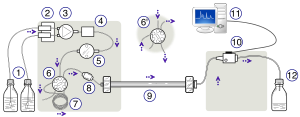
High-performance liquid chromatography HPLC 설정; 왼쪽에서 오른쪽으로 두 용제의 경사를 생성하는 펌핑 장치 - 강철로 보강된 기둥과 흡광도 측정을 위한 검출기. | |
| 약어 | HPLC |
|---|---|
| 분류 | 크로마토그래피 |
| 분석 물질 | 유기 분자 생체 분자 이온 중합체 |
| 기타 기법 | |
| 관련 | 크로마토그래피 수성 정상 위상 크로마토그래피 친수성 상호작용 크로마토그래피 이온교환크로마토그래피 크기 제외 크로마토그래피 마이크로텔라 액체 크로마토그래피 |
| 하이픈으로 연결됨 | 액체 크로마토그래피-질량분석법 |
고성능 액체 크로마토그래피(HPLC)는 이전에 고압 액체 크로마토그래피(High-performance lich chromatography, HPLC)로 불리며, 혼합물의 각 성분을 분리, 식별, 정량화하는 데 사용되는 분석 화학 기법이다. 그것은 고체 흡착 물질로 채워진 기둥을 통해 샘플 혼합물이 들어 있는 가압 액체 용제를 통과시키기 위해 펌프에 의존한다. 표본의 각 성분은 흡착 물질과 약간 다르게 상호작용하여 서로 다른 성분에 대해 다른 유속을 유발하고 성분의 분리를 유도한다.
HPLC는 제조(예: 제약 및 생물학적 제품의 생산 과정 중), 법적(예: 소변 내 성능 향상 약품 탐지), 연구(예: 복잡한 생물학적 샘플 또는 유사한 합성 화학물질의 성분 분리), 의료(예: 비타민 D 레브 검출)에 사용되어 왔다.혈청(혈청)의 Els) 목적.[1]
크로마토그래피는 흡착을 수반하는 대량 이전 과정으로 설명할 수 있다. HPLC는 가압된 액체와 표본 혼합물을 흡착제로 채워진 기둥을 통해 통과시키기 위해 펌프에 의존하여 표본 구성요소의 분리를 유도한다. 기둥의 활성 성분인 흡착제는 일반적으로 고체 입자(예를 들어 실리카, 폴리머 등), 2~50μm 크기로 만들어진 미세한 물질이다. 표본 혼합물의 성분은 흡착제 입자와의 상호작용 정도가 다르기 때문에 서로 분리된다. 가압 액체는 일반적으로 용제(예: 물, 아세토나이트릴 및/또는 메탄올)의 혼합물이며 "이동상"이라고 한다. 그것의 성분과 온도는 샘플 성분과 흡착제 사이에 발생하는 상호작용에 영향을 미침으로써 분리 과정에서 주요한 역할을 한다. 이러한 상호작용은 자연에서 물리적인데, 예를 들어 소수성(분열성), 쌍극-디폴(dipole-dipole), 이오닉(ionic)과 같은 것이 대부분이다.
HPLC는 운용 압력이 현저하게 더 높기 때문에 전통적인 ("저압") 액체 크로마토그래피와 구별되는 반면, 일반적인 액체 크로마토그래피는 일반적으로 이동 단계를 칼럼을 통과하기 위해 중력에 의존한다. 분석 HPLC로 분리된 작은 표본 양 때문에, 일반적인 기둥 치수는 직경 2.1–4.6 mm, 길이 30–250 mm이다. 또한 HPLC 기둥은 더 작은 흡착 입자(평균 입자 크기에서 2–50 μm)로 만들어진다. 이를 통해 혼합물을 분리할 때 HPLC가 우수한 분해력(화합물을 구별할 수 있는 능력)을 얻을 수 있어 대중적인 크로마토그래피 기법이 되고 있다.
HPLC 기기의 개략도는 일반적으로 디가서, 샘플러, 펌프 및 검출기를 포함한다. 샘플러는 샘플 혼합물을 이동 위상 스트림으로 가져와 칼럼으로 운반한다. 펌프는 칼럼을 통해 이동 단계의 원하는 흐름과 구성을 전달한다. 검출기는 컬럼에서 발생하는 샘플 구성 요소의 양에 비례하는 신호를 생성하므로 샘플 구성 요소의 정량적 분석이 가능하다. 디지털 마이크로프로세서와 사용자 소프트웨어는 HPLC 계측기를 제어하고 데이터 분석을 제공한다. HPLC 계측기의 일부 기계식 펌프 모델은 시간 변화에 따라 여러 용매를 혼합하여 이동 단계에서 조합 구배를 발생시킬 수 있다. UV/Vis, PDA(광다이오드 어레이) 등 다양한 검출기가 공통적으로 사용되거나 질량 분광법에 기반한다. 대부분의 HPLC 기기에는 분리 작업이 수행되는 온도를 조절할 수 있는 컬럼 오븐도 있다.
작전
분리 및 분석할 샘플 혼합물은 별도의 작은 볼륨(일반적으로 마이크로리터)에서 기둥을 통해 스며드는 이동 단계의 흐름에 도입된다. 표본의 성분은 흡착제와의 특정 물리적 상호작용의 함수인 서로 다른 속도로 기둥을 통해 이동한다(정지 단계라고도 함). 각 성분의 속도는 화학적 특성, 정지 단계(기둥)의 특성 및 이동 단계의 구성에 따라 달라진다. 특정 분석 물질이 용출되는 시간(기둥에서 나오는 시간)을 그 보존 시간이라고 한다. 특정 조건에서 측정한 잔류 시간은 주어진 분석 물질의 식별 특성이다.
입자 크기, 다공성 및 표면 화학에 따라 다양한 흡착제로 채워지는 다양한 유형의 컬럼을 사용할 수 있다. 작은 입자 크기 포장 재료를 사용하기 위해서는 더 높은 작동 압력("백압")을 사용해야 하며 일반적으로 크로마토그래픽 분해능(기둥에서 나오는 연속 분석물질 사이의 피크 분리 정도)을 개선한다. 흡착제 입자는 자연에서 소수성 또는 극성을 가질 수 있다.
사용되는 일반적인 이동 단계에는 다양한 유기 용매(가장 일반적인 것은 아세토나이트릴과 메탄올)와 물의 잘못된 조합이 포함된다. 일부 HPLC 기법은 무수 이동 단계를 사용한다(아래 정상 위상 크로마토그래피 참조). 이동 단계의 수용성 성분은 샘플 성분의 분리를 돕기 위해 산(형식, 인산 또는 삼불화탄산 등) 또는 염분을 포함할 수 있다. 이동 단계의 구성은 크로마토그래픽 분석 중에 일정하게 유지될 수 있다("이소크라틱 용출 모드") 또는 변화("진도 용출 모드"). 이소크라테스 용출은 일반적으로 정지 단계에 대한 친화력이 매우 다른 표본 구성요소의 분리에 효과적이다. 구배 용출에서 이동 단계의 구성은 일반적으로 낮은 용출 강도에서 높은 용출 강도로 변화한다. 모바일 단계의 용출강도는 용출강도가 높은 분석물질 보유시간(=유속시간이 짧음)에 의해 반영된다. 역상 크로마토그래피에서 일반적인 그라데이션 프로필은 5% 아세토나이트릴(수중 또는 수용성 버퍼)에서 시작하여 5~25분 동안 95% 아세토나이트릴로 선형적으로 진행될 수 있다. 일정한 이동 위상 구성 기간은 모든 구배 프로파일의 일부가 될 수 있다. 예를 들어 이동 위상 구성은 1~3분 동안 5% 아세토나이트릴로 일정하게 유지한 후 95% 아세토나이트릴까지의 선형 변화가 뒤따를 수 있다.
이동 단계의 선택된 구성은 다양한 샘플 구성 요소("분석")와 정지 단계(예: 역상 HPLC에서의 소수성 상호작용) 사이의 상호작용 강도에 따라 달라진다. 고정 및 이동 단계에 대한 선호도에 따라 분리 프로세스 중에 두 단계 사이의 분석 분할이 열에서 이루어진다. 이 분할 과정은 액체-액체 추출 과정에서 발생하는 것과 유사하지만 단계별이 아니라 연속적이다. 이 예에서 물/아세토나이트릴 경사를 사용하면 이동 단계가 아세토나이트릴(즉, 용출 강도가 더 높은 이동 단계)에 집중되면 더 많은 소수성 구성 요소가 늦게 용출될 것이다.
이동식 위상 성분, 첨가제(염류 또는 산과 같은) 및 구배 조건의 선택은 칼럼 및 샘플 구성 요소의 특성에 따라 달라진다. 적절한 분리를 제공하는 HPLC 방법을 찾기 위해 샘플로 일련의 시험 실행을 수행하는 경우가 많다.
역사와 발전
HPLC 이전에 과학자들은 표준 액체 크로마토그래피 기술을 사용했다. 액체 크로마토그래프 시스템은 용제의 유량이 중력에 의존하기 때문에 비효율적인 것이 대부분이었다. 분리 작업은 여러 시간, 때로는 며칠이 걸렸다. 당시 가스 크로마토그래피(GC)는 액화 크로마토그래피(LC)보다 강력했지만, 극지방 고분자 생물다중화체의 가스상 분리 및 분석은 불가능하다고 판단되었다.[3] GC는 용액의 열적 불안정성 때문에 많은 생화학자들에게 효과가 없었다.[4] 그 결과, HPLC의 개발로 귀결될 수 있는 대체 방법이 가설되었다.
1941년 마틴과 싱게의 정석 작업에 이어 1960년대 칼 기딩스, 요제프 휴버 등에 의해 패킹-입자 지름을 일반 LC(및 GC) 수준인 150μm 이하로 현저히 낮추고 이동 위상 속도를 높이기 위해 압력을 사용함으로써 LC를 고효율 모드로 운영할 수 있을 것으로 예측되었다.[3] 이러한 예측은 60년대부터 70년대까지 광범위한 실험과 정교함을 거쳤다. 초기 개발 연구는 LC 입자를 개선하기 시작했고, 표면상 다공성 입자인 지팍스의 발명은 HPLC 기술에 유망했다.[5]
1970년대는 하드웨어와 계측기에 많은 발전을 가져왔다. 연구원들은 HPLC 시스템의 초보적인 설계를 하기 위해 펌프와 인젝터를 사용하기 시작했다.[6] 가스 앰프 펌프는 일정한 압력으로 작동하며 일정한 흐름과 정량화를 위해 누출 없는 씰이나 체크 밸브가 필요하지 않았기 때문에 이상적이었다.[4] 하드웨어 이정표는 Dupont IPD(Industrial Polymers Division)에서 제작되었으며, 저드웰-볼륨 구배 장치가 활용되고 있으며, 중격 인젝터를 루프 분사 밸브로 교체하는 등의 작업이 이루어졌다.[4]
계측적 발전도 중요했지만, HPLC의 역사는 주로 입자 기술의 역사와 진화에 관한 것이다.[4] 다공성 입자 도입 이후 효율을 높이기 위해 입자 크기를 줄이는 추세도 꾸준히 나타나고 있다.[4] 그러나 입자 크기를 줄임으로써 새로운 문제가 발생하였다. 실제적인 단점은 칼럼을 통해 이동 유체를 강제로 통과시키기 위해 필요한 과도한 압력 강하와 극도로 미세한 재료의 균일한 패킹을 준비하기 어렵다는 데서 기인한다.[7] 입자 크기가 현저히 감소할 때마다 통상 압력을 처리하기 위해 또 다른 계기 개발이 일어나야 한다.[4]
종류들
칸막이 크로마토그래피

칸막이 크로마토그래피는 화학자들이 개발한 최초의 크로마토그래피 종류 중 하나이다.[8] 분할계수 원리는 종이 크로마토그래피, 박층 크로마토그래피, 가스상 및 액체-액체 분리 어플리케이션에 적용되었다. 1952년 노벨 화학상은 아미노산 분리에 사용된 이 기술을 개발한 공로로 아처 존 포터 마틴과 리처드 로런스 밀링턴 싱에 의해 획득되었다.[9] 칸막이 크로마토그래피는 종이 크로마토그래피와 같이 "내부" 고체 지지 매트릭스의 곡물이나 섬유 내에 보존 용제를 사용하거나 정지 단계와 일부 쿨롱 및/또는 수소 기증자의 상호작용을 이용한다. 액체 정지 위상과 용출액 사이의 분자 분할 분석. 친수 상호작용 크로마토그래피(HILIC; HPLC 내 하위 기술)에서와 마찬가지로 이 방법은 극성의 차이를 바탕으로 분석물질을 분리한다. HILIC는 주로 물과 함께 아세토나이트릴로 만들어진 결합 극 정지 위상과 이동 위상을 가장 많이 사용한다. 파티션 HPLC는 역사적으로 결합되지 않은 실리카 또는 알루미나 지지대에 사용되어 왔다. 각각은 상대 극성차에 의해 분석물질을 분리하는 데 효과적이다. HILIC 접합 페이즈는 단일 크로마토그래픽 실행에서 산성 용액, 기본 용액 및 중성 용액을 분리할 수 있는 장점이 있다.[10]
극성 분석 물질은 극성 정지 위상과 관련된 정지 물층으로 확산되어, 따라서 유지된다. 극성 분석 물질과 극성 정지 단계(이동 단계와 상대적) 사이의 상호작용이 강할수록 용출 시간은 길어진다. 상호작용 강도는 더 많은 편광 그룹(예: 히드록실-)과 수소 결합이 가능한 그룹이 더 많은 분석 물질 분자 구조의 기능 그룹에 따라 달라진다. 쿨롱브(정전기) 상호작용도 보존을 증가시킬 수 있다. 이동 단계에서 더 많은 극성 용제를 사용하면 분석 물질의 보존 시간이 감소하는 반면, 소수성 용제는 보존 시간을 증가시키는 경향이 있다.
정상 위상 크로마토그래피
정상 위상 크로마토그래피는 화학자들이 최초로 개발한 HPLC의 종류 중 하나이다. 정상 위상 HPLC(Normal-phase HPLC)라고도 하는 이 방법은 실리카와 같은 극 정지 표면에 대한 친화력에 기초하여 분석 물질을 분리하므로 흡착제 표면과의 극 상호작용(수소-본딩 또는 쌍극-디폴 유형의 상호작용)을 수행하는 분석 물질 능력에 기초한다. NP-HPLC는 비극성 비극성 이동 단계(예: 클로로포름)를 사용하며, 비극성 용매에 쉽게 용해되는 분석물질을 분리하는 데 효과적이다. 분석 물질은 극 정지 단계와 관련되고 유지된다. 흡착 강도는 분석 물질 극성 증가와 함께 증가한다. 상호작용 강도는 분석 물질 분자의 구조에 존재하는 기능 그룹뿐만 아니라 강체 인자에 따라 달라진다. 교호작용 강도에 미치는 강도의 강인 방해물의 영향으로 이 방법은 구조 등가물을 분해(분리)할 수 있다.
이동 단계에서 더 많은 극성 용제를 사용하면 분석 물질의 보존 시간이 감소하는 반면, 소수성 용제는 더 느린 용출(보유 시간 증가)을 유발하는 경향이 있다. 이동 단계에서 물의 흔적과 같은 극성 용제는 고정된 결합(물) 층을 형성하는 정지 단계의 단단한 표면에 흡착하는 경향이 있으며, 고정된 결합(물) 층은 유지에 적극적인 역할을 하는 것으로 간주된다. 이 동작은 흡착 메커니즘에 의해 거의 독점적으로 관리되기 때문에 정상 위상 크로마토그래피에 다소 특이하다(즉, 분석 물질은 흡착 표면에 부착된 리간드의 용해층보다는 고체 표면과 상호작용한다. 아래 역상 HPLC도 참조). 흡착 크로마토그래피는 활성(건조) 규소 또는 알루미나 지지대의 기둥과 박층 크로마토그래피 형식 모두에서 구조적인 이성질체 분리에 여전히 널리 사용된다.
칸막이-와 NP-HPLC는 1970년대에 실리카나 알루미나 크로마토그래피 매체의 표면에 물이나 양성 유기 용매층이 존재하여 보존 시간의 재현성이 떨어졌기 때문에 역상 HPLC의 발달로 인해 인기를 잃었다. 이 계층은 이동 단계 구성의 변화(예: 습기 수준)에 따라 변화하여 유지 시간이 표류한다.
최근에는 재현성이 향상된 힐릭 접합 단계가 개발되고, 기술의 유용성 범위에 대한 이해도가 높아지면서 파티션 크로마토그래피가 다시 인기를 끌고 있다.
변위 크로마토그래피
변위 크로마토그래피의 기본 원리는 다음과 같다: 크로마토그래피 매트릭스에 대한 친화력이 높은 분자는 결합 부위에서 효과적으로 경쟁하게 되며,[11] 따라서 친화력이 낮은 모든 분자를 대체하게 된다. 변위 크로마토그래피와 용출 크로마토그래피 사이에는 뚜렷한 차이가 있다. 용출 모드에서는 일반적으로 좁은 가우스 피크의 컬럼에서 물질이 나온다. 최대한의 정화를 달성하기 위해서는 가급적 기준선보다 넓은 봉우리 분리가 필요하다. 용출 모드에서 혼합물의 어떤 성분이 기둥 아래로 이동하는 속도는 많은 요인에 따라 달라진다. 그러나 두 물질이 서로 다른 속도로 이동하여 해결되려면 생체 분자와 크로마토그래피 매트릭스 사이의 어떤 상호작용에 상당한 차이가 있어야 한다. 이 차이의 효과를 최대화하기 위해 작동 파라미터를 조정한다. 대부분의 경우, 피크의 기준선 분리는 구배 용출과 낮은 기둥 적재를 통해서만 달성할 수 있다. 따라서 용출모드 크로마토그래피에 대한 두 가지 단점, 특히 준비 스케일에서, 구배 용매 펌핑으로 인한 운영상의 복잡성과 칼럼 하중에 의한 낮은 처리량으로 인한 낮은 처리량이다. 변위 크로마토그래피는 성분이 '피크'가 아닌 순수 물질의 연속된 영역으로 분해된다는 점에서 용출 크로마토그래피에 비해 장점이 있다. 이 공정이 이소재의 비선형성을 이용하기 때문에, 주어진 기둥에 더 큰 기둥 피드를 분리할 수 있으며, 정제된 구성품은 훨씬 더 높은 농도로 회수된다.
역상 크로마토그래피(RPC)
역상 HPLC(RP-HPLC)는 비극 정지 위상과 수용성, 중간 극 이동 위상이 있다. 하나의 일반적인 고정 위상은 RMeSiCl로2 표면 변형된 실리카인데, 여기서 R은 CH나1837 CH와817 같은 직선 체인 알킬 그룹이다. 이러한 정지 단계에서는 극성이 적은 분자의 체류 시간이 긴 반면 극성 분자는 더 쉽게 용출된다(분석 초기). 조사자는 이동 단계에 더 많은 물을 추가함으로써 유지 시간을 증가시킬 수 있다. 따라서 현재 보다 친수성 이동 단계에 비해 친수성 정지 단계의 친수성 분석 물질의 친화력이 더 강해진다. 마찬가지로, 조사자는 용출액에 유기 용제를 더 첨가하여 보존 시간을 줄일 수 있다. RP-HPLC는 매우 일반적으로 사용되기 때문에 추가 규격 없이 종종 "HPLC"로 잘못 언급된다. 제약업계는 정기적으로 RP-HPLC를 고용하여 약의 출시 전에 자격을 부여한다.
RP-HPLC는 소수성 상호작용의 원리로 작동하는데, 이는 이극성 물 구조에서 높은 대칭성에서 기인하며 생명과학의 모든 과정에서 가장 중요한 역할을 한다. RP-HPLC는 이러한 상호작용 힘을 측정할 수 있다. 고정 위상에 대한 분석물질의 결합은 정지 위상의 리간드와 연관되었을 때 분석물질 분자의 비극 부분 주위의 접촉 표면적에 비례한다. 이러한 솔보포비아 효과는 분석 물질과 C-체인18 대 양쪽의 콤플렉스를 둘러싼 "캐비티 감소"를 위한 물의 힘에 의해 지배된다. 이 과정에서 방출되는 에너지는 용출액 표면장력(물: 7−6.3×10 J/cm², 메탄올−6: 2.2×10 J/cm²)과 각각 분석물질과 리간드의 소수성 표면에 비례한다. 극성 용매(메탄올, 아세토나이트릴)를 이동상(mobile phase)에 넣어 물의 표면 장력을 감소시킴으로써 보존을 줄일 수 있다. 그라데이션 용출은 분석 과정에서 수성 이동 단계의 극성과 표면 장력을 자동으로 감소시킴으로써 이 효과를 사용한다.
분석물질 분자의 구조적 특성은 그 유지 특성에 중요한 역할을 한다. 일반적으로 소수성 표면적이 더 큰 분석물질(C–H, C–C, S-S 등 일반적으로 비극성 원자결합)은 물 구조와 상호작용을 하지 않기 때문에 더 오래 유지된다. 반면 극 표면적이 더 높은 분석 물질(구조에서 -OH, -NH2, COO− 또는 -NH와3+ 같은 극성 그룹의 존재에 의해 선호됨)은 물에 더 잘 통합되기 때문에 덜 유지된다. 그러한 상호작용은 매우 큰 분자가 표면 리간드(alkyl 체인)와의 상호작용이 일어나는 정지 단계의 모공에 대한 접근만 제한될 수 있다는 점에서 강직된 영향을 받는다. 그러한 표면적 장애는 일반적으로 덜 유지되는 결과를 초래한다.
유지 시간은 소수성(비극성) 표면적에 따라 증가한다. 분기 체인 화합물은 전체 표면적이 감소하기 때문에 해당 선형 이소머보다 더 빠르게 용출된다. 마찬가지로 단일 C-C 결합을 가진 유기 화합물은 이중 또는 삼중 결합이 단일 C-C 결합보다 짧기 때문에 C=C 또는 C-C 삼중 결합보다 늦게 용출된다.
이동식 위상 표면 장력(용출 구조물의 유기 강도)을 제외하고, 다른 이동 위상 수정자는 분석 물질 보유에 영향을 미칠 수 있다. 예를 들어 무기염의 첨가는 수용액의 표면장력(NaCl의 경우 Mol당 1.5×10−7 J/cm², (NH4)2SO의4 경우 2.5×10−7 J/cm²)을 중간 정도 선형 증가시키며, 분석물질-솔루션 인터페이스의 엔트로피는 표면장력에 의해 제어되기 때문에 염의 첨가는 유지 시간을 증가시키는 경향이 있다. 이 기법은 단백질 분석에서 단백질의 가벼운 분리 및 회복과 생물학적 활동 보호에 사용된다(수소 상호작용 크로마토그래피, HIC).
또 다른 중요한 요소는 이동상 pH이다. 왜냐하면 그것은 분석물질의 소수성 특성을 바꿀 수 있기 때문이다. 이러한 이유로 대부분의 방법은 인산나트륨과 같은 완충제를 사용하여 pH를 제어한다. 버퍼는 pH의 제어, 정지상 실리카 표면의 전하중화, 분석물질 전하를 중화시키는 이온쌍화제의 역할을 한다. 암모늄 포메이트는 분석 암모늄 유도체의 형성에 의해 특정 분석물질의 탐지를 개선하기 위해 질량 분광법에 일반적으로 첨가된다. 아세트산과 같은 휘발성 유기산, 또는 가장 흔히 포뮬릭산(formic acid)은 질량 분광법을 사용하여 기둥 용융제를 분석하면 이동 단계에 첨가되는 경우가 많다. 트라이플루오로아세트산은 검출기와 용제 전달체계의 지속성 때문에 질량분석 용도에 자주 사용되지 않지만 상당히 강한 유기산인 만큼 다른 검출기를 활용하는 용도에서 카르복실산 등 분석물질의 보유를 개선하는 데 효과적일 수 있다. 산과 완충기의 효과는 도포에 따라 다르지만 일반적으로 크로마토그래픽 분해능을 향상시킨다.
역상기둥은 일반 실리카기둥에 비해 상당히 손상되기 어렵지만, 많은 역상기둥은 알킬 유도 실리카 입자로 구성되며, 수성기둥은 기초 실리카 입자를 파괴하기 때문에 절대 수성기둥과 함께 사용해서는 안 된다. 수산과 함께 사용할 수 있지만 기둥은 HPLC 장비의 금속 부품을 부식시킬 수 있으므로 너무 오랫동안 산에 노출되어서는 안 된다. RP-HPLC 기둥은 잔여산이나 완충제를 제거하기 위해 사용한 후 깨끗한 용매로 플러싱하고 용매의 적절한 조성에 저장해야 한다. 물질을 분리할 수 있는 최상의 능력을 유지하려면 HPLC 기둥의 금속 함량을 낮게 유지해야 한다. 기둥의 금속 함량에 대한 좋은 테스트는 2,2'-와 4,4'-비피리딘의 혼합물인 샘플을 주입하는 것이다. 2,2'-bipy는 금속을 킬레이트할 수 있기 때문에, 실리카 표면에 금속 이온이 존재할 때 2,2'-bipy의 봉우리 모양이 왜곡(꼬리)될 것이다...[citation needed]
크기 제외 크로마토그래피
젤 투과 크로마토그래피 또는 젤 여과 크로마토그래피라고도 알려진 크기 배제 크로마토그래피(SEC)는 분자 크기(실제로 입자의 스톡스 반지름에 의해)를 기준으로 입자를 분리한다. 일반적으로 저 분해능 크로마토그래피이므로 정화의 최종적인 "광택화" 단계를 위해 예약되는 경우가 많다. 정제된 단백질의 3차 구조와 2차 구조를 결정하는 데도 유용하다. SEC는 주로 단백질이나 중합체와 같은 큰 분자의 분석에 사용된다. SEC는 이 작은 분자들을 입자의 모공에 가두면서 작용한다. 더 큰 분자는 모공 속으로 들어가기엔 너무 크기 때문에 모공 옆을 그냥 지나간다. 따라서 분자가 클수록 작은 분자, 즉 분자가 작을수록 유지 시간이 길어진다.
이 기법은 다당류의 분자량 결정에 널리 사용된다. SEC는 상업적으로 이용 가능한 다양한 저분자 중량 헤파린의 분자 중량 비교를 위한 공식 기술(유럽 약리학에서 제안함)이다.
이온교환크로마토그래피
이온교환 크로마토그래피(IC)에서 보존은 용액 이온과 정지상(statter phase)에 바인딩된 충전부 사이의 매력에 기초한다. 기둥에 충전된 부위와 같은 전하의 용액 이온은 결합에서 제외되며, 기둥에 충전된 부위의 반대 전하의 용액 이온은 유지된다. 기둥에 고정되어 있는 솔류트 이온은 용매조건(용액의 염분농도를 높여 용매계통의 이온효과를 증가시켜 기둥온도를 높이고 용매의 pH를 바꾸는 등)을 변경하여 기둥에서 용출할 수 있다.
이온교환기의 종류로는 폴리스티렌 레진, 셀룰로오스, 덱스트란 이온교환기(겔), 제어 포어 글라스 또는 다공성 실리카 등이 있다. 폴리스티렌 레진은 체인의 안정성을 높여주는 교차 연동을 허용한다. 교차 연계가 높으면 스위칭이 감소하여 등거리 교정 시간이 증가하며 궁극적으로 선택성이 개선된다. 셀룰로오스 및 덱스트란 이온 교환기는 모공 크기가 크고 충전 밀도가 낮아 단백질 분리에 적합
일반적으로 이온 교환기는 더 높은 전하와 더 작은 반경의 이온 결합을 선호한다.
역이온(레진 내 기능 그룹에 대한) 농도가 증가하면 유지 시간이 감소한다. pH가 감소하면 양이온 교환의 보존 시간이 감소하는 반면 pH가 증가하면 음이온 교환의 보존 시간이 감소한다. 예를 들어 양이온 교환기둥에서 용매의 pH를 낮추면 음이온 정지상에서의 위치를 경쟁할 수 있는 수소 이온이 더 많아져 약하게 결합되는 양이온을 용해한다.
이러한 형태의 크로마토그래피는 정수, 미량 성분의 선입견, 리간드 교환 크로마토그래피, 단백질의 이온 교환 크로마토그래피, 탄수화물 및 올리고당류의 고-pH 음이온 교환 크로마토그래피 등 응용분야에서 널리 사용된다.
생물선도 크로마토그래피
이 크로마토그래픽 공정은 생물학적으로 활성 물질의 특성에 의존하여 안정적이고 구체적이며 가역적인 콤플렉스를 형성한다. 이러한 복합체의 형성은 Van der Waals 상호작용, 정전기 상호작용, 쌍극자-디폴 상호작용, 소수성 상호작용, 수소 결합과 같은 일반적인 분자력의 참여를 포함한다. 효율적이고 생물학적 결합은 보완적 결합 사이트에서 이들 힘 중 몇 개의 동시적이고 일치된 작용에 의해 형성된다.
수성 정상 위상 크로마토그래피
수성 정상 위상 크로마토그래피(ANP)는 역상 크로마토그래피(RP)와 유기 정상 위상 크로마토그래피(ONP) 사이의 이동 위상 영역을 포괄하는 크로마토그래피 기법이다. 이 기법은 역상 용제를 이용한 정상 위상 용출이 나타나며 친수성 화합물의 고유한 선택성을 달성하기 위해 사용된다.[citation needed]
이소크라테스 및 그라데이션 용출
이동 단계 구성이 절차 전체에 걸쳐 일정하게 유지되는 분리를 이소크라테스(일정한 구성을 의미함)라고 한다. (이러한 예시에서는 전체 시술에서 메탄올 비율이 일정하게 유지됨, 즉 10%) 이 단어는 HPLC의 선구자 중 한 명이었던 Csaba Horvath에 의해 만들어졌다.[citation needed]
이동 단계 구성은 일정하게 유지될 필요가 없다. 분리 과정에서 이동상 구성이 변경되는 분리를 구배 용출이라고 한다.[12] 10% 메탄올에서 시작해 20분 후 90% 메탄올에서 끝나는 경사가 대표적인 예다. 이동 단계의 두 구성 요소는 일반적으로 "A"와 "B"로 불리며, A는 용액이 천천히 용액이 용해될 수 있는 "약한" 용제인 반면, B는 기둥에서 용액을 빠르게 용해하는 "강한" 용제인 것이다. 역상 크로마토그래피에서 용제 A는 물이나 수성 완충제인 경우가 많은 반면, B는 아세토나이트릴, 메탄올, THF, 이소프로판올과 같이 물과 오용되는 유기용제다.
이소크라테스 용출에서 최대 폭은 이론적 판의 수인 N에 대한 방정식에 따라 선형적으로 유지 시간에 따라 증가한다. 이로 인해 늦게 녹는 산봉우리들이 매우 평평하고 넓어진다는 단점으로 이어진다. 그들의 모양과 너비는 그들이 봉우리로서 인식되는 것을 막을 수 있다.
구배 용출은 후발진 구성 요소의 유지를 감소시켜 더 빨리 용출되도록 하여 대부분의 구성 요소에 대해 더 좁은(더 높은) 피크를 제공한다. 이는 또한 유기 용출액의 농도가 증가함에 따라 피크의 꼬리 부분을 앞으로 밀기 때문에 꼬리가 있는 피크의 피크 형상을 개선한다. 이것은 또한 추적 분석에 중요한 피크 높이(피크 높이를 "샤르퍼"처럼 보인다)를 증가시킨다. 그라데이션 프로그램은 최소 시간 내에 최적의 분리를 원하는 욕구에 따라 유기성분 비율의 갑작스런 "단계" 증가 또는 다른 시간에 다른 기울기를 포함할 수 있다.
이소크라테스 용출에서 기둥 치수(길이 및 내경)가 바뀌어도 선택성은 변하지 않는다. 즉, 피크가 동일한 순서로 용출된다. 경사로 용출 시 용출 순서는 치수 또는 유량 변화에 따라 변경될 수 있다.[citation needed]
역상 크로마토그래피에서의 추진력은 물 구조의 높은 순서에서 발생한다. 이동 단계의 유기적 요소의 역할은 이 높은 질서를 감소시켜 수성 요소의 지연 강도를 감소시키는 것이다.
매개변수
이론적
HPLC 분리는 UV 검출기 또는 질량 분광기와 같은 계측기에 의해 검출되었을 때 신호 피크로의 구성품의 분리를 설명하는 이론적 매개변수와 방정식을 가지고 있다. 매개변수는 크게 판형 이론(칸막이 크로마토그래프의 일부로서)과 판형학/반 리메이커 방정식의 비율 이론의 두 세트의 크로마타그래프 이론에서 도출된다. 물론 속도이론은 보다 정확한 이론으로 간주되지만 HPLC 크로마토그램 분석을 통해 실행에 옮길 수 있다.
이들은 종이 크로마토그래피 분리에 대한 보존 계수 계산과 유사하지만, HPLC가 혼합물을 크로마토그램에서 피크(밴드)로 검출된 둘 이상의 성분으로 얼마나 잘 분리하는지를 설명한다. HPLC 매개변수는 효율성 계수(N), 보존 계수(카파 프라임), 분리 계수(알파)이다. 두 성분의 피크가 서로 얼마나 잘 분리되거나 중첩되는지를 설명하는 분해능 방정식의 변수가 인자를 함께 사용한다. 이러한 매개변수는 다른 HPLC 모드(예: 이온 교환 및 크기 제외)보다 HPLC 역상 및 HPLC 정상 위상 분리를 설명하는 데만 주로 사용된다.
보이드 용적은 용제가 점유하는 기둥의 공간의 양이다. 기둥의 내부 포장재 바깥에 있는 기둥 안의 공간이다. 보이드 용적은 크로마토그램에서 첫 번째 성분 피크 검출로 측정되며, 이는 일반적으로 표본 혼합물에 존재하는 용매로서, 이상적으로는 표본 용매가 기둥과 상호작용하지 않고 기둥을 통해 흐르지만 여전히 HPLC 용매와는 구별되는 것으로 검출될 수 있다. 보이드 부피는 보정 계수로 사용된다.
효율 계수(N)는 가장 넓은 지점(기준에서)에서 피크의 폭에 상대적인 구성 요소 피크 면적("보존 시간")의 비율로 크로마토그램에서 날카로운 구성 요소가 얼마나 피크인지를 실질적으로 측정한다. 높고, 날카롭고, 상대적으로 좁은 피크는 분리 방법이 혼합물에서 성분을 효율적으로 제거했다는 것을 나타낸다; 고효율이다. 효율성은 HPLC column과 HPLC 방법에 따라 매우 좌우된다. 효율 계수는 판 번호와 '이론 판의 수'와 동의어다.
보존 계수(카파 프라임)는 혼합물의 성분이 컬럼에 얼마나 오래 붙었는지를 측정하고, 크로마토그램에서 피크 곡선 아래의 영역으로 측정한다(HPLC 크로마토그램은 시간의 함수임). 각 크로마토그램 피크는 자체 보존 계수(예: 첫 번째 피크의 보존 계수에 대한 카파1)를 갖는다. 이 인자는 기둥의 보이드 부피에 의해 보정될 수 있다.
분리 계수(alpha)는 혼합물의 두 인접 성분(즉, 크로마토그램의 두 인접 대역)이 얼마나 잘 분리되었는지에 대한 상대적 비교다. 이 인수는 인접한 크로마토그램 피크 쌍의 보존 인자의 비율에 따라 정의되며, 기둥의 보이드 부피에 의해 보정될 수도 있다. 분리 계수 값이 1.0보다 클수록 분리가 더 좋으며, HPLC 방법 이상의 2.0은 분리에 필요하지 않을 수 있다. 분해능 방정식은 고효율과 분리 인자가 HPLC 분리의 구성요소 피크 분해능을 향상시키는 세 가지 요인과 관련된다.
내경
HPLC 기둥의 내경(ID)은 구배 용출에서 검출 감도와 분리 선택성에 영향을 미치는 중요한 매개변수다. 또한 칼럼에 적재할 수 있는 분석물질의 수량을 결정한다. 더 큰 기둥이 산업용 애플리케이션에서 흔히 볼 수 있는데, 예를 들어 나중에 사용하기 위한 의약품의 정화와 같은 것이다. 저ID기둥은 부하용량을 희생하면서 감도가 향상되고 용매 소모량이 낮아졌다.
더 큰 ID 열(10 mm 이상)은 적재 용량이 크기 때문에 사용 가능한 양의 물질을 정화하기 위해 사용된다.
해석 축척 기둥(4.6 mm)은 가장 일반적인 유형의 기둥이었지만, 작은 기둥은 빠르게 인기를 얻고 있다. 그것들은 샘플의 전통적인 정량적 분석에 사용되며 종종 UV-Vis 흡광도 검출기를 사용한다.
특수 UV-vis 검출기, 형광 검출기 또는 액체 크로마토그래피-질량분석과 같은 기타 검출 방법 중 하나를 사용하여 감도가 더 높은 경우에 적용할 때 좁은 보어 컬럼(1–2 mm)을 사용한다.
모세관 기둥 (0.3 mm 이하)은 질량 분광법 같은 대체 검출 수단과 거의 독점적으로 사용된다. 그것들은 보통 더 큰 기둥들이 사용하는 스테인리스강 관보다는 융합된 실리카 모세혈관으로 만들어진다.
입자 크기
대부분의 전통적인 HPLC는 작은 구형 실리카 입자(매우 작은 구슬)의 외부에 부착된 정지 위상으로 수행된다. 이 입자들은 크기가 다양하며 5µm 구슬이 가장 흔하다. 작은 입자는 일반적으로 더 많은 표면적을 제공하고 분리를 더 잘하지만, 최적의 선형 속도에 필요한 압력은 입자 직경의 역 제곱에 따라 증가한다.[13][14][15]
기둥 속도, 효율 및 역압의 방정식에[16] 따르면 입자 지름을 절반으로 줄이고 기둥의 크기를 동일하게 유지하면 기둥 속도와 효율이 두 배로 증가하지만, 4배는 배압을 증가시킨다. 그리고 작은 입자 HPLC도 폭이 넓어지는 것을 줄일 수 있다.[17] 더 큰 입자는 준비 HPLC(칼럼 직경 5 cm ~ 30 cm)와 고체상 추출과 같은 비 HPLC 용도에 사용된다.
모공 사이즈
많은 고정 위상은 더 큰 표면적을 제공하기 위해 다공성이다. 모공이 작으면 표면적이 넓어지는 반면 모공 크기가 클수록 운동성이 좋아지는 반면 특히 큰 분석 물질의 경우 더욱 그렇다. 예를 들어, 모공보다 약간 작은 단백질은 모공 속으로 들어갈 수 있지만 한 번 안으로 쉽게 빠져나가지 않는다.
펌프압력
펌프는 압력 용량에 따라 다르지만, 펌프의 성능은 일관되고 재현 가능한 체적 유량을 산출하는 능력에 따라 측정된다. 압력은 최대 60 MPa(6000lbf/in2) 또는 약 600 대기에 도달할 수 있다. 현대의 HPLC 시스템은 훨씬 높은 압력에서 작동하도록 개선되었고, 따라서 기둥에서 훨씬 더 작은 입자 크기(<2 μm)를 사용할 수 있다. 초고압 크로마토그래피 시스템이라고도 할 수 있는 이러한 "초고성능 액체 크로마토그래피" 시스템이나 UHPLC는 최대 120 MPa(17,405lbf/in2) 또는 약 1200 대기에서 작동할 수 있다.[18][19] "UPLC"[20]라는 용어는 Waters Corporation의 상표이지만, UHPLC의 보다 일반적인 기법을 가리키는 데 사용되기도 한다.
디텍터
HPLC 검출기는 범용 또는 선택적 두 가지 범주로 분류된다. 범용 검출기는 일반적으로 용액으로 이동 위상과 이동 위상 사이의 물리적 속성의 차이를 측정하여 벌크 속성(예: 굴절 지수)을 측정하는 반면 선택적 검출기는 용액의 물리적 또는 화학적 특성에 단순히 반응하여 용액 속성(예: UV-Vis 흡광도)을 측정한다.[21] HPLC는 일반적으로 UV-Vis 흡광도 검출기를 사용하지만, 광범위한 다른 크로마토그래피 검출기를 사용할 수 있다. UV-Vis 흡광도 감지를 보완하는 범용 검출기는 충전식 에어로졸 검출기(CAD)이다. 일반적으로 사용되는 일종의 검출기에는 굴절률 검출기가 포함되어 있는데, 굴절률 검출기는 유동 셀을 통해 이동할 때 용출량의 굴절률 변화를 측정하여 판독값을 제공한다. 예를 들어 LCMS는 일반적으로 UV-Vis와 질량 분광계를 결합하여 여러 개의 검출기를 사용할 수 있다.
전기화학적 검출기(ECD)와 함께 사용할 경우 HPLC-ECD는 신경화학적 분석 연구 애플리케이션에서 노레피네프린, 도파민, 세로토닌, 글루탐산염, GABA, 아세틸콜린 등과 같은 신경전달물질을 선택적으로 검출한다.[22] HPLC-ECD는 대퇴골 범위에 대한 신경전달물질을 검출한다. 신경전달물질을 검출하는 다른 방법으로는 액체 크로마토그래피-질량분석법, ELISA 또는 라디오임문분석법이 있다.
오토샘플러
HPLC 오토샘플러를 사용하면 많은 수의 샘플이 HPLC 시스템에 자동으로 주입될 수 있다. 또한 HPLC 오토샘플러는 주입량 및 기법이 각 주입에 대해 정확히 동일하므로 높은 수준의 주입량 정밀도를 제공한다. 샘플링 챔버 내에서 샘플을 교반할 수 있으므로 균질성을 촉진할 수 있다.[23]
적용들
제조업
HPLC는 실험실 및 임상 과학 모두에 많은 응용 프로그램을 가지고 있다. 신뢰할 수 있는 방법으로 제품 순도를 확보하고 보장할 수 있기 때문에 제약 개발에 사용되는 일반적인 기술이다.[24] HPLC는 매우 높은 품질의 (순수) 제품을 생산할 수 있지만, 그것이 항상 벌크 의약품 재료의 생산에 사용되는 일차적인 방법은 아니다.[25] 유럽의 약리학에 따르면 HPLC는 합성물의 15.5%에 불과하다.[26] 그러나, 그것은 미국 내 합성물의 44%에서 역할을 한다.[27] 이는 대규모의 HPLC가 값비싼 기법이 될 수 있기 때문에 통화 및 시간 제약의 차이 때문일 수 있다. HPLC와 함께 발생하는 특수성, 정밀도, 정확도의 증가는 불행히도 비용 증가와 일치한다.
합법적
이 기술은 또한 소변에서 불법 약물을 검출하는 데도 사용된다. 약물을 검출하는 가장 일반적인 방법은 면역측정법이다.[28] 이 방법이 훨씬 편리하다. 그러나, 편리함은 광범위한 약품의 특성과 커버리지의 비용으로 온다. HPLC는 순도를 결정하는 방법이며, 약물의 농도를 평가할 때 HPLC를 단독으로 사용하는 것은 다소 불충분하다. 이와 함께, 이러한 맥락에서 HPLC는 질량 분광 분석과 함께 수행되는 경우가 많다.[29] MS와 연계해 가스 크로마토그래피 대신 액체 크로마토그래피를 사용하면 아세틸화제나 알킬화제 등으로 파생할 필요가 없어져 부담스러운 추가 단계가 될 수 있다.[30] 이 기법은 도핑제, 약물대사물, 글루쿠로니드 접합제, 암페타민, 오피오이드, 코카인, BZD, 케타민, LSD, 대마초, 농약 등 다양한 물질을 검출하는 데 사용되어 왔다.[31][32] 매스 분광 분석과 함께 HPLC를 수행하면 HPLC 실험 런의 표준화에 대한 절대적 필요성이 감소한다.
리서치
유사한 검사를 연구 목적으로 수행할 수 있으며, 항풍뇨제나 천식제 같은 잠재적 임상 후보물질의 농도를 검출할 수 있다.[33] 이 기법은 수집된 표본에서 여러 종을 관찰하는 데도 분명히 유용하지만, 종 정체성에 대한 정보를 찾을 때 표준 해결책을 사용해야 한다. 이러한 유형의 연구에서는 순도가 필수적이기 때문에 합성 반응의 결과를 확인하는 방법으로 사용된다. 그러나 질량분석은 여전히 종을 식별하는 더 신뢰할 수 있는 방법이다.
메디컬
HPLC의 의학적 사용은 약물 분석을 포함할 수 있지만, 영양분 분석의 범주에 더 가깝게 포함된다. 소변이 약물 농도를 분석하는 가장 흔한 매개체인 반면 혈청은 HPLC로 대부분의 의학 분석을 위해 채취한 샘플이다.[34] 임상 연구에 유용한 다른 분자 검출 방법은 HPLC 즉 면역측정법에 대해 시험되었다. 이것의 한 예에서, 경쟁 단백질 결합 검사(CPBA)와 HPLC를 비타민 D 검출의 민감도와 비교했다. 어린이들의 비타민D 결핍을 진단하는데 유용한 것으로, 이 CPBA의 민감도와 특수성은 HPLC 용량의 각각 40%와 60%에 불과한 것으로 밝혀졌다.[35] 값비싼 도구지만 HPLC의 정확도는 거의 타의 추종을 불허한다.
참고 항목
참조
- ^ Gerber, F.; Krummen, M.; Potgeter, H.; Roth, A.; Siffrin, C.; Spoendlin, C. (2004). "Practical aspects of fast reversed-phase high-performance liquid chromatography using 3μm particle packed columns and monolithic columns in pharmaceutical development and production working under current good manufacturing practice". Journal of Chromatography A. 1036 (2): 127–133. doi:10.1016/j.chroma.2004.02.056. PMID 15146913.
- ^ Morgan, David J. (2003-11-19). "Fraction collector (post on Flickr)". Flickr. Retrieved 28 October 2015.
- ^ a b Karger, Barry L. (1997). "HPLC: Early and Recent Perspectives". Journal of Chemical Education. 74 (1): 45. Bibcode:1997JChEd..74...45K. doi:10.1021/ed074p45.
- ^ a b c d e f 헨리, 리처드 A. (2009년 2월 1일) "The Early Days of HPLC at Dupont" 크로마토그래피 온라인. Avanstar Communications Inc.
- ^ 일러, R.K. (1979) 실리카의 화학. 존 와일리 & 선즈. 뉴욕
- ^ Karger, B. L.; Berry, L. V. (1971). "Rapid liquid-chromatographic separation of steroids on columns heavily loaded with stationary phase". Clin. Chem. 17 (8): 757–64. doi:10.1093/clinchem/17.8.757. PMID 4254537.
- ^ 기딩, J. 캘빈(1965) 크로마토그래피의 역학, 제1부 원리 및 이론 뉴욕주, Marcel Dekker, Inc. 281 페이지.
- ^ Ettre, C. (2001). "Milestones in Chromatography: The Birth of Partition Chromatography" (PDF). LCGC. 19 (5): 506–512. Retrieved 2016-02-26.
- ^ Martin, A J P; Synge, R L M (1941). "Separation of the higher monoamino-acids by counter-current liquid-liquid extraction: the amino-acid composition of wool". Biochemical Journal. 35 (1–2): 91–121. doi:10.1042/bj0350091. PMC 1265473. PMID 16747393.
- ^ 린지는, S.;Kealey, D(1987년).고성능 액체 크로마토 그래피.Wiley도. OSTI 7013902. 검토 헝, L.B로부터, Parcher, J.F.;쇼어즈. 미국 플로리다 주, J.C, 워드, E.H.(1988년)."surface-coverage 프로그래밍에 특별gas–solid 크로마토 그래피에 있는adsorbable 가스와 실험 이론적 기초".J.Am. 화학.속짱. 110(11):1090–1096. doi:10.1021/ac00162a003.
- ^ 변위 크로마토그래피. Sacheminc.com. 2011-06-07 검색됨 2008년 9월 15일 웨이백 머신에 보관
- ^ Snyder, Lloyd R.; Dolan, John W. (2006). High-Performance Gradient Elution: The Practical Application of the Linear-Solvent-Strength Model. Wiley Interscience. ISBN 978-0470055519.
- ^ 메이저, 로널드 E.. (2010-09-07) 2μm 이하의 다공성 입자에 대한 빠르고 초고속 HPLC — 여기에서 어디로 가야 할까? – LC-GC 유럽. Lcgceurope.com. 2011-06-07 검색됨
- ^ Xiang, Y.; Liu Y.; Lee M.L. (2006). "Ultrahigh pressure liquid chromatography using elevated temperature". Journal of Chromatography A. 1104 (1–2): 198–202. doi:10.1016/j.chroma.2005.11.118. PMID 16376355.
- ^ Horváth, Cs.; Preiss B.A.; Lipsky S.R. (1967). "Fast liquid chromatography. Investigation of operating parameters and the separation of nucleotides on pellicular ion exchangers". Analytical Chemistry. 39 (12): 1422–1428. doi:10.1021/ac60256a003. PMID 6073805.
- ^ Nguyen, Dao T.-T.; Guillarme, Davy; Rudaz, Serge; Veuthey, Jean-Luc (2006). "Fast analysis in liquid chromatography using small particle size and high pressure". Journal of Separation Science. 29 (12): 1836–1848. doi:10.1002/jssc.200600189. ISSN 1615-9306. PMID 16970187.
- ^ Gritti, Fabrice; Guiochon, Georges (2013). "The van Deemter equation: Assumptions, limits, and adjustment to modern high performance liquid chromatography". Journal of Chromatography A. 1302: 1–13. doi:10.1016/j.chroma.2013.06.032. PMID 23838304.
- ^ 샹, Y; 류 Y; 리 M.L. (2006) "높은 온도를 이용한 초고압 액체 크로마토그래피" Chromatography A. 1104 (1–2): 198–202. doi:10.1016/j.chroma. 2005.11.118. PMID 16376355.
- ^ 1290 Infinity Quaternary 펌프. 애질런트
- ^ waters. "Trademarks : Waters". www.waters.com.
- ^ K., Robards (1994). Principles and practice of modern chromatographic methods. Haddad, P. R., Jackson, P. E. Amsterdam: Elsevier/Academic Press. ISBN 9780080571782. OCLC 815471219.
- ^ "HPLC-ECD (Electrochemical Detection) Fundamentals".
- ^ Markovitch, Omer; Ottelé, Jim; Veldman, Obe; Otto, Sijbren (2020). "Automated device for continuous stirring while sampling in liquid chromatography systems". Communications Chemistry. 3: 180. doi:10.1038/s42004-020-00427-5.
- ^ Gerber, Frederic (May 2004). "Practical aspects of fast reversed-phase high-performance liquid chromatography using 3 μm particle packed columns and monolithic columns in pharmaceutical development and production working under current good manufacturing practice". Journal of Chromatography. 1036 (2): 127–33. doi:10.1016/j.chroma.2004.02.056. PMID 15146913.
- ^ Siddiqui, Masoom Raza; AlOthman, Zeid A.; Rahman, Nafisur (2013). "Analytical techniques in pharmaceutical analysis: A review". Arabian Journal of Chemistry. 10: S1409–S1421. doi:10.1016/j.arabjc.2013.04.016.
- ^ 유럽 약리회, 2002년 4차 개정, 유럽 위원회 스트라스부르.
- ^ 2004년 미국 약리병리학, 27부. 록빌, MD의 USP 컨벤션 주식회사.
- ^ Pesce, Amadeo; Rosenthal, Murray; West, Robert; West, Cameron; Crews, Bridgit; Mikel, Charles; Almazan, Perla; Latyshev, Sergey (2010-06-01). "An evaluation of the diagnostic accuracy of liquid chromatography-tandem mass spectrometry versus immunoassay drug testing in pain patients". Pain Physician. 13 (3): 273–281. PMID 20495592.
- ^ Tsai, I.-Lin; Weng, Te-I.; Tseng, Yufeng J.; Tan, Happy Kuy-Lok; Sun, Hsiao-Ju; Kuo, Ching-Hua (2013-12-01). "Screening and confirmation of 62 drugs of abuse and metabolites in urine by ultra-high-performance liquid chromatography-quadrupole time-of-flight mass spectrometry". Journal of Analytical Toxicology. 37 (9): 642–651. doi:10.1093/jat/bkt083. PMID 24084874.
- ^ Weinmann, W.; Renz, M.; Vogt, S.; Pollak, S. (2000-01-01). "Automated solid-phase extraction and two-step derivatisation for simultaneous analysis of basic illicit drugs in serum by GC/MS". International Journal of Legal Medicine. 113 (4): 229–235. doi:10.1007/s004149900098. PMID 10929239. S2CID 20451772.
- ^ Kolmonen, Marjo; Leinonen, Antti; Pelander, Anna; Ojanperä, Ilkka (2007-02-28). "A general screening method for doping agents in human urine by solid phase extraction and liquid chromatography/time-of-flight mass spectrometry". Analytica Chimica Acta. 585 (1): 94–102. doi:10.1016/j.aca.2006.12.028. PMID 17386652.
- ^ Pelander, Anna; Ojanperä, Ilkka; Laks, Suvi; Rasanen, Ilpo; Vuori, Erkki (2003-11-01). "Toxicological screening with formula-based metabolite identification by liquid chromatography/time-of-flight mass spectrometry". Analytical Chemistry. 75 (21): 5710–5718. doi:10.1021/ac030162o. PMID 14588010.
- ^ Nobilis, Milan; Pour, Milan; Senel, Petr; Pavlík, Jan; Kunes, Jirí; Voprsalová, Marie; Kolárová, Lenka; Holcapek, Michal (2007-06-15). "Metabolic profiling of a potential antifungal drug, 3-(4-bromophenyl)-5-acetoxymethyl-2,5-dihydrofuran-2-one, in mouse urine using high-performance liquid chromatography with UV photodiode-array and mass spectrometric detection". Journal of Chromatography B. 853 (1–2): 10–19. doi:10.1016/j.jchromb.2007.02.045. PMID 17400036.
- ^ Sundström, Mira; Pelander, Anna; Angerer, Verena; Hutter, Melanie; Kneisel, Stefan; Ojanperä, Ilkka (2013-10-01). "A high-sensitivity ultra-high performance liquid chromatography/high-resolution time-of-flight mass spectrometry (UHPLC-HR-TOFMS) method for screening synthetic cannabinoids and other drugs of abuse in urine". Analytical and Bioanalytical Chemistry. 405 (26): 8463–8474. doi:10.1007/s00216-013-7272-8. PMID 23954996. S2CID 25743579.
- ^ Zahedi Rad, Maliheh; Neyestani, Tirang Reza; Nikooyeh, Bahareh; Shariatzadeh, Nastaran; Kalayi, Ali; Khalaji, Niloufar; Gharavi, Azam (2015-01-01). "Competitive Protein-binding assay-based Enzyme-immunoassay Method, Compared to High-pressure Liquid Chromatography, Has a Very Lower Diagnostic Value to Detect Vitamin D Deficiency in 9–12 Years Children". International Journal of Preventive Medicine. 6: 67. doi:10.4103/2008-7802.161069. PMC 4542329. PMID 26330983.
추가 읽기
- L. R. Snyder, J. J. Kirkland, J. W. Dolan, 현대 액체 크로마토그래피 소개, John Wiley & Sons, New York, 2009.
- M.W. Dong, Modern HPLC. 와일리, 2006년
- L. R. Snyder, J. J. Kirkland, J. L. Glajch, Practical HPLC Method Development, John Wiley & Sons, New York.
- S. Ahuja 및 H. T. 라스무센(ed), HPLC Method Development for Pharmethics, Academic Press, 2007.
- S. Ahuja 및 M.W. Dong (edd), HPLC에 의한 의약품 분석 핸드북, Exvier/Academic Press, 2005.
- Y. V. 카자케비치와 R. 2007년 Wiley의 LoBrutto (ed.), HPLC for Pharmical Sciences.
- U. D. Neue, HPLC 열: 1997년 뉴욕 Wiley-VCH의 이론, 기술 및 실습
- M. C. McMaster, HPLC, 실용 사용자 가이드, Wiley, 2007.
외부 링크
| Wikimedia Commons는 고성능 액체 크로마토그래피와 관련된 미디어를 보유하고 있다. |






