운동 분해능
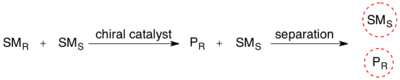
Kinetic resolution유기 화학에서, 운동 분해능은 인종 혼합물에서 두 개의 항산화제를 구별하는 수단이다.운동 분해능에서 두 개의 항산화제는 치랄 촉매나 시약과의 화학 반응에서 서로 다른 반응 속도로 반응하여 덜 반응하는 항산화 물질의 항산화 샘플이 발생한다.[1]키랄 분해능과는 반대로 운동 분해능은 이질소성 제품의 다른 물리적 특성에 의존하지 않고, 오히려 레이스믹 스타트 재료의 다른 화학적 특성에 의존한다.이 비작동 시작 재료의 항독성 초과(ee)는 더 많은 제품이 형성될수록 지속적으로 상승하며, 반응이 완전히 완료되기 직전에 100%에 도달한다.운동 분해능은 항산화제 또는 항항산화제 복합체 간의 반응도 차이에 의존한다.운동 분해능은 유기화학에 있어서의 개념으로 유기합성에 있어서의 치랄 분자의 조성에 이용될 수 있다.순수 합성 시약과 촉매를 활용한 운동 분해능 반응은 지난 30년 동안 많은 유용한 합성 기법이 개발되었지만 유기 합성에 적용할 때 효소 운동 분해능을 사용하는 것보다 훨씬 덜 흔하다.[2]null
역사
처음 보고된 운동 분해능은 루이 파스퇴르에 의해 달성되었다.수성 경마암모늄 타르트레이트를 페니실륨 글라우쿰의 곰팡이와 반응시킨 후, 그는 남은 타르트를 다시 절개하여 그것이 레보토릭임을 발견했다.[3]금형에 존재하는 치랄 미생물은 (R,R)-타트레이트의 대사 작용을 선택적으로 촉매화하여 (S,S)타트레이트의 과잉을 남겼다.null
합성수단에 의한 운동학적 분해능은 1899년 마르크발트와 맥켄지에 의해 광학적으로 활성(--menthol)이 있는 경혈성 만델릭산을 에스테르화하면서 처음 보고되었다.경주산이 초과한 상태에서, 그들은 (+--만델산에서 파생된 에스터의 형성이 (--)만델산에서 에스터가 형성되는 것보다 더 빠를 것을 관찰했다.무반응산은 (----)만델산을 약간 초과하는 것으로 관찰되었으며, 에스테르는 사포닌화 시 (+--만델산)을 산출하는 것으로 나중에 밝혀졌다.이 관찰의 중요성은 이론적으로 (--)멘톨의 반만 사용했다면 (----만델릭산)의 고농축 표본을 준비할 수 있었을 것이라는 것이었다.이러한 관찰은 유기화학에서 운동 분해능의 사용의 시작인 다른 치랄산의 성공적인 운동 분해능으로 이어졌다.[4][5]null
이론
운동 분해능은 (잠재적으로) 서로 다른 활성화 에너지로 인해 한 쌍의 엔노머를 불가역적으로 구별하기 위한 가능한 방법이다.두 에반토머가 정의상 동일한 Gibbs 자유 에너지 수준에 있고, 두 에반토머와의 반응 산물도 동일한 수준에 있는 반면, g{\즉 전환 상태 에너지는 다를 수 있다.아래 이미지에서 R 에난토머는 ‡ 보다 낮으므로 S 에난토머보다 더 빠르게 반응한다.null
이상적인 운동 분해능은 오직 하나의 에반토머만이 반응하는 즉, kR>>k이다S.운동 분해능의 선택성(s)은 kR>k에S 대해 각각 s=kR/kS/k씩S R과 S의R 반작용의 속도 상수와 관련된다.이러한 선택성은 상대적인 반응 속도라고도 할 수 있다.이는 고에너지 전환 상태와 저에너지 전환 상태 사이의 자유 에너지 차인 G }{\ G에 대해 기록할 수 있다[6]
선택성은 1차 운동학(기질)을 가정할 경우, 회수된 출발 재료의 ee와 변환(c)의 측면으로도 표현할 수 있다.만일 출발 재료 경주장의 S 에난토머가 초과 회수된다고 가정할 경우, S와 R 에난토머의 농도(몰 분율)를 다음과 같이 표현할 수 있다.
출발 재료의 ee는 어디에 있다.반응의 시작을 나타내는 c=0의 경우, 0 = = 1 0}={}{ 이 경우 에반토머의 초기 농도를 나타낸다.그리고, 스토이히메트릭 치랄 분해제 B*는
분해제가 치알 촉매와 함께 스토오치메트릭과 아치랄인 경우 [B*] 용어는 나타나지 않는다.아무튼 R과 비슷한 표현으로 s를 as로 표현할 수 있다.
만약 우리가 이것을 제품의 항항생성 과잉인 ee"라는 관점에서 표현하고 싶다면, 우리는 R과 S의 제품 R'과 S'에 각각 사용해야만 한다.
여기서 보면 알 수 있다.
우리에게 주는 것은
위에서 파생된 s에 대한 표현을 연결하면
또한, c와 ee에 대한 표현은 parametry되어 t의 관점에서 C와 ee에 대한 명시적 표현을 제공할 수 있다.첫째, t 산출물의 함수로 [S]와 [R]에 대해 명시적으로 해결한다.
ee와 c에 대한 표현에 연결되면
일반성을 잃지 않고 k=1을 허용할 수 있는데, k=s를 주어 위의 표현을SR 단순화한다.마찬가지로, t의 함수로서 ee″에 대한 식을 도출할 수 있다.
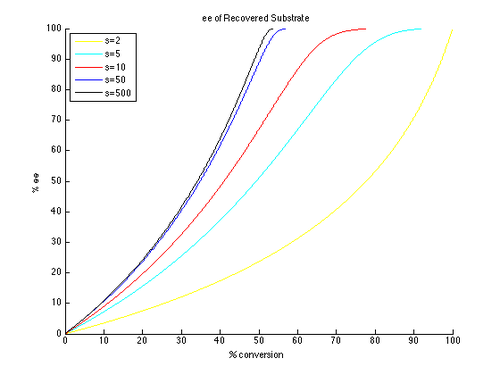
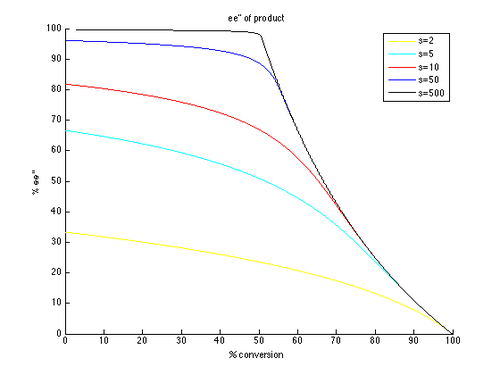
따라서 아래와 같이 다른 곡선을 생성하는 s의 매개변수와 다른 값을 t로 하여 ee와 ee″ 대 c의 플롯을 생성할 수 있다.null
알 수 있듯이, 높은 항항성 초과량은 비접촉식 출발 물질에 훨씬 더 쉽게 달성할 수 있다.그러나 ee와 변환 사이에는 트레이드오프가 있으며, 더 높은 변환에서 얻은 (회수된 기질 중) ee가 더 높으며, 따라서 더 낮은 절연 수율이 있다.예를 들어 선택성 계수가 10에 불과할 경우 약 70%의 변환으로 99% ee가 가능하여 약 30%의 수율을 얻을 수 있다.반대로 제품의 좋은 ee와 수율을 얻기 위해서는 매우 높은 선택성 인자가 필요하다.예를 들어 선택성 계수가 10이면 eeu가 약 80% 이상이면 달성할 수 없으며, 보다 현실적인 변환을 위해 eeu 값이 현저히 낮아진다.고농축 제품의 경우 합리적인 수율에서 50을 초과하는 선택성이 요구된다.null
이것은 운동 분해능의 진정한 운동학의 단순화된 버전이다.그 반응이 기질에서 첫 번째 순서라는 가정은 제한적이며, 기질에 대한 의존도가 변환에 의존하여 훨씬 더 복잡한 그림이 나올 수도 있다.결과적으로, k의rel 공식은 이상적인 운동 분해능에만 적용되므로, 공통 접근법은 수율과 ee의 수율만을 측정하고 보고하는 것이다.초기 기질 촉매 복합체 형성을 고려하는 것은 간단하며, 이는 1차 동력학을 부정할 수 있다.그러나 도출된 일반적인 결론은 선택성과 전환이 ee에 미치는 영향을 이해하는 데 여전히 도움이 된다.null
실용성
비대칭 카탈루션의 등장으로 엔노퓨어 제품 조성을 위해 운동 분해능을 활용하는 실용성을 고려할 필요가 있다.비대칭 촉매 또는 보조 기반 경로를 통해 얻을 수 있는 제품의 경우에도 경주용 동료는 앙코푸어 재료보다 훨씬 저렴하여 소재의 50%에 내재된 "손실"에도 비용 효율성이 높아질 수 있다.다음은 실제 운동 분해능을 위해 필요한 조건으로서 제안되었다.[6]
현재까지, 운동 분해능을 위한 촉매들이 개발되어, 위 기준의 전부는 아닐지라도, 대부분 충족시켜, 유기 합성에 사용하기 위한 실용성이 높다.다음 절에서는 몇 가지 주요 예를 논의한다.null
합성 시약을 이용한 반응
아세틸화 반응
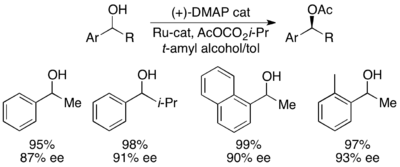
그레고리 푸와 동료들은 치랄 DMAP 아날로그를 활용한 방법론을 개발해 2차 알코올의 탁월한 운동 분해능을 달성했다.[7]용매로 에테르를 활용한 초기 연구, 낮은 촉매 하중(2 mol%), 아틸레이팅제로서의 아세트산 무수화물, 상온에서의 트리에틸아민 등은 회수 알코올 제품의 [8]99.2%에 해당하는 14-52의 선택성을 보였다.그러나 용제 스크리닝은 테르트-아밀알코올의 사용으로 반응성과 선택성이 모두 증가했음을 입증했다.[9]null
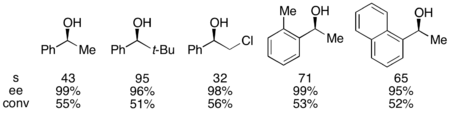
벤치마크 기질 1페닐타놀의 경우, 0°C에서 실행했을 때 55% 전환 시 비접촉 알코올의 99% ee에 해당한다.이 시스템은 아래에 표시된 것처럼 촉매의 (--enantomer)를 활용하여 최대 95개의 높은 선택도와 1%의 낮은 촉매 하중으로 다수의 아릴랄카르비놀 분해능에 능하다는 것이 입증되었다.이것은 매우 낮은 전환으로 높은 영양가 있는 알코올을 만들어 내었고, 또한 뛰어난 수율을 제공했다.또한 선택도가 높으면 항산화 아세틸화 제품이 높게 나타나며, 오톨리메틸카르비놀에 대한 아세틸화 알코올의 90% 샘플이 s=71로 나타난다.null
또한, Fu는 인종적 디올(Meso diols의 비대칭화뿐만 아니라)의 고선택적 아틸화 현상을 최초로 보고했다.1%의 낮은 촉매 부하로 인해 에반티오엔강화다이올은 98% ee와 43%의 수율에서 회복되었고, 디아세테이트는 39% ee와 99% ee에서 회복되었다.나머지 물질은 모노아세테이트의 혼합물로 회수되었다.null
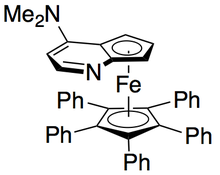
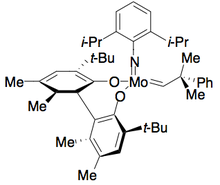
평면-치랄 DMAP 촉매도 운동적으로 프로파글릭 알코올을 해결하는데 효과가 있는 것으로 나타났다.[10]그러나 이 경우 선택성은 기초가 없는 상태에서 가장 높은 것으로 나타났다.0°C에서 촉매의 1 mol%로 실행하면 최대 20개의 선택도를 얻을 수 있다.이 방법의 제한사항에는 원격 알킬 위치에서의 카보닐이나 알케인과 같은 불포화 기능성 요건이 포함된다.DMAP 촉매의 (+-enantiomer)를 사용하여 분해된 알코올은 다음과 같다.null
푸는 또한 키랄 DMAP 촉매의 동맹 알코올 해결 능력을 보여주었다.[11]효과적인 선택성은 알코올을 함유한 그룹에 대체하는 보석류 또는 시스의 존재 여부에 따라 결정되며, 가장 높은 선택성을 보이는 트랜스페닐 알코올을 제외하고는 두드러지게 나타났다.DMAP 촉매의 (+-enantiomer)의 1-2.5 mol%를 사용하여 아래 표시된 알코올을 트리에틸아민이 있는 상태에서 해결했다.null
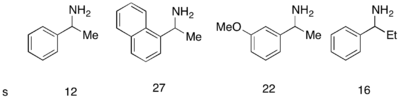
Fu의 DMAP 아날로그 촉매제가 운동학적 알코올을 분해하는 데 예외적으로 잘 작동했지만, 아민의 운동학적 분해능을 위해 사용하는 데는 성공적이지 못했다.아민의 성공적인 운동 분해능 아킬레이션을 위해 새로운 아틸레이팅제와 함께 사용할 수 있는 유사한 촉매인 PPY*가 개발되었다.–50 °C에서 클로로포름의 10 mol%(---PPY*)로 아민의 아틸화에서 양호한 선택성이 관찰되었다(아래 그림 참조).[12]유사한 프로토콜이 인돌린의 운동 분해능을 위해 개발되었다.[13]null
에폭시화 및 이하이드록시화
K가 개발한 샤플리스 에폭시디화. 1980년 배리 샤플리스(Barry Sharfleless)[14]는 우방성 알코올의 인종적 혼합물의 운동학적 분해능을 위해 이용되었다.[15][16]이 방법은 많은 동맹관계를 가진 알코올을 해결하는데 매우 효과적이지만 여러 가지 단점이 있다.반응 시간은 최대 6일 동안 지속될 수 있으며, 촉매는 재활용할 수 없다.그러나 샤플리스 비대칭 에폭시드 운동 분해능은 현재까지 가장 효과적인 합성 운동 분해능 중 하나로 남아 있다.촉매에는 다양한 타르트레이트가 사용될 수 있다. 디이소프로필 타르트레이트를 사용하는 대표적인 방법이 아래에 제시되어 있다.이 방법은 많은 이차 동맹 알코올에 일반적으로 사용되어 왔다.[17]null
샤플리스 비대칭 다이드록실화도 운동 분해능의 한 방법으로 사용되어 왔다.[18][19]그러나 동일한 결의안이 보다 경제적인 다른 방식으로 달성될 수 있기 때문에 이 방법은 널리 사용되지 않는다.또한, 시 에폭시드는 제한된 선택 올레핀의 운동 분해능에 영향을 미치는 것으로 나타났다.[20]이 방법 또한 널리 쓰이지 않고 기계론적 관심사다.null
에폭시드 개구부
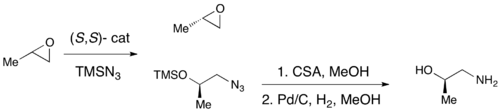
샤를리스 에폭시디화, 시 에폭시디화, 제이콥센 에폭시디화를 활용하여 항항제 에폭시디화가 성공적으로 달성되었지만, 이 방법들 중 어느 것도 핵심 치랄 구성 블록인 터미널 에폭시드의 효율적인 비대칭 합성을 가능하게 하는 것은 없다.대부분의 인종적 단자 에폭시드의 값싼 가격과 고전적 분해능에 일반적으로 영향을 받지 않기 때문에, 단자 에폭시드의 효과적인 운동 분해능은 매우 중요한 합성 방법론의 역할을 할 것이다.1996년 제이콥센과 동료들은 아지드 음이온의 공격과 함께 핵포함 링 개방을 통한 에폭시드의 운동 분해능을 위한 방법론을 개발했다.(R,R) 촉매가 표시된다.[21]촉매의 하중은 0.5 mol%까지 낮을 경우 효과적으로 에폭시드를 단자 위치에서 항저항적으로 열 수 있으며, 에폭시드는 엔antioenriced epoxide 시작 물질과 1,2-azido 알코올을 산출할 수 있다.수익률은 거의 양적 수준이고 ee는 우수했다(대부분의 경우 95%).1,2아지도 알코올은 아래와 같이 수소화하여 1,2아미노 알코올을 투여할 수 있다.null
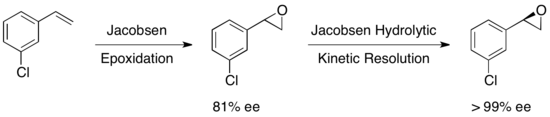
1997년, 제이콥센의 그룹은 그들의 초기 작업을 개선한 방법론을 발표하여 에폭시드 오프닝에서 물을 핵물질로 사용할 수 있게 했다.거의 동일한 촉매를 사용하여, ee는 회복된 시동 물질 에폭시드와 1,2-diol 제품 모두에서 98%를 초과했다.아래 예에서는 58g의 척도로 가수 분해능(HKR)을 실시하여 >99% ee에서 26g(44%), 98% ee에서 38g(50%)의 인내티컬 에폭시드가 발생하였다.[22]null
많은 다른 기판들을 조사했고, 회복된 에폭시드의 수율은 99% ee에 대해 36-48%이다.Jacobsen의 가수 분해능은 Jacobsen epoxidation과 병행하여 아래와 같이 특정 올레핀으로부터 enopure epoxide를 산출할 수 있다.첫 번째 에폭시드는 약간 엔티오엔시드(Enantioenced epoxide)를 산출하고, 이후 운동 분해능은 본질적으로 단일 에반토머를 산출한다.이 접근방식의 장점은 높은 항억제력을 달성하는 데 필요한 가수분해량을 줄일 수 있는 능력으로서 올레핀을 기반으로 하여 약 90%까지 전체 수율을 허용한다.[23]null
궁극적으로 제이콥센 에폭시드 개방 운동 분해능은 에폭시드와 제품, 용제가 없는 또는 낮은 솔벤트 조건에서 높은 항산화 순도를 생성하며 대규모로 적용되었다.특히 HKR에 대한 제이콥센 방법론은 멀티톤 규모로 수행될 수 있고 물을 핵물질로 활용함으로써 비용 효율성이 매우 높은 산업 공정을 초래한다는 점에서 매우 매력적이다.인상적인 성과에도 불구하고, HKR은 일반적으로 하나의 스테레오센트로 단순한 단자 에폭시드를 분해하는 데 적용되어 왔다.꽤 최근에 D.A. Devalankar 외 연구진은 인접한 C–C 결합 대체물을 포함하는 2-steerocinated Co-catalyste 의 HKR을 포함하는 우아한 프로토콜을 보고했다.[24]null
산화
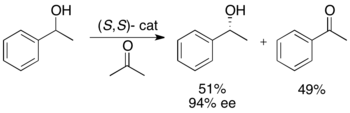
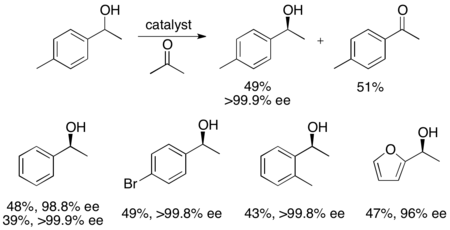
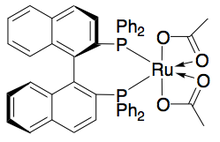
료지 노요리와 동료들은 수소 이전을 통한 벤질릭과 동맹의 2차 알코올의 운동적 분해능을 위한 방법론을 개발했다.루테늄 복합체는 아세톤으로부터 보다 반응성이 높은 에난토머의 산화를 촉진하여 무반응 에난토푸레 알코올, 산화 케톤, 이소프로판올을 생산한다.아래 예제에서 아세톤이 있는 상태에서 촉매의 (S,S) 엔안티머에 1페닐타놀을 노출하면 51% ee (R)-1페닐타놀의 수율이 94% ee (R)-1페닐타놀과 함께 부산물로 49% 아세토페논과 이소프로판올이 발생한다.[25]null
이 방법론은 본질적으로 노요리가 케톤을 비대칭적으로 이전하는 수소를 감소시켜 항산화 알코올을 산출하는 것과 반대되는 것이다.[26]이것은 재료의 절반의 손실 없이 동일한 제품을 달성할 수 있는 유사한 방법이 있기 때문에 운동 분해능법의 매력을 제한한다.따라서, 운동 분해능은 경혈 알코올이 적어도 케톤 가격의 절반 이상이거나 접근하기 훨씬 쉬운 경우에만 수행될 것이다.null
또한 우에무라와 히다이는 벤질 알코올의 운동 분해능 산화를 위한 루테늄 촉매를 개발하여 높은 항산화 알코올을 좋은 수율에서 생산하고 있다.[27]콤플렉스 캔은 노요리의 촉매와 마찬가지로 케톤과 이소프로판올 사이의 수소전달에 영향을 미쳐 엔티오펜시브알코올(>99% ee)과 산화케톤을 부산물로 하여 레이스 알콜의 운동 분해능에도 영향을 미친다.케톤을 항항제적으로 줄여 99% ee에서 대부분의 벤질 알코올을 공급하고 다수의 경혈성 벤질 알코올을 분해하여 아래와 같이 단일 에노머를 높은 수율(최대 49%)을 부여할 수 있다.이 방법은 노요리 운동 분해능과 같은 단점을 가지고 있는데, 즉, 케톤을 항항제적으로 감소시켜도 알코올에 접근할 수 있다는 것이다.또한 촉매의 에반토머는 단 1개만 보고되었다.null
수소화
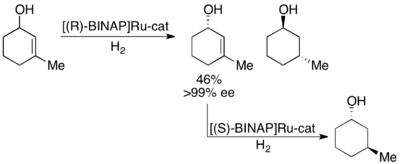
노요리는 올레핀의 비대칭 수소화에 의한 동맹 알코올의 운동 분해능도 입증했다.[28]Ru[BINAP] 콤플렉스를 활용하면 아래와 같이 선택적 수소가 첨가된 알코올 외에 불포화 알코올의 높은 수치를 얻을 수 있다.따라서, 남아 있는 항정신병 동맹 알코올의 두 번째 수소화는 포화 알코올의 두 항정신병적 순수 샘플을 제공할 것이다.노요리는 우수한 수율과 우수한 ee에 좋은 것(최대 99%)을 가진 다수의 동맹 술을 해결했다.null
링 클로징 메타텍스
호비다와 슈록은 디에닐 동맹 알코올의 링 클로징 메타텍스 운동 분해능을 위한 촉매를 개발했다.[29]몰리브데넘 알킬리덴 촉매는 1개의 에난토머를 선택적으로 촉매하여 링 클로징 메타텍스(tetatex)를 수행하여 아래와 같이 에난토푸어 알코올과 에난토푸어 클로즈드 링을 발생시킨다.촉매는 1,6다이엔을 해결하는 데 가장 효과적이다.그러나 알카인 간 거리를 1,7로 늘리는 등 기질에 약간의 구조적 변화는 때로는 다른 촉매를 사용해야 하는 경우도 있어 이 방법의 효능을 떨어뜨릴 수 있다.null
효소반응
아킬레이션스
합성 운동 분해능 절차와 마찬가지로 효소 아킬화 운동 분해능은 합성 맥락에서 가장 광범위한 적용을 보았다.특히 중요한 것은 아미노산을 효율적이고 저렴하게 준비하기 위한 효소 운동 분해능의 사용이었다.상업적인 규모로 볼 때, 아킬라제를 사용하는 데구사의 방법론은 수많은 자연적이고 부자연스러운 아미노산을 해결할 수 있다.경합성 혼합물은 Strecker 합성을 통해 준비될 수 있으며, 포신 신장 아킬라아제(직선 체인 기질용) 또는 곰팡이 아스페르길루스 오리아제(접이식 사이드 체인 기질용)의 효소를 사용하면 효과적으로 항산화 아미노산을 높은 수율(85~90%)에서 산출할 수 있다.미작동된 출발 물질은 현장에서 레이싱할 수 있어 이를 동적 운동 분해능으로 만들 수 있다.[30]null
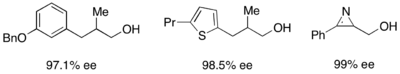
또한, 리파아제는 학문적 환경이나 산업적 환경 모두에서 운동적 분해능을 위해 광범위하게 사용된다.[31][32]지질은 1차 알코올, 2차 알코올, 제한된 3차 알코올, 카복시산, 디올, 그리고 치랄 알렌까지 해결하는데 사용되어 왔다.PSL(Phyomonas cepacia, PSL)의 리파아제는 1차 알코올의 분해에 가장 널리 사용되고 있으며, 아래에 제시된 1차 알코올을 키네틱하게 해결하기 위해 아세테이트 비닐과 함께 사용되어 왔다.null
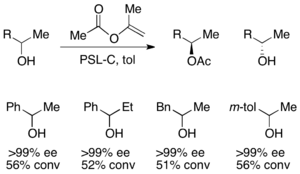
2차 알코올의 분해능을 위해, 녹농성 세페시아 리파아제(PSL-C)가 효과적으로 고용되어 알코올의 (R)-엔티머의 우수한 ee를 생성하였다.[33]아세틸화제로 이소프로페닐 아세테이트를 사용하면 아세톤이 부산물로 생성되어 분자 체를 이용한 반응에서 효과적으로 제거된다.null
산화 및 감소
베이커의 효모(BY)는 α-강인성 카보닐 화합물의 운동 분해능에 활용되었다.[34][35]이 효소는 아래에 나타낸 것과 같이 1개의 에반토머를 선택적으로 감소시켜 높은 엔티오엔화 알코올과 케톤은 아래와 같다.null
베이커의 효모는 산화 작용에 의한 2차 벤질 알코올의 운동 분해능에도 사용되었다.[36]회수된 알코올 중 우수한 ee가 보고되었지만, 일반적으로 60% 이상의 전환이 필요하여 수율이 감소한다.베이커의 효모는 β-케토스터의 감소를 통한 운동 분해능에도 사용되었다.[37]그러나 노요리가 이 글의 뒷부분에서 상세히 기술한 동일 기질에 대한 결의의 성공에 비추어 볼 때, 이것은 별로 쓸모가 없었다.null
동적 운동 분해능
동적 운동 분해능(DKR)은 출발 재료 경주 동료가 쉽게 인지할 수 있을 때 발생하며, 그 결과 반응 중 모든 지점에서 본질적으로 경주 시작 재료 혼합이 발생한다.그러면, 작동 장벽이 낮은 에반토머는 이론적으로 최대 100%의 수율을 형성할 수 있다.이는 표준 운동 분해능과는 대조적이며, 이는 반드시 최대 수확량이 50%에 달한다.이러한 이유로 동적 운동 분해능은 유기적 합성에 극히 실용적인 응용을 가지고 있다.관찰된 역학관계는 커틴-함메트 원리에 기초한다.양쪽 에반토머의 반응에 대한 장벽은 반드시 경시화의 장벽보다 높으며, 따라서 경주동료를 포함하는 운동적 우물이 발생한다.이것은R 글쓰기와 맞먹는다, k>kS.
DKR의 이론과 실제 적용에 대해 상세히 기술한 다수의 우수한 리뷰가 2008년에 발표되었다.[38][39][40]null
노요리 비대칭 수소화
케톤에 대한 노요리 비대칭 수소화는 직장에서 동적 운동 분해능을 보여주는 좋은 예다.항정신병 β-케토스터는 경시화를 겪을 수 있으며, X가 할로겐인 Ru[(R)-BINAP]X2 형태의 치랄 촉매의 선택은 항정신병자 중 한 명이 우선적으로 더 빠르게 반응하게 한다.대표적인 반응에 대한 상대적 자유 에너지는 다음과 같다.[41][42]알 수 있듯이, 경구화 중간은 수소화에 대한 전환 상태보다 자유 에너지가 낮아서 빠른 레이스화 및 제품의 단일 엔노머의 높은 수율을 초래한다.null
에반토머는 그들의 공통 에놀을 통해 상호 교환하는데, 에반토머들 사이에 위치하는 에너지 최소값이다.표시된 반응은 위에 표시된 안티 제품의 93% ee 샘플을 산출한다.용제 선택은 디클로로메탄과 메탄올이 모두 특정 기판에 효과를 나타내기 때문에 이질제거성에 큰 영향을 미치는 것으로 보인다.노요리와 다른 이들은 또한 ee와 이뇨제 비(dr) 모두에서 개선된 새로운 촉매들을 개발했다.null
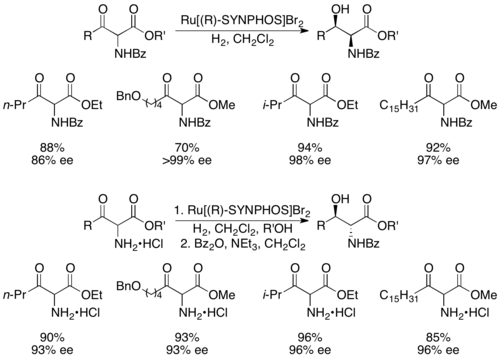
제네와 동료들은 선택성이 높은 비대칭 수소를 수행하는 루테늄 콤플렉스를 형성하는 BINAP 아날로그인 SYNPHOS를 개발했다.[43]Enantiopure Ru[SYNPHOS]Br은2 아래와 같이 인종 α-아미노-β-케토에스터를 선택적으로 수소화하여 아미노알코올을 에노푸레(R)-SYNPHOS를 이용하는 것으로 나타났다.[44] 1,2-합성 아미노알코올은 벤조일 보호 아미노 화합물로부터 제조된 반면, 아민 염산염으로부터 항균이 제조되었다.null
후 아세틸레이션 수정
최근, 그레고리 푸와 동료들은 효과적인 동적 운동 분해능을 생산하기 위한 이전의 운동 분해능 작업의 수정을 보고했다.[45]Fu는 오른쪽에 보이는 루테늄 경주용 촉매와 그의 평면 치랄 DMAP 촉매를 사용하여 아래와 같이 최대 99%와 93% ee의 2차 알코올의 동적 운동 분해능을 입증했다.동적 운동 분해능에 널리 사용되는 DMAP 촉매의 응용을 더욱 발전시키기 위한 작업이 진행 중이다.null
효소 동적 운동 분해능
많은 효소 동적 운동 분해능이 보고되었다.[46]PSL을 사용하는 대표적인 예는 아틸화제로서 트리에틸아민과 아세트산 비닐이 있는 곳에서 인종적 아틸로인을 효과적으로 해결한다.[47]아래 나온 것처럼 제품은 75% 수율과 97% ee에서 격리됐다.베이스가 없는 상태에서 규칙적인 운동 분해능이 발생하여 92% ee에서 99% eyylated 제품의 45% 수율과 53%의 시작재료가 발생하였다.null
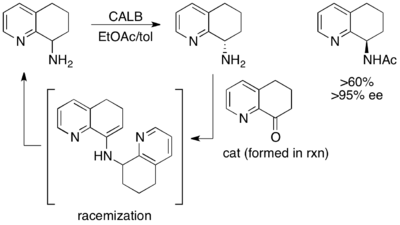
고수익(high-turning)은 아니지만 또 다른 뛰어난 예는 (±8-아미노-5,6,7,8-테트라하이드로퀴놀린)의 운동 분해능이다.톨루엔과 에틸 아세테이트의 칸디다 남극 리파아제 B(CALB)에 3-24시간 동안 노출되면 정상 운동 분해능이 발생하여 시작 물질 97% ee의 수율 45%, 아세틸화 아민 제품 >97%의 수율 45%가 발생한다.단, 40~48시간 동안 저어가도록 허용하면 레이싱 스타트 소재와 95% ee 아큐레이트 제품의 60% 이상이 회수된다.[48]null
여기서, 미작용을 시작한 물질은 조광 에나민을 통해 현장에서 레이싱하여, 엔노푸어 아킬레이트 아민 제품의 50% 이상의 수율을 회복한다.null
화학적 동적 운동 분해능
화학 시약/촉매를 이용하여 시작 물질의 레이스메이징을 수행하고 효소를 선택적으로 화학적 효소 동적 운동 분해능이라고 불리는 하나의 엔노머로 반응하는 여러 가지 보고된 절차가 있다.[49]PSL-C는 루테늄 촉매(경주화용)와 함께 이용되어 엔안티오푸어(>95% ee) Δ-히드록실락톤을 생산했다.[50]null
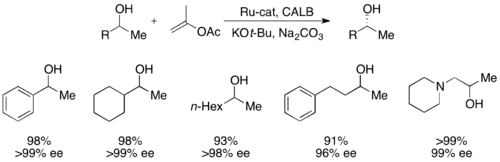
최근에는 Beckvall이 CALB와 루테늄 레이스화 콤플렉스를 활용하여 2차 알코올을 최대 99%, ee가 최대 >99%로 해결했다.[51]null
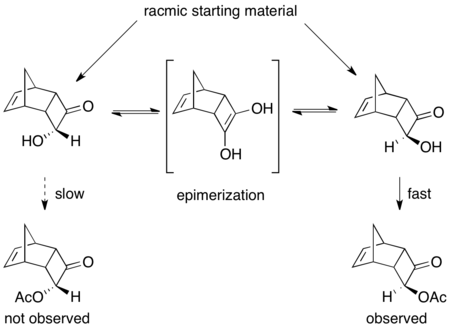
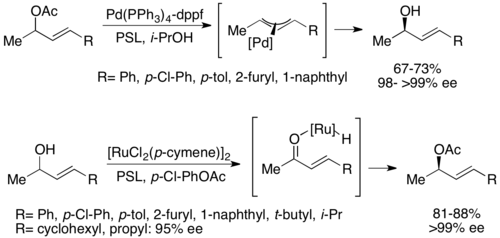
두 번째 유형의 화학적 동적 운동 분해능은 팔라듐을 가진 아군 아세테이트의 π-all 복합체를 포함한다.여기서 레이스메이징은 아세테이트의 상실로 발생하며, 아래와 같이 전이 금속 중심과 함께 양이온 콤플렉스를 형성한다.[52]팔라듐은 이러한 반응을 촉진하는 것으로 나타났으며 루테늄은 유사한 반응에 영향을 미치는 것으로 아래와 같이 나타났다.[53]null
병렬 운동 분해능
병렬 운동 분해능(PKR)에서, 인종 혼합물이 반응하여 두 개의 비 내성 제품을 형성하며, 종종 완전히 다른 반응 경로를 통해 이루어진다.PKR을 사용하면 형성된 제품이 항산화제가 아니기 때문에 전환과 ee 사이의 트레이드오프가 없다.[54][55]PKR의 한 가지 전략은 반응 혼합물에서 반응성이 낮은 에반토머(원하는 키랄 촉매에 노출됨)를 반응 혼합물에서 제거하는 것이다. 두 번째 반응 조건을 우선시하여 이상적인 반응 속도로 반응한다.따라서 두 항산화제는 동일한 비율로 서로 다른 경로에서 소비된다.PKR 실험은 입체파, 레지오디버전트 또는 구조적으로 상이할 수 있다.[56]지금까지 보고된 PKR 중 가장 효율성이 높은 것 중 하나는 1998년 기시 요시토에 의해 달성되었다; CBS의 경혈성 스테로이드 케톤 감소가 입체적 감소를 초래하여 아래와 같이 99% ee의 두 개의 이뇨제를 생산했다.[57]null
PKR은 또한 효소 촉매의 사용으로 달성되었다.곰팡이 모티렐라 이사벨리나 NRRL 1757을 사용하여, 인종적 β-케톤니트릴레스의 감소는 두 개의 이염 제거제를 제공하는데, 이 균들은 분리되고 다시 산화하여 고농축 β-케톤니트릴레스를 제공할 수 있다.[58]그러나 매우 종합적으로 유용한 병렬 운동 분해능은 아직 발견되지 않았다.허용 가능한 ee와 수율을 제공하는 많은 절차가 발견되었지만, 고도로 선택적인 병렬 운동 분해능을 제공하는 예는 매우 드물며 단순히 어느 정도 선택적인 반응을 보이는 것은 아니다.예를 들어, 푸의 병렬 운동 분해능 4알키날스는 아래 나온 것처럼 낮은 수율과 약간 엔티오엔리히치 사이클로프텐테논으로 매우 엔티오엔리히치한 사이클로부타논을 산출한다.[59]null
이론적으로, 병렬 운동 분해능은 각각의 원하는 제품을 주기 때문에 가장 높은 ee 제품을 제공할 수 있다.예를 들어, s=49를 사용한 두 가지 보완적 반응의 경우 100% 변환은 50% 수율과 96% ee의 제품을 제공할 것이다.이러한 동일한 값은 단순한 운동 분해능에 s=200이 필요하다.그런 만큼 PKR의 약속은 앞으로도 많은 관심을 끌고 있다.이번 기시 CBS 감축은 이 약속을 이행하는 몇 안 되는 사례 중 하나로 남아 있다.null
참고 항목
참조
- ^ Fiaud, J.C.; Kagan, H.B. (1988). "Kinetic Resolution". In Eliel, E.L.; Wilen, S.H. (eds.). Topics in Stereochemistry. Vol. 18. New York: John Wiley and Sons, Inc. pp. 249–340.
- ^ Robinson, D.E.J.E.; Bull, S.D. (2005). "Kinetic resolution strategies using non-enzymatic catalysts". Tetrahedron: Asymmetry. 14 (11): 1407–1446. doi:10.1016/S0957-4166(03)00209-X.
- ^ Pasteur, L.C. (1858). C. R. Acad. Sci. Paris. 46: 615–618.
{{cite journal}}:누락 또는 비어 있음title=(도움말) - ^ Marckwald, W.; McKenzie, A. (1899). "Ueber eine principiell neue Methode zur Spaltung racemischer Verbindungen in die activen Bestandtheile". Ber. Dtsch. Chem. Ges. 32 (2): 2130–2136. doi:10.1002/cber.189903202130.
- ^ Roger, R.; Read, J. (1952). "Alexander McKenzie: 1869-1951". Obituary Notices of Fellows of the Royal Society. 8 (21): 206–228. doi:10.1098/rsbm.1952.0014.
- ^ a b Keith, J. M.; Larrow, J. F.; Jacobsen, E. N. (2001). "Practical Considerations in Kinetic Resolution Reactions". Adv. Synth. Catal. 343: 5–26. doi:10.1002/1615-4169(20010129)343:1<5::AID-ADSC5>3.0.CO;2-I.
- ^ Wurz, R.P.; Lee, E.C.; Ruble, J.C.; Fu, G.C. (2007). "Synthesis and Resolution of Planar-Chiral Derivatives of 4-(Dimethylamino)pyridine". Adv. Synth. Catal. 349 (14–15): 2345–2352. doi:10.1002/adsc.200700219.
- ^ Ruble, J.C.; Latham, H.A.; Fu, G.C. (1997). "Effective Kinetic Resolution of Secondary Alcohols with a Planar-Chiral Analogue of 4-(Dimethylamino)pyridine. Use of the Fe(C5Ph5) Group in Asymmetric Catalysis". J. Am. Chem. Soc. 119 (6): 1492–1493. doi:10.1021/ja963835b.
- ^ Ruble, J.C.; Tweddell, J.; Fu, G.C. (1998). "Kinetic Resolution of Arylakylcarbinols Catalyzed by a Planar-Chiral Derivative of DMAP: A New Benchmark for Nonenzymatic Acylation". J. Org. Chem. 63 (9): 2794–2795. doi:10.1021/jo980183w.
- ^ Tao, B.; Ruble, J.C.; Hoic, D.A.; Fu, G.C. (1999). "Nonenzymatic Kinetic Resolution of Propargylic Alcohols by a Planar−Chiral DMAP Derivative: Crystallographic Characterization of the Acylated Catalyst". J. Am. Chem. Soc. 121 (21): 2091–5092. doi:10.1021/ja9906958.
- ^ Bellemin-Laponnaz, S.; Tweddell, J.; Ruble, J.C.; Breitling, F.M.; Fu, G.C. (2000). "The kinetic resolution of allylic alcohols by a non-enzymatic acylation catalyst; application to natural product synthesis". Chem. Commun. (12): 2091–5092. doi:10.1039/B002041I.
- ^ Arai, S.; Bellemin-Laponnaz, S.; Fu, G.C. (2001). "Kinetic Resolution of Amines by a Nonenzymatic Acylation Catalyst". Angew. Chem. Int. Ed. 133 (1): 240–242. doi:10.1002/1521-3757(20010105)113:1<240::AID-ANGE240>3.0.CO;2-E.
- ^ Arp, F.O.; Fu, G.C. (2006). "Kinetic Resolutions of Inolines by a Nonenzymatic Acylation Catalyst". J. Am. Chem. Soc. 128 (44): 14264–14265. doi:10.1021/ja0657859. PMC 2569996. PMID 17076493.
- ^ Katsuki, T.; Sharpless, K.B. (1980). "The first practical method for asymmetric epoxidation". J. Am. Chem. Soc. 102 (18): 5974–5976. doi:10.1021/ja00538a077.
- ^ Martin, V.; Woodard, S.; Katsuki, T.; Yamada, Y.; Ikeda, M.; Sharpless, K.B. (1981). "Kinetic resolution of racemic allylic alcohols by enantioselective epoxidation. A route to substances of absolute enantiomeric purity?". J. Am. Chem. Soc. 103 (23): 6237–6240. doi:10.1021/ja00410a053.
- ^ Gao, Yun; Klunder, J.M.; Hanson, R.M.; Masamune, H.; Ko, S.Y.; Sharpless, K.B. (1987). "Catalytic asymmetric epoxidation and kinetic resolution: modified procedures including in situ derivatization". J. Am. Chem. Soc. 109 (19): 5765–5780. doi:10.1021/ja00253a032.
- ^ Kitano, Y.; Matsumoto, T.; Sato, F. (1988). "A highly efficient kinetic resolution of γ- and β- trimethylsilyl secondary allylic alcohols by the sharpless asymmetric epoxidation". Tetrahedron. 44 (13): 4073–4086. doi:10.1016/S0040-4020(01)86657-6.
- ^ VanNieuwenhze, M.S.; Sharpless, K.B. (1993). "Kinetic resolution of racemic olefins via asymmetric dihydroxylation". J. Am. Chem. Soc. 115 (17): 7864–7865. doi:10.1021/ja00070a037.
- ^ Corey, E.J.; Noe, M.C.; Guzman-Perez, A. (1995). "Kinetic Resolution by Enantioselective Dihydroxylation of Secondary Allylic 4-Methoxybenzoate Esters Using a Mechanistically Designed Cinchona Alkaloid Catalyst". J. Am. Chem. Soc. 117 (44): 10817–10824. doi:10.1021/ja00149a004.
- ^ Lorenz, J.C.; Frohn, M.; Zhou, X.; Zhang, J.-R.; Tang, Y.; Burke, C.; Shi, Y. (2005). "Transition State Studies on the Dioxirane-Mediated Asymmetric Epoxidation via Kinetic Resolution and Desymmetrization". J. Org. Chem. 70 (8): 2904–2911. doi:10.1021/jo048217p. PMID 15822948.
- ^ Larrow, J.F.; Schaus, S.E.; Jacobsen, E.N. (1996). "Kinetic Resolution of Terminal Epoxides via Highly Regioselective and Enantioselective Ring Opening with TMSN3. An Efficient, Catalytic Route to 1,2-Amino Alcohols". J. Am. Chem. Soc. 118 (31): 7420–7421. doi:10.1021/ja961708+.
- ^ Tokunaga, M.; Larrow, J.F.; Kakiuchi, F.; Jacobsen, E.N. (1997). "Asymmetric Catalysis with Water: Efficient Kinetic Resolution of Terminal Epoxides by Means of Catalytic Hydrolysis". Science. 277 (5328): 936–938. doi:10.1126/science.277.5328.936. PMID 9252321.
- ^ Brandes, B.D.; Jacobsen, E.N. (1997). "Synthesis of enantiopure 3-chlorostyrene oxide via an asymmetric epoxidation-hydrolytic kinetic resolution sequence". Tet. Asymm. 8 (23): 3927–3933. doi:10.1016/S0957-4166(97)00568-5.
- ^ Sudalai, A.; Karabal, P.U.; Devalankar, D.A. (2013). "Optically pure γ-butyrolactones and epoxy esters via two stereocentered HKR of 3-substituted epoxy esters: a formal synthesis of (−)-paroxetine, Ro 67-8867 and(+)-eldanolide". Org. Biomol. Chem. 11 (8): 1280–1285. doi:10.1039/c3ob27321k. PMID 23334653.
- ^ Hashiguchi, S.; Fujii, A.; Haack, K.-J.; Matsumura, K.; Ikariya, T.; Noyori, R. (1997). "Kinetic Resolution of Racemic Secondary Alcohols by RuII-Catalyzed Hydrogen Transfer". Angew. Chem. Int. Ed. 36 (3): 288–290. doi:10.1002/anie.199702881.
- ^ Hashiguchi, S.; Fujii, A.; Takehara, J.; Ikariya, T.; Noyori, R. (1995). "Asymmetric Transfer Hydrogenation of Aromatic Ketones Catalyzed by Chiral Ruthenium(II) Complexes". J. Am. Chem. Soc. 117 (28): 7562–7563. doi:10.1021/ja00133a037.
- ^ Nishibayashi, Y.; Takei, I.; Uemura, S.; Hidai, M. (1999). "Extremely High Enantioselective Redox Reaction of Ketones and Alcohols Catalyzed by RuCl2(PPh3)(oxazolinylferrocenylphosphine)". Organometallics. 18 (12): 2291–2293. doi:10.1021/om990210o.
- ^ Kitamura, M.; Kasahara, I.; Manabe, K.; Noyori, R.; Takaya, H. (1988). "Kinetic resolution of racemic allylic alcohols by BINAP-ruthenium(II) catalyzed hydrogenation". J. Org. Chem. 53 (3): 708–710. doi:10.1021/jo00238a048.
- ^ Hoveyda, A.H.; Schrock, R.R. (2001). "Catalytic Asymmetric Olefin Metathesis". Chem. Eur. J. 7 (5): 945–950. doi:10.1002/1521-3765(20010302)7:5<945::AID-CHEM945>3.0.CO;2-3. PMID 11303874.
- ^ 미국 특허 6656710, Bommarius & Perseck, Degussa AG에 할당된 "레이스마아제와 아킬레이트를 이용한 아미노산 생산 프로세스"
- ^ Ghanem, A.; Aboul-Enein, H.Y. (2005). "Application of lipases in kinetic resolution of racemates". Chirality. 17 (1): 1–15. doi:10.1002/chir.20089. PMID 15515046.
- ^ "Chiral technology: industrial biocatalysis with standard hydrolytic bulk enzymes". Specialty Chemicals Magazine. 27 (8): 38. 2007.
- ^ Ghanem, A.; Schurig, V. (2003). "Lipase-catalyzed Irreversible Transesterification of Secondary Alcohols Using Isopropenyl Acetate" (PDF). Monatshefte für Chemie. 134 (8): 1151–1157. doi:10.1007/s00706-003-0025-1. S2CID 96922176.
- ^ Santaniello, E.; Ferraboschi, P.; Grisenti, P.; Manzocchi, A. (1992). "The biocatalytic approach to the preparation of enantiomerically pure chiral building blocks". Chem. Rev. 92 (5): 1071–1140. doi:10.1021/cr00013a016.
- ^ Ticozzi, C.; Zanarotti, Antonio (1989). "Enantioselective Microbial Reduction of 5-Acetylisoxazolines – A Novel Method for Stereochemical Control on Yeast Reduction". Liebigs Ann. Chem. 1989 (12): 1257–1259. doi:10.1002/jlac.198919890299.
- ^ Fantin, G.; Fogagnolo, M.; Medici, A.; Pedrini, P.; Poli, S. (1993). "Kinetic resolution of 1-aryl- and 1-heteroaryl ethanols by oxidation with Baker's yeast". Tetrahedron Lett. 34 (5): 883–884. doi:10.1016/0040-4039(93)89039-S.
- ^ Brooks, D.W.; Wilson, M.; Webb, M. (1987). "Different enzymic reactions of an enantiomeric pair: simultaneous dual kinetic resolution of a keto ester by bakers' yeast". J. Org. Chem. 52 (11): 2244–2248. doi:10.1021/jo00387a026.
- ^ Pellissier, H. (2008). "Recent developments in dynamic kinetic resolution". Tetrahedron. 64 (8): 1563–1601. doi:10.1016/j.tet.2007.10.080.
- ^ Pellissier, H. (2003). "Dynamic kinetic resolution". Tetrahedron. 59 (42): 8291–8327. doi:10.1016/S0040-4020(03)01022-6.
- ^ Ward, R.S. (1995). "Dynamic kinetic resolution". Tetrahedron: Asymmetry. 6 (7): 1475–1490. doi:10.1016/0957-4166(95)00179-S.
- ^ Kitamura, M.; Tokunaga, M.; Noyori, R. (1993). "Quantitative expression of dynamic kinetic resolution of chirally labile enantiomers: stereoselective hydrogenation of 2-substituted 3-oxo carboxylic esters catalyzed by BINAP-ruthenium(II) complexes". J. Am. Chem. Soc. 115 (1): 144–152. doi:10.1021/ja00054a020.
- ^ Noyori, R.; Ikeda, T.; Ohkuma, T.; Widhalm, M.; Kitamura, M.; Takaya, H.; Akutagawa, S.; Sayo, N.; Saito, T. (1989). "Stereoselective hydrogenation via dynamic kinetic resolution". J. Am. Chem. Soc. 111 (25): 9134–9135. doi:10.1021/ja00207a038.
- ^ de Paule, S.D.; Jeulin, S.; Ratovelomanana-Vidal, V.; Genêt, J-P.; Champion, N.; Dellis, P. (2003). "Synthesis and Molecular Modeling Studies of SYNPHOS®, a New, Efficient Diphosphane Ligand For Ruthenium-Catalyzed Asymmetric Hydrogenation". Eur. J. Org. Chem. 2003 (10): 1931–1941. doi:10.1002/ejoc.200200634.
- ^ Mordant, C.; Ratovelomanana-Vidal, V.; Dünkelmann, P.; Genêt, J.-P. (2004). "A Versatile Route to syn- and anti-α-Amino β-Hydroxy Esters from β-Keto Esters by Dynamic Kinetic Resolution with Ru-SYNPHOS® Catalyst". Eur. J. Org. Chem. 2004 (14): 3017–3026. doi:10.1002/ejoc.200400078.
- ^ Lee, S.Y.; Murphy, J.M.; Ukai, A.; Fu, G.C. (2012). "Nonenzymatic Dynamic Kinetic Resolution of Secondary Alcohols via Enantioselective Acylation: Synthetic and Mechanistic Studies". J. Am. Chem. Soc. 134 (36): 15149–15153. doi:10.1021/ja307425g. PMC 3447740. PMID 22934603.
- ^ Pellissier, H. (2003). "Lipase–triethylamine-mediated dynamic transesterification of a tricyclic acyloin having a latent meso-structure: a new route to optically pure oxodicyclopentadiene". Tetrahedron. 59 (42): 8291–9327. doi:10.1016/S0040-4020(03)01022-6.
- ^ Taniguchi, T.; Ogasawara, K. (1997). "Lipase–triethylamine-mediated dynamic transesterification of a tricyclic acyloin having a latent meso-structure: a new route to optically pure oxodicyclopentadiene". Chemical Communications (15): 1399–1400. doi:10.1039/A702910A.
- ^ Crawford, J.B.; Skerlj, R.T.; Bridger, G.J. (2007). "Spontaneous Enzymatically Mediated Dynamic Kinetic Resolution of 8-Amino-5,6,7,8-tetrahydroquinoline". J. Org. Chem. 72 (2): 669–671. doi:10.1021/jo062037t. PMID 17221995.
- ^ Pàmies, O.; Bäckvall, J.-E. (2004). "Chemoenzymatic dynamic kinetic resolution". Trends in Biotechnology. 22 (3): 130–135. doi:10.1016/j.tibtech.2004.01.005. PMID 15036863.
- ^ Pàmies, O.; Bäckvall, J.-E. (2002). "Enzymatic Kinetic Resolution and Chemoenzymatic Dynamic Kinetic Resolution of δ-Hydroxy Esters. An Efficient Route to Chiral δ-Lactones". J. Org. Chem. 67 (4): 1261–1265. doi:10.1021/jo016096c. PMID 11846671.
- ^ Martín-Matute, B.; Edin, M.; Bogár, K.; Kaynak, F.B.; Bäckvall, J.-E. (2005). "Combined Ruthenium(II) and Lipase Catalysis for Efficient Dynamic Kinetic Resolution of Secondary Alcohols. Insight into the Racemization Mechanism". J. Am. Chem. Soc. 127 (64): 8817–8825. doi:10.1021/ja051576x. PMID 15954789.
- ^ Choi, Y.K.; Suh, J.H.; Lee, D.; Lim, I.T.; Jung, J.Y.; Kim, M.-J. (1999). "Dynamic Kinetic Resolution of Acyclic Allylic Acetates Using Lipase and Palladium". J. Org. Chem. 64 (22): 8423–8424. doi:10.1021/jo990956w. PMID 11674772.
- ^ Lee, D.; Huh, E.A.; Kim, M.-J.; Jung, H.M.; Koh, J.H.; Park, J. (2000). "Dynamic Kinetic Resolution of Allylic Alcohols Mediated by Ruthenium- and Lipase-Based Catalysts". Org. Lett. 2 (15): 2377–2379. doi:10.1021/ol006159y. PMID 10930288.
- ^ Eames, J. (2000). "Parallel Kinetic Resolutions". Angew. Chem. Int. Ed. 39 (5): 885–888. doi:10.1002/(SICI)1521-3773(20000303)39:5<885::AID-ANIE885>3.0.CO;2-2. PMID 10760881.
- ^ Dehil, J.R.; Gotor, V. (2002). "Parallel kinetic resolution of racemic mixtures: a new strategy for the preparation of enantiopure compounds?". Chem. Soc. Rev. 31 (6): 365–370. doi:10.1039/B205280F. PMID 12491751.
- ^ Vedejs, E.; Jure, M. (2005). "Efficiency in Nonenzymatic Kinetic Resolution". Angew. Chem. Int. Ed. 44 (5): 3974–4001. doi:10.1002/anie.200460842. PMID 15942973.
- ^ Kurosu, M.; Kishi, Y. (1998). "A Novel Example for Optical Resolution of Racemic Ketones Originating from Batrachotoxin Synthesis". J. Org. Chem. 63 (18): 6100–6101. doi:10.1021/jo981416m. PMID 11672234.
- ^ Dehil, J.R.; Gotor, V. (2002). "Preparation of Enantiopure Ketones and Alcohols Containing a Quaternary Stereocenter through Parallel Kinetic Resolution of β-Keto Nitriles". J. Org. Chem. 67 (5): 1716–1718. doi:10.1021/jo011092t. PMID 11871913.
- ^ Tanaka, K.; Fu, G.C. (2003). "Parallel Kinetic Resolution of 4-Alkynals Catalyzed by Rh(I)/Tol-BINAP: Synthesis of Enantioenriched Cyclobutanones and Cyclopentenones". J. Am. Chem. Soc. 125 (27): 8078–8079. doi:10.1021/ja035489l. PMID 12837058.





![[S]={\frac {(1+ee)(1-c)}{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bedb0ada89fbba54020c618907425dc858a2591b)
![[R]={\frac {(1-ee)(1-c)}{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1a61e8391de522b72a3580bd1214d5112057d741)

![{\frac {d[S]}{dt}}=-k_{S}[S][B^{*}]\implies \log[S]=-k_{S}[B^{*}]t+\log S_{0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0cb65f6ee0307b80ab311cb9d09726947bd97ac1)
![{\displaystyle s={\frac {k_{R}}{k_{S}}}={\frac {\log[R]-\log R_{0}}{\log[S]-\log S_{0}}}={\frac {\log[(1-c)(1-ee)]+\log {\frac {1}{2}}-\log R_{0}}{\log[(1-c)(1+ee)]+\log {\frac {1}{2}}-\log S_{0}}}={\frac {\log[(1-c)(1-ee)]}{\log[(1-c)(1+ee)]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/156b26edecc36af36374614253bb2842be3e550b)
![ee''={\frac {[R']-[S']}{[R']+[S']}}={\frac {ee(1-c)}{c}}\implies ee=ee''{\frac {c}{1-c}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0876f7366b97d07d9a002cb750fdb1a42ca25448)




![{\displaystyle s={\frac {\log[1-c(1+ee'')]}{\log[1-c(1-ee'')]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d142162d7ab054c445d0ee122e6ed2b2880103a)
![{\frac {d[S]}{dt}}=-k_{S}[S]\implies S={\frac {1}{2}}e^{{-k_{S}t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fcf79858e21ac5c20f56338e038c1a28e2b6e77)
![ee={\frac {[S]-[R]}{[S]+[R]}}={\frac {e^{{-k_{S}t}}-e^{{-k_{R}t}}}{e^{{-k_{S}t}}+e^{{-k_{R}t}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/537dcb1d65d95eea71ade3ed04fb39937e993fb2)
![c=1-{\big (}[S]-[R]{\big )}=1-{\frac {e^{{-k_{S}t}}+e^{{-k_{R}t}}}{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/002346d2f288670c618bfcddfabc48db5fe6a46b)